Химическая физика, 2021, T. 40, № 5, стр. 86-90
Влияние частиц слоя Юнге на скорость разрушения озона в нижней стратосфере
И. К. Ларин 1, *, А. Е. Алоян 2, **, А. Н. Ермаков 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт вычислительной математики им. Г.И. Марчука
Российской академии наук
Москва, Россия
* E-mail: iklarin@narod.ru
** E-mail: aloyan@m.inm.ras.ru
Поступила в редакцию 16.03.2020
После доработки 07.07.2020
Принята к публикации 20.07.2020
Аннотация
В работе приводятся результаты расчетов динамики разрушения озона в нижней стратосфере, выполненные с учетом гетерогенных химических реакций, протекающих со скоростью w(–O3)ГХР, см–3 ⋅ с–1, с участием частиц слоя Юнге (background aerosol). Найденный в расчетах на высотах менее 16 км драматический спад w(–O3)ГХР в сравнении со скоростью убыли озона, рассчитанной с участием газовых химических реакций (w(–O3)), свидетельствует об ингибирующей роли частиц аэрозоля. Причиной выступает захват из воздуха частицами аэрозоля молекул N2O5. Их быстрый сток влечет за собой резкий спад концентраций компонент семейства NOx в воздухе, а также, хотя и менее выраженное, снижение концентраций компонентов семейств HOx и Оx, участвующих в разрушении озона. На бóльших высотах: 16–22 км, величина w(–O3)ГХР напротив, оказывается несколько выше w(–O3); сказывается ускорение процесса разрушения с компонентами семейств HOx и ClOx. Возросший уровень их концентраций и скоростей реакций с озоном обязан пониженному содержанию в воздухе компонентов семейства NOx. Это положительное влияние гетерогенных химических реакций с участием частиц аэрозоля на w(–O3)ГХР практически вырождается, однако на еще бóльших высотах. Причиной служит снижение содержания частиц аэрозоля, а также ускорение фотодиссоциации молекул N2O5(г)$\xrightarrow{{h{{\nu }}}}$ NO3(г) + NO2(г), что в совокупности сопровождается подавлением процесса их захвата частицами.
ВВЕДЕНИЕ
Ранее [1] при рассмотрении влияния частиц слоя Юнге [2] на время жизни “нечетного кислорода” в нижней стратосфере нами отмечалась важная роль гетерогенных химических реакций (ГХР) [3–5] в сложном цикле атмосферных химических процессов с участием компонент семейства Ox. О влиянии частиц слоя Юнге на скорость разрушения озона косвенно свидетельствуют и данные натурных наблюдений концентраций компонентов семейств, участвующих в разрушении озона в средних широтах в натурных экспериментах SPADE (Stratospheric Photochemistry Aerosols and Dynamics Expedition) [6]. В этой связи в работе [7] нами указывалось, что именно ГХР с участием частиц этого слоя являются причиной отрицательной тенденции изменения концентрации озона в нижней стратосфере в период так называемого озонового кризиса (конец XX столетия). Цель данной работы – проведение численных расчетов с учетом влияния сульфатного аэрозоля на скорость разрушения озона на высотах, отвечающих расположению частиц слоя Юнге в нижней стратосфере: 10–25 км.
МОДЕЛЬ ChemWG
В настоящей работе, как и в [7], о влиянии ГХР с участием частиц слоя Юнге на концентрации малых составляющих в нижней стратосфере и скорости реакций с их участием судили с применением ранее построенной 0-мерной модели (ChemWG). В работе [8] подобным образом рассматривалось и локальное разрушение озона в нижней стратосфере в высоких широтах (68 ± 10)° с.ш. с участием больших (5 и более мкм) частиц тригидрата азотной кислоты (NAT rocks). Описание модели ChemWG, включающей блок химических реакций в газовой фазе, аналогичный модели SOCRATES [9], а также блоки процессов массообмена на границе “газ–капля” и жидкофазных реакций в каплях, дается в работе [7]. Численные расчеты выполнялись для единичного объема газа с равномерно распределенными по его объему каплями (r = 0.1 мкм) на высотах от 10 до 25 км. Время счета составляло ≤3 ⋅ 106 с (≈30 сут). При этом, как и в модели SOCRATES, содержание малых примесей рассчитывалось с учетом их суточных изменений. В расчетах принимали во внимание диффузионные ограничения жидкофазных реакций в объеме частиц аэрозоля.
По результатам рассмотрения было найдено, что основную роль в данных условиях играют процессы гидролиза захватываемых из воздуха молекул N2O5 и в гораздо меньшей степени процессы гидролиза ClONO2:
(1)
${{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{5}}({\text{р - р}})}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{NO}}_{{{\text{2}}({\text{р - р}})}}^{ - } + {\text{NO}}_{{{\text{3}}({\text{р - р}})}}^{ - } + {\text{2H}}_{{({\text{р - р}})}}^{ + },$(2)
${\text{ClON}}{{{\text{O}}}_{{2\left( {{\text{р - р}}} \right)}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{HOC}}{{{\text{l}}}_{{{\text{(р - р)}}}}} + {\text{HN}}{{{\text{O}}}_{{{\text{3}}\left( {{\text{р - р}}} \right)}}}.$Оба эти процесса быстро протекают в приповерхностном слое капель, а их скорости пропорциональны площади их удельной поверхности: 3L/r. Здесь L – объемное содержание капельной влаги в газе (см3 аэрозоля/см3 воздуха).
Необходимые для вычислений скоростей этих ГХР удельные величины объема/поверхности частиц сульфатного аэрозоля в нижней стратосфере заимствовались из данных натурных экспериментов по измерению содержания серной кислоты в нижней стратосфере [10]. Физико-химические свойства переохлажденных капель (содержание серной кислоты – 50–78% вес.%, плотность – 1.4–1.8 г/мл, активность воды и свободных протонов – соответственно ∼2 ⋅ 10–3–0.3 и 3 ⋅ 102–3 ⋅ 105 моль/л и другие) рассчитывались с привлечением модели AIM (Atmospheric Inorganic Model) [11]. В расчетах использовались также данные о растворимости “резервуарных” хлорсодержащих газов (HCl, ClNO3) и N2O5, которые были получены в экспериментах (wetted wall flow tube technique [12] и других) по изучению динамики захвата газовых молекул переохлажденными растворами серной кислоты, а также данные об их вязкости и кинетике низкотемпературных жидкофазных химических реакций [13]. Высотные профили концентраций индивидуальных компонентов в газовой фазе (xi, см–3), а также температуры и относительной влажности (RH) в заданной географической точке рассчитывали с использованием двумерной интерактивной модели SOCRATES. Приводимые ниже результаты расчетов отвечают средним широтам (50° с.ш.) и летнему времени (июнь 1995 г.).
РЕЗУЛЬТАТЫ РАСЧЕТОВ И ИХ ОБСУЖДЕНИЕ
По результатам расчетов было найдено, что вопреки невысокой растворимости большинства компонент рассматриваемых нами семейств их высотные профили обнаруживают существенные изменения при учете захвата аэрозолем газовых молекул N2O5 и СlONO2. Так, концентрация NO2 – одной из компонент NOx-семейства – на высотах ≤17 км оказывается гораздо более низкой (на порядок величины [1]) в сравнении с рассчитанными нами в отсутствие ГХР. Еще более ощутимыми оказываются изменения концентраций N2O5 – предшественника NO2: N2O5(г)$\xrightarrow{{h{{\nu }}}}$ NO3(г) + NO2(г). Их величины оказываются на три-четыре порядка более низкими в сравнении с рассчитанными значениями [N2O5] в пренебрежении гидролизом (1). С быстрым захватом N2O5 частицами сульфатного аэрозоля вблизи нижней границы слоя Юнге связано и снижение в 3–4 раза на этих высотах концентраций радикалов ОН и НО2 – компонентов НОх-семейства. Их спад вызван снижением концентрации HNO3, обусловленным как растворением, так и уменьшением [OН] и [NO2] и, как результат, подавлением фотодиссоциации паров азотной кислоты. Спад на этих высотах концентрации ClO – компонента семейства ClOх, участвующего в разрушении озона, также связан с захватом хлорнитрата аэрозольными частицами по реакции (2).
Как отмечалось в работе [1], рассчитанные высотные профили концентраций компонентов семейств NOx, НОх и ClOx повторяют высотный профиль распределения массовой концентрации частиц слоя Юнге в нижней стратосфере. При этом, однако, максимумы концентраций ОН и ClO находятся на несколько больших высотах (на 1–3 км), чем минимум концентрации NO2. В случае радикала ОН причина смещения максимума их концентрации вверх – рост содержания озона, а в случае ClO – растущее с увеличением высоты над подстилающей поверхностью содержание резервуарных хлорсодержащих газов (HCl, ClONO2) – предшественников ClO, так как основной источник HCl и ClONO2 – хлорфторуглероды, которые располагаются на бóльших высотах.
Свидетельства изменений концентраций компонент семейств, участвующих в разрушении озона, вызванном частицами аэрозоля, находим, рассматривая данные цитировавшихся выше натурных экспериментов SPADA [6]. Так, на высоте ∼19 км (∼50° с.ш., ≈67 мБар, Т ≈ 216 К, середина мая 1993 г.) содержание NO2 по этим данным снижалось почти втрое, концентрации OH и НО2 возрастали примерно на 30–50%, а концентрация ClO – приблизительно вчетверо. При этом в качестве “базового уровня их содержания” (т.е. в отсутствие частиц слоя Юнге) рассматривались концентрации этих компонентов, рассчитанные в приближении отсутствия ГХР с частицами. Похожий рост демонстрируют концентрации радикалов ОН и ClO и по данным наших расчетов [1].
На рис. 1 показаны вертикальные профили рассчитанных парциальных скоростей разрушения озона в каталитических циклах HOx, NOx, ClOx и Ох, а также вертикальный профиль их суммарной скорости. При их расчетах в каждом из этих циклов в качестве звеньев продолжения цепи рассматривались те из них, которые характеризуются наименьшей скоростью и лимитируют динамику цикла в целом. К выводу о корректности данного подхода к расчетам w(–O3) авторы пришли в работе [14] при обсуждении иных, по нашему мнению, ошибочных подходов [15–17] к расчетам скорости цепного разрушения озона в нижней стратосфере. При вычислениях абсолютных значений w(–O3) принималось также во внимание, что концентрация компоненты O в семействе Ox определяется не только процессами внутри самого семейства, но также при взаимодействии с компонентами семейств HOx, NOx, ClOx, в которых разрушается озон [14].
Рис. 1.
Рассчитанные с учетом гетерогенных химических реакций с участием частиц слоя Юнге в нижней стратосфере высотные профили парциальных скоростей разрушения озона (тонкие линии) и вертикальный профиль их суммарной скорости (жирная кривая) в каталитических циклах HOx, NOx, ClOx и Ох для условий июня 1995 года на широте 50° с.ш. (см. текст). На вставке приводится сравнение высотных профилей суммарных скоростей разрушения озона с участием частиц слоя Юнге (1) и без их учета (2).
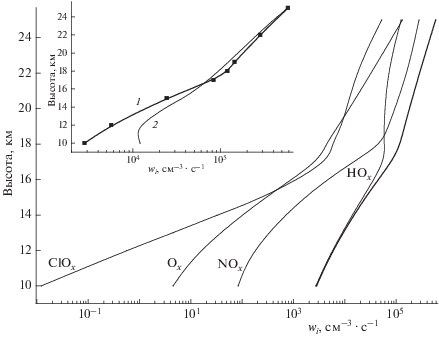
На вставке к рис. 1 приводится сопоставление вертикальных профилей рассчитанных нами значений суммарных скоростей разрушения озона в отсутствие ГХР (кривая 1) и и при их учете (кривая 2). Из этих данных следует, что влияние сульфатного аэрозоля на разрушение озона существенным образом изменяется в зависимости от высоты над подстилающей поверхностью, что связано с рассматривавшейся выше изменчивостью концентраций компонент этих семейств. Так, на высотах <16 км присутствие сульфатных частиц ингибирует разрушение озона. Это вызвано эффективным захватом из воздуха частицами аэрозоля газовых молекул N2O5, что обусловлено их быстрым гидролизом (1) в конденсированной фазе. Ключевой при этом оказывается конкуренция процессов фотораспада N2O5(г) с временем τhν (N2O5(г)$\xrightarrow{{h{{\nu }}}}$ NO3(г) + NO2(г)) и их захвата частицами аэрозоля (τзахв). При этом ввиду высокой скорости реакции (1) гидролиза молекул N2O5 [13] можно считать, что динамику этого процесса определяет динамика их захвата: τзахв = 4r/αϖL. Здесь α = 0.1 – так называемый коэффициент реакционного захвата N2O5 [13], а ϖ – средняя тепловая скорость молекул N2O5(г) в см/с. Оценки показывают, что диффузия в газе в процессе захвата N2O5(г) оказывается лимитирующей стадией лишь при r ≥ 10 мкм. На высотах до 16 км преобладающим в рассматриваемой конкуренции процессов оказывается захват N2O5(г). Его осуществление сопровождается снижением концентраций NO, NO2 и уменьшением скорости разрушения озона в азотном цикле (см. рис. 1). Одновременно, хотя и в гораздо меньшей степени, на этих высотах снижаются и концентрации ОН и НО2, что также приводит к уменьшению скоростей разрушения озона в HOx-цикле. Это негативное влияние частиц аэрозоля на скорости циклов HOx, NOx на этих высотах лишь отчасти компенсирует возросшая при этом скорость разрушения озона в циклах Ox и ClOx.
По мере подъема над подстилающей поверхностью объемная доля частиц аэрозоля снижается, и скорость захвата из воздуха молекул N2O5 спадает, т.е. τзахв растет. Напротив, коэффициент фотодиссоциации N2O5, ${{j}_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}$ = $\tau _{{h{{\nu }}}}^{{ - {\text{1}}}}$ по мере подъема над подстилающей поверхностью нарастает, что приводит к уменьшению времени жизни молекул N2O5 и росту скорости их фотораспада, т.е. τhν уменьшается. Все это приводит к росту концентраций NO, NO2(г) и увеличению скорости разрушения озона не только в азотном, но и в других циклах (см. рис. 1). Критическим оказывается объемное содержание частиц аэрозоля: Lкр ≥ 4r${{j}_{{{{{\text{N}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}$/3αϖ ≥ 3 ⋅ 10–13. Приведенная оценка Lкр находится в согласии с данными расчетов объемного содержания частиц сульфатного аэрозоля на нижней границе слоя Юнге (10 км). Основная часть молекул N2O5(г) переходит по этой причине в частицы сульфатного аэрозоля, что замедляет разрушение озона в циклах NOx и HOx.
На высотах от ≤17 до ≈23 км рассчитанные значения w(–O3)ГХР оказываются несколько меньшими (≈10–15%) в сравнении с w(–O3). Это значит, что на этих высотах присутствие в нижней стратосфере частиц аэрозоля способствует ускорению процесса разрушения озона. При этом активацию процесса его разрушения обеспечивает в основном рост скорости реакций HOx-цикла вследствие сохраняющегося на этих высотах подавления процессов ОН/HO2 + NO(NO2), хотя определенную роль играют также реакции ClOx-цикла (хлорная активация). На динамике разрушения озона сказывается и рост скорости разрушения озона в NOx-цикле по мере подъема, что маскирует активацию этого процесса в HOx- и ClOx-циклах. Как отмечалось, увеличение скорости разрушения озона в NOx-цикле обусловлено нарастанием концентраций NO, NO2 и NO3 по мере подъема вследствие снижения скорости захвата N2O5 из-за уменьшения концентрации частиц аэрозоля (см. вставку на рис. 1).
На высотах >22 км влияние частиц сульфатного аэрозоля на скорость разрушения озона практически вырождается. Это связано не только с уменьшением объемной доли частиц аэрозоля и ростом содержания в них серной кислоты по мере подъема над подстилающей поверхностью, но также с ростом скорости газофазных реакций. Причиной уменьшения объемной доли частиц аэрозоля служит нарастание температуры и снижение относительной влажности воздуха с ростом высоты над подстилающей поверхностью. Как следствие, серная кислота из сульфатных частиц переходит в газовую фазу, что ведет к испарению частиц сульфатного аэрозоля. С этими процессами связано и происхождение верхней границы слоя Юнге [2, 18]. На верхней границе последнего объемная доля частиц сульфатного аэрозоля снижается примерно втрое, а коэффициент фотодиссоциации возрастает приблизительно в 1.5 раза. В таких условиях это приводит к тому, что τзахв/τhν$ \gg $ 1 и основная часть молекул N2O5 остается в газовой фазе.
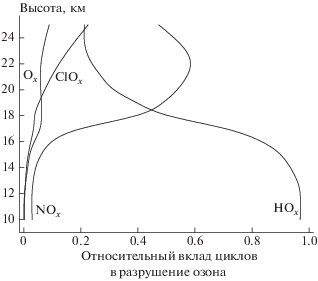
На рис. 2 показаны высотные профили относительных вкладов циклов ClOx, Ox, HOx и NOx в разрушение озона в летнее время на широте 50° с.ш. Видно, что на высотах <16 км доминирующим оказывается вклад реакций разрушения озона в HOx-цикле. На его долю при подъеме на высоту от 10 до 16 км приходится от ∼98% до ∼60% всего разрушаемого в нижней стратосфере озона, а на долю NOx-цикла на высотах <16 км – не более ≤10%. При этом в Ox- и ClOx-циклах в сумме разрушается не более 6% (∼2.2% + 3.7%) озона. Это заметно разнится с найденным в расчетах распределением вкладов этих циклов в разрушение озона при игнорировании ГХР с участием частиц слоя Юнге. Так, на долю Ox-, HOx-, ClOx- и NOx-циклов приходится соответственно ∼5%, ∼69%, ≤1% и ∼25%. Как отмечалось, это связано в основном с подавлением на этих высотах реакций разрушения озона в NOx-цикле, что вызвано эффективным захватом частицами аэрозоля молекул N2O5.
ЗАКЛЮЧЕНИЕ
В работе приводятся результаты численных расчетов с учетом влияния частиц слоя Юнге на скорость разрушения озона. Расчеты указывают на существенное влияние захвата из воздуха молекул N2O5 этими частицами на концентрации бóльшей части компонент NOx-, HOx- и ClOx-циклов разрушения озона. При этом рассматриваемые изменения концентраций компонентов этих семейств, а также изменения скоростей разрушения озона не связаны непосредственно с ГХР. Причиной этих изменений выступают лишь ГХР с участием N2O5/СlONO2 и частиц слоя Юнге. Их влияние обусловлено снижением концентраций компонентов NOx-семейства и подавлением реакций их компонент с компонентами семейств HOx и ClOx. Поэтому влияние захвата из воздуха молекул N2O5 необходимо учитывать даже в летнее время в расчетах динамики разрушения озона в каталитических HOx-, NOx-, ClOx- и Ох-циклах в нижней стратосфере.
Работа выполнена при поддержке Российским фондом фундаментальных исследований (проекты № 19-05-00080 и № 19-05-50007 (Микромир)), а также в рамках госзадания ФИЦ ХФ РАН им. Н.Н. Семёнова (регистрационный номер AAAA-А20-120011390097-9).
Список литературы
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2017. Т. 36. № 1. С. 90.
Junge C.E., Chagnon C.W. Manson J.E. // J. Meteorol. 1961. V. 18. P. 81.
Кумпаненко И.В., Рощин А.В., Иванова Н.А. и др. // Хим. физика. 2018. Т. 37. № 2. С. 25.
Зеленов В.В., Апарина Е.В., Козловский В.И., Сулименков И.В., Носырев А.Е. // Хим. физика. 2018. Т. 37. № 3. С. 72.
Алоян А.Е., Ермаков А.Н., Арутюнян В.О. // Хим. физика. 2019. Т. 38. № 1. С. 81.
Salawitch R.J., Wofsy S.C., Wennberg P.O. et al. // Geophys. Res. Let. 1994. V. 21. P. 2547.
Ларин И.К., Алоян А.Е., Ермаков А.Н. // Хим. физика. 2016. Т. 35. № 9. С. 76.
Voigt C., Schlager H., Luo B.P. et al. // Atmos. Chem. Phys. 2005. V. 5. P. 1371.
http://cdp.ucar.edu/browse/browse.htm?uri=http:// dataportal.ucar.edu/metadata/acd/software/Socrates/ Socrates.thredds.xml
Myhre G., Berglen T.F., Myhre C.L.E. et al. // Tellus. 2004. V. 56B. P. 294.
http://www.aim.env.uea.ac.uk/aim/aim.php
Hanson D.R. // J. Phys. Chem. A. 1998. V. 102. P. 4794.
Shi Q., Jayne J.T., Kolb C.E. et al. // J. Geophys. Res. 2001. V. 106. P. 24259.
Ларин И.К. // Хим. физика. 2017. Т. 36. № 3. С. 87.
Brasseur G., Solomon S. Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Third revised and enlarged edition. Montreal, Canada: Springer, 2005.
Jacob D.J. Introduction to Atmospheric Chemistry. Princeton: University Press, 1999.
Shimazaki T. Minor constituents in the middle atmosphere. Tokyo, Japan: Terra Scientific Publishing Company, 1985.
Carslaw K.S., Peter T., Clegg S.L. // Rev. Geophys. 1997. V. 35. P. 125.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика