Химическая физика, 2021, T. 40, № 6, стр. 10-13
Окисление со на покрытии из наночастиц палладия при подаче на него электрического напряжения
М. В. Гришин 1, А. К. Гатин 1, В. Г. Слуцкий 1, *, А. С. Федотов 2, В. А. Харитонов 1, Б. Р. Шуб 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
* E-mail: slutsky@.chph.ras.ru
Поступила в редакцию 12.02.2020
После доработки 28.08.2020
Принята к публикации 20.09.2020
Аннотация
Экспериментально установлена возможность увеличения каталитической активности покрытия из наночастиц палладия при окислении СО путем подачи на него положительного электрического напряжения. Подача на покрытие напряжения U = +10 В приводит к увеличению скорости окисления СО на 14% при 330 °С, атмосферном давлении и начальном составе смеси 1.8% СО + 10.2% О2 + Ar.
ВВЕДЕНИЕ
Палладий и платина (в виде покрытий из наночастиц) используются как катализаторы окисления СО в конверторах, которыми оснащаются современные автомобили для снижения вредных выбросов в выхлопных газах [1–4]. Увеличение активности указанных катализаторов является актуальной задачей, решение которой будет способствовать как увеличению экологической чистоты двигателей внутреннего сгорания, так и снижению стоимости конверторов за счет уменьшения требуемой для окисления СО массы дорогостоящих катализаторов из благородных металлов.
В настоящее время основным приемом, позволяющим влиять на активность каталитических нанопокрытий, является изменение материала подложки, на которую наносится покрытие (см. обзоры [5, 6]). В общем случае подложка может оказывать следующие воздействия на состояние нанесенных на нее наночастиц: предотвращать слипание наночастиц либо способствовать их агрегации, изменять форму, состав и заряд наночастиц, стабилизировать промежуточные продукты реакции. В результате этих воздействий химические свойства наночастиц могут изменяться в широких пределах. В работах [7–13] рассмотрена взаимосвязь между каталитическими свойствами покрытий и такими их характеристиками, как элементный состав, форма, размеры и электронное строение наночастиц, а также среднее межчастичное расстояние и природа подложки.
Впервые возможность увеличения активности электропроводящих каталитических покрытий из наночастиц путем подачи на них электрического напряжения от внешнего источника установлена в нашей работе [14]. Примером катализируемой реакции было разложение аммиака, а примером нанопокрытия – покрытие из электропроводящих борорганических наночастиц со средним размером 14.6 нм состава (C2B10H4)n. В наших ранних экспериментах [14] подача на покрытие из борорганических наночастиц положительного напряжения U = +6 В приводила к увеличению скорости разложения NH3 на 26%.
Работоспособность указанного метода применительно к покрытиям из наночастиц платины продемонстрирована в наших опытах по каталитическому гидрированию этилена и окислению СО на таких покрытиях. Показано, что увеличение скорости гидрирования C2H4 составляло 40% при подаче на покрытие положительного напряжения U = +10 В [15], а при окислении СО подача на покрытие напряжения +10 или +30 В приводила к увеличению скорости реакции на 18 и 54% соответственно [16, 17]. В то же время эффект от подачи на покрытия из наночастиц платины отрицательного напряжения был существенно ниже.
Цель данной работы – экспериментальное доказательство возможности увеличения каталитической активности покрытий из наночастиц палладия при окислении СО разработанным нами методом – путем подачи на покрытия положительного электрического напряжения.
ЭКСПЕРИМЕНТАЛЬНЫЕ УСЛОВИЯ
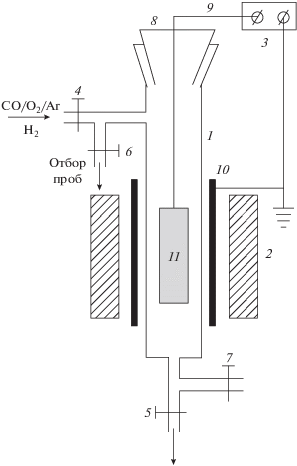
Эксперименты по окислению СО в смеси начального состава 1.8% СО + 10.2% О2 + Ar проводили при температуре 330 °С и атмосферном давлении в статической установке, состоящей из вертикального реактора 1, электронагреваемой печи 2 и источника напряжения 3 (рис. 1). Реактор состоял из стеклянной трубки высотой 250 мм с внутренним диаметром 5 мм, снабженной вентилями 4–7 и разъемным шлифом 8 с впаянным в него электродом 9 из молибденовой проволоки диаметром 0.25 мм. Электрод подсоединяли к незаземленной клемме источника напряжения 3. Заземленную клемму соединяли с металлической фольгой 10, охватывающей стеклянную трубку реактора. К электроду крепили алюминиевую пластину 11 размером 100 × 3 мм с нанесенным на нее с двух сторон покрытием из наночастиц палладия. Нанесение покрытия осуществлялось следующим образом. Вначале на каждую из сторон пластины наносили и высушивали на воздухе 150 мкл водного раствора нитрата палладия Pd(NO3)2 c содержанием палладия 0.3 ⋅ 10–2 мг/мл. Затем пластину подсоединяли к электроду 9 и с помощью шлифа 8 помещали в реактор, где в потоке водорода (30 мл/мин) ее прогревали с использованием печи 2 до 480 °С в течение 4 ч. При этом происходило разложение Pd(NO3)2 и на пластине образовывалось палладиевое покрытие. После этого печь выключали и приготовленный образец пластины с покрытием из наночастиц охлаждали до комнатной температуры в потоке водорода. Затем реактор продували смесью CO/O2/Ar указанного состава (расход смеси – 30 мл/мин), вентили 4 и 5 закрывали, и в таком виде реактор оставляли на несколько часов до начала экспериментов.
Эксперименты начинали с прогрева реактора до 330 °С в потоке исходной смеси с расходом 30 мл/мин при открытых вентилях 4 и 5 (рис. 1). После этого проводили три серии экспериментов. В первой серии напряжение U от источника 3 на образец 11 с паладиевым покрытием не подавали (U = 0). Первый опыт этой серии начинали сразу после достижения реактором температуры в 330 °С. После этого реактор дополнительно продували исходной смесью с указанным расходом в течение 5 мин. Затем вентили 4 и 5 закрывали и заполнившую реактор смесь выдерживали в нем в течение 10 мин. По истечении этого времени вентили 6 и 7 открывали и с помощью подсоединенного к вентилю 6 шприца проводили отбор пробы из реактора для хроматографического анализа состава продуктов реакции. Затем реактор опять продували исходной смесью (время продувки – 5 мин, расход смеси – 30 мл/мин) и аналогично первому проводили второй, а затем и третий опыты с целью оценки воспроизводимости результатов.
После этого на палладиевое покрытие подавали положительное напряжение U = +10 В и начинали вторую серию экспериментов. Реактор снова продували исходной смесью в течение 5 мин с расходом смеси 30 мл/мин, закрывали реактор и выдерживали в нем смесь в течение 10 мин, осуществляли отбор пробы из реактора и хроматографически определяли содержание СО и СО2 в отобранной пробе. Подобную процедуру проводили трижды. Затем напряжение отключали (U = 0) и по той же методике, что и в экспериментах с подачей напряжения на образец, определяли состав продуктов реакции при отсутствии напряжения на платиновом покрытии. Повторное проведение экспериментов при U = 0 связано с тем, что подача на образец напряжения могла приводить к частичному уносу с образца заряженных палладиевых наночастиц под действием электрического поля и последующему их уносу из реактора во время его продувки свежей смесью. Третья серия экспериментов полностью повторяла вторую серию для доказательства воспроизводимости результатов.
Для оценки влияния материала подложки на окисление СО проводили контрольные опыты, в которых использовали алюминиевую пластину без покрытия. Опыты проводили по той же методике, что и опыты с палладиевым покрытием.
Структуру палладиевого нанопокрытия, созданного на алюминиевой подложке описанным выше методом, определяли по данным сканирующей туннельной микроскопии. Этот метод использовался нами ранее для определения физико-химических свойств структурированных на наноуровне покрытий, в том числе в условиях воздействия внешнего электрического поля [18, 19].
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
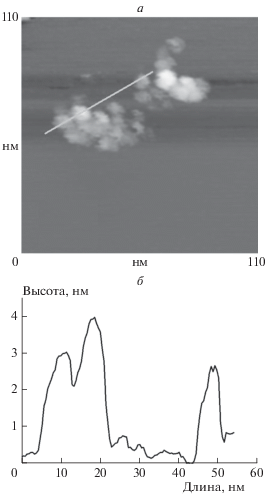
На рис. 2 приведено топографическое изображение палладиевого покрытия на поверхности алюминиевой пластины (а) и его профиль (б). Как следует из этого рисунка, покрытие состоит из наночастиц с характерным размером 0.5–5 нм.
Рис. 2.
Топографическое изображение палладиевого нанопокрытия на поверхности алюминиевой пластины (а) и профиль покрытия (б) вдоль линии, указанной на фотографии.
На рис. 3 приведены экспериментальные данные по степени превращения (конверсии) СО в СО2, которая определяется по формуле
Рис. 3.
Конверсия CO на палладиевом нанопокрытии с последовательной подачей на него напряжения. Светлые точки – U = 0, черные точки – U = +10 В. Опыты проведены при 330 °С, атмосферном давлении, начальном составе смеси 1.8% СО + 10.2% О2 + Ar и времени экспозиции 10 мин.
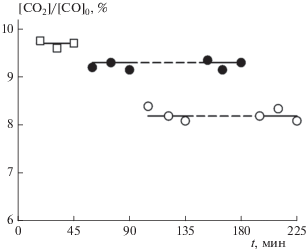
как без подачи на палладиевое покрытие электрического напряжения (U = 0) (светлые точки), так и при U = +10 В (черные точки). Из рис. 3 следует, что после подачи на покрытие положительного напряжения степень конверсии в последующих опытах с U = 0 уменьшается по сравнению с этим же параметром до подачи напряжения. В условиях эксперимента такое падение составляет 15%. Это означает, что при подаче напряжения на образец и возникновения заряда на палладиевых наночастицах часть из них уносится с поверхности образца под действием электрического поля с последующим уносом их из реактора во время его продувки. В результате количество наночастиц на образце уменьшается, что и объясняет падение каталитической активности образца после подачи на него напряжения.
Обнаруженный эффект уноса означает, что для корректного определения влияния напряжения на каталитическую активность образца с покрытием из наночастиц палладия необходимо сравнивать степень конверсии СО при подаче напряжения со степенью конверсии СО при U = 0 после экспериментов с подачей напряжения. Сравнивая подобным образом данные рис. 3 при U = +10 В с данными при U = 0 после экспериментов с подачей напряжения заключаем, что в условиях эксперимента подача на палладиевое покрытие напряжения U = +10 В приводит к увеличению каталитической активности покрытия на 14%. Отметим, что в контрольных опытах с образцом без палладиевого покрытия конверсия CO не наблюдалась как при U = 0, так и при U = +10 В.
Таким образом, полученные результаты свидетельствуют о возможности увеличения каталитической активности покрытий из наночастиц палладия при окислении СО путем подачи на него положительного напряжения.
ЗАКЛЮЧЕНИЕ
Впервые экспериментально доказана возможность увеличения каталитической активности покрытия из наночастиц палладия при окислении СО путем подачи на него положительного электрического напряжения. В условиях эксперимента при 330 °С, атмосферном давлении и начальном составе смеси 1.8% СО + 10.2% О2 + Ar скорость окисления СО возрастает на 14% при подаче на покрытие напряжения U = +10 В.
Работа выполнена в рамках госзадания ФИЦ ХФ РАН (тема 45.9, 0082-2014-0011).
Список литературы
Csere C. // Car and Driver. 1988. V. 33. № 7. P. 63.
Kaspar J., Fornasiero P., Graziani M. // Catalysis Today. 1999. V. 50. № 2. P. 285.
Brandt E., Wang Y., Grizzle J. // IEEE Trans. Control Syst. Technol. 2000. V. 8. № 5. P. 767.
Алексахин А.В., Кириченко А.С. // Экономика в промышленности. 2013. № 4. С. 3.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. № 2. С. 167.
Roldan Cuenya B. // Thin Solid Films. 2010. V. 518. P. 3127.
Гришин М.В., Гатин А.К., Дохликова Н.В., Кирсанкин А.А., Кулак А.И., Николаев С.А., Шуб Б.Р. // Кинетика и катализ. 2015. Т. 56. № 4. С. 532.
Эллерт О.Г., Цодиков М.В., Николаев С.А., Новоторцев В.М. // Успехи химии. 2014. Т. 83. № 8. С. 718.
Николаев С.А., Смирнов В.В., Васильков А.Ю., Подшибихин В.Л. // Кинетика и катализ. 2010. Т. 51. № 3. С. 396.
Simakova I.L., Solkina Yu.S., Moroz B.L. et al. // Appl. Catal. A: General. 2010. V. 385. № 1–2. P. 136.
Roldan Cuenya B., Behafarid F. // Surf. Sci. Rep. 2015. V. 70. P. 135.
Ланин С.Н., Пичугина Д.А., Шестаков А.Ф. и др. // ЖФХ. 2010. Т. 84. № 12. С. 2330.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2015. Т. 34. № 7. С. 3.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Цыганов С.А., Шуб Б.Р. // Хим. физика. 2016. Т. 35. № 6. С. 85.
Корчак В.Н., Гришин М.В., Быховский М.Я., Гатин А.К., Слуцкий В.Г., Харитонов В.А., Цыганов С.А., Шуб Б.Р. // Хим. физика. 2017. Т. 36. № 11. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Федотов А.С., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2020. Т. 39. № 3. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г., Федотов А.С., Харитонов В.А., Шуб Б.Р. // Хим. физика. 2020. Т. 39. № 5. С. 84.
Гатин А.К., Гришин М.В., Колченко Н.Н., Сарвадий С.Ю., Шуб Б.Р. // Хим. физика. 2017. Т. 36. № 3. С. 81.
Гатин А.К., Гришин М.В., Сарвадий С.Ю., Шуб Б.Р. // Хим. физика. 2018. № 3. С. 48.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика