Химическая физика, 2021, T. 40, № 6, стр. 33-37
Взаимосвязь констант ингибирования матриксной металлопротеиназы-2 олигопептидом APP-IP и его мутантными формами и электронных дескрипторов связывания
А. М. Кулакова 1, М. Г. Хренова 1, 2, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт биохимии им. А.Н. Баха Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
Москва, Россия
* E-mail: khrenova.maria@gmail.com
Поступила в редакцию 04.06.2020
После доработки 27.06.2020
Принята к публикации 20.07.2020
Аннотация
Для комплексов металлопротеиназы-2 с ингибитором APP-IP и его мутантными формами рассчитаны дескрипторы электронной плотности и показано, что функция локализации электронов ELF координационной связи катиона цинка и атома лиганда показывает различия в экспериментально наблюдаемых константах ингибирования.
1. ВВЕДЕНИЕ
Матриксные металлопротеиназы (MMP) – семейство внеклеточных цинкзависимых эндопептидаз, регулирующих постоянство состава внеклеточного матрикса. При развитии онкологических заболеваний в ряде случаев происходит неконтролируемый рост концентрации активной формы этих ферментов, что приводит к ускорению распространения метастазов. Поэтому актуальной задачей является разработка соединений, селективно ингибирующих эти белки [1, 2].
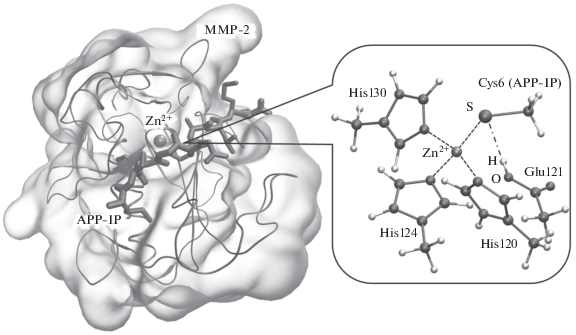
В недавней работе было показано, что олигопептид-предшественник β-амилоида APP-IP является селективным ингибитором матриксной металлопротеиназы второго типа – MMP-2 [3]. На основании данных рентгеноструктурного анализа показано, что при образовании нековалентного комплекса фермента с ингибитором аминокислотный остаток Asp6 образует координационную связь с катионом цинка активного центра. При этом остальные аминокислотные остатки олигопептида APP-IP располагаются в связывающих карманах на поверхности белка (рис. 1). В более поздних работах были экспериментально изучены мутантные формы APP-IP с точечными аминокислотными заменами Asp6Cys (APP-IP-Asp6Cys) и Asp6Ser (APP-IP-Asp6Ser). Цистеиновый мутант оказался более слабым ингибитором, чем исходный APP-IP. Их константы ингибирования составляют 7 ⋅ 10–6 и 4 ⋅ 10–8 М соответственно. При этом сериновый мутант APP-IP-Asp6Ser не проявлял ингибирующую способность вплоть до концентрации 10–4 М [4].
Рис. 1.
КМ/ММ-модель комплекса MMP-2 с ингибитором APP-IP-Asp6Cys. Прозрачной изоповерхностью и лентами показан белок MMP-2, стержнями – APP-IP-Asp6Cys. Шаростержневое представление соответствует активному центру фермента, координационные связи цинка показаны штриховыми линиями, водородная связь обозначена штрих-пунктирной линией.
В данной работе предлагается интерпретация наблюдаемой закономерности на основании изучения электронно-плотностных характеристик комплексов фермент–ингибитор, а также модельных систем, содержащих ацетат, метанол и метантиол, сольватированных молекулами воды.
2. МОДЕЛИ И МЕТОДЫ
В работе исследуется электронная плотность для трех модельных систем, представляющих собой комплексы MMP-2 с APP-IP или его мутантными формами; структуры комплексов с APP-IP и APP-IP-Asp6Cys были ранее исследованы в работе [5]. Эти структуры получены по результатам расчетов комбинированным методом квантовой механики/молекулярной механики (КМ/ММ) равновесных геометрических параметров систем, состоящих из белковой макромолекулы, олигопептидного ингибитора, катиона цинка активного центра фермента, структурообразующих катионов кальция и цинка, а также молекул воды, сольватирующих белок. Описание квантовомеханической подсистемы проводилось зарекомендовавшим себя [6] методом функционала электронной плотности в варианте PBE0/6-31G** [7], атомы белковой макромолекулы и катионы металла классической подсистемы описывались силовым полем AMBER [8], а молекулы воды – набором параметров TIP3P [9].
Для изучения систем в водном растворителе использовали кластерную модель с микросольватацией, т.е. добавляли несколько молекул воды для насыщения изучаемой молекулы водородными связями: в случае ацетата – 5 молекул воды, в случае метанола и метантиола – по три молекулы воды. Расчеты также проводились методом PBE0/6-31G**. Все квантовохимические и КМ/ММ-расчеты проводились в программном пакете NWChem [10]. Для анализа электронной плотности использовался программный пакет Multiwfn [11]. В рамках квантово-топологической теории атомов в молекулах [12] находились критические точки связи (КТС), являющиеся седловыми точками электронной плотности и характеризующие взаимодействующие пары атомов. В данной работе нас интересовали координационные связи цинка и боковой цепи шестого остатка ингибитора, а также водородная связь шестого остатка ингибитора с аспартатом активного центра (цистеина, аспартата или серина; см. рис. 1). Для систем с микросольватацией анализировались водородные связи изучаемых молекул с молекулами воды. Важность изучения этих связей показана в работах [13–15]. В качестве дескрипторов электронной плотности в КТС использовали саму электронную плотность ρb, лапласиан электронной плотности ∇2ρb, эллиптичность ε, плотность электронной энергии Hb, функцию локализации электронов ELF, локатор локализованных орбиталей LOL и индекс η, определяющийся как абсолютная величина отношения наименьшего и наибольшего собственных значений гессиана электронной плотности и характеризующий связь. Эти дескрипторы были успешно применены для объяснения различий в реакционной способности цефалоспориновых соединений в бактериальных цинк-зависимых ферментах – металло-β-лактамазах [16–18]. Для визуализации трехмерных моделей использована программа VMD [19].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Анализ взаимодействий в комплексах MMP-2 – олигопептид
В табл. 1 представлены электронно-плотностные характеристики изучаемых систем. Все рассматриваемые координационные и водородные связи удовлетворяют условиям для лапласиана электронной плотности ∇2ρb > 0 и плотности электронной энергии Hb < 0 в КТС, что соответствует промежуточному типу связей между ковалентными и нековалентными взаимодействиями [20]. Среди всех комплексов наибольшим значением индекса η характеризуется координационная связь S⋅⋅⋅Zn, что говорит о ее наибольшем ковалентном характере среди трех рассматриваемых типов координационных связей между цинком и функциональной группой [21]. Это наблюдение полностью соответствует многочисленным экспериментальным данным о структурообразующей функции координационной связи атома серы остатка цистеина и катиона цинка [22], например в случае образования мотива цинкового пальца [5]. Если сравнить между собой системы, в которых атомы кислорода образуют координационные связи с катионом цинка, можно заметить, что индекс η одинаковый для связи O2⋅⋅⋅Zn в системе с карбоксилатом и для связи цинка с алкоголятом (табл. 1). При этом координационная связь в системе с остатком серина короче, чем в системе с аспартатом. Это связано с тем, что в комплексе с APP-IP координационное число цинка возрастает до 5, что не является типичным для катиона Zn2+.
Таблица 1.
Свойства координационных и водородных связей в модельных системах: равновесные расстояния R (Å) и дескрипторы в критических точках связи (электронная плотность ρb (а.е.), лапласиан электронной плотности ∇2ρb (а.е.), эллиптичность ε, плотность электронной энергии Hb (а.е.), функция локализации электронов ELF, локатор локализованных орбиталей LOL и индекс η
| Связь | R | ρb | ∇2ρb | ε | Hb | ELF | LOL | η |
|---|---|---|---|---|---|---|---|---|
| Комплекс APP-IP с MMP-2 | ||||||||
| O1⋅⋅⋅Zn | 2.23 | 0.047 | 0.196 | 0.042 | –0.006 | 0.092 | 0.241 | 0.188 |
| O2⋅⋅⋅Zn | 2.09 | 0.068 | 0.253 | 0.024 | –0.020 | 0.131 | 0.280 | 0.217 |
| O⋅⋅⋅H | 1.66 | 0.053 | 0.151 | 0.022 | –0.002 | 0.220 | 0.347 | 0.278 |
| Сумма | 0.167 | |||||||
| Комплекс APP-IP-Asp6Cys с MMP-2 | ||||||||
| S⋅⋅⋅Zn | 2.28 | 0.073 | 0.139 | 0.067 | –0.027 | 0.258 | 0.371 | 0.274 |
| H⋅⋅⋅S | 2.39 | 0.020 | 0.039 | 0.058 | –0.001 | 0.143 | 0.291 | 0.262 |
| Сумма | 0.093 | |||||||
| Комплекс APP-IP-Asp6Ser с MMP-2 | ||||||||
| O⋅⋅⋅Zn | 1.91 | 0.098 | 0.375 | 0.022 | –0.044 | 0.157 | 0.302 | 0.217 |
| H⋅⋅⋅O | 1.41 | 0.100 | 0.105 | 0.039 | –0.045 | 0.431 | 0.465 | 0.418 |
| Сумма | 0.197 | |||||||
| Ацетат с микросольватацией | ||||||||
| O⋅⋅⋅HO(вода) | 2.04 | 0.023 | 0.064 | 0.005 | –0.001 | 0.089 | 0.238 | 0.233 |
| » | 1.75 | 0.041 | 0.117 | 0.013 | –0.001 | 0.177 | 0.317 | 0.259 |
| » | 2.00 | 0.025 | 0.068 | 0.007 | –0.001 | 0.100 | 0.250 | 0.239 |
| » | 2.08 | 0.021 | 0.058 | 0.067 | –0.001 | 0.079 | 0.226 | 0.235 |
| » | 1.70 | 0.046 | 0.131 | 0.044 | –0.001 | 0.202 | 0.335 | 0.271 |
| Сумма | 0.156 | |||||||
| Метантиол с микросольватацией | ||||||||
| SH⋅⋅⋅O(вода) | 2.01 | 0.026 | 0.060 | 0.043 | –0.002 | 0.129 | 0.278 | 0.262 |
| S⋅⋅⋅HO(вода) | 2.85 | 0.007 | 0.027 | 0.333 | 0.001 | 0.020 | 0.127 | 0.163 |
| » | 2.34 | 0.022 | 0.048 | 0.062 | –0.001 | 0.127 | 0.276 | 0.256 |
| Сумма | 0.055 | |||||||
| Метанол с микросольватацией | ||||||||
| OH⋅⋅⋅O(вода) | 1.76 | 0.038 | 0.114 | 0.041 | 0.0001 | 0.155 | 0.300 | 0.254 |
| O⋅⋅⋅HO(вода) | 1.94 | 0.035 | 0.107 | 0.068 | –0.0001 | 0.140 | 0.287 | 0.249 |
| » | 1.80 | 0.028 | 0.077 | 0.062 | –0.001 | 0.111 | 0.261 | 0.249 |
| Сумма | 0.101 | |||||||
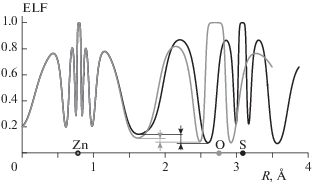
Еще одной характеристикой электронной плотности является функция локализации электронов ELF. Анализ профилей ELF применяется для определения силы водородной связи [23]. Мерой количественной оценки служит индекс CVB (core-valence bifurcation), определяемый как разность значений ELF в минимуме, соответствующем границе между остовной и валентной областями атома, донирующего электронную пару в нековалентное взаимодействие, и в минимуме между валентными областями двух атомов. На рис. 2 представлены профили ELF для двух координационных связей в системах с остатком цистеина и серина. Из этих профилей можно видеть, что индекс CVB для связи Zn⋅⋅⋅S значительно превышает таковой для связи Zn⋅⋅⋅O. Это обстоятельство дополнительно подтверждает вывод о том, что координационная связь с атомом серы является более прочной.
Взаимодействия функциональных групп с молекулами воды
Для описания взаимодействий функциональных групп в растворе использовалась модель микросольватации (подробнее см. в разд. 2). Проводилось изучение водородных связей молекул ацетата, метанола и метантиола с молекулами воды. Метанол и метантиол находились в нейтральной форме, что соответствовало условиям ферментативных экспериментов. Для всех исследуемых систем водородные связи характеризуются небольшим отрицательным или небольшим положительным значениями Hb, что говорит о сильных водородных связях и связях средней силы.
Факторы, определяющие константы ингибирования
Процессы образования комплексов белок–ингибитор происходят в водных растворах, поэтому при определении параметров связывания необходимо сопоставить взаимодействия с участием лиганда в растворе и в белке. Значения плотности электронной энергии Hb значительно выше (менее отрицательные) в расчетах в рамках модели микросольватации, чем в активном центре фермента, что свидетельствует о более слабых взаимодействиях в первом случае. Далее сравнивались значения электронной плотности в критической точке связи в белковых и кластерных моделях. Такое сравнение показывает, что суммарная электронная плотность, приходящаяся на все взаимодействия, в белке выше. При этом значения для систем с ингибиторами APP-IP и APP-IP-Asp6Cys сравнимы. В то же время для системы с APP-IP-Asp6Ser наблюдается двукратное изменение электронной плотности при переходе от сольватационной оболочки к активному центру фермента. На данном этапе исследования сложно дать однозначную интерпретацию взаимосвязи ингибирующей способности и разности электронной плотности в КТС. Возможно, чрезмерное накопление электронной плотности в КТС приводит к увеличению стерической электронной энергии, что дестабилизирует такие взаимодействия. Интерпретация данного факта, а также анализ нелокальных дескрипторов электронной плотности будут проводиться в последующих работах.
4. ЗАКЛЮЧЕНИЕ
Методами квантовой химии и КМ/ММ исследованы комплексы олигопептидных ингибиторов на основе APP-IP с MMP-2, а также модельные соединения со спиртовой, карбоксильной и тиольной группами в водном окружении. Взаимодействия этих функциональных групп количественно охарактеризованы с помощью дескриптора электронной плотности, связанного с функцией локализации электронов ELF и рассчитанного в критических точках связей. Это позволило интерпретировать отсутствие ингибирующей способности мутантной формы APP-IP-Asp6Ser.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (проект № 18-03-00605) с использованием оборудования Центра коллективного пользования сверхвысокопроизводительными вычислительными ресурсами МГУ им. М.В. Ломоносова.
Список литературы
Vandenbroucke R.E., Libert C. // Nat. Rev. Drug Discov. 2014. V. 13. P. 904; https://doi.org/10.1038/nrd4390
Ndinguri M.W., Bhowmick M., Tokmina-Roszyk D., Robichaud T.K., Fields G.B. // Molecules. 2012. V. 17. Issue 12. P. 14230; https://doi.org/10.3390/molecules171214230
Hashimoto H., Takeuchi T., Komatsu K. et al. // J. Biol. Chem. 2011. V. 286. P. 33236; https://doi.org/10.1074/jbc.M111.264176
Khrenova M.G., Solovyev I.D., Lapshin G.D., Savitsky A.P. // Mendeleev Commun. 2017. V. 27. Issue 2. P. 157; https://doi.org/10.1016/j.mencom.2017.03.017
Khrenova M.G., Savitsky A.P., Topol I.A., Nemukhin A.V. // J. Phys. Chem. B. 2014. V. 118. Issue 47. P. 13505; https://doi.org/10.1021/jp5088702
Метелешко Ю.И., Немухин А.В., Хренова М.Г. // Хим. физика. 2019. Т. 38. № 6. С. 3.
Adamo C., Barone V. // J. Chem. Phys. 1999. V. 110. P. 6158; https://doi.org/10.1063/1.478522
Cornell W.D., Cieplak P., Bayly C.I. et al. // J. Amer. Chem. Soc. 1995. V. 117. Issue 19. P. 5179; https://doi.org/10.1021/ja00124a002
Jorgensen W.L., Chandrasekhar J., Madura J.D., Impey R.W., Klein M.L. // J. Chem. Phys. 1983. V. 79. Issue 2. P. 926; https://doi.org/10.1063/1.445869
Valiev M., Bylaska E. J., Govind N. et al. // Comput. Phys. Commun. 2010. V. 181. Issue 9. P. 1477; https://doi.org/10.1016/j.cpc.2010.04.018
Lu T., Chen F. // J. Comput. Chem. 2012. V. 33. Issue 5. P. 580; https://doi.org/10.1002/jcc.22885
Bader R.F.W. Atoms in Molecules – A Quantum Theory. Oxford University Press, 1990.
Майоров В.Д., Волошенко Г.И., Кислина И.С., Тараканова Е.Г. // Хим. физика. 2020. Т. 39. № 1. С. 7.
Тарасов Д.Н., Тигер Р.П. // Хим. физика. 2019. Т. 38. № 5. С. 45.
Абдуллаев А.А., Рабаданов Г.А. // Хим. физика. 2018. Т. 37. № 3. С. 3.
Хренова М.Г., Томилко А.В., Цирельсон В.Г. // Вестн. МГУ. Сер. 2, Химия. 2019. Т. 60. № 3. С. 141.
Khrenova M.G., Tsirelson V.G. // Mendeleev Commun. 2019. V. 29. Issue 5. P. 492; https://doi.org/10.1016/j.mencom.2019.09.004
Khrenova M.G., Krivitskaya A.V., Tsirelson V.G. // New J. Chem. 2019. V. 43. P. 7329; https://doi.org/10.1039/c9nj00254e
Humphrey W., Dalke A., Schulten K. // J. Mol. Graph. 1996. V. 14. Issue 1. P. 33; https://doi.org/10.1016/0263-7855(96)00018-5
Bader R.F.W., Essen H. // J. Chem. Phys. 1984. V. 80. P. 1943; https://doi.org/10.1063/1.446956
Niepötter B., Herbst-Irmer R., Kratzert D. et al. // Angew. Chem. Intern. Ed. 2014. V. 53. Issue 10. P. 2766; https://doi.org/10.1002/anie.201308609
Laitaoja M., Valjakka J., Jänis J. // Inorg. Chem. 2013. V. 52. Issue 19. P. 10983; https://doi.org/10.1021/ic401072d
Fuster F., Silvi B. // Theor. Chem. Acc. 2000. V. 104. Issue 1. P. 13; https://doi.org/10.1007/s002149900100
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика