Химическая физика, 2021, T. 40, № 7, стр. 11-15
Поглощение кислорода тройной системой эпоксид стирола – хлорид меди(II) – ионол в растворе метанола
Л. В. Петров 1, *, В. М. Соляников 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: plv@icp.ac.ru
Поступила в редакцию 29.06.2020
После доработки 16.11.2020
Принята к публикации 20.11.2020
Аннотация
Изучено окисление молекулярным кислородом тройной системы эпоксид стирола (ЭС) – CuCl2 – ионол (ИОЛ) в растворе метанола. Найдено, что скорость окисления V прямо пропорциональна [ИОЛ], порядки по ЭС и хлориду меди дробные, равные 0.4 и 0.5 соответственно. Впервые показано, что поглощение кислорода свойственно аналогичным тройным системам, включающим вместо ЭС эпоксиды иного строения. Обнаружена специфика действия хлорид-аниона в окислении: тройная система ЭС – ацетат Cu(II) – ионол кислорода не поглощает. Введение в эту систему хлорида натрия активирует окисление. Система ЭС – NaCl – ионол не окисляется, но введение в нее ацетата Cu(II) вызывает поглощение кислорода. Эксперимент доказывает необходимость присутствия хлорид-аниона для окисления тройной системы.
Изучение химии лабильных органических соединений эпоксидов, производных гетероцикла оксирана, в последние 25 лет привело к ряду результатов, дополняющих прежние представления о механизмах превращения эпоксидов как о чисто гетеролитических процессах. Так, данные о хорошо известной способности эпокисей реагировать с нуклеофилами (вода, спирты, амины и другие реагенты) в присутствии кислот или металлорганических соединений, использующихся в качестве катализаторов гетеролитических реакций [1–3], дополнены недавними результатами изучения расходования гидропероксидов в тройной системе ЭС – п-толуолсульфокислота (ТСК) – ROOH [4] и спектрального исследования тройной системы ЭС – ТСК – пиридин с обнаружением образования карбена фенилметилена [5] – активной промежуточной частицы. Давно замечена термостабильность оксирановых циклов даже в присутствии радикальных инициаторов [6]. Соответственно, медленно, с короткими цепями окисляется эпоксид стирола в присутствии инициатора при 140 °С [7]. Однако легко поглощают кислород двойные системы ЭС – кислота при температуре 70 °С [8, 9]. Высокотемпературная реакция ЭС с α-нафтолом в присутствии ТСК (тройная система) протекает с образованием продуктов, отвечающих классике гетеролитической реакции [10]. Однако изучение тройных систем ЭС – кислота – гидрохинон и ЭС – хлорид меди(II) – α-нафтол при температурах на ~75 °C ниже обнаружило альтернативный гетеролизу маршрут окисления этих систем кислородом с образованием бензальдегида – продукта расщепления кольца исходного фенилоксирана [11–13].
В этой статье представлены результаты изучения реакции поглощения кислорода тройной системой ЭС – CuCl2 – ионол (ионол, или 2,6-ди-трет-бутил-4-метилфенол – ингибитор, используемый в науке и практике окисления углеводородов). Статья продолжает серию работ по изучению окисления тройных систем эпоксид – катализатор – ингибитор [14]. Данных по изучению сложного механизма окисления таких систем недостаточно для создания модели механизма даже первого приближения. Поэтому целесообразно расширение круга объектов исследований такого рода. Центральный вопрос этих исследований можно сформулировать так: в чем общность и различие механизмов окисления двойной системы ЭС – кислота и тройных систем ЭС – кислота – ингибитор и ЭС – соль металла – ингибитор [5, 11, 15]? Конкретнее: различается ли природа частиц, образующихся и реагирующих с кислородом в этих системах, или же это обнаруженный ранее фенилметилен [5]? Практический аспект этого направления связан с поиском перспективных систем для использования их в качестве новых радикальных инициаторов на эпоксидной, а не на гидропероксидной [16, 17] основе. Нужны системы с высоким отношением скоростей окисления $\left( {{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \right)$ и расходования эпоксида (VЭС). Экспериментально полученная величина ${{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{{V}_{{{\text{ЭС}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{ЭС}}}}}}}$ > 0.5 для какой-либо системы была бы обнадеживающим показателем в этом плане.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованный в работе ионол предварительно перекристаллизовывали из этанола для очистки. Растворитель метанол очищали в процессе ректификации. Соль CuCl2 · 2H2O марки “Ч” использовали без дополнительной очистки. Опыты в стеклянной барботажной ячейке, отбор проб и последующий количественный анализ методом высокоэффективной жидкостной хроматографии проводили так же, как и в работе [13]. Пробы (0.5 мкл) через дозатор вводили в стандартные стеклянные колонки (150 × 3 мм) чешского жидкостного хроматографа “ГПЦ” с УФ-детектором LCD 2563. В основном определении эпоксида стирола (УФ-254) использована колонка с наполнителем “Separon SGX CN” с размером частиц 5–7 мкм и элюент н-гептан + 0.1 об.% изопропанола при давлении на входе в колонку 4 МПа и скорости потока 0.5 мл/мин. Ионол (УФ-313) анализировали на колонке с обращенной фазой “Separon SGX C18” (размер частиц – 5 мкм) и спиртово-водным элюентом (90 об.% CH3OH + + 10 об.% H2O) при давлении на входе в колонку 10 МПа и скорости потока 0.2 мл/мин. Содержание эпоксида стирола дополнительно контролировалось и в условиях обращенной фазы.
Скорости поглощения кислорода измеряли в опытах по поглощению кислорода при постоянном давлении 1 атм в кварцевом реакторе манометрической установки конструкции В.Ф. Цепалова. Независимость величин скорости окисления от частоты встряхивания реактора (перемешивания) проверена опытным путем. Кривые поглощения кислорода (см. ниже рис. 2, 5) идут не из начала координат, так как согласно методике проведения опытов отсчет времени окисления вели с момента начала обогрева, т.е. с момента погружения реактора в термостат.
При выборе объекта изучения, имея два фенола с трет-бутильными группами в 2,6-положениях (так называемые стерически затрудненные ингибиторы), 2,4,6-три-трет-бутилфенол (ТТБФ) и 2,6-ди-трет-бутил-4-метилфенол (ИОЛ), предпочли последний, исходя из удобства эксперимента: окисляемости двух тройных систем, включающих эти фенолы, близки. Но оксидаты ТТБФ содержали окрашенный вязкий осадок, трудноудалимый со стенок реактора. Оксидаты же системы с ионолом прозрачны, без осадка, поэтому после обычного промывания ацетоном использованный реактор готов к следующему опыту.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
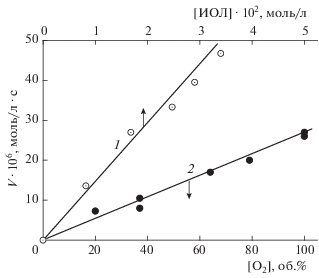
На рис. 1 представлены примеры кинетических кривых поглощения кислорода тройной системой ЭС – CuCl2 – ИОЛ. Окисление каталитическое по природе, хотя число каталитических циклов невелико: для кривых 3 и 4 рис. 1 отношение Δ[O2]/[CuCl2] составляет 4 и 6 соответственно. Зависимости начальных скоростей окисления от концентраций CuCl2 и ЭС даны на рис. 2. По этим данным рассчитаны дробные величины частных порядков реакции n: nCu = 0.5 и nЭС = 0.4 соответственно. Скорость окисления пропорциональна величине [ИОЛ] в растворе (nИОЛ = 1) и содержанию кислорода в газовой смеси (рис. 3). Соответственно, скорость окисления выражается через концентрации реагентов как V = = k[ЭС]0.4[CuCl2]0.5[ИОЛ]1.0 при 100%-ном содержании кислорода в газовой фазе. По данным опытов при разных температурах (317–330 K) рассчитаны эффективные величины энергии активации Ea и константы скорости в аррениусовской форме: Ea = = 50.2 кДж/моль, k [(л/моль)0.9 ∙ с–1] = 4.8 ∙ 106 × × exp(–50.2/RT). При сопоставлении величины Ea с ранее полученными данными обнаруживаются непривычно низкие величины энергий активации окисления тройных систем ЭС – CuCl2 – ароматический спирт: 50, 34, 44.0 кДж/моль соответственно для ионола, гидрохинона, α-нафтола в растворе метанола [12] и 22 кДж/моль для тройной системы с гидрохиноном в водном растворе трет-бутанола [14]. Для сравнения величина Ea окисления двойной системы ЭС – ТСК равна 84 кДж/моль, а в реакции накопления продукта окисления бензальдегида Ea = 89 кДж/моль [13].
Рис. 1.
Кинетические кривые поглощения кислорода в растворе метанола при 323 К тройной системой эпоксид стирола – CuCl2 – ионол при [ЭС] = 0.35, [ИОЛ] = 0.0164 моль/л и [CuCl2 ∙ 2H2O] = 11.6 ∙ 10–3 (1), 3.65 ∙ 10–3 (2), 2.5 ∙ 10–3 (3), 1.16 ∙ 10–3 моль/л (4).
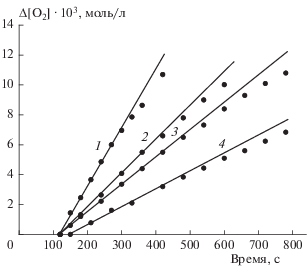
Рис. 2.
Зависимости скорости окисления в растворе метанола при 323 К тройной системы ЭС – CuCl2 – ИОЛ: 1 – от [CuCl2 ∙ 2H2O] при [ЭС] = 0.35, [ИОЛ] = = 0.0164 моль/л; 2 – от [ЭС] при [CuCl2 ∙ 2H2O] = = 5.0 ∙ 10–3, [ИОЛ] = 0.0164 моль/л.
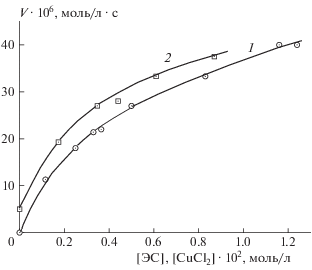
Рис. 3.
Зависимости скорости окисления в растворе метанола при 323 К тройной системы ЭС – CuCl2 – ИОЛ от концентрации ионола (1) и от процентного содержания кислорода в газе-окислителе (2); [ИОЛ] = = 0.0164 моль/л, [ЭС] = 0.35, [CuCl2 ∙ 2H2O] = 5.0 ⋅ ⋅ 10–3 моль/л.
В предположении о явном различии значений Ea для упомянутых тройных и двойных систем вследствие реализации разных механизмов окисления, мы попытались найти химические проявления такой разницы. В опытах по окислению нескольких тройных систем эпоксид – CuCl2 – α-нафтол с разными эпоксидами обнаружено различие такого рода. Оказалось, что введение следующих эпоксидов: фенилглицидилового эфира, эпихлоргидрина, окиси циклогексена, бутилглицидилового эфира, в метанольный раствор CuCl2 – α-нафтол вызывает быстрое поглощение кислорода, т.е. эти тройные системы реагируют с кислородом аналогично системам на основе ЭС, но ни одна двойная система эпоксид–кислота, кроме содержащей эпоксид стирола, кислород не поглощает. Экспериментальное подтверждение упомянутой аналогии продемонстрировано на рис. 4: кинетическая кривая 1 относится к новой тройной системе: бутилглицидиловый эфир (БГЭ) – CuCl2 – ионол. Изломы кривых поглощения 2–4 рис. 4 (ускорение окисления) связаны с введением в двойные системы недостающего третьего компонента тройной системы БГЭ – CuCl2 – ИОЛ (см. подпись к рис. 4). Обнаружение новых тройных систем значительно увеличивает потенциал исследований в этой области.
Рис. 4.
Кинетические кривые поглощения кислорода в растворе метанола при 323 К: 1 – тройной системой БГЭ – CuCl2 – ИОЛ при концентрациях компонентов 0.28, 0.005 и 0.0136, моль/л соответственно; 2–4 – двойными системами CuCl2 – ионол, БГЭ – CuCl2, БГЭ – ионол до и после ввода (помечен стрелкой) недостающего компонента указанной выше тройной системы.
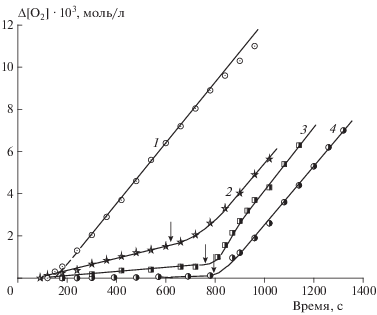
Рис. 5.
Кривые изменения во времени концентрации эпоксида стирола (кривые 1–3, левая шкала, светлые точки) и ионола (кривые 1 '–3 ', правая шкала, темные точки) до и после ввода на шестой минуте опытов (360 с) третьего компонента в соответствующие двойные системы: 1, 1 ' – CuCl2 в систему ЭС – ИОЛ; 2, 2 ' – ионола в систему ЭС– CuCl2; 3, 3 ' – эпоксида в систему CuCl2 – ИОЛ; [ЭС] = 0.47, [CuCl2 ] = 0.011, [ИОЛ] = 0.021 моль/л; раствор метанола, 323 K, барботаж кислорода.
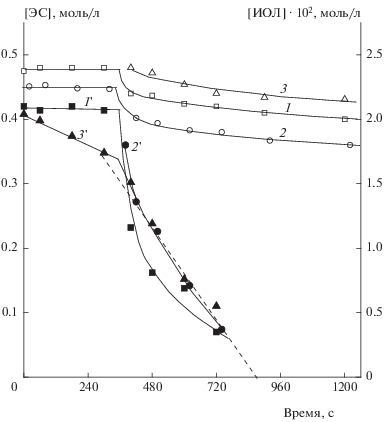
На рис. 5 представлены данные по расходованию эпоксида стирола (кривые 1–3) и ионола (кривые 1'–3 ') Этот рисунок иллюстрирует эффект, полученный от ввода недостающего компонента изучаемой тройной системы в исходные двойные системы: растворы пар компонентов ЭС – ИОЛ (1), ЭС – CuCl2 (2), CuCl2 – ИОЛ (3). Из этих данных следует, что эпоксид стирола, хлорид меди и ионол действительно образуют тройную синергистическую систему, в которой расходуются эпоксид и ионол и при этом поглощается кислород. Для трех этих процессов справедливо неравенство VТрС$ \gg $ ΣVДС, где VТрС и VДС – скорости расходования ЭС, ИОЛ и поглощения O2 в тройной (индекс “ТрС”) и двойной (индекс “ДС”) системах. Данные рис. 5 позволили оценить величину отношения ${{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{{V}_{{{\text{ЭС}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{ЭС}}}}}}}$ – традиционного критерия соотношения гомолитического и нерадикального маршрутов превращения эпоксида стирола. Начальную скорость VЭС рассчитали как среднюю величину тангенсов наклона начальных участков кривых расходования ЭС 1–3 рис. 5. В интервале времени между седьмой и десятой минутами, т.е. в течение трех минут в опытах, которым соответствуют кривые 1–3 рис. 5, расходуется в среднем ~0.025 моль/л эпоксида, отсюда VЭС ≈ ≈ 1.4 ∙ 10–4 моль/л ∙ с. Рассчитанная по концентрационной зависимости ${{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = k [ЭС]0.4[CuCl2]0.5[ИОЛ]1.0 (k = 0.034 (л/моль)0.9 ∙ с–1) скорость поглощения кислорода ${{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 5.5 ∙ 10–5 моль/л ∙ с (экспериментально измеренное значение ${{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 5.7 ∙ 10-5 моль/л ∙ с близко к расчетному), а отношение ${{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{{V}_{{{\text{ЭС}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{ЭС}}}}}}}$ ≈ 0.4, т.е. вклад радикального процесса в брутто-расходование эпоксида стирола составляет около 40%. Это самый высокий показатель выхода радикалов в изученных системах на основе катализированного превращения эпоксида стирола. До сих пор наибольший выход (~24%) зафиксирован в тройной системе гидрохинон – эпоксид стирола – п‑толуолсульфокислота [14]; обнаружение систем с выходом >50% интересно для создания в перспективе новых радикальных инициаторов.
Рассчитав по тангенсу наклона штриховой линии на рис. 5 скорость расходования ионола VИОЛ = = 2.6 ∙ 10–5, используя рассчитанные выше значения ${{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ = 5.5 ∙ 10–5 и VЭС = 1.4 ∙ 10–4 моль/л ∙ с, находим ${{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{{V}_{{{\text{ИОЛ}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{ИОЛ}}}}}}}$ = 2.11 и VЭС/VИОЛ = 5.4. Расходование в тройной системе одной молекулы ингибитора сопровождается поглощением двух молекул кислорода и расходованием пяти молекул эпоксида. В тройной системе гидрохинон – ЭС – кислота [11] убыли одной молекулы диоксибензола отвечает расходование также пяти молекул эпоксида. Объяснить природу такого соотношения пока невозможно.
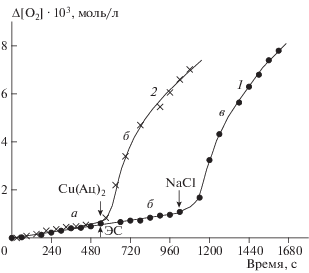
В ходе данной работы по изучению окисления тройной ЭС – CuCl2 – ИОЛ получен ответ на вопрос, возникший в ходе работы с тройной системой ЭС – CuCl2 – α-нафтол [12], а именно: почему каталитической активностью в окислении обладает только хлорид меди, но совершенно не активны сульфат и ацетат меди? В случае сульфата меди помехой могла быть малая растворимость его в метаноле, но ацетат Cu(II) хорошо растворяется в спирте. На рис. 6 приведены две кинетические кривые поглощения кислорода, сопоставление которых приводит к выводу о необходимости присутствия в растворе хлор-аниона как участника окисления. Действительно, при наличии в тройной системе ацетата меди окисление не идет (участок б кривой 1, рис. 6), введение хлорида натрия вызывает окисление. Присутствие только хлорида натрия недостаточно для протекания реакции (участок а кривой 2), введение Cu(Ац)2 (участок б кривой 2) активирует поглощение O2. В этом эксперименте отчетливо выявился еще один аспект сложности изучаемой реакции – чувствительность ее к природе противоиона атома металла-катализатора.
Рис. 6.
Кинетические кривые поглощения кислорода в метаноле при 330 K: 1а – двойной системой ИОЛ – ацетат меди; 1б – тройной системой ИОЛ – ацетат меди – ЭС, ЭС введен в ходе опыта на 9-й минуте (540 с); 1в – той же системой, что и в случае 1б, после ввода NaCl на 18-й минуте (1080 с); 2а – тройной системой ИОЛ – ЭС – NaCl; 2б – той же системой, что и в случае 2а, после ввода ацетата меди на 9-й минуте (540 с); [ЭС] = 0.35, [ИОЛ] = 0.011, [Cu(Ац)2 ∙ H2O] = 0.003, [NaCl] = 0.03 моль/л.
Работа выполнена по теме госзадания (регистрационный номер АААА-А19-119071890015-6).
Список литературы
Parker R.E., Isaacs N.S. // Chem. Rev. 1959. V. 59. № 4. P. 737.
Weil T., Kotke M., Kleiner Ch.M., Schreiner P.R. // Org. Lett. 2008. V. 10. № 8. P. 1513.
Tan N., Yin Sh., Li Y. et al. // J. Organomet. Chem. 2011. V. 696. № 8. P. 1579.
Петров Л.В., Соляников В.М. // Нефтехимия. 2005. Т. 45. № 3. С. 225.
Спирин М.Г., Бричкин С.Б., Петров Л.В. // Изв. АН. Сер. хим. 2016. № 10. С. 2452.
Мелешевич А.П. // Успехи химии. 1970. Т. 39. № 3. С. 444.
Петров Л.В., Психа Б.Л., Соляников В.М. // Нефтехимия. 2009. Т. 49. № 3. С. 263.
Петров Л.В., Психа Б.Л., Соляников В.М. // Нефтехимия. 2007. Т. 47. № 5. С. 379.
Петров Л.В., Соляников В.М. // Нефтехимия. 2011. Т. 51. № 6. С. 467.
Guss C.O., Williams H.R., Jules L.H. // J. Amer. Chem. Soc. 1951. V. 73. № 3. P. 1257.
Петров Л.В., Соляников В.М. // Нефтехимия. 2017. Т. 57. № 4. С. 474.
Петров Л.В., Соляников В.М. // Изв. АН. Сер. хим. 2020. № 10. С. 1869.
Петров Л.В., Соляников В.М. // Нефтехимия. 1999. Т. 39. № 2. С. 107.
Петров Л.В., Соляников В.М. // Хим. физика. 2018. Т. 37. № 12. С. 28.
Петров Л.В., Соляников В.М. // Хим. физика. 2020. Т. 39. № 1. С. 19.
Смурова Л.А. // Хим. физика. 2017. Т. 36. № 3. С. 47.
Смурова Л.А., Карташева З.С. // Хим. физика. 2019. Т. 38. № 5. С. 88.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


