Химическая физика, 2021, T. 40, № 7, стр. 58-66
Влияние модифицирующих добавок на процесс высвобождения лекарственных веществ из жидких лекарственных форм
А. С. Шуршина 1, А. Р. Галина 1, Р. Ю. Лаздин 1, В. В. Чернова 1, Е. И. Кулиш 1, *
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Башкирский государственный университет”
Уфа, Башкортостан
* E-mail: onlyalena@mail.ru
Поступила в редакцию 20.11.2020
После доработки 26.01.2021
Принята к публикации 22.02.2021
Аннотация
Проведено изучение влияния содержания натриевой соли сукцинила хитозана, а также присутствия модифицирующих добавок (этанола и глицерина) на кинетику высвобождения лекарственного вещества (ЛВ) диоксидина из жидкой лекарственной формы. Установлено, что добавление к жидкой лекарственной форме на основе сукцинила хитозана этанола сопровождается изменением вязкостных характеристик полимера, что приводит к уменьшению количества ЛВ, удерживаемого полимерной цепью, и увеличению скорости высвобождения диоксидина. Введение глицерина, напротив, приводит к уменьшению скорости высвобождения ЛВ и коэффициента диффузии, что сопровождается усилением пролонгирующего действия полимера на выход ЛВ из жидкой лекарственной формы за счет повышения общей вязкости системы.
ВВЕДЕНИЕ
К проблеме создания эффективных и действенных лекарственных средств приковано внимание многих ученых [1–9]. Имеется большое количество работ, посвященных синтезу новых веществ с ярко выраженной фармакологической активностью [10–13]. Но следует понимать, что синтез нового лекарственного вещества (ЛВ) еще не означает создание лекарства, поскольку лекарство (лекарственное средство, лекарственный препарат) и лекарственное вещество – далеко не одно и то же [14, 15]. Синтез принципиально новых лекарственных веществ – явление редкое. Основные затраты времени и ресурсов занимают доклинические и клинические испытания, в том числе проверка токсичности, подбор оптимальной и предельной доз, а также отработка устойчивой технологии. Приготовление новых, более эффективных лекарственных форм на основе давно известных ЛВ способно возместить вложенные на исследования средства намного быстрее. Поэтому задача разработки новых и оптимизация ныне существующих лекарственных форм [16] на основе известных ЛВ очень актуальна.
Лекарственная форма, в которой находится ЛВ, является очень важным показателем биодоступности и эффективности фармакологического действия лекарственного препарата [17]. Фактически избранная форма применения может быть причиной того, что приготовленное лекарство или совсем не окажет воздействия на организм, или оно будет весьма незначительным.
Среди основных лекарственных форм выделяют и жидкие лекарственные формы (ЖЛФ). Как и любые другие формы, ЖЛФ имеют свои преимущества и недостатки [18]. В качестве достоинств можно отметить высокую биологическую доступность ЛВ, отсутствие раздражающего действия на слизистые оболочки, удобство приема (особенно в детской и гериатрической практике), а в качестве недостатков – относительную неустойчивость в процессе хранения, высокую скорость элиминации, возможность служить благоприятной средой для развития микроорганизмов и др.
Некоторые из указанных недостатков могут быть практически устранены за счет добавления в раствор лекарственного препарата модифицирующих добавок, повышающих вязкость, – главным образом полимеров [17, 19]. Следствием повышения вязкости является, например, замедление многих физико-химических процессов, которые могут привести к ухудшению их характеристик, таких как окисление или гидролиз. Если полимер при этом будет обладать бактерицидным или бактериостатическим действием, то это позволит исключить процесс развития микроорганизмов.
Кроме того, введение полимеров в ЖЛФ позволяет улучшить растворимость лекарственного начала и повысить его проницаемость через клеточные мембраны [20, 21], пероральную биодоступность [22–24]. Наличие соответствующего полимера в ЖЛФ не только улучшает биодоступность, но и обеспечивает пролонгированное высвобождение ЛВ [25]. Варьируя природу используемых полимеров и лекарств, можно создавать различные комбинации лекарственных средств, ранее несовместимых друг с другом [26].
В качестве загущающей основы для создания ЖЛФ лекарственных препаратов перспективным представляется использование аминополисахарида хитозана и его производных [27], обладающих комплексом уникальных свойств, таких как биосовместимость с тканями организма, бактериостатичность, способность к биодеградации и многих других [28–34]. Вместе с тем, использование модифицирующих добавок, как полимерных, так и низкомолекулярных, приводящих к повышенной вязкости ЖЛФ, может существенным образом сказаться на фармакодинамике и фармакокинетике лекарственного препарата.
Таким образом, целью данной работы было изучение влияния модифицирующих добавок на процесс высвобождения лекарственных веществ из ЖЛФ. В качестве полимерной модифицирующей добавки использовано водорастворимое производное хитозана – натриевая соль сукцинила хитозана, в качестве низкомолекулярных добавок – этанол и глицерин.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования был взят образец натриевой соли сукцинила хитозана (СХТЗ) производства ЗАО “Биoпрoгресс” (г. Щёлково, Россия, ТУ 9284-027-11734126-08) с молекулярной массой 67 000 а.е.м. Степень замещения СХТЗ по аминогруппам составляет 75%. Степень деацетилирования исходного образца хитозана, из которого был получен СХТЗ, составляла 82%. Полное растворение СХТЗ в бидистиллированной воде происходило в течение 1 сут. В качестве ЛВ использовался антибиотик диоксидин (ДО) производства ОАО “Новосибхимфарм” (г. Новосибирск, Россия). Лекарственное вещество использовали без дополнительной очистки. Для изучения взаимодействия ЛВ с полимером были исследованы УФ-спектры индивидуальных соединений и их смесей на спектрофотометре “UV-2600” с интегрирующей сферой ISR-2600Plus компании “Shimadzu” (Япония) в диапазоне длин волн 200–400 нм. Концентрация растворов СХТЗ, используемых в ходе исследования, составляла 1 ⋅ 10–5–1 ⋅ 10–1 моль/л, концентрация ДО – 1 ⋅ 10–4 моль/л. Для определения константы устойчивости (Kуст) аддуктов реакции и их состава использовали методы изомолярных серий и мольных отношений [35].
Относительную и текущую характеристическую вязкость разбавленных растворов полимеров определяли с помощью вискозиметра Уббелоде при температуре Т = (25 ± 1) °С, используя подход Баранова, позволяющий исключить влияние эффекта полиэлектролитного набухания на значение характеристической вязкости полимера [36]. Согласно подходу Баранова [37], значение ∂ln(ηотн)/∂c в каждой точке кривой зависимости lnηотн от с может рассматриваться как “текущее значение характеристической вязкости”:
(1)
${{\left[ \eta \right]}^{*}} = \frac{{\partial \ln ({{\eta }_{{{\text{отн}}}}})}}{{\partial c}},$где ηотн – значение относительной вязкости раствора полимера, с – концентрация полимера в растворе.
Очевидно, что при с → 0 величина [η]* соответствует начальному наклону кривой зависимости ln ηотн от с и совпадает с величиной характеристической вязкости [η], описывающей поведение изолированной макромолекулы.
Для определения возможности протекания агрегационных процессов использовали следующие рассуждения. При описании вязкостных свойств разбавленных растворов, как правило, исходят из линейной зависимости приращения вязкости от концентрации полимерного раствора. Однако в случае полярных полимеров, к которым относится СХТЗ, существует вероятность протекания обратимых агрегационных процессов, которые могут иметь место не только в области полуразбавленных, но даже и в области разбавленных растворов. В этом случае вклад в вязкость вносят не отдельные частицы с объемом V0, а их агрегаты, объем которых V(n) зависит не только от числа составляющих его частиц n, но и от плотности их упаковки, характеризуемой фрактальной размерностью D:
В результате неплотной упаковки частиц в агрегате их вклад в вязкость начинает зависеть от концентрации нелинейно:
Следовательно, любое отклонение показателя δ от единицы свидетельствует о том, что данная система является структурированной. При этом обработка экспериментальных зависимостей удельной вязкости растворов СХТЗ от его концентрации в воде и водно-спиртовых растворах, в двойных логарифмических координатах позволяет определить степенной показатель δ в зависимости (3) и фактически найти “текущее значение агрегированности системы”.
Абсолютную (динамическую) вязкость определяли на модульном динамическом реометре Haake Mars III компании Thermo Fisher Scientific (Германия) при температуре 25 °С в режиме сдвигового деформирования в диапазоне скоростей от 0.01 до 10 с–1.
Кинетику выхода ЛВ из жидкой лекарственной формы оценивали методом диализа при термостатируемых условиях при температуре (25 ± 1) °С. Для этого раствор полимера определенной концентрации, предварительно смешанный с ЛВ, помещали в целлофановый мешок и опускали в сосуд, наполненный бидистиллированной водой. Пробы диализата отбирали через определенные промежутки времени и рассчитывали количество выделившегося ЛВ методом спектрофотометрии в УФ-области при длине волны, соответствующей максимуму поглощения ЛВ. В качестве раствора сравнения использовали раствор полимера. Количество ЛВ, выделившееся из пленки к моменту времени t (Gs), оценивали по калибровочной кривой. Момент установления в растворе постоянной концентрации ЛВ (G∞) считали моментом установления равновесия. Коэффициенты диффузии определяли, основываясь на подходе Кранка [38]. При условии Gs/G∞ ≤ 0.5
где Gs(t) – концентрация десорбированного вещества в момент времени t, G∞ − значение Gs при t → ∞, L – толщина полупроницаемой мембраны.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день имеются многочисленные свидетельства того, что степень фармакологического действия препарата зависит не только от типа и количества лекарственного вещества, всасывающегося в организм, но и от формы лекарственного препарата [39]. Причина этого в том, что лекарственный препарат попадает в системный кровоток сразу только при внутрисосудистом введении. При всех других способах введения этому предшествует целый ряд разнообразных процессов. Прежде всего ЛВ должно высвободиться из лекарственной формы. Когда лекарство перешло в растворимую, пригодную к поглощению форму, ему еще предстоит преодолеть ряд мембран, перед тем как проникнуть в капиллярное русло и попасть в системный кровоток. То есть, когда лекарство вводится в организм внесосудистым путем, целый ряд химико-фармацевтических и медико-биологических (эндогенных) факторов способны оказать существенное влияние на его биодоступность [40]. Не рассматривая эндогенные факторы, обратим внимание на влияние наличия вспомогательных веществ в лекарственной форме на процесс высвобождения ЛВ.
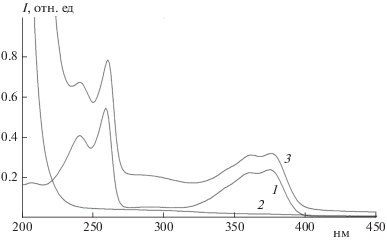
Для начала необходимо учесть, что вспомогательное вещество (в нашем случае – это СХТЗ) или вещества могут быть неиндифферентными по отношению к ЛВ и друг к другу [41]. Так происходит и в нашем случае. Спектр поглощения ДО в водном растворе имеет три максимума поглощения: при 235, 266 и 382 нм (рис. 1). При добавлении в раствор эквивалентного количества СХТЗ, который при концентрации 10–5–10–1 моль/л в УФ-области не поглощает, интенсивность пика поглощения ДО заметно возрастает, а максимумы поглощения батохромно сдвигаются примерно на 3–5 нм.
По различию в значениях длин волн, Δλ, соответствующих максимуму поглощения комплекса и индивидуального ЛВ, можно оценить энергию связи в комплексном соединении по формуле Планка:
где ΔE – энергия связи, h – постоянная Планка, c – скорость света.
Значение энергии связи в комплексах СХТЗ с ДО, оцененное по сдвигу максимумов поглощения в УФ-спектрах, составляет порядка 10–15 кДж/моль. Небольшие значения величин энергий связи позволяют предположить, что комплексообразование осуществляется посредством водородных связей.
Состав аддуктов реакции, определенный методами изомолярных серий и молярных отношений, составил 1 : 1. Константа устойчивости равна 1.2 ⋅ 105 л/моль.
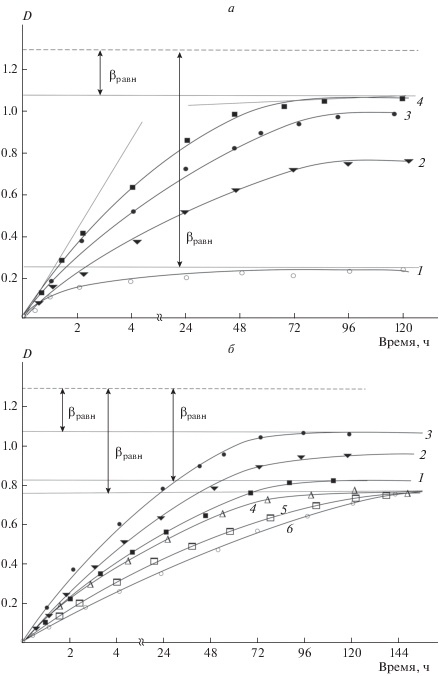
Поскольку комплекс СХТЗ–ДО в предельно разбавленном растворе может быть охарактеризован как соединение со средней устойчивостью, оно принципиально способно обеспечить определенный уровень пролонгирования действия лекарственного вещества за счет его закрепления на цепи полимера. И действительно, как видно из кривой 1 рис. 2а, выход ДО из разбавленного раствора СХТЗ происходит достаточно медленно. Кинетические кривые выхода ЛВ при этом достигают предела, соответствующего равновесному выходу ДО. По разнице между значением оптической плотности D, соответствующей равновесному выходу ДО, и оптической плотности, соответствующей количеству ЛВ, введенного в раствор, можно определить значение βравн – равновесно закрепленного на макромолекулярной цепи количества ЛВ. Обращает на себя внимание тот факт, что в общем случае, чем выше концентрация СХТЗ в растворе, тем меньше значение βравн. Данный факт позволяет допустить, что с повышением вязкости раствора СХТЗ эффект пролонгирования фактически может нивелироваться.
Рис. 2.
Кинетическая кривая выхода ДО из раствора СХТЗ концентрацией 0.2 (1), 1.5 (2), 3.0 (3), 5.0 г/дл (4) – а и 1.5 г/дл – б, содержащей модифицирующую добавку этанол (1–3) и глицерин (4–6) в концентрации 1 (1, 4), 2 (2, 5) и 3 моль/л (3, 6). Содержание ДО в растворе – 10–4 моль. Штриховыми линиями дано значение оптической плотности D, соответствующее количеству ДО, введенного в раствор полимера.
Зависимость коэффициентов диффузии высвобождения ДО из ЖЛФ на основе СХТЗ представлена в табл. 1. Видно, что по мере увеличения концентрации СХТЗ в растворе происходит закономерное уменьшение прочно закрепленного на цепи полимера количества ДО и, соответственно, увеличение коэффициента диффузии. То есть повышение концентрации полимера в растворе сопровождается не уменьшением, как можно было бы ожидать, а повышением значения скорости высвобождения ДО из ЖЛФ.
Таблица 1.
Результаты обработки данных, полученных из кинетических кривых высвобождения ДО из растворов СХТЗ
| ССХТЗ, г/дл | Используемая добавка | Сдобавки, моль/л | D ⋅ 1010, см2/с | βравн, мас.% | η, Па ⋅ с | ηотн |
|---|---|---|---|---|---|---|
| 0.1 | – | – | 0.84 | 80 | 0.009 | 1.2 |
| 1.0 | – | – | 1.12 | 63 | 0.010 | 1.9 |
| 1.5 | – | – | 1.45 | 38 | 0.012 | 7.9 |
| этанол | 1 | 2.12 | 34 | 0.020 | 10.1 | |
| 2 | 2.48 | 22 | 0.032 | 25.5 | ||
| 3 | 2.76 | 20 | 0.035 | 31.6 | ||
| глицерин | 1 | 1.43 | 36 | 0.024 | 7.9 | |
| 2 | 1.30 | 34 | 0.037 | 8.3 | ||
| 3 | 1.25 | 33 | 0.040 | 10.2 | ||
| 2.0 | – | – | 1.65 | 19 | 0.028 | 31.6 |
| этанол | 1 | 1.88 | 13 | 0.038 | 63.3 | |
| 2 | 2.27 | 12 | 0.055 | 79.5 | ||
| 3 | 2.76 | 10 | 0.064 | 100.2 | ||
| глицерин | 1 | 1.52 | 17 | 0.040 | 38.9 | |
| 2 | 1.42 | 16 | 0.058 | 48.6 | ||
| 3 | 1.23 | 15 | 0.073 | 56.4 | ||
| 6.0 | – | – | 2.20 | 13 | 0.088 | 630.1 |
| 8.0 | – | – | 2.27 | 12 | 0.100 | 978.5 |
Наиболее вероятной причиной уменьшения значения βравн при увеличении содержания СХТЗ в растворе является общее повышение вязкости (табл. 1), которое сопровождается имеющим место структурообразованием полимера. В свою очередь, структурообразование связано с уменьшением размера макромолекулярного клубка (уменьшением текущего значения характеристической вязкости) и агрегацией макромолекул, что приводит к уменьшению доступности звеньев СХТЗ для взаимодействия с ДО и делает эффект пролонгирования не столь очевидным (табл. 2).
Таблица 2.
Характеристики разбавленного раствора СХТЗ в присутствии модифицирующих добавок
| ССХТЗ в растворе, г/дл | Используемая добавка | Сдобавки, моль/л | [η]*, дл/г | δ* |
|---|---|---|---|---|
| 0.1 | этанол | 0 | 3.2 | 1.01 |
| 1 | 2.7 | 1.10 | ||
| 2 | 2.5 | 1.13 | ||
| 3 | 2.3 | 1.16 | ||
| 0.5 | 0 | 2.3 | 1.14 | |
| 3 | 2.2 | 1.40 | ||
| 1.0 | 0 | 2.1 | 1.20 | |
| 3 | 1.9 | 1.85 | ||
| 0.1 | глицерин | 1 | 3.2 | 1.01 |
| 2 | 3.1 | 1.02 | ||
| 3 | 3.1 | 1.03 | ||
| 0.5 | 3 | 2.3 | 1.15 | |
| 1.0 | 3 | 2.0 | 1.25 |
К такому же эффекту (уменьшению значения βравн и увеличению коэффициентов диффузии) приводит добавление в раствор, содержащий СХТЗ и ДО, модифицирующей добавки – этанола. Как видно из данных рис. 2б, чем больше спирта находится в растворе, тем меньше количество прочно закрепляемого на полимерной цепи ЛВ.
Следует сказать, что присутствие этанола в системе СХТЗ – растворитель сопровождается целым рядом изменений в конформационно-надмолекулярном состоянии полимера в растворе [42]. Так, добавление спирта приводит к сжатию макромолекулярного клубка, на что однозначно указывает уменьшение текущей характеристической вязкости полимера в растворе, и повышению показателя агрегированности макромолекул (табл. 2).
Сжатие макромолекулярного клубка, так же как и повышение степени агрегированности, являются факторами, препятствующими закреплению ЛВ на макромолекуле. В результате происходят закономерные изменения скорости выхода ДО из раствора СХТЗ и значений коэффициентов диффузии.
Несколько иное влияние на состояние полимера в растворе оказывает другая часто используемая в медицинской практике добавка – глицерин, также “структурно” неиндифферентная по отношению к СХТЗ [43]. Справедливости ради отметим, что в отличие от этанола присутствие глицерина слабее сказывается и на конформационном, и на надмолекулярном состояниях полимера в растворе (см. табл. 2). При этом подобное различное влияние глицерина и этанола на состояние СХТЗ проявляется в широком концентрационном диапазоне.
Различие в действии одноатомного (этанол) и многоатомного (глицерин) спиртов на конформационно-надмолекулярное состояние СХТЗ обусловлено следующим. Ни этанол, ни глицерин не растворяет СХТЗ. При этом введение этанола в раствор полимера в количестве ∼50% и более от объема растворителя приводит к фазовому выделению полимера из растворов. При использовании в качестве модифицирующей добавки многоатомного спирта глицерина складывается несколько иная ситуация. Многоатомный спирт не способен растворить полимер, но и не способен инициировать процесс разделения фаз даже при многократном превышении количества модифицирующей добавки над количеством растворителя. Таким образом, многоатомный спирт играет роль сорастворителя, а одноатомный – осадителя.
Следствием различного характера влияния этих модифицирующих добавок на макромолекулы СХТЗ является различие в процессах высвобождения ЛВ из ЖЛФ, содержащей этанол (рис. 2б, кривые 1–3) и глицерин (рис. 2б, кривые 4–6). Анализируя данные, представленные на рис. 2б, можно отметить, что в отличие от тех закономерностей, которые имели место при повышении концентрации этанола в растворе, добавление глицерина не приводит к изменению значения βравн. Более того, повышение содержания глицерина в растворе сопровождается уменьшением значений коэффициентов диффузии, а не увеличением, как это было при использовании этанола.
Обращает на себя внимание тот факт, что введение низкомолекулярных модифицирующих добавок этанола и глицерина в раствор СХТЗ–ДО сопровождается дополнительным ростом как абсолютной (динамической), так и относительной вязкости (табл. 1). При этом значения динамической вязкости больше для добавок СХТЗ–глицерин, а относительной – для добавок СХТЗ–этанол. Поскольку относительная вязкость показывает, какой вклад в общее значение вязкости системы дает именно полимер, можно утверждать, что именно введение этанола сопровождается большим дополнительным структурированием макромолекул, в то время как высокие значения динамической вязкости в системе СХТЗ–вода–глицерин обусловлены высокой вязкостью самого глицерина.
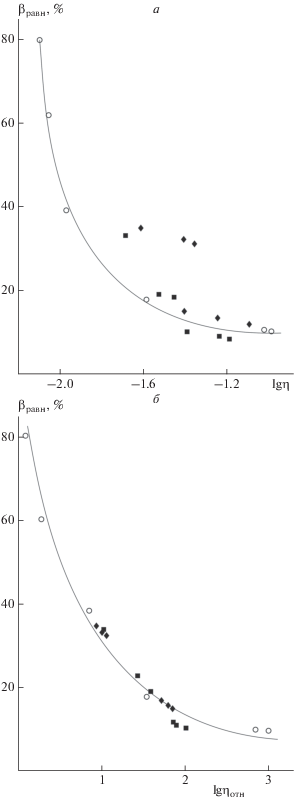
Поскольку вязкость ЖЛФ невысока, то именно усиление процессов структурообразования полимера в растворе, вызванное либо повышением содержания СХТЗ в растворе, либо введением низкомолекулярной модифицирующей добавки, приводит к уменьшению доли прочно закрепленного на полимерной цепи ЛВ. Соответственно, зависимость вязкости от значения количества ЛВ, прочно удерживаемого полимерной цепью, корректнее описывается в координатах “относительная вязкость – β”, чем в координатах “абсолютная вязкость – β” (см. рис. 3а и б). Это позволяет утверждать, что количество ЛВ, закрепляемого на макромолекуле, определяется не просто вязкостью среды, а скорее степенью структурированности макромолекул, меру которой отражает именно относительная вязкость.
Рис. 3.
Зависимость количества ЛВ, удерживаемого полимерной цепью, от динамической (а) и относительной (б) вязкости раствора СХТЗ в отсутствие модифицирующей добавки (⚪) и в присутствии этанола (◆) и глицерина (◼) в полулогарифмических координатах.
Таким образом, варьируя природу и количество модифицирующей добавки, можно в существенной степени регулировать скорость высвобождения лекарственного препарата из ЖЛФ. В тех случаях, когда повышение вязкости связано с агрегацией макромолекул за счет имеющего место структурообразования полимера, значения βравн будут уменьшаться, и этот факт будет приводить к увеличению значений коэффициентов диффузии. Но если добиться повышения вязкости не за счет структурирования полимера в растворе, а, например, за счет повышения вязкости растворителя, это не скажется на значении удерживаемого цепью количества ЛВ, но приведет к уменьшению значений коэффициентов диффузии высвобождения ЛВ за счет общего повышения вязкости системы, т.е. к более выраженному пролонгированному эффекту.
Справедливости ради надо заметить, что диффузия лекарственных веществ из лекарственной формы не всегда коррелирует с их абсорбцией и всасыванием. Имеется множество экспериментальных данных, подтверждающих тот факт, что в жидких и мягких лекарственных формах не только ее реологические свойства, но и тип основы, наличие ПАВ и растворителей влияют на процесс всасывания [44, 45]. Например, мази с витаминами А, С, а также мази многих сульфаниламидов, резорцина, левомицетина и других антибиотиков более эффективны на водных основах – гелях полиэтиленоксида и других, чем на жировых [45–47]. Мази оксида цинка на гидрофильных основах, напротив, малоэффективны по сравнению с мазями на жировой основе [45]. Некоторые вспомогательные вещества способствуют образованию полиморфных структур лекарственных веществ, что обуславливает их бионеэквивалентность. Например, в присутствии твина-80 образуется наиболее активная полиморфная форма метилпреднизолона [45, 46]. Таким образом, вопрос о влиянии лекарственной формы и вспомогательных веществ на процессы диффузии и абсорбции лекарственного вещества из лекарственной формы требует дальнейшей проработки.
ВЫВОДЫ
1. Исследована кинетика высвобождения лекарственного вещества диоксидина из жидкой лекарственной формы, модифицированной натриевой солью сукцинила хитозана. Установлено, что повышение содержания последнего в ЖЛФ приводит к уменьшению доли ЛВ, удерживаемого полимерной цепью, и, соответственно, к увеличению скорости выделения лекарственного вещества из жидкой лекарственной формы.
2. Установлено, что добавление к жидкой лекарственной форме на основе СХТЗ дополнительной модифицирующей добавки этанола сопровождается сжатием макромолекулярного клубка, увеличением степени агрегации макромолекул и резким ростом относительной вязкости. В результате в присутствии этанола имеет место уменьшение количества ДВ, удерживаемого полимерной цепью, и увеличение скорости высвобождения диоксидина.
3. Добавление к жидкой лекарственной форме на основе СХТЗ дополнительной модифицирующей добавки глицерина практически не сказывается на размере макромолекулярного клубка и степени агрегации макромолекул, но сказывается на общей вязкости системы. Как следствие, количество ЛВ, удерживаемого полимерной цепью, не изменяется, а скорость высвобождения ЛВ и коэффициент диффузии уменьшаются, что приводит к усилению пролонгирующего действия полимера на выход лекарственного вещества из жидкой лекарственной формы.
Список литературы
Poon W., Kingston B.R., Ouyang B. et al. // Nat. Nanotechnol. 2020. V. 15. P. 819.
Ma Z., Li J., Lin K. et al. // Nat. Commun. 2020. V. 11. P. 4615.
Johnson A., Kong F., Miao S. et al. // Sci. Rep. 2020. V. 10. P. 18037.
Yuan Y., Song J., Zhang M. et al // Ibid. 2020. V. 10. P. 15497.
Boström J., Brown D., Young R. et al. // Nat. Rev. Drug Discov. 2018. V. 17. P. 709.
Stewart C.A., Finer Y., Hatton B.D. // Sci. Rep. 2018. V. 8. P. 895.
Doi N., Yamauchi Y., Ikegami R. et al. // Polym. J. 2020. V. 52. P. 1375; https://doi.org/10.1038/s41428-020-0387-9
Shin D.Y., Park J., Choi M. et al. // Sci. Rep. 2020. V. 10. P. 16811.
Moradali M.F., Rehm B.H.A. // Nat. Rev. Microbiol. 2020. V. 18. P. 195.
Solano L.N., Nelson G.L., Ronayne C.T. et al. // Sci. Rep. 2020. V. 10. P. 17969.
Blakemore D.C., Castro L., Churcher I. et al. // Nature Chem. 2018. V. 10. P. 383.
Butler M.S., Paterson D.L. // J. Antibiot. 2020. V. 73. P. 329.
Efange N.M., Lobe M.M.M., Keumoe R. et al. // Sci. Rep. 2020. V. 10. P. 17932.
Полный медицинский справочник фармацевта. М.: Эксмо, 2013.
Муравьев И.А. Технология лекарств. Изд. 3-е, переработанное и дополненное. Т. 1. М.: Медицина, 1980.
Каркищенко В.Н., Каркищенко Н.Н., Шустов Е.Б. Фармакологические основы терапии. Тезаурус: Руководство для врачей и студентов. Изд. 3-е – новая редакция. М., СПб: Айсинг, 2018.
Марченко Л.Г., Русак А.В., Смехова И.Е. Технология мягких лекарственных форм. СПб.: СпецЛит, 2004.
Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов. М.: ГЭОТАР-Медиа, 2010.
Демина Н.Б. Дис. … д-ра фарм. наук. М.: ГОУ ВПО “Московская медицинская академия”, 2003.
Russo J., Fiegel J., Brogden N.K. // Pharmaceutics. 2020. V. 12. Issue 12. P. 1214.
Sipos B., Szabó-Révész P., Csóka I. et al. // Ibid. Issue 8. P. 697.
Potharaju S., Mutyam S.K., Liu M. et al. // Pharm. Develop. Technol. 2020. V. 25. Issue 5. P. 625.
Ronchi F., Sereno A., Paide M. et al. // J. Drug Delivery Sci. Technol. 2019. V. 54. P. 101273.
Salvi V., Pawar P. // Pharm. Nanotechnol. 2020. V. 8. Issue 2. P. 133.
Bhalerao H., Koteshwara K.B., Chandran S. // AAPS PharmSciTech. 2019. V. 20. Issue 7. P. 272.
Bergstrom C.A.S., El Sayed M., Alhalaweh A. // Mol. Pharmaceutics. 2020. V. 17. Issue 10. P. 4018.
Штильман М.И. Полимеры медико-биологического назначения. М.: ИКЦ “Академкнига”, 2006.
Park H., Park K. // ACS Symposium Series. V. 2 / Eds. Ottenbrite R.M., Huang S.J., Park K. V. 627. Washington, D.C.: ACS, 1996. P. 7.
Yin Y., Yang Y., Xu H. // J. Appl. Polym. Sci. 2002. V. 83. Issue 13. P. 2835.
Bell C.L., Peppas N.A. // Adv. Polym. Sci. 1995. V. 122. P. 125.
Rabea E.I., Badawy M.E.T., Stevens C.V. // Biomacromolecules. 2003. № 4. P. 1457.
Sivakumar M., Paduranga Rao K. // J. Appl. Polym. Sci. 2002. V. 83. Issue 14. P. 3045.
Chuang W.Y., Young T.H., Yao C.H., Chiu W.Y. // Biomaterials. 1999. V. 20. P. 1479.
Чернова В.В., Шуршина А.С., Кулиш Е.И. // Хим. физика. 2018. Т. 37. № 6. С. 83.
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа. Л.: Химия, 1986.
Чернова В.В., Шуршина А.С., Базунова М.В., Кулиш Е.И. // ЖПХ. 2015. Т. 88. № 4. С. 616.
Баранов В.Г., Френкель С.Я., Агранова С.А. и др. // Высокомолекуляр. соединения. 1987. Т. 29. С. 745.
Crank J. The Mathematics of Diffusion. Oxford: Clarendon Press, 1975.
Крылов Ю.Ф., Бобырев В.М. Фармакология. М.: ВУНМЦ МЗ РФ, 1999.
Шуршина А.С., Галина А.Р., Чернова В.В., Кузина Л.Г., Кулиш Е.И. // Хим. физика. 2018. Т. 37. № 2. С. 56.
Фармакология / Под ред. Аляутдина Р.Н. М.: ГЭОТАР-МЕД, 2004.
Базунова М.В., Чернова В.В., Лаздин Р.Ю., и др. // Хим. физика. 2018. Т. 37. № 12. С. 51.
Lazdin R., Bazunova M., Chernova V. et al. // Chem. and Chem. Technol. 2019. Issue 13. № 3. P. 352.
Гладышев В.В., Давтян Л.Л., Дроздов А.Л., Бирюк И.А., Кечин И.Л. Биофармация. Днипро: ЧМП “Экономика”, 2018.
Тихонов А.И., Ярных Т.Г., Зупанец И.А. и др. Биофармация. Xарьков: изд-во НФаУ: Золотые страницы, 2003.
Фармацевтические и медико-биологические аспекты лекарств / Под ред. Перцева И.М., Зупанца И.А. Харьков: изд-во НФАУ, 1999.
Большаков В.Н. Вспомогательные вещества в технологии лекарственных форм. Л.: Ленингр. хим.-фармац. ин-т, 1991.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика