Химическая физика, 2021, T. 40, № 7, стр. 3-10
Фотохромизм комплексов молекул спирооксазинов с ионами магния и тербия
Т. М. Валова 1, В. А. Барачевский 1, 2, *, А. И. Шиенок 3, Н. Л. Зайченко 3
1 Центр фотохимии Федерального научно-исследовательского центра “Кристаллография и фотоника”
Российской академии наук
Москва, Россия
2 Межведомственный центр аналитических исследований по физике, химии и биологии
при Президиуме Российской академии наук
Москва, Россия
3 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: barva@photonics.ru
Поступила в редакцию 30.09.2020
После доработки 18.11.2020
Принята к публикации 20.11.2020
Аннотация
Проведено спектрально-кинетическое исследование процессов комплексообразования молекул фотохромных спирооксазинов, содержащих электронодонорные и электроноакцепторные заместители в оксазиновом фрагменте, с катионами магния и тербия. Установлена зависимость фотохромных свойств и механизма комплексообразования от структуры фотохромных соединений.
ВВЕДЕНИЕ
В связи с разработкой инновационных “умных” материалов фотохромные системы, испытывающие обратимые фотоиндуцированные превращения между двумя формами с различными физико-химическими свойствами, привлекают внимание возможностью их использования при создании новых материалов для применения в различных областях науки и техники [1]. Особый интерес вызывают фотохромные спиросоединения (спиропираны и спирооксазины), которые могут быть использованы для разработки оптических сенсоров катионов металлов на основе явления комплексообразования между молекулами фотохромных соединений и ионами металлов [2, 3].
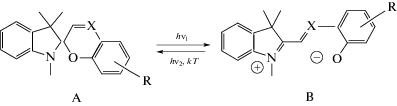
Эти соединения испытывают обратимые фотоиндуцированные превращения между бесцветной (А) и фотоиндуцированной окрашенной (В) формами (Схема 1 ).
Схема 1 . Фотохромные превращения спироциклических соединений.
Х = СH–спиропираны; Х = N–спирооксазины.
Обычно комплексы возникают в результате взаимодействия между фенолятным кислородом фотоиндуцированной окрашенной формы В и катионами металлов (Схема 1 ). Эти комплексы могут проявлять как положительный (переход из бесцветной (А) в окрашенную (В) форму под действием УФ-света), так и отрицательный фотохромизм (переход из формы В в форму А под действием видимого света).
Наиболее интенсивные исследования в этом направлении проводились с использованием спиропиранов [2–4]. Комплексообразование спирооксазинов с ионами металлов исследовалось менее интенсивно, хотя они более перспективны для использования в сенсорике, поскольку отличаются от спиропиранов более высокой устойчивостью к необратимым фотохимическим превращениям.
Ранее было исследовано комплексообразование серии фенантролиновых спирооксазинов с ионами металлов [5–7]. Обнаружен отрицательный фотохромизм растворов этих соединений в метаноле при введении катионов Ni2+ [5]. Окрашенный комплекс, характеризующийся полосой поглощения с максимумом при 600 нм, обесцвечивался под действием видимого излучения и возвращался в исходное состояние через 600 с. Смещение равновесия в сторону мероцианиновой формы и отрицательный фотохромизм наблюдался после введения нитратов редкоземельных элементов и перхлоратов щелочноземельных металлов в ацетонитрильные растворы ряда производных спиронафтооксазинов [8]. Сдвиг равновесия в сторону окрашенной формы при введении в растворы спирооксазинов катионов металлов свидетельствует о том, что в результате комплексообразования уровень энергии основного состояния мероцианиновой формы снижается относительно энергии основного состояния исходной неокрашенной формы настолько, что обеспечивает термическое заселение уровня окрашенной формы. Интенсивность полос поглощения мероцианиновой формы определяется заселенностью этого уровня [9]. Энергия стабилизации окрашенной формы зависит от заряда и ионного радиуса атома металла. Отрицательный фотохромизм проявляют комплексы ионов металлов с молекулами сульфобутилзамещенных спирооксазинов [10].
Комплексообразование гибридных молекул 1,3-дигидро-8'-(2-гидрокси-5-фенилазобензилиденимино)-1,3,3-триметилспиро{2H-индол-2,3'-[3H]-нафто[2,1-b] [1, 4]оксазина} с рядом ионов металлов проявляется только в изменении скорости темновой релаксации мероцианиновой формы, но не в спектральных сдвигах полос поглощения [11]. В случае ионов Cu2+ образуются несветочувствительные комплексы. Молекулы бихромофорного фотохромного спирооксазина с гидроксинафтилидениминным фрагментом при взаимодействии с ионами металлов образуют комплексы как с гидроксинафтилидениминным фрагментом в случае закрытой спирооксазиновой формы, так и с этим же фрагментом и фенолятным кислородом мероцианинового изомера [12].
Анализ результатов исследования комплексообразования молекул спирооксазинов с ионами металлов показывает, что влияние природы заместителей на фотохромные свойства этих соединений ранее не изучалось. Цель настоящей работы – сравнительное спектрально-кинетическое исследование процессов взаимодействия молекул спирооксазинов, содержащих в оксазиновом фрагменте электронодонорные или электроноакцепторные заместители, с катионами магния и тербия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
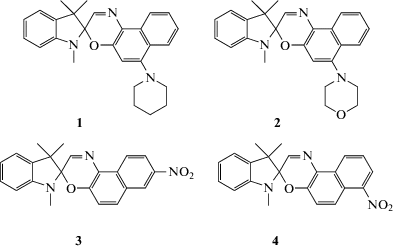
В качестве объектов исследования были выбраны четыре спирооксазина 1–4.
В качестве растворителя использовали ацетонитрил безводный (99.8%) фирмы “Sigma-Aldrich”. Рабочая концентрация растворов составляла С = 2 ⋅ 10–4 М в присутствии катионов металлов в соотношении лиганд (L)/металл (Me) = = 1/100. В исследованиях использованы соли Mg(ClO4)2, Mg(NO3)2 и Tb(NO3)3 фирмы “Aldrich”.
Cпектрально-кинетические измерения растворов исследуемых соединений и их комплексов с металлами проводили в кварцевой кювете с длиной оптического пути 0.2 см на спектрофотометре “Cary 60” (Agilent Technologies).
Облучение осуществляли светом ксеноновой лампы L8253 осветителя LC-4 фирмы “Hamamatsu”. Для фотоокрашивания растворов использовали светофильтр УФС-1, а для фотообесцвечивания – светофильтры ЖС-16 или ЖС-10.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
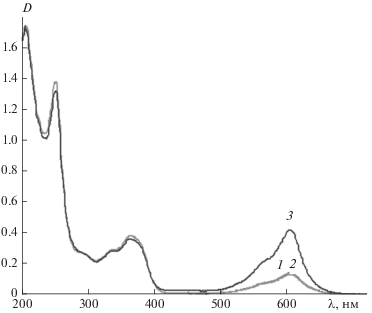
В исходном состоянии спирооксазин 1 в ацетонитриле бесцветен и характеризуется двумя полосами поглощения при 250 и 365 нм (рис. 1, кривая 1; табл. 1). Фотоиндуцированная мерооксазиновая форма характеризуется структурной полосой поглощения с максимумом при 575 нм (рис. 1, кривая 2; табл. 1). Соединение проявляет фотохромные свойства, спонтанно возвращаясь в темноте в исходное бесцветное состояние.
Рис. 1.
Спектры поглощения раствора соединения 1 в ацетонитриле (С = 2 ⋅ 10–4 М) до (1) и после (2) УФ-облучения через светофильтр УФС-1.
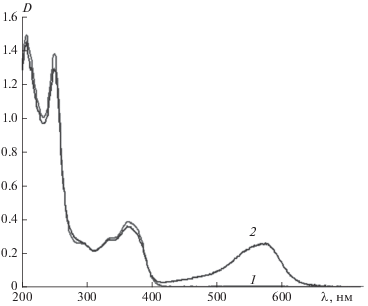
Таблица 1.
Спектральные характеристики спирооксазинов и их комплексов с ионами металлов в ацетонитриле при соотношении L/Me = 1/100
| Соединение | Металл | До УФ-облучения | После УФ-облучения | $\Delta D_{{\text{В}}}^{{{\text{фот}}}}$ | ±ΔλВ, нм | |
|---|---|---|---|---|---|---|
| $\lambda _{{\text{A}}}^{{{\text{макс}}}},$ нм $\left( {D_{{\text{A}}}^{{{\text{макс}}}}} \right)$ |
$\lambda _{{\text{В}}}^{{{\text{макс}}}},$ нм $\left( {D_{{\text{В}}}^{{{\text{макс}}}}} \right)$ |
$\lambda _{{\text{В}}}^{{{\text{макс}}}},$ нм $\left( {D_{{\text{В}}}^{{{\text{макс}}}}} \right)$ |
||||
| 1 | – | 365 (0.37) | 575 (0.01) | 575 (0.24) | 0.23 | – |
| Mg2+ | 365 (0.38) | 605 (0.12) | 605 (0.47) | 0.35 | +30 | |
| Tb3+ | 360 (0.23) | 610 (1.89) | 610 (2.40) | 0.51 | +35 | |
| 2 | – | 360 (0.39) | 580 (0.004) | 580 (0.14) | 0.14 | – |
| Mg2+ | 360 (0.38) | 605 (0.08) | 605 (0.41) | 0.33 | +25 | |
| Tb3+ | 360 (0.29) | 610 (1.30) | 610 (2.45) | 1.15 | +30 | |
| 3 | – | 360 (0.49) | 605 (0.002) | 605 (1.66) | 1.66 | – |
| Mg2+ | 365 (0.51) | 580 (0.002) | 580 (1.33) | 1.33 | –25 | |
| Tb3+ | 360 (0.50) | 560 (0.05) | 560 (0.97) | 0.92 | –45 | |
| 4 | – | 350 (0.24) | 605 (0.001) | 605 (0.68) | 0.68 | – |
| Mg2+ | 350 (0.25) | 585 (0.001) | 585 (0.97) | 0.97 | –20 | |
| Tb3+ | 350 (0.24) | 565 (0.004) | 565 (0.88) | 0.88 | –40 | |
Примечание: $\lambda _{{\text{А}}}^{{{\text{макс}}}}$ и $\lambda _{{\text{В}}}^{{{\text{макс}}}}$ – длины волн в максимумах полос поглощения спироциклической А и мероцианиновой В форм соответственно; $D_{{\text{A}}}^{{{\text{макс}}}}$ и $D_{{\text{В}}}^{{{\text{макс}}}}$ – величины оптической плотности в максимумах полос поглощения спироциклической и мероцианиновой форм соответственно; $\Delta D_{{\text{В}}}^{{{\text{фот}}}}$ – фотоиндуцированное изменение оптической плотности в максимуме полосы поглощения мероцианиновой формы; ±ΔλВ – величина спектрального сдвига максимума полосы поглощения мероцианиновой формы комплексов относительно положения максимума полосы в отсутствие ионов; L/Me – мольное соотношение концентраций фотохромного соединения и ионов металлов.
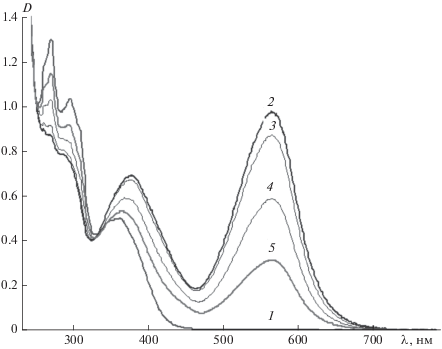
После введения в раствор катионов Мg2+ раствор окрашивается в отсутствие УФ-излучения (рис. 2, кривая 1). При этом максимум полосы поглощения фотоиндуцированной мерооксазиновой формы батохромно смещается на 30 нм (табл. 1). При облучении раствора видимым светом он не обесцвечивается (рис. 3, кривая 2). Интенсивность полосы поглощения окрашенной формы обратимо возрастает после облучения раствора УФ-светом (рис. 2, кривая 3), проявляя положительный фотохромизм. Однако фотохромные превращения наблюдаются при том значении оптической плотности, которое возникает после введения в раствор иона металла. Здесь и далее полученные результаты не различались при использовании как перхлоратов, так и нитратов магния.
Подобные, но более эффективные необратимые превращения наблюдаются сразу после введения в раствор соединения 1 ионов тербия Tb3+ (рис. 3, кривая 1; табл. 1). При этом максимум полосы поглощения мерооксазиновой формы спирооксазина в присутствии этого иона смещается в длинноволновую сторону на 35 нм относительно положения максимума той же полосы в отсутствие иона. Окрашенный исходный раствор также не обесцвечивался под действием видимого излучения (рис. 3, кривая 2).
Фотоиндуцированное изменение оптической плотности раствора под действием УФ-облучения незначительно (рис. 3, кривая 3; табл. 1) в силу того, что практически все молекулы мерооксазиновой формы фотохромного спирооксазина образовали комплексы с ионами металла при их введении в раствор еще до облучения (табл. 1). Подобные спектральные изменения обнаружены и для спирооксазина 2 (табл. 1).
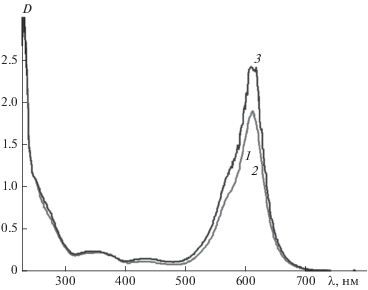
Введение электроноакцепторных заместителей в оксазиновый фрагмент спирооксазина (соединения 3 и 4) приводит к батохромному смещению полос поглощения фотоиндуцированной мерооксазиновой формы на 20–30 нм (рис. 4, табл. 1) по сравнению с положением этих полос поглощения для спироксазинов 1 и 2, содержащих электронодонорные заместители (табл. 1). Это согласуется с ранее полученными результатами исследования влияния природы заместителей на спектральные свойства мерооксазиновой формы [1].
Рис. 4.
Спектры поглощения соединения 3 в ацетонитриле (С = 2 ⋅ 10–4 М) до (1), после УФ-облучения через светофильтр УФС-1 (2) и последующей темновой релаксации (3–5).
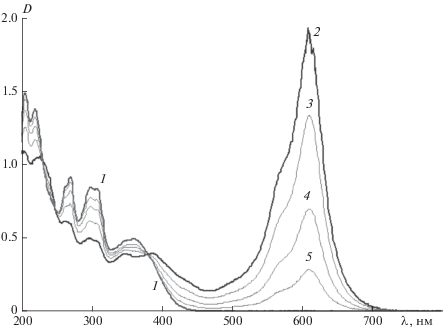
В отличие от спирооксазинов 1 и 2, фотохромные соединения 3 и 4 не окрашиваются при введении катионов металлов в их растворы (рис. 5, 6; табл. 1). Кроме того, при образовании комплексов с катионами металлов полоса поглощения фотоиндуцированной мерооксазиновой формы испытывает не батохромное, а гипсохромное смещение до 45 нм относительно положения максимума полосы поглощения этой формы в отсутствие катионов, а образующиеся комплексы проявляют положительный фотохромизм (рис. 5 и 6; табл. 1). Подобные результаты спектрально-кинетического исследования получены для растворов спирооксазина 4 (табл. 1).
Анализ полученных результатов показывает, что при комплексообразовании с катионами металлов спирооксазины с электронодонорными (1 и 2) и электроноакцепторными заместителями (3 и 4) проявляют различное поведение. В отличие от соединений 3 и 4, спирооксазины 1 и 2 образуют окрашенную мерооксазиновую форму сразу после введения в их растворы катионов металлов еще до УФ-облучения. При этом наблюдается батохромный сдвиг максимума полосы поглощения мероцианиновой формы на 25–35 нм. Это свидетельствует о высокой гиперполяризуемости возбужденных состояний этих комплексов. Наибольшие спектральные сдвиги проявляет соединение 1, что, по-видимому, связано с большей электронодонорной способностью заместителя по сравнению с соединением 2. Интенсивность полосы поглощения в видимой области спектра, возникающей сразу после введения катионов металлов в растворы фотохромных соединений, зависит от природы катионов. Она резко возрастает при увеличении ионного потенциала катиона (ср. данные для катионов Mg2+ и Tb3+ в табл. 1). При этом комплексы, образующиеся под действием УФ-облучения, характеризуются теми же максимумами полос поглощения, что и полосы поглощения, возникающие при введении катионов металлов в раствор до облучения. Однако они проявляют фотохромные свойства, возвращаясь в отсутствие света в исходную спирооксазиновую форму.
При используемом соотношении L/Me = = 1/100 реально могут образоваться только динамические комплексы с одной молекулой мероцианина. К сожалению, окрашенные комплексы, образующиеся до УФ-облучения, не обладают обратным фотохромизмом. Вероятно, это связано с высоким потенциальным барьером для термической релаксации из состояния комплекса в исходное спироциклическое состояние. При этом существует равновесие между спирооксазиновой формой и ее комплексами с катионами металлов. В случае ионов Tb3+ оно смещено в сторону комплексов, возникающих до облучения растворов. Оставшиеся спирооксазиновые молекулы образуют дополнительные комплексы с фенолятным кислородом мерооксазиновой формы при фотовозбуждении.
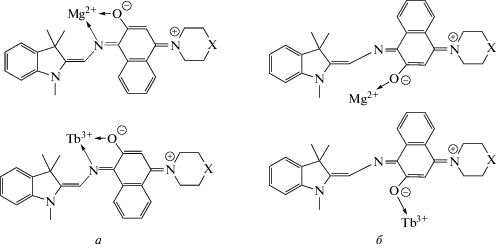
Возможное объяснение полученным результатам заключается в том, что комплексообразование соединений этого типа осуществляется по различным центрам (Схема 2 ). Мы предполагаем, что для спирооксазинов 1 и 2 образуются металлокомплексы хелатного (а) и фенолятного (б) типа.
Схема 2 . Возможные структуры комплексов соединений 1 и 2 с ионами Mg2+ и Tb3+ (X = CH2 для 1, X = O для 2).
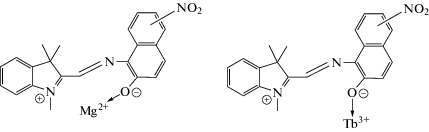
В случае спирооксазинов с электроноакцепторными нитро-заместителями (3 и 4) диалкиламино-группа, на которой может фиксироваться положительный заряд, отсутствует, поэтому комплексы образуются только при фотовозбуждении (Схема 3 ).
Схема 3 . Возможные структуры комплексов соединения 3 и 4 с ионами Mg2+ и Tb3+.
Гипсохромный сдвиг полос поглощения мерооксазиновой формы этих спирооксазинов свидетельствует о пониженной поляризуемости возбужденных состояний молекул, образующих комплекс. В этом случае комплексообразование осуществляется только с фенолятным кислородом мерооксазиновой формы.
ЗАКЛЮЧЕНИЕ
В отличие от спиропиранов комплексы исследованных молекул спирооксазинов, различающихся природой заместителей в оксазиновом фрагменте (с электронодонорными и электроноакцепторными свойствами), с катионами металлов не обладают обратным фотохромизмом. В случае спирооксазинов с электронодонорными пиперидино- и морфолиновыми заместителями окрашенные комплексы до облучения образуются, но они не проявляют фотохромных свойств. Для всех исследованных спирооксазинов характерно фотоиндуцированное образование комплексов с положительным фотохромизмом.
Работа выполнена при поддержке Министерством науки и высшего образования в рамках государственного задания ФНИЦ “Кристаллография и фотоника” РАН (АААА-А19-119040590066-7) в части спектрально-кинетического исследования процессов комплексообразования, МЦАИ РАН – в части разработки методики комплексообразования и ФИЦ химической физики им. Н.Н. Семёнова РАН (тема 0082-2019-0003) – в части синтеза спирооксазинов.
Список литературы
Photochromic Materials: Preparation, Properties and Applications / Eds. Tian H., Zhang J. Weinheim, Germany: Wiley-VCH, 2016.
Paramonov S.V., Lokshin V., Fedorova O.A. // J. Photochem. Photobiol., C. 2011. V. 12. P. 209.
Barachevsky V.A. // Rev. J. Chem. 2013. V. 3. P. 52.
Демина О.В., Беликов Н.Е., Мельникова И.А. и др. // Хим. физика. 2019. Т. 38. № 12. С. 44.
Zhang C., Zhang Z., Fan M. et al. // Dyes Pigm. 2008. V. 76. P. 832.
Zhang Z., Zhang C., Fan M. et al. // Ibid. V. 77. P. 469.
Kopelman R.A., Snyder S.M., Frank N.L. // J. Amer. Chem. Soc. 2003. V. 125. P. 13 684.
Строкач Ю.П., Валова Т.М., Барачевский В.А. и др. // Журн. научн. и прикл. фотографии. 1999. Т. 44. С. 1.
Лобанов А.В., Мельников М.Я. // Хим. физика. 2019. Т. 38. № 7. С. 11.
Fedorov Yu.V., Shepel N.E., Peregudov A.S. et al. // J. Photochem. Photobiol., A. 2019. V. 371. P. 453.
Попов Л.Д., Зайченко Н.Л., Барачевский В.А. и др. // ЖОХ. 2013. Т. 83. С. 2025.
Строкач Ю.П., Валова Т.М., Барачевский В.А. и др. // Изв. АН. Сер. хим. 2005. Т. 54. С. 1434.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика