Химическая физика, 2021, T. 40, № 8, стр. 82-90
Образование колебательно-возбужденных молекул HF при ингибировании горения водорода и метана в кислороде и воздухе дихлордифторметаном
А. И. Родионов 1, Н. М. Рубцов 2, А. Н. Виноградов 3, А. П. Калинин 4, *, И. Д. Родионов 1, К. Я. Трошин 1, Г. И. Цветков 2, В. И. Черныш 2, Б. С. Сеплярский 2
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
Москва, Россия
3 Акционерное общество “Научно-технический центр "Реагент”
Москва, Россия
4 Институт проблем механики им. А.Ю. Ишлинского Российской академии наук
Москва, Россия
* E-mail: kalinin@ipmnet.ru
Поступила в редакцию 19.06.2020
После доработки 24.07.2020
Принята к публикации 20.08.2020
Аннотация
С использованием гиперспектрометров видимого и ближнего инфракрасного диапазонов в продуктах реакций окисления водорода и метана в присутствии дифтордихлорметана (CF2Cl2) впервые обнаружены колебательно-возбужденные молекулы HF(v = 2, 3). Инициирование горения водорода и метана в воздушной и кислородной средах при атмосферном и пониженном давлении осуществлялось посредством искрового разряда. Регистрация распространения фронта пламени осуществлялась с помощью скоростной цветной киносъемки. Установлено, что молекулы HF(v = 3) при горении метана образуются в момент достижения максимальной скорости химического превращения, т.е. реакции с участием молекул CF2Cl2 конкурируют непосредственно с процессом развития реакционных цепей. Также обнаружено, что концентрационный предел воспламенения заранее перемешанной водородовоздушной смеси в присутствии дифтордихлорметана при давлении 1 атм превышает 10% CF2Cl2, при этом концентрационный предел воспламенения заранее перемешанной метановоздушной смеси составляет 1% CF2Cl2. Это означает, что активные центры горения водорода и метана, определяющие развитие горения, имеют разную химическую природу. Показано, что совокупность реакций с участием молекулы дифтордихлорметана, приводящих к образованию HF(v = 2, 3) при горении метана, должна включать активные центры горения метана.
ВВЕДЕНИЕ
Изучение процессов горения с участием фторуглеродов (хладонов) представляет как научный, так и практический интерес. Научный интерес связан с установлением механизма ингибирования пламени фторуглеродами. Практический интерес вызван тем, что фторуглероды являются как хладагентами, так и эффективными подавителями воспламенения огнеопасных газовых смесей и в недавнем прошлом широко использовались для обеспечения безопасности персонала и оборудования [1–3]. Использование этих соединений осложнено Монреальским соглашением по ограничению применения так называемых озоноразрушающих веществ, к числу которых отнесены эффективные ингибиторы горения – фторхлоруглероды. Однако озоновая дыра над Антарктидой, обнаруженная в 1985 году, остается почти столь же большой, как и в 1987 году, когда Монреальское соглашение было подписано. Научный интерес к фторхлоруглеродам связан с установлением химической природы реакций, вызывающих подавление горения, которое называется ингибированием, если эффективность добавки наблюдается при ее содержании в 10 раз меньшем содержания горючего.
Механизм ингибирования пламени хладонами до конца не изучен. Очевидно, что обрыв реакции с участием молекулы ингибитора может быть достаточно эффективен, если эта молекула реагирует с активным центром, участвующим в реакции разветвления [4] или продолжения [5] реакционной цепи. Убедиться в этом можно только на основе непосредственного измерения скорости реакции этого активного центра с ингибитором кинетическими или спектроскопическими методами. В работе [6] показано, что наиболее эффективным ингибитором из “озонобезопасных” является С4F10, минимальная эффективная концентрация которого составляет 6%. Однако при этом концентрация метана в стехиометрической смеси составляет около 9%, т.е. концентрация горючего сравнима с концентрацией ингибитора. Представляет интерес выяснить эффективность влияния “запрещенных” хлорсодержащих фреонов на горение водорода и метана, поскольку, как видно из сказанного выше, хлорфторуглероды не имеют отношения к разрушению озоносодержащего слоя.
В настоящей работе использованы новые методы дистанционного изучения процессов горения и взрыва, основанные на оптоэлектронных устройствах. Одновременное использование дистанционных сенсоров с традиционными лабораторными устройствами существенно расширяет объем получаемых результатов. Следует отметить, что современные сенсоры, такие как гиперспектральные приборы, обладают совершенно уникальными возможностями проведения 4D-измерений отраженного, рассеянного или излученного света. Регистрируются: 1) время, 2) длина волны, 3) интенсивность спектра на данной длине волны, 4) координата излучающего фрагмента источника света [7]. Гиперспектрометр позволяет одновременно осуществлять измерение спектральной и пространственной координат. При этом число спектральных и пространственных каналов может варьироваться от сотен до тысячи. Этот метод успешно дополняется методом скоростной цветной фотосъемки [8]. Последний позволяет визуализировать распространение фронта пламени и обнаруживать особенности процессов горения, в частности такие, как переход гладкого фронта пламени в ячеистую структуру [9] и т.п.
Цель настоящей работы – получение новых данных о химическом механизме действия ингибирующих добавок на процесс горения на примере исследования эффективности ингибирования окисления водорода и метана в воздушной и кислородной средах небольшими количествами дифтордихлорметана CF2Cl2, а также обнаружение в этом процессе колебательно-возбужденных молекул HF(v = 2, 3) с использованием гиперспектрометрических измерений совместно с цветной скоростной киносъемкой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментальной установке для регистрации излучения использовались гиперспектрометры и скоростная цветная фотокамера. Проводились эксперименты по анализу оптических спектров горения водорода и метана в кислороде и воздухе при атмосферном и пониженном давлении.
На рис. 1 показана схема экспериментальной установки. Реактор длиной 25 см и диаметром 12 см был изготовлен из нержавеющей стали и оборудован разборными крышками и оптическим окном из лейкосапфира. Опыты проводили при начальной комнатной температуре. Откачанный реактор заполняли газовой смесью из буферного объема высокого давления до необходимого давления и осуществляли инициирование искрой между двумя медными электродами (1.5 Дж). В экспериментах с составлением горючей смеси непосредственно в реакторе компоненты смеси напускали, начиная с компонента с наименьшей концентрацией.
Рис. 1.
Схема экспериментальной установки: 1 – реактор из нержавеющей стали, 2 – электронагреватель, 3 – тепловая изоляция, 4 – клапаны, 5 – буферный объем высокого давления, 6 – оптическое окно, 7 – цифровая кинокамера, 8 – сборки гиперспектрометров ВИД-3 и БИК, 9 – манометр, 10 – AЦП-преобразователь и компьютер для получения и накопления данных, 11 – цифровой милливольтметр, 12 – источник питания, 13 – искровой промежуток.
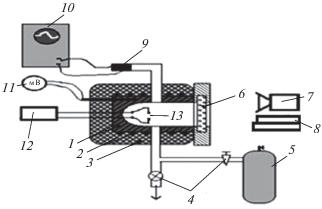
Давление в процессе горения регистрировали с помощью тензорезистивного датчика “Карат-ДИ”, сигнал с которого подавали через АЦП на компьютер. Перед каждым экспериментом реактор откачивали до 10–1 Торр. Давление в реакторе регистрировали образцовым вакуумметром, а в буферном объеме – образцовым манометром. Газы Н2, О2, СН4, CF2Cl2 использовали марки “ХЧ”. Регистрацию процесса горения осуществляли гиперспектрометрами, а также цветной скоростной кинокамерой Casio Exilim F1 Pro через оптическое окно в съемной крышке (рис. 1). Использовались гиперспектрометры видимого (ВИД) [10] и ближнего инфракрасного (БИК) [11] спектральных диапазонов: 400–1000 нм и 900–1800 нм соответственно.
Опыты были выполнены с газовыми смесями (H2 + воздух)стех + 10% CF2Cl2, (CH4 + воздух)стех + + (0–10%) CF2Cl2, (H2 + О2)стех + (10–15%) CF2Cl2, (СH4 + О2)стех + (10–15%) CF2Cl2. Использовались реагенты марки “ХЧ”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ЭКСПЕРИМЕНТА
В опытах с использованием скоростной цветной киносъемки было установлено, что 10%-ная добавка CF2Cl2 не оказывает заметного ингибирующего действия на горение заранее перемешанной смеси Н2–воздух, согласно [12–14]. Поскольку константа скорости реакции Н + CF2Cl2k = (3.3 ± 0.5) ⋅ 10–10 см3 ⋅ моль–1 ⋅ с–1 [15], атомы водорода почти при каждом соударении с молекулами фторхлоруглерода погибают. Наблюдаемое слабое ингибирование означает, что молекулы CF2Cl2 участвуют также в конкурирующих реакциях развития реакционных цепей. Однако добавка всего 1% CF2Cl2 к заранее перемешанной стехиометрической смеси метана с воздухом полностью подавляет инициированное воспламенение.
Также проводились эксперименты по инициированному воспламенению газовой смеси, приготовленной непосредственно в реакторе. При этом было установлено, что горючая смесь, приготовленная при напуске сначала 2% CF2Cl2 и затем стехиометрической смеси СН4–воздух до общего давления в 1 атм, не воспламеняется. Однако если смесь приготовить в обратном порядке (сначала напускается стехиометрическая смесь СН4–воздух, а затем – CF2Cl2 до давления в 1 атм), то воспламенение происходит уже при 4%-ной концентрации CF2Cl2. В присутствии хладона скачок давления выше, чем в его отсутствие (рис. 2). Поскольку этот скачок связан с повышением давления за счет выделения тепла при инициированном воспламенении [16], то это означает, что при окислении метана в присутствии хладона выделяется дополнительное тепло. Таким образом, понятие предела инициированного горения имеет смысл только для предварительно перемешанных смесей. Если же смеси создаются непосредственно перед применением, то наличие или отсутствие воспламенения определяется как порядком смешения, так и, видимо, геометрическими характеристиками установки.
Рис. 2.
Скоростная съемка распространения инициированного искровым разрядом фронта пламени в газовой смеси: а – (CH4 + воздух)стех, начальное давление – 1 атм; б – (CH4 + воздух)стех + 4% CF2Cl2. Внизу – осциллограммы изменения давления при инициированном воспламенении вышеуказанных смесей. Цифра на кадре соответствует порядковому номеру кадра после инициирования, скорость съемки – 600 кадров/c.
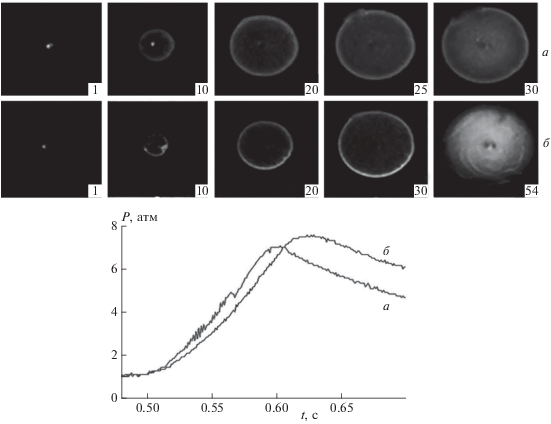
Полученный результат означает, что CF2Cl2 является не разбавителем, а эффективным ингибитором, действующая концентрация которого ниже концентрации горючего (9.5% в стехиометрической смеси метана с воздухом) почти в 10 раз. Таким образом, в условиях одной и той же установки концентрационный предел воспламенения смеси (H2 + воздух)стех в присутствии дифтордихлорметана превышает 10% CF2Cl2, при этом концентрационный предел воспламенения смеси (CH4 + воздух)стех составляет 1% CF2Cl2. Значит, согласно [17], нами получено дополнительное доказательство того, что активные центры горения метана и водорода, определяющие развитие горения, имеют разную химическую природу.
С помощью измерений гиперспектрометром и одновременной скоростной цветной киносъемки было исследовано горение смесей водорода и метана с воздухом и кислородом в присутствии дифтордихлорметана. На рис. 3 представлены спектры горения смеси (H2 + воздух)стех в присутствии 10% СF2Cl2 в видимой и ближней ИК-области при атмосферном давлении. Из рис. 3а видно, что в спектральном интервале 850–1000 нм находятся наиболее интенсивные полосы, которые по литературным данным относятся к переходу HF(v = 3) [18]. Отметим, что во фронте ингибированного пламени разогрев меньше, и линии спектров щелочных металлов Na и K, характерные для горячих пламен, слабоинтенсивны.
Рис. 3.
Спектры горения смеси (H2 + О2)стех в присутствии 10% СF2Cl2 при общем давлении 1.5 атм в видимой (а) и ближней ИК-области (б), зарегистрированные гиперспектрометрами; в – положение излучательных полос HF(2–0) и Н2О в ближней ИК-области по данным [18]; г – спектр излучения в ближней ИК-области смеси (H2 + О2)стех в присутствии 10% СF2Cl2 (1), наложенный на спектр излучения смеси (H2 + О2)стех (2).
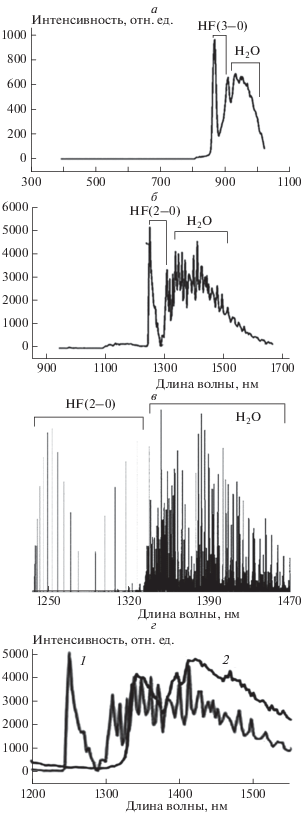
На рис. 3б представлен спектр горения смеси (Н2–воздух)стех в присутствии 10% СF2Cl2 в ближней ИК-области. Проведем отнесение полос, используя литературные данные [19], представленные на рис. 3в. Из сравнения рис. 3б и в следует, что полосы при 1250 и 1320 нм принадлежат колебательно-возбужденным молекулам HF(v = 2). Широкая полоса с максимумом при 1400 нм обусловлена излучением Н2О [19]. Это отнесение иллюстрирует рис. 3г, на котором представлен спектр воспламенения смеси (Н2 + воздух)стех в присутствии 10% СF2Cl2 (спектр 1), в ближней ИК-области наложенный на спектр воспламенения смеси (Н2 + + воздух)стех (спектр 2). Видно, что этот рисунок адекватно моделирует спектр, приведенный на рис. 3б.
Таким образом, в продуктах реакции горения смеси (H2 + воздух)стех в присутствии 10% СF2Cl2 обнаружены колебательно-возбужденные молекулы HF(v = 2, 3). Отметим, что молекулы HF в состоянии v = 3 были также обнаружены нами при ингибировании газофазного окисления природного газа перфтордекалином (C10F18) [20]. Молекулы HF(v = 3) могут возникать в практически термонейтральной реакции [15, 20, 21]:
(1)
${\text{Н}} + {\text{C}}{{{\text{F}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}} \to {\text{НF}} + {\text{CFC}}{{{\text{l}}}_{2}},$Для увеличения чувствительности методики путем добавления бóльшего количества хладона были использованы кислородные смеси вместо воздушных газовых смесей. Поскольку гиперспектральные измерения позволяют получать в процессе горения зависимость спектров от времени, мы использовали возможность связать эти спектры с изменением давления в реакторе.
На рис. 4а показана зависимость давления в реакторе от времени для процесса горения смеси (H2 + О2)стех + 10% CF2Cl2 при первоначальном давлении в реакторе 150 Торр. Тонким вертикальным линиям на рис. 4а соответствуют последовательности спектров в видимой области (гиперспектрометр ВИД), приведенные на рис. 4б. Цифры на этом рисунке означают последовательные временны́е кадры, регистрируемые гиперспектрометром.
Рис. 4.
а – Осциллограмма давления в реакторе при горении смеси (H2 + О2)стех + 10% CF2Cl2 при первоначальном давлении в реакторе 150 Торр, тонким вертикальным линиям соответствуют спектры на рис. 4б; б – зависимости относительных интенсивностей спектров в видимой области от времени для смеси (H2 + О2)стех + 10% CF2Cl2, измеренные гиперспектрометром БИК для давления 150 Торр, спектры соответствуют цифрам на рис. 4а; в – осциллограмма давления в реакторе при горении смеси (СH4 + О2)стех + + 10% CF2Cl2 при первоначальном давлении в реакторе 200 Торр, тонким вертикальным линиям соответствуют спектры на рис. 4г; г – зависимости относительных интенсивностей спектров в ближней ИК-области от времени для смеси (СH4 + О2)стех + 10% CF2Cl2, измеренные гиперспектрометром БИК для давления 200 Торр, спектры соответствуют цифрам на рис. 4в.
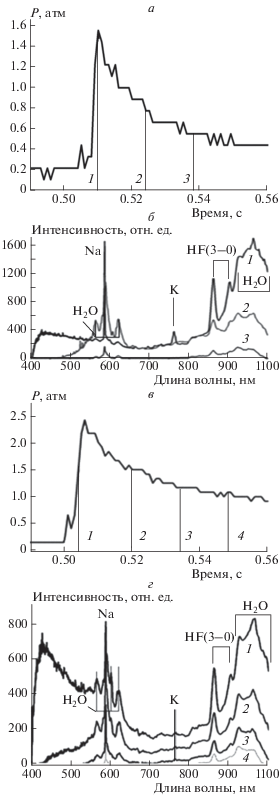
На рис. 4в показана зависимость давления в реакторе от времени для процесса горения смеси (СH4 + О2)стех + 10% CF2Cl2 при первоначальном давлении в реакторе 100 Торр. Тонким вертикальным линиям на рис. 4в соответствуют последовательности спектров в видимой области (гиперспектрометр ВИД), приведенные на рис. 4г. Обратим внимание на то, что в спектрах горячих продуктов реакции регистрируются также линии щелочных металлов – Na и K (рис. 4б, г, спектры 2–4). Из рис. 4 видно также, что в момент времени, соответствующий максимальной скорости химического превращения (рис. 4а, линия 1), в видимом спектре горения водорода и метана наблюдаются полосы паров воды в областях 600 и 950 нм [16] и полосы HF(v = 3); см. рис. 4б, г). Поскольку молекулы HF(v = 3) при горении метана образуются в момент достижения максимальной скорости химического превращения, этот факт указывает на то, что реакции с участием молекул CF2Cl2 конкурируют непосредственно с процессом развития реакционных цепей. При горении водорода, как видно из рис. 4б, реакции с участием молекул CF2Cl2 не приводят к химическому ингибированию, т.е. эти молекулы участвуют также в конкурирующих реакциях развития реакционных цепей.
В последующих опытах проводили сравнение интенсивностей излучения HF при горении водорода и метана в присутствии активной добавки. В описанных ниже экспериментах были использованы газовые смеси 2H2 + О2 + 10–15% CF2Cl2 и (СH4 + О2)стех + 10–15% CF2Cl2 Исследовали изменение интенсивностей сигнала HF(v = 2, 3) в зависимости от концентрации CF2Cl2. На рис. 5а, б приведены спектры излучения смесей (H2 + О2)стех + + 10% или 15% CF2Cl2 и (СH4 + О2)стех + 10% или 15% CF2Cl2, полученные для спектрального интервала 400–970 нм, а на рис. 5в, г – для интервала 970–1700 нм при начальном давлении 100 Торр. Из последовательности спектров во времени для каждого эксперимента был выбран спектр с максимальной интенсивностью. Видно, что в спектрах излучения при более интенсивном по сравнению с воздухом горении кислородных смесей излучательные линии атомов щелочных металлов (Na, K) [16] весьма интенсивны.
Рис. 5.
Спектры излучения при воспламенении следующих смесей: а – (H2 + О2)стех + 10% CF2Cl2 (1) и (СH4 + О2)стех + + 10% CF2Cl2 (2), полученные для спектрального интервала 400–970 нм; б – (H2 + О2)стех + 15% CF2Cl2 (1) и (СH4 + О2)стех + 15% CF2Cl2 (2), полученные для спектрального интервала 400–970 нм; в – (H2 + О2)стех + 10% CF2Cl2 (1) и (СH4 + О2)стех + 10% CF2Cl2 (2), полученные для спектрального интервала 970–1700 нм; г – (СH4 + О2)стех + 10% CF2Cl2 (1) и (H2 + О2)стех + + 10% CF2Cl2 (2), полученные для спектрального интервала 970–1700 нм. Начальное давление – 100 Торр. Из последовательности спектров во времени для каждого эксперимента выбран спектр с максимальной интенсивностью.
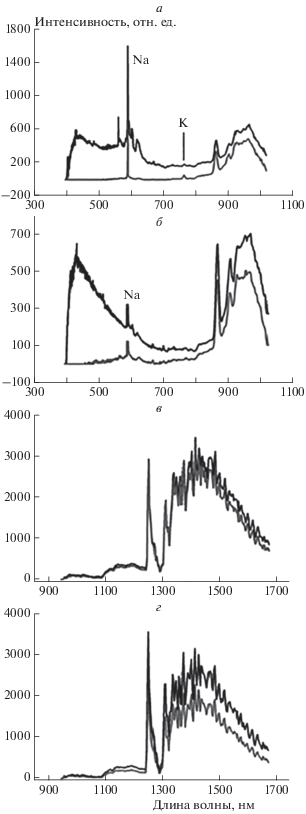
Из рис. 4, 5 следует, что излучение молекул HF(v = 2, 3) наблюдается при горении стехиометрической смеси метана с кислородом в присутствии 10% CF2Cl2, при этом максимальная интенсивность полос HF(v = 2, 3) при горении метана в кислороде даже выше, чем при горении гремучей смеси в присутствии такого же количества хладона.
Трудно ожидать, что максимальная концентрация атомов Н в ходе горения СН4 выше, чем при горении Н2. Более того, как указано выше, активные центры горения водорода и метана, определяющие развитие горения, имеют разную химическую природу. Это означает, что реакция с CF2Cl2, приводящая к образованию HF(v = 2, 3) при горении метана, должна включать активный центр горения метана. Поскольку CF2Cl2 является эффективным ингибитором горения метана, то этот активный центр должен участвовать в элементарном акте разветвления или продолжения реакционной цепи и содержать атом Н, чтобы образовать молекулу НF.
В настоящее время сведения по константам скорости элементарных реакций, имеющиеся в литературе, ограничены и противоречивы. По последним данным скорость реакции атомов кислорода в основном состоянии с хладоном [22]:
(2)
$О{{(}^{1}}D) + {\text{C}}{{{\text{F}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}} \to {\text{2Cl}} + Продукты,$В работе [23] дана оценка скорости реакции (в [24], наоборот, утверждается, что эта реакция практически не идет)
(3)
${\text{OH}} + {\text{C}}{{{\text{F}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}} \to Продукты\,\,({\text{CCl}}{{{\text{F}}}_{2}} + {\text{HOCl}}),$В реакции отрыва хлора от молекул CCl4, CFCl3 и CF2Cl2 радикалами CH3 при температуре 128 °C [25] величины констант скорости, полученные для этих трех реакций, соотносятся как 1 : 24 : 126. Данные работы [26] позволяют оценить константу скорости реакции (если результаты, полученные в работах [25, 26], верны)
(4)
${\text{C}}{{{\text{H}}}_{3}} + {\text{C}}{{{\text{F}}}_{{\text{2}}}}{\text{C}}{{{\text{l}}}_{2}} \to Продукты.$В работе [26] измерены константы скорости реакций
(5)
${\text{C}}{{{\text{H}}}_{3}} + {\text{CC}}{{{\text{l}}}_{4}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{Cl}} + {\text{CC}}{{{\text{l}}}_{3}},$(6)
${\text{C}}{{{\text{H}}}_{{\text{3}}}} + {\text{CC}}{{{\text{l}}}_{{\text{3}}}}{\text{Br}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{Br}} + {\text{CC}}{{{\text{l}}}_{3}},$Оценка константы скорости реакции (4) составит k4 ≈ 126k5 в предположении, что энергия активации реакции (4) равна некоторой средней величине из значений энергий активации реакций (5) и (6), т.е. k4 ≈ 109exp(–5000/RT) см3 ⋅ моль–1 ⋅ с–1. Полученная величина соответствует сравнительно медленной реакции, которая не может отвечать за эффективное ингибирование реакции газофазного окисления метана.
Следует отметить также, что полностью фторированные углеводороды являются худшими ингибиторами, чем CF2Cl2. Например, как указано выше, наиболее эффективным ингибитором из “озонобезопасных” является С4F10, минимальная эффективная концентрация которого составляет 6% [6]. Кроме того, мы ранее показали, что октадекафтордекагидронафталин (“искусственная кровь”, C10F18) в количестве 0.9% не ингибирует полностью окисление стехиометрической метановоздушной смеси; для полного ингибирования требуется дополнительно разбавить эту смесь углекислым газом в количестве 15% [20]. Это означает, что, как и в случае окисления водорода, за ингибирование окисления метана дихлордифторметаном отвечает некоторый цикл реакций, природа которых, также как и величины констант скорости этих реакций, требует существенного уточнения.
ЗАКЛЮЧЕНИЕ
С использованием гиперспектрометров видимого и ближнего инфракрасного диапазонов в продуктах реакций окисления водорода и метана в присутствии дифтордихлорметана впервые обнаружены колебательно-возбужденные молекулы HF(v = 2, 3). Показано, что применение оптоэлектронных устройств обеспечивает существенное повышение информативности получаемых результатов. Установлено, что молекулы HF(v = 3) при горении метана образуются в момент достижения максимальной скорости химического превращения, т.е. реакции с участием молекул CF2Cl2 конкурируют непосредственно с процессом развития реакционных цепей. Экспериментально показано, что максимальные интенсивности полос HF(v = 3) и HF(v = 2) при горении метана в кислороде выше, чем при горении гремучей смеси в присутствии такого же количества хладона. Это означает, что реакция с CF2Cl2, приводящая к образованию HF(v = 2, 3) при горении метана, должна включать активный центр горения метана. Кроме того, поскольку CF2Cl2 является эффективным ингибитором (его рабочая концентрация составляет ~10% от доли горючего), то этот активный центр должен участвовать в элементарном акте разветвления или продолжения реакционной цепи и содержать атом водорода, чтобы образовать молекулу НF.
Установлено, что концентрационный предел воспламенения заранее перемешанной водородовоздушной смеси в присутствии дифтордихлорметана при давлении 1 атм превышает 10% CF2Cl2, при этом концентрационный предел воспламенения заранее перемешанной метановоздушной смеси составляет 1% CF2Cl2. Это означает, что активные центры горения водорода и метана, определяющие развитие горения, имеют разную химическую природу.
В части проведения экспериментов по изучению ингибирования горения водорода и метана в кислороде и воздухе добавками дихлордифторметана работа выполнена в рамках госзадания ФИЦ ХФ РАН (регистрационный номер АААА-А21-121011990037-8); эксперименты при использовании скоростной цветной киносъемки выполнены в рамках госзадания ИСМАН по теме 44.1, в части изучения горения на основе гиперспектрометра – в рамках госзадания ИПМех РАН (регитрационный номер АААА-А20-120011690135-5), в части обработки результатов экспериментов – в рамках госзаданий с регистрационными номерами AAAA-A17-117021310376-4, АААА-А17-117112240026-5 и АААА-А21-121011990037-8.
Список литературы
Соколик А.С. Самовоспламенение, пламя и детонация в газах. М.: Изд-во АН СССР, 1960.
Coward H.F., Jones G.W. Limits of flammability of gases and vapors. Bulletin 503. Washington: Bureau of Mines, 1952.
Zabetakis M.G. Flammability characteristics of combustible gases and vapors. Bulletin 627. Washington: Bureau of Mines, 1965.
Азатян В.В., Бакланов Д.И., Гвоздева Л.Г. и др. // Докл. АН. 2001. Т. 376. № 1. С. 55.
Рубцов Н.М. Азатян В.В. Бородулин P.P. // Изв. АН СССР. Сер. хим. 1980. № 6. С. 1234.
Голов Н.В. Дис. … канд. техн. наук. М.: ВНИИПО, 2017.
Калинин А.П., Трошин К.Я., Орлов А.Г., Родионов А.И. // Датчики и системы. 2008. № 12. С. 19.
Рубцов Н.М., Калинин А.П., Цветков Г.И., Трошин К.Я., Родионов А.И. // Хим. физика. 2018. Т. 37. №11. С. 42
Рубцов Н.М., Трошин К.Я., Борисов А.А. и др. // Хим. физика. 2011. Т. 30. № 1. С. 1.
Виноградов А.Н., Егоров В.В., Калинин А.П., Родионов А.И., Родионов И.Д. // Оптич. журн. 2016. Т. 83. № 4. С. 54.
Рубцов Н.М., Виноградов А.Н., Калинин А.П. и др. // Хим. физика. 2019. Т. 38. № 4. С. 53.
Азатян. В.В., Шебеко Ю.Н., Болодьян И.А., Навценя В.Ю. // Физика горения и взрыва. 2006. № 6. С. 96.
Tokuhashi K., Urano Y., Horuguchi S., Kondo S.E. // Combustion Science and Technology. 1990. V. 72. № 1–3. P. 117.
Babushok V.I., Linteris G.T., Meier O., Pagliaro J.L. // Combustion Science and Technology. 2014. V. 186. № 6. P. 792.
Dobis O., Benson S.W. // J. Phys. Chem. A. 2000. V. 104. № 4. P. 777.
Lewis B., Von Elbe G. Combustion, Explosions and Flame in Gases. N.Y.–London: Acad. Press, 1987.
Рубцов Н.М., Цветков Г.И., Черныш В.И. // Кинетика и катализ. 2008. Т. 49. № 3. С. 363.
Herzberg G. Molecular Spectra and Molecular Structure. V. 1. Spectra of Diatomic Molecules. 2nd ed. N.Y.: Van Nostrand, 1950.
Hole O.M. In situ HF-concentration measurements in combustion environments using diode laser absorption spectroscopy. A theoretical investigation. Bachelor Project in Physics University of Lund, 2011.
Rubtsov N.M., Seplyarskii B.S., Tsvetkov G.I., Chernysh V.I. // Mendeleev Commun. 2010. № 20. P. 98.
Егоров Д.Л., Храпковский Г.М. // Вестн. Казан. технол. ун-та. 2011. Т. 14. № 1. С. 7.
Brasseur G., Jacob D. Chemical Mechanism. In Modeling of Atmospheric Chemistry. Cambridge: Cambridge University Press, 2017.
Belikov Y., Nikolayshvili S. // J. Earth Sci. Engin. 2016. № 6. P. 115.
Atkinson R., Hansen D.A., Pitts J.N., Jr. // J. Chem. Phys. 1975. № 63. P. 1703.
Hautecloque S. // J. Photochem. 1977. V. 7. № 2. P. 83.
Macken R.V., Sidebottom H.W. // Intern. J. Chem. Kin. 1979. V. 11. № 5. P. 321.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


