Химическая физика, 2022, T. 41, № 11, стр. 24-32
Исследование двухстадийной пиролитической конверсии высушенного осадка сточных вод в синтез-газ
Г. Я. Герасимов 1, *, В. В. Хасхачих 2, Г. А. Сычев 3, О. М. Ларина 3, В. М. Зайченко 3
1 Институт механики Московского государственного университета им. М.В. Ломоносова
Москва, Россия
2 Вирумааский колледж, Таллинский технический университет
Таллин, Эстония
3 Объединенный институт высоких температур Российской академии наук
Москва, Россия
* E-mail: gerasimov@imec.msu.ru
Поступила в редакцию 25.01.2022
После доработки 16.02.2022
Принята к публикации 21.02.2022
- EDN: DTCLPX
- DOI: 10.31857/S0207401X22110048
Аннотация
Проведено комплексное исследование двухстадийной термической переработки высушенного осадка сточных вод в синтез-газ с высоким содержанием водорода. Данные термогравиметрического анализа исследуемого материала были использованы для определения кинетических параметров его разложения. Экспериментальное исследование пиролиза высушенного осадка сточных вод в реакторе с неподвижным слоем позволило выявить основные закономерности образования продуктов пиролиза (полукокс, смола, неконденсирующийся газ и вода). С помощью данных газовой хромато-масс-спектрометрии была сделана оценка качества жидких продуктов пиролиза. Показано, что двухстадийная термохимическая конверсия исходного материала, сочетающая пиролиз и последующий гетерогенный крекинг летучих продуктов пиролиза, позволяет эффективно получать достаточно чистый высококалорийный газ, основными компонентами которого являются водород и монооксид углерода.
ВВЕДЕНИЕ
Осадок сточных вод (ОСВ) представляет собой продукт анаэробного сбраживания органических веществ на городских очистных сооружениях [1]. В последнее время наблюдается значительный рост производства этого вида отходов, связанный с быстрой урбанизацией и индустриализацией в различных странах мира [2–4]. Проблема контроля за накоплением ОСВ связана с рядом трудностей, в основе которых лежит отсутствие технических решений, позволяющих одновременно удовлетворить экологическим и экономическим требованиям их утилизации [5]. Основными путями утилизации ОСВ являются их захоронение, использование в сельском хозяйстве в качестве удобрения почвы, термическая переработка, а во многих развивающихся странах – неконтролируемый сброс в окружающую среду [6].
Термохимическая переработка ОСВ в энергетические продукты имеет более высокие экономические показатели, более высокую эффективность и большее сокращение объема утилизируемого материала по сравнению с другими методами переработки [7]. Этот метод утилизации включает в себя сжигание, пиролиз и газификацию ОСВ [8, 9]. Пиролиз считается предпочтительным вариантом, поскольку он позволяет уменьшить количество вредных выбросов, а также для него не требуется дорогостоящей подготовки исходного материала. Он приспособлен для переработки отходов различного вида, включая твердые коммунальные отходы [10], отработанные шины [11], полимерные отходы [12] и др. Пиролиз в сочетании с каталитическим реформингом позволяет получать высококачественное жидкое топливо для транспорта [13, 14].
Производство водорода из биомассы и органических отходов рассматривается в настоящее время как один из наиболее перспективных источников энергии, поскольку водород имеет высокую теплотворную способность по сравнению с традиционными видами топлива, а его сжигание способствует сокращению выбросов парниковых газов [15]. Термохимическая переработка биомассы путем газификации позволяет получать высококалорийный синтез-газ с большим содержанием водорода, который может использоваться для комбинированного производства тепла и электроэнергии [16, 17]. В качестве альтернативной технологии получения синтез-газа можно рассматривать двухстадийную пиролитическую конверсию биомассы в газообразное топливо [18]. Эта технология включает в себя пиролиз и последующий гетерогенный крекинг летучих продуктов пиролиза в среде, нагретой до 1000 °C. Основные ее достоинства – высокая степень энергетической конверсии исходного сырья и отсутствие в конечном продукте жидкой фракции. В настоящей работе представлены результаты исследования двухстадийного пиролитического процесса применительно к переработке ОСВ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемый материал и методы анализа
Исследования проводили с образцами ОСВ, взятыми с городских очистных сооружений (г. Люберцы, Московская область), которые прошли предварительную термофильную обработку в анаэробных метантенках при температуре 50–53 °С. Материал образцов в высушенном виде представляет собой сыпучую массу темно-коричневого цвета с небольшой примесью волокон органического происхождения. Средний размер частиц исходного сырья составляет величину порядка нескольких миллиметров. Изображение исследуемого материала приведено на рис. 1.
Для определения элементного состава высушенных образцов ОСВ использовали CHNS-анализатор Vario MACRO cube производства компании Elementar Analysensysteme GmbH (Germany). Калибровочную процедуру проводили с помощью сертифицированных образцов сульфаниламида. При этом стандартное отклонение результатов измерения не превышало 0.2%. Содержание кислорода в образцах ОСВ определяли по остаточному принципу. Высшую теплоту сгорания исследуемого материала рассчитывали по формуле Менделеева. Для проведения технического анализа использовали анализатор STA 449 F3 Jupiter производства компании Netzsch (Germany) в режиме TG-DTG. Нагрев образцов осуществляли в атмосфере азота со скоростью β = 10 °C/мин до конечной температуры 815 °C. Результаты технического и элементного анализа исследуемого материала приведены в табл. 1.
Таблица 1.
Технический и элементный анализ исследуемого образца ОСВ
| Технический анализ, мас.%* | Элементный анализ, мас.%* | ||
|---|---|---|---|
| параметр | значение | элемент | количество |
| Влажность | 6.61 | C | 25.52 |
| Выход летучих | 41.44 | H | 3.36 |
| Зольность | 42.85 | S | 1.18 |
| Остаточный углерод | 9.10 | N | 3.35 |
| Высшая теплота сгорания, МДж/кг | 11.13 | O** | 17.13 |
Анализ компонентного состава неконденсирующегося газа пиролиза осуществляли с использованием газового хроматографа “Хроматэк-Кристалл 5000.1” (Россия). Хроматограф оснащен двумя детекторами теплопроводности и пламенно-ионизационным детектором, который обладает высокой чувствительностью к органическим соединениям. Обработку сигналов проводили с помощью специализированного программного обеспечения “Хроматэк Аналитик”. Определение компонентного состава жидких продуктов пиролиза было проведено на хромато-масс-спектрометре Thermo Focus DSQ II производства фирмы “Thermo Electron” (USA). Для идентификации компонентов смеси использовались референтные масс-спектры, представленные в базе данных NIST/EPA/NIH 17.
Термогравиметрический анализ образцов ОСВ для последующего определения кинетических параметров их термического разложения проводили на приборе синхронного термического анализа STA 2500 Regulus производства компании Netzsch Gerätebau GmbH (Germany) в режиме TG-DTG до конечной температуры 950 °С со скоростью нагрева β = 10, 20 и 50 °С/мин. Реакционный объем во время эксперимента продувался азотом для обеспечения инертности атмосферы. Измерения проводили в корундовых (Al2O3) тиглях объемом 0.3 мл. Во время нагрева фиксировали изменение массы образца. Для проведения термического анализа в режиме TG-FTIR анализатор STA 2500 Regulus был соединен обогреваемой газовой линией с ИК-фурье-спектрометром Invenio-S компании Bruker Optik GmbH (USA).
Экспериментальные установки
Пиролиз высушенного ОСВ проводили на лабораторной установке, основным элементом которой является реактор пиролиза с неподвижным слоем. Схема установки и описание принципа ее работы приведены в работе [19]. Реактор пиролиза представляет собой модифицированную реторту Фишера, которая отличается от стандартной реторты тем, что она изготовлена из нержавеющей стали и ее объем увеличен до 210 см3. Реактор помещен в цилиндрическую электрическую печь и герметично соединен со стеклянной двугорлой колбой, которая погружена в охлаждаемую ванну и выполняет роль конденсатора для жидких продуктов пиролиза. Выходящий неконденсирующийся газ накапливался в газгольдере. Темпом нагрева электрической печи управляли с помощью специального регулятора. Он составлял 10 °С/мин, что контролировали по термопаре, помещенной снаружи реактора.
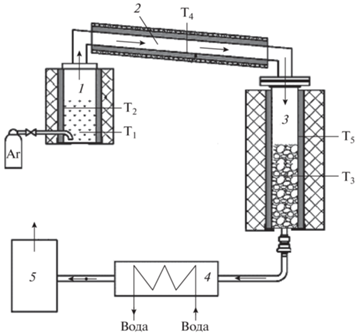
Двухстадийную пиролитическую конверсию исследуемого материала в синтез-газ проводили на лабораторной установке, схема которой приведена на рис. 2. Установка состоит из реактора пиролиза 1 с неподвижным слоем и реактора крекинга 3, которые соединены газоходом 2. Исходное сырье помещали в реактор пиролиза и нагревали до определенной температуры, которую контролировали термопарами Т1 и Т2. Летучие продукты пиролиза поступали в реактор крекинга, который заполнен древесным углем или керамикой. Температуру в реакторе крекинга фиксировали на уровне 1000 °С и контролировали термопарами T3 и T5. Теплообменник 4, охлаждаемый водой, использовали для контроля за степенью деструкции жидкой фракции в реакторе крекинга. Объем неконденсирующегося газа измеряли расходомером 5. Перед началом эксперимента установку продували аргоном.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кинетика термического разложения
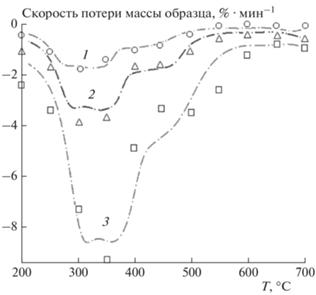
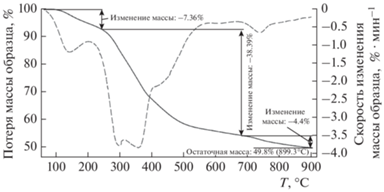
На рис. 3 показаны кривые термогравиметрического (TГ) и дифференциального термогравиметрического (ДТГ) анализов образца ОСВ, полученные при его нагреве со скоростью β = 20 °C/мин в нейтральной атмосфере. Кривая ТГ представляет собой зависимость массы образца (в % от исходной массы) от времени процесса, а кривая ДТГ описывает скорость потери массы. ТГ–ДТГ-Анализ исследуемого материала обычно используется для понимания механизма его термического разложения, а также для определения кинетических параметров этого процесса. Видно, что процесс разложения характеризуется тремя температурными областями. Первая область (T < 220 °C) соответствует испарению абсорбированной влаги и разложению низкостабильных органических соединений. Вторая область, лежащая в интервале температур от 220 до 680 °C, связана с основной потерей массы образца в 38.39%. Сложный характер поведения ДТГ-кривой в этой области говорит о разложении различных составляющих органической массы. Как показано в работе [20], эти составляющие можно идентифицировать с гемицеллюлозой, целлюлозой и лигнином, которые дают пики на ДТГ-кривой при 295, 360 и 420 °C соответственно. И наконец, третья область может быть связана с разложением неорганических материалов, таких как карбонат кальция [21].
Рис. 3.
Результаты TГ- (сплошная линия) и ДТГ-анализов (штриховая линия) анализа ОСВ при скорости нагрева β = = 20 °С/мин.
Данные ТГ–ДТГ-анализа образца ОСВ, приведенные на рис. 3, были использованы для определения кинетики его термического разложения. Кинетические параметры многостадийного процесса обычно определяются исходя из зависимости степени конверсии материала в i-й стадии процесса, αi, от времени t. Основное кинетическое уравнение может быть записано в виде
(1)
$d{{\alpha }_{i}}{\text{/}}dt = {{k}_{i}}\left( T \right){{\left( {1 - {{\alpha }_{i}}} \right)}^{{ni}}},\,\,\,\alpha {\text{ }} = {{V}_{i}}/{{V}_{i}}_{\infty }.$(2)
$d{{\alpha }_{i}}{\text{/}}dT = {{A}_{i}}{{\beta }^{{ - 1}}}{{\left( {1 - {{\alpha }_{i}}} \right)}^{{ni}}}\exp \left( { - {{E}_{i}}/RT} \right).$Имеется много методов определения кинетических параметров A и E с использованием уравнения (2) [22]. При этом простейшие кинетические модели рассматривают двух- или трехстадийный процесс [21]. В некоторых моделях учитывается зависимость кинетических параметров от степени конверсии α [23], скорости нагрева β и размера частиц перерабатываемого материала [24]. В кинетической модели, представленной в работе [25], основная масса органической составляющей ОСВ представлена в виде смеси гемицеллюлозы, целлюлозы и лигнина. Кинетические параметры их разложения получены путем многопараметрической подгонки результатов расчета суммарной степени конверсии к данным ТГ–ДТГ-анализа с минимизацией среднеквадратичного отклонения во всем температурном интервале. Уточненные параметры модели, учитывающие данные ТГ–ДТГ-анализа исследуемого образца ОСВ при β = 20 °C/мин, приведены в табл. 2.
Таблица 2.
Кинетические параметры термического разложения ОСВ
| Стадия | Vi∞, мас.% | Ai, мин–1 | Ei, кДж/моль | ni |
|---|---|---|---|---|
| 1 | 7.36 | 2.75 · 102 | 24.88 | 1.00 |
| 2 | 11.68 | 1.12 · 107 | 79.07 | 0.96 |
| 3 | 14.26 | 2.32 · 1016 | 191.42 | 2.96 |
| 4 | 12.45 | 1.65 · 105 | 80.72 | 1.20 |
| 5 | 4.47 | 7.94 · 103 | 90.90 | 1.00 |
Сравнение данных ТГ–ДТГ-анализа при скоростях нагрева β = 10, 20 и 50 °C/мин с результатами расчета показано на рис. 4 и 5. Расчет проведен по формуле (2) с использованием уточненных кинетических параметров из табл. 2. Видно, что кинетические параметры модели, полученные при β = 20 °C/мин, хорошо воспроизводят ТГ–ДТГ-кривые для других значений этого параметра процесса. Анализ рис. 4 показывает, что с увеличением скорости нагрева TG кривая, представляющая собой зависимость относительной массы исследуемого образца от времени, смещается вверх. Причина в том, что при более быстром нагреве до определенной температуры время процесса уменьшается. В этом случае органическая масса образца не успевает достичь такой же степени разложения, как при низкой скорости нагрева до той же температуры. Хотя при этом, как видно из рис. 5, скорость разложения значительно увеличивается.
Продукты пиролиза
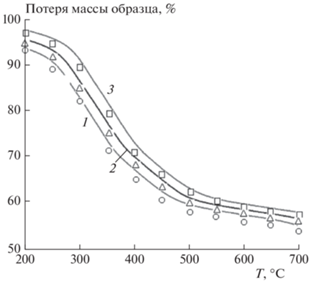
Пиролиз образцов ОСВ на лабораторной установке с неподвижным слоем проводился с целью изучения основных закономерностей образования продуктов пиролиза, к которым относятся полукокс, смола, неконденсирующийся газ и вода. Влияние температуры на выход полукокса показано на рис. 6. Температура эксперимента соответствует конечной температуре процесса пиролиза. Измеренные значения потери массы исследуемого материала были получены при следующих условиях. Материал нагревался от начальной до конечной температуры со скоростью β = 10 °C/мин с последующим охлаждением реактора со скоростью β = = –10 °C/мин. Поведение полукокса характеризуется монотонным снижением его концентрации в продуктах пиролиза с 74.64 мас.% при 259 °С до 55.19 мас.% при 650 °С из-за разложения органической массы ОСВ.
Рис. 6.
Сравнение экспериментальных данных по выходу полукокса, полученных в реакторе с неподвижным слоем (точки), с кинетическим расчетом (кривая 1) и данными TГ-анализа (кривая 2).
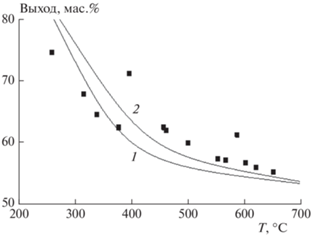
На рис. 6 приведены также результаты кинетического расчета (кривая 1) и данные ТГ-анализа (кривая 2). Кинетический расчет проведен при тех же условиях нагрева и последующего охлаждения исследуемого материала, что и в эксперименте. Видно, что в температурной области до 400 °C результаты расчета и данные эксперимента практически совпадают. Последующее увеличение температуры приводит к смещению экспериментальных точек вверх. Это может быть объяснено тем фактом, что температура процесса измерялась с помощью термопары, расположенной на стенке реактора. Температура внутри реактора была ниже, что ведет к снижению степени разложения исследуемого образца. Разница между ТГ-кривой и данными расчета объясняется тем, что в ТГ-анализе не учитывается последующее медленное охлаждение образца, что приводит к дополнительному разложению его материала.
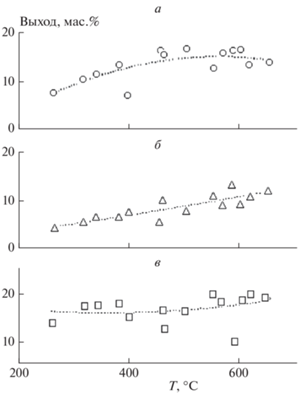
Температурные зависимости выхода смолы, неконденсирующегося газа и воды при пиролизе ОСВ приведена на рис. 7. Видно, что выход смолы увеличивается с ростом температуры, достигает максимума в 16.5 мас.% при Т = 460 °С, а затем начинает уменьшаться, как это показано на рис. 7а. Уменьшение выхода смолы связано с вторичными реакциями ее разложения при повышенных температурах. Данную температуру можно считать оптимальной для реакторов с внешним нагревом, если целью процесса является получение максимального выхода смолы. Соответствующее значение, полученное в реакторе с твердым теплоносителем в условиях быстрого нагрева, составляет 21.3 мас.% [26]. Выход газа (см. рис. 7б) характеризуется монотонным увеличением с ростом температуры от 5 мас.% при 300 °С до 12 мас.% при 650 °С. Содержание воды в продуктах пиролиза ОСВ практически не изменяется с ростом температуры и находится на уровне 15–20 мас.% (см. рис. 7в). Пирогенетическая вода образуется в результате разложения белков, лигноцеллюлозы и жирных кислот, содержащихся в ОСВ [27].
Рис. 7.
Выход смолы (а), газа (б) и пирогенетической воды (в) в зависимости от температуры процесса. Точки – экспериментальные данные, линии – подгоночные кривые.
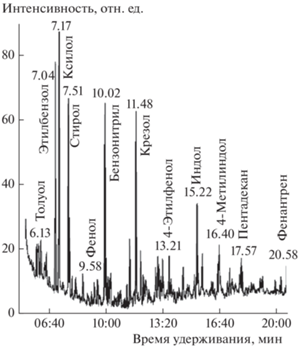
Конденсируемые соединения в продуктах пиролиза ОСВ представляют собой сложную смесь окисленных углеводородов и пирогенетической воды, содержание которой в 2–3 раза превосходит количество влаги в исходном сырье, что указывает на высокую эффективность реакций ее образования при пиролизе. Отделенная от воды смола пиролиза была проанализирована с помощью метода газовой хромато-масс-спектрометрии. Полученная этим методом хроматограмма смолы, полученная при 650 °С, приведена на рис. 8. Видно, что смола пиролиза включает большое количество ароматических, кислородсодержащих и азотсодержащих соединений, содержание которых в исследуемом образце характеризуется относительной площадью хроматографического пика. Ароматические соединения представлены в основном толуолом (4.19%), этилбензолом (11.54%), ксилолом (14.37%), стиролом (5.72%) и крезолом (7.72%). К основным кислородсодержащим соединениям относятся масляная кислота (2.68%), фенол (7.74%) и этилфенол (2.75%). Азотсодержащие соединения включают метилпиридин (2.68%), метилпиразин (2.60%), пиридинол (1.96%), индол (3.91%) и бензонитрил (2.27%). Полученные данные согласуются с результатами исследований других авторов [28].
Двухстадийная конверсия в синтез-газ
Смола пиролиза вызывает повышенный интерес с точки зрения возможности ее применения в качестве жидкого топлива. Тем не менее большое содержание высокомолекулярных соединений затрудняет ее прямое использование в энергетических целях. Тяжелые алифатические углеводороды и арены способствуют образованию нагара и выбросам полициклических ароматических углеводородов в окружающую среду. Кислородсодержащие компоненты ведут к коррозии внутренних поверхностей энергетических установок. Компоненты с большим содержанием азота ответственны за образование значительного количества оксидов азота в продуктах сгорания. Все это ведет к поиску путей преобразования жидких продуктов пиролиза в более ценное энергетическое топливо [29, 30].
Альтернативой простому пиролизу является двухстадийная термохимическая конверсия ОСВ, сочетающая пиролиз и последующий крекинг летучих продуктов пиролиза с образованием синтез-газа с высоким содержанием водорода [18]. Данный процесс исследовали на комбинированной лабораторной установке, изображенной на рис. 2. Исходный образец ОСВ помещали в реактор пиролиза и нагревали со скоростью 10 °С/мин. При достижении термопарой Т1 заданной температуры проводилась выдержка в течение 20 мин. Образующиеся летучие продукты пиролиза поступали в реактор крекинга, предварительно нагретый до 1000 °С. Большая удельная поверхность наполнителя реактора (древесный уголь или керамика) способствует быстрому нагреву летучих продуктов и последующему гетерогенному крекингу высокомолекулярных углеводородных соединений, входящих в их состав.
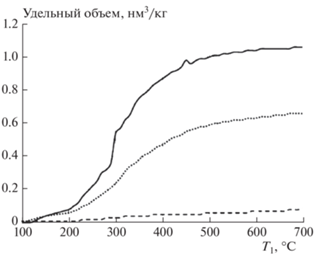
На рис. 9 приведена зависимость удельного объема газа, образующегося при проведении процесса, от температуры Т1 в реакторе пиролиза Т1. Исследованы три случая: пиролиз без крекинга, пиролиз с крекингом на керамике и пиролиз с крекингом на древесном угле. Видно, что двухстадийный процесс дает значительно более высокий выход газа, чем простой пиролиз. Увеличение выхода синтез-газа при древесноугольном наполнителе связано в первую очередь с гетерогенными реакциями взаимодействия H2O и CO2 с углеродом, которые приводят к образованию H2 и CO. С другой стороны, древесный уголь играет роль катализатора, который способствует разложению углеводородных компонентов газа.
Рис. 9.
Зависимость удельного объема неконденсирующихся газов от температуры T1 в реакторе пиролиза: простой пиролиз (штриховая линия); пиролиз с крекингом на керамике (точечная линия); пиролиз с крекингом на древесном угле (сплошная линия).
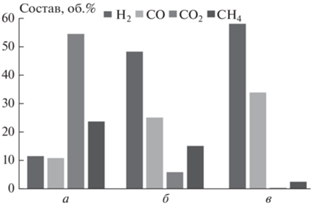
В процессе двухстадийной пиролитической конверсии ОСВ образуется синтез-газ, основными компонентами которого являются водород и оксид углерода. При этом за счет крекинга летучих продуктов пиролиза происходит практически полное разложение высокомолекулярных углеводородных компонентов, что приводит к отсутствию жидкой фазы в охлажденных продуктах двухстадийного процесса. Состав газа, образующегося в трех вариантах проведения процесса (простой пиролиз, пиролиз с крекингом на керамике и пиролиз с крекингом на древесном угле), приведен на рис. 10. Видно, что при крекинге на древесном угле газ состоит из H2 (58.2 об.%) и CO (33.8 об.%) с небольшой примесью CH4. Степень энергетической конверсии исходного материала в газ при этом составляет η = 61%, а калорийность газа Q = 11.4 МДж/нм3. Таким образом, в зависимости от параметров процесса и конкретной схемы его реализации двухстадийная пиролитическая переработка ОСВ позволяет эффективно получать достаточно чистый высококалорийный газ, основными компонентами которого являются водород и монооксид углерода.
ЗАКЛЮЧЕНИЕ
Для понимания механизма термического разложения высушенного образца ОСВ проведен его термогравиметрический анализ. Кинетические параметры процесса, полученные с использованием данных ТГ–ДТГ-анализа, дают достаточно хорошее описание поведения исследуемого образца в реакторе пиролиза с неподвижным слоем.
Экспериментальное исследование пиролиза ОСВ в реакторе с неподвижным слоем показывает, что основными продуктами его термического разложения являются полукокс, смола, неконденсирующийся газ и вода. Поведение полукокса характеризуется монотонным снижением его концентрации в продуктах пиролиза с 74.64 мас.% при 259 °С до 55.19 мас.% при 650 °С. Выход смолы увеличивается с ростом температуры, достигает максимума в 16.5 мас.% при Т = 460 °С, а затем начинает уменьшаться. Выход газа характеризуется монотонным увеличением от 5 мас.% при 300 °С до 12 мас.% при 650 °С. Содержание воды практически не меняется и находится на уровне 15–20 мас.%. Анализ смолы пиролиза методом хромато-масс-спектрометрии показывает, что она включает большое количество ароматических, кислородсодержащих и азотсодержащих соединений, что затрудняет ее прямое использование в энергетических целях.
Альтернативой простому пиролизу является двухстадийная термохимическая конверсия ОСВ. Данный процесс исследовался на комбинированной лабораторной установке, которая состоит из реактора пиролиза и реактора крекинга летучих продуктов пиролиза. Показано, что при крекинге на древесном угле образующийся синтез-газ состоит из H2 (58.2 об.%), CO (33.8 об.%) и небольшой примеси CH4. Степень энергетической конверсии исходного материала в газ при этом составляет 61%, а калорийность газа равна 11.4 МДж/нм3.
Работа выполнена по гранту Российского фонда фундаментальных исследований № 20-58-00043 (Бел_а), а также в рамках госзадания Министерства науки и высшего образования Российской Федерации “Экспериментальное и теоретическое исследование кинетических процессов в газах” (регистрационный номер АААА-А19-119012990112-4).
Список литературы
Vasco-Correa J., Khanal S., Manandhar A., Shah A. // Bioresour. Technol. 2018. V. 247. P. 1015.
Seiple T.E., Coleman A.M., Skaggs R.L. // J. Environ. Manage. 2017. V. 197. P. 673.
Namsaraev Z.B., Gotovtsev P.M., Komova A.V., Vasilov R.G. // Renew. Sustain. Energy Rev. 2018. V. 81. P. 625.
Oladejo J., Shu K., Luo X., Yang G., Wu T. // Energies. 2019. V. 12. № 1. P. 60.
Kacprzak M., Neczaj E., Fijałkowski K. et al. // Environ. Res. 2017. V. 156. P. 39.
Schell M., Horst T., Quicker P. // J. Environ. Manage. 2020. V. 263. № 110367.
Syed-Hassan S.S.A., Wang Y., Hu S., Su S., Xiang J. // Renew. Sustain. Energy Rev. 2017. V. 80. P. 888.
Gao N., Kamran K., Quan C., Williams P.T. // Prog. Energy Combust. Sci. 2020. V. 79. № 100 843.
Jiang G., Xu D., Hao B., Liu L., Wang S., Wu Z. // J. Clean. Prod. 2021. V. 311. № 127811.
Хасхачих В.В., Ларина О.М., Сычев Г.А., Герасимов Г.Я., Зайченко В.М. // Теплофизика высоких температур. 2021. Т. 59. № 3. С. 467.
Тереза А.М., Агафонов Г.Л., Андержанов Э.К. и др. // Хим. физика. 2020. Т. 39. № 8. С. 58.
Бревнов П.Н., Новокшонова Л.А., Крашенинников В.Г. и др. // Хим. физика. 2019. Т. 38. № 9. С. 54.
Neumann J., Jäger N., Apfelbacher A. et al. // Biomass Bioenergy. 2016. V. 89. P. 91.
Zhu F., Zhang R., Zhao L., Qi J. // Renew. Sustain. Energy Rev. 2021. V. 135. № 110260.
Shahabuddin M., Krishna B.B., Bhaskar T., Perkins G. // Bioresour. Technol. 2020. V. 299. № 122557.
Alves O., Calado L., Panizio R.M., Gonçales M., Monteiro E., Brito P. // Waste Manage. 2021. V. 131. P. 148.
Brachi P., Di Fraia S., Massarotti N., Vanoli L. // Energy Conver. Manage.: X. 2022. V. 13. № 100171.
Лавренов В.А., Ларина О.М., Синельщиков В.А., Сычев Г.А. // Теплофизика высоких температур. 2016. Т. 54. № 6. С. 950.
Хасхачих В.В., Корнильева В.Ф., Герасимов Г.Я. // Инж.-физ. журн. 2021. Т. 94. № 3. С. 599.
Thipkhundthod P., Meeyoo V., Rangsunvigit P., Rirksomboon T. // J. Anal. Appl. Pyrolysis. 2007. V. 79. P. 78.
Gao N., Li J., Qi B. et al. // Ibid. 2014. V. 105. P. 43.
Shahbeig H., Nosrati M. // Renew. Sustain. Energy Rev. 2020. V. 119. № 109567.
Naqvi S., Tari R., Hameed Z. // Fuel. 2018. V. 233. P. 529.
Xu Q., Tang S., Wang J., Ko J.H. // Process Saf. Environ. Prot. 2018. V. 115. P. 49.
Barneto A.G., Carmona J.A., Alfonso J.E.M., Blanco J.D. // J. Anal. Appl. Pyrolysis. 2009. V. 86. P. 108.
Gerasimov G., Khaskhachikh V., Potapov O. et al. // Waste Manage. 2019. V. 87. P. 218.
Lin Y.-C., Cho J., Tompsett G.A., Westmoreland P.R., Huber G.W. // J. Phys. Chem.: C. 2009. V. 113. P. 20097.
Huang F., Yu Y., Huang Y. // J. Anal. Appl. Pyrolysis. 2018. V. 130. P. 36.
Haghighat M., Majidian N., Hallajisani A., Samipourgiri M. // Sustain. Energy Technol. Assess. 2020. V. 42. № 100 870.
Liu X., Zhu F., Zhang R., Zhao L., Qi J. // Renew. Sustain. Energy Rev. 2021. V. 135. № 110260.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика