Химическая физика, 2022, T. 41, № 3, стр. 22-28
Изменение параметров воспламенения нанодисперсных порошков железа при длительном хранении
С. Г. Вадченко 1, *, М. И. Алымов 1
1 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
Черноголовка, Россия
* E-mail: vadchenko@ism.ac.ru
Поступила в редакцию 23.08.2021
После доработки 27.09.2021
Принята к публикации 20.10.2021
- EDN: NDYNYX
- DOI: 10.31857/S0207401X2203013X
Аннотация
В работе исследовано воспламенение образцов, спрессованных из нанодисперсного порошка железа с частицами наноразмера, хранящегося после изготовления в течение четырех лет. Температура воспламенения образцов, спрессованных из первоначально пирофорного порошка со средним диаметром частиц 85 нм, составляла около 105 °C. В результате окисления и агломерирования порошка при длительном хранении в воздушной атмосфере температура воспламенения повысилась до 225 °C. Проведено сравнение температур воспламенения нанодисперсного порошка железа и порошков железа со средними размерами частиц 3, 4.6 и 55 мкм. Показана возможность частичного восстановления реакционной способности таких порошков железа после их отжига в аргоне.
ВВЕДЕНИЕ
Хранение и безопасное использование нанодисперсных порошков металлов обладающих пирофорными свойствами, составляют важную часть их производства и применения [1–9]. Как правило, после их изготовления нанопорошки пассивируют [10–12]. Как долго после пассивации могут храниться порошки и насколько они теряют при хранении свою реакционную способность важные вопросы их практического применения. При длительном хранении порошков металлов происходит их естественная пассивация – они теряют свою высокую реакционную способность вследствие образования крупных и прочных агломератов, что приводит к уменьшению удельной поверхности. При разгерметизации сосуда с порошком и контакте с воздухом на поверхности частиц происходит рост оксидных слоев. Начальные стадии окисления наночастиц порошка железа от 20 мин до 3 мес исследованы в работе [13]. Было показано, что через 20 мин после получения порошка термическим разложением Fe(CO)5 на его поверхности уже имеются вюстит Fe1 – xO и магнетит Fe3O4. До 120 мин выдержки изменения несущественны, а в дальнейшем при хранении до 3 мес на рентгенограммах наблюдается исчезновение пиков вюстита.
В работах [14, 15] исследовали термическую стабильность и горение порошков Fe, полученных методом электрического взрыва проводников после хранения в течение 16 и 18 лет. В работе [16] были исследованы порошки Al с частицами наноразмера, хранящиеся в течение 27 лет на воздухе в естественных условиях. За время хранения их реакционная способность снижается, но они остаются чрезвычайно активными. В работе [14] показано, что в ряду порошков металлов Al, Zn, Cu, Fe наиболее существенно снижается реакционная способность железа. Скорость горения порошка Fe после 16 лет хранения уменьшилась в два раза. Реакционная способность наночастиц порошков металлов и ее изменение при длительном хранении зависят от величины удельной поверхности, морфологии частиц, степени их окисления. Эти параметры зависят от способа получения порошка. Данных об изменении реакционной способности при длительном хранении порошков Fe, полученных восстановлением гидроксида железа водородом [17], нет. Исследование изменения реакционной способности такого порошка при длительном хранении в лабораторных условиях является одной из целей работы.
В некоторых случаях необходимо восстановление реакционной способности таких порошков. Повторный отжиг их в водороде требует специального оборудования и особых мер безопасности. Кроме того, обработка водородом может приводить к снижению активности металлов в атмосферном кислороде [18]. В данной работе показано изменение температуры воспламенения порошков железа после длительного хранения и предложен механизм частичного восстановления их реакционной способности при отжиге в аргоне.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали порошки железа с частицами наноразмера, полученные восстановлением гидроксида железа водородом [17]. Все эксперименты проводили с порошком из одной партии. После изготовления первое вскрытие сосуда с порошком и прессование образцов проводили в атмосфере аргона. В дальнейшем порошок железа хранился в закрытом сосуде в воздушной атмосфере. Удельную поверхность наночастиц железа определяли по методу Брунауэра–Эммета–Тейлора (БЭТ) на приборе Sorbi-M (“МЕТА”, Новосибирск). Исследуемые образцы представляли собой таблетки диаметром 3–3.1 мм, толщиной 1.5–2.5 мм и массой 40–60 мг. Вес измеряли на аналитических весах AND GR-202 (“A&D Co.”, Япония) с точностью 0.01 мг. Относительная плотность образцов составляла 0.4–0.52. Рентгенофазовый анализ (РФА) проводили на дифрактометре ДРОН-3М (“Буревестник”, Санкт-Петербург).
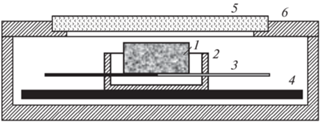
В качестве критерия реакционной способности порошков была выбрана температура воспламенения, определяемая как резкий подъем температуры образца, обусловленный разогревом за счет реакции окисления. Схема проведения эксперимента показана на рис. 1. Для определения температуры воспламенения образцы укладывали в тигель из нитрида бора на плоскую дифференциальную термопару из вольфрамо-рениевых проволок ВР5/ВР20, прокатанных до толщины 20 мкм. Градуировка термопары проверялась по температурам кипения воды, плавления цинка, алюминия и меди. Зазор между образцом и стенками тигля был не менее 1 мм, что обеспечивало равнодоступность воздуха к образцу. Тигель нагревали с помощью расположенной под ним графитовой ленты, через которую пропускали электрический ток. Эксперименты проводили на воздухе с открытой крышкой реактора, а для отжига образцов – в протоке аргона при атмосферном давлении. Процесс нагрева регистрировали на компьютере и записывали на видеокамеру.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 представлены рентгенограммы порошков железа после их изготовления и хранения от пяти сут до четырех лет. При хранении порошка происходит его окисление, что видно по заметному росту пиков оксида Fe3O4 (рентгенограммы 1–3).
Рис. 2.
Рентгенограммы порошков: 1 – после изготовления и хранения в аргоне в течение 5 сут; 2, 3 – после хранения в воздушной атмосфере в течение 18 и 48 мес соответственно; 4 – после отжига в аргоне; 5 – после воспламенения; ⚫ – α-Fe, ◼ – Fe3O4, ◆ – Fe2O3, ▲ – FeO.
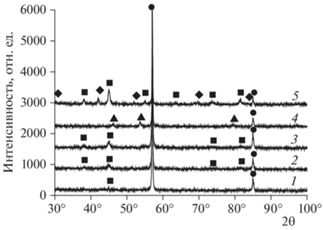
На рис. 3 показаны фотографии образцов исходного порошка и порошка после хранения в течение 4 лет 10 мес, которые показывают изменение морфологии частиц и их слипание. Удельная поверхность порошка за время хранения уменьшилась с 9 до 6.6 м2/г. Изменение удельной поверхности вызвано как агломерацией частиц, так и ростом на их поверхности оксидов. Если известна удельная поверхность порошков S, то по формуле d = 6/(ρS), где ρ = 7.85 г/см3 (плотность железа), можно рассчитать средний диаметр d частиц железа. При S = 9.0 м2/г диаметр наночастиц железа равен 85 нм. После хранения расчетный средний диаметр частиц увеличился до 101 нм. Анализ поверхности частиц методом сканирующей электронной микроскопии (СЭМ) показал, что концентрация кислорода за время хранения увеличилась от 3–8 до 22–27 ат.%. На основании результатов рентгенофазового анализа методом корундовых чисел оценена концентрация оксида железа Fe3O4 после различных сроков хранения. По этим данным и результатам СЭМ в приближении сферической геометрии частиц со средним размером 85 нм были рассчитаны усредненные значения толщин пленок оксида Fe3O4, которые составили от 1 нм в образце исходного порошка до 4 нм после 18 мес хранения и 8 нм после 4 лет хранения. Очевидно, что это очень приближенная оценка, но она подтверждает значительный рост оксидной пленки. Полученные значения толщины пленки меньше, чем дает расчет по величине удельной поверхности, которая меняется также из-за агломерации. Воспламенение и горение порошка приводит к росту количества Fe3O4 и появлению оксида Fe2O3 (рис. 2, рентгенограмма 5), а образцы приобретают коричневый цвет.
Рис. 3.
Фотографии образцов порошков железа: а – после изготовления и хранения в аргоне в течение 5 сут; б – после хранения в течение 4 лет 10 мес в воздушной атмосфере.

На рис. 4 показаны типичные термограммы нагрева образцов после их хранения в атмосфере аргона от пяти сут до четырех лет. Для сравнения на рис. 4 приведены термограммы нагрева особо чистого карбонильного железа (марки ОСЧ6-2, ТУ 6-09-3000-78) со средним размером частиц 4.6 мкм и железного порошка марки ПЖР 3.200.28 (фракция 50–63 мкм). Критическую температуру воспламенения Tig определяли как точку пересечения касательных, проведенных на участках разогрева и резкого роста температуры (рис. 4, кривая 5). Температура воспламенения образцов из радиотехнического железа марки Р-10 со средним размером частиц 3 мкм такая же, как и у карбонильного железа марки ОСЧ. Температура воспламенения карбонильного железа составляет 280 ± 10 °C (термограмма 5). На термограмме нагрева образца из железного порошка марки ПЖР (термограмма 6) в области 440 °C наблюдается ускорение роста температуры, которое условно можно назвать воспламенением. Сравнение с температурами начала окисления или воспламенения, полученными в других работах, показывает, что они зависят от многих факторов: способа получения порошка, примесей, размеров образцов, метода исследования и т.д. Так, в работе [19] термогравиметрическим методом исследовали окисление порошка железа с размером частиц 30–3000 нм, полученного путем электрического взрыва железной проволоки в инертной атмосфере (НИИ высоких напряжений при Томском политехническом университете). Масса образцов составляла 5–10 мг. Поверхность образца за счет значительного теплового эффекта реакции окисления достигает температуры саморазогрева (~300 °С), выше которой происходит тепловое самовозгорание (тление) порошка. В работе [20] показано, что после микроволнового облучения порошка Fe температура начала его окисления возрастала с 150 до 158 °С, а для железа марки Р-10 – немонотонно менялась в диапазоне 150–275 °С.
Рис. 4.
Термограммы нагрева образцов порошков железа: 1 – t = 5 сут, 2 – 4 мес, 3 – 18 мес, 4 – 48 мес, 5 – образец из карбонильного железа марки ОСЧ, 6 – образец из железного порошка марки ПЖР.
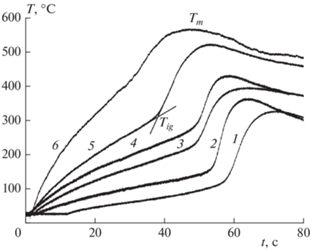
Значение максимальной температуры Tm, достигаемой при горении, увеличивается при повышении температуры воспламенения. Это происходит за счет увеличения температуры нагрева до Tc, но разогрев образцов (разность температур) ΔT = Tm – Tig при этом снижается от ΔT = 210 °C (после хранения порошков в течение 5 сут) до ΔT = 165 °C (после хранения в течение четырех лет). Уменьшение разогрева происходит как за счет увеличения толщины пленки оксидов, так и за счет уменьшения удельной поверхности порошка вследствие агломерации.
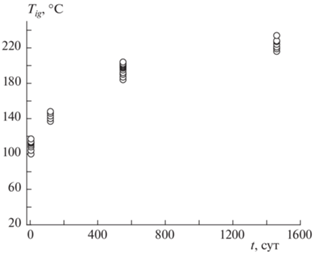
Зависимость температуры воспламенения порошков Fe от времени хранения показана на рис. 5. Из рисунка видно, что Tig возрастает от 105 ± 5 °C до 225 ± 10 °C после 48 мес хранения. Эта зависимость может быть приближенно описана логарифмическим уравнением Tig ≈ 65.5 + 20.1 ln(t + 1), где t – время в сут.
В некоторых случаях необходимо восстановление активности порошков после длительного хранения. Относительно простым способом оказался отжиг в аргоне. Процесс частичного восстановления реакционной способности железа заключается в кратковременном (несколько секунд) нагреве порошка до температуры 560–600 °C и обусловлен распадом вюстита при температуре 560 °С по обратимой эвтектоидной реакции Fe1– xO ↔ α-Fe + + Fe3O4. Строение окалины соответствует диаграмме состояния [21, 22] и состоит из слоев оксидов железа; наибольшую толщину имеет слой вюстита. Согласно данным из [22], при температурах выше 700 °C соотношение значений толщины слоев оксидов составляет hFeO : ${{h}_{{{\text{F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}}}}$ : ${{h}_{{{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}}$ ≈ 100 : 10 : 1. Ниже температуры 570 °C вюстит разлагается на металлическое железо и магнетит, но тонкая пленка вюстита, прилегающая к железу, может сохраняться до температуры 400 °C. Механизмы окисления различны для массивных образцов и наночастиц. Сведения о формировании состава слоев при температурах ниже 570 °C на поверхности железа противоречивы [22]. По одним данным, при низких температурах формируются только слои Fe3O4 и Fe2O3, по другим – при комнатной температуре наночастицы железа быстро покрываются двойным слоем, состоящим из вюстита, прилегающего к железу, и магнетита [13, 23–25]. В работе [26] установлено, что для массивных образцов при комнатной температуре кинетика роста слоев Fe3O4 и Fe2O3 подчиняется логарифмической зависимости от времени. Для порошков железа, полученных восстановлением при 800 °С, прирост массы происходит по линейному закону [27].
За четыре года хранения порошка на частицах железа образовалась достаточно толстая пленка оксида Fe3O4. После нагрева в аргоне до температур выше 560 °C фаза Fe3O4 исчезает, но появляется фаза FeO (рентгенограмма 4 на рис. 2). Переход магнетита в вюстит и обратно при нагреве и охлаждении наблюдается визуально по изменению цвета образца. Термограммы процесса отжига и воспламенения показаны на рис. 6. После нагрева образца в аргоне и охлаждения до комнатной температуры в реактор напускали воздух, при этом начиналась реакция и разогрев образца. В зависимости от температуры отжига величина разогрева достигает ΔT = 70 °С, а температура воспламенения снижается на 60 °С. Цикл нагрева в аргоне и впуск в реактор воздуха после охлаждения образца может быть повторен несколько раз и после каждого нагрева в аргоне и охлаждения при впуске воздуха наблюдается разогрев металла (рис. 6).
Рис. 6.
Термограмма нагрева образца в аргоне (I) и его воспламенения на воздухе (II): 1 – время впуска воздуха в реактор, 2 – включение нагрева образца. На вставке: воспламенение образца после трехкратного отжига в аргоне и разогрева на воздухе (III).
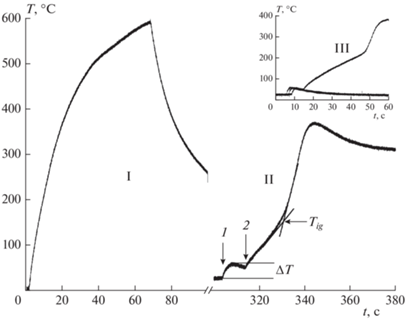
Нужно отметить, что после нагрева в аргоне карбонильного железа марки ОСЧ 6-2 и железа марки Р-10 разогрева на воздухе при комнатной температуре и изменения температуры воспламенения не наблюдали. Одной из причин является различие в размере частиц. Так, при одинаковой толщине слоев оксида, отношение объема оксида на поверхности наночастицы к объему наночастицы в 30–50 раз больше, чем для частиц размером 3–5 мкм. Поэтому объем активного железа, образующегося по реакции разложения вюстита на частицах микронного размера, незначителен. Для подтверждения этого предположения порошок карбонильного железа марки ОСЧ 6-2 был предварительно окислен, а затем нагрет в аргоне. В этом случае после охлаждения образца и впуска в реактор воздуха происходил разогрев образца на 5–10 °С, а температура перегиба на термограммах воспламенения карбонильного железа понижалась на 20–30 °С.
Возможный механизм частичного восстановления реакционной способности порошка железа может быть представлен следующим образом. При нагреве в аргоне Fe диффундирует из наночастицы в слой Fe3O4 и восстанавливает его: Fe3O4 + Fe → → FeOх. При охлаждении происходит обратная реакция: FeOх → Fe3O4 + Fe. После охлаждения образца до комнатной температуры восстановленное железо находится в активном состоянии в слое оксида и на его поверхности и при впуске в реактор воздуха начинается реакция окисления с выделением тепла. Восстановление железа из его оксида также наблюдали в работе [26] при нагреве наночастиц до температуры 450 °C в вакууме при давлении 5 · 10(–10) мбар.
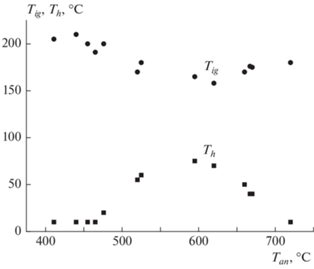
На рис. 7 показаны зависимости температуры воспламенения Tig и температуры разогрева Th образца из порошка, хранящегося четыре года, при впуске воздуха при комнатной температуре от температуры отжига в аргоне Tan. При нагреве в аргоне образцов до температур менее 450 °С эффекта уменьшения Tig не наблюдали. Минимум и максимум на графиках зависимостей Tig(Tan) и Th(Tan) связаны со спеканием порошка при температурах нагрева выше 650 °C, который приводит к уменьшению его удельной поверхности. На порошках карбонильного и радиотехнического железа со средним размером частиц 3–4.6 мкм после нагрева и охлаждения в аргоне и последующем впуске воздуха разогрева не наблюдали, что связано с малой толщиной оксидной пленки по отношению к объему частицы.
ЗАКЛЮЧЕНИЕ
Температура воспламенения порошка железа с частицами наноразмера при длительном хранении в атмосфере воздуха растет приблизительно по логарифмическому закону и за четыре года изменилась от 105 до 225 °C за счет увеличения толщины оксидных пленок и агломерации порошка. Реакционная способность порошка Fe может быть частично восстановлена кратковременным нагревом в атмосфере аргона до температуры 560–600 °C вследствие распада при охлаждении вюстита на магнетит и выделяющееся при этом активное железо. При нагреве порошка Fe в аргоне выше 650 °C спекание приводит к уменьшению его удельной поверхности и эффект снижения температуры воспламенения исчезает. Предложенный механизм частичного восстановления реакционной способности подтверждается экспериментами с использованием дополнительно окисленных порошков карбонильного железа марок ОСЧ и Р-10. Таким образом, после длительного хранения порошка железа, полученного восстановлением гидроксида железа водородом, его использование в пиротехнических устройствах ограничено, но возможно для других применений, например модификации стали.
Авторы благодарят В.A. Зеленского и А.Б. Анкудинова за предоставленные для исследования наноразмерные порошки железа.
Список литературы
Бернер М.К., Зарко В.Е., Талавар М.Б. // Физика горения и взрыва. 2013. Т. 49. № 6. С. 3.
Bouillard J., Vignes A., Dufaud O. et al. // J. Hazard. Mater. 2010. V. 181. № 1–3. P. 873; https://doi.org/10.1016/j.jhazmat.2010.05.094
Лернер М.И., Сваровская Н.В., Псахье С.Г. и др. // Рос. нанотехнол. 2009. Т. 4. № 11–12. С. 56.
Metal Nanopowders: Production, Characterization, and Energetic Applications / Eds. Gromov A.A., Teipel U.J. Winheim–Berlin: VCH, 2014; https://doi.org/10.1002/9783527680696
Моногаров К.А., Мееров Д.Б., Фролов Ю.В. и др. // Хим. физика. 2019. Т. 38. № 8. С. 40; https://doi.org/10.1134/S0207401X19080119
Hosokawa M., Nogi K., Naito M. et al. Nanoparticle Technology Handbook. 3rd ed. Elsevier, 2007;https://doi.org/10.1016/C2017-0-01011-X
Васильев А.А., Дзидзигури Э.Л., Ефимов М.Н. и др. // Хим. физика. 2021. Т. 40. № 6. С. 18; https://doi.org/10.31857/S0207401X21060157
Чуканов Н.В., Ларикова Т.С., Дрёмова Н.Н. и др. // Хим. физика. 2020. Т. 39. № 3. С. 71; https://doi.org/10.31857/S0207401X20030036
Алымов М.И., Сеплярский Б.С., Вадченко С.Г. и др. // Хим. физика. 2021. Т. 40. № 4. С. 85; https://doi.org/10.31857/S0207401X21040026
Рубцов Н.М., Сеплярский Б.С., Алымов М.И. Критические явления и размерные эффекты в автоволновых процессах с экзотермическими реакциями. Саратов: “КУБиК”, 2019.
Alymov M.I., Rubtsov N.M., Seplyarsky B.S. et al. // Mendeleev Commun. 2017. V. 27. Issue 5. P. 482; https://doi.org/10.1016/j.mencom.2017.09.017
Алымов М.И., Рубцов Н.М., Сеплярский Б.С. и др. // Докл. АН. 2017. Т. 477. № 2. С. 186; https://doi.org/10.7868/S0869565217320111
Simeonidis K., Mourdikoudis S., Tsiaoussis I. et al. // Mod. Phys. Lett. B. 2007. V. 21. № 18. P. 1143; https://doi.org/10.1142/S0217984907013845
Kyrmakova O.S., Sechin A.I., Nazarenko O.V. // J. Phys.: Conf. Ser. 2017. V. 881. № 1. P. D12027; https://doi.org/10.1088/1742-6596/881/1/012027
Nazarenko O.B., Sechin A.I., Amelkovich Y.A. // Met. Mater. Intern. 2021. V. 27. P. 962; https://doi.org/10.1007/s12540-019-00443-8
Nazarenko O.B., Amelkovich Yu.A., Sechin A.I. // Appl. Surf. Sci. 2014. V. 321. P. 475; https://doi.org/10.1016/j.apsusc.2014.10.034
Алымов М.И., Рубцов Н.М., Сеплярский Б.С. и др. // Неорган. материалы. 2017. Т. 53. № 9. С. 929.
Зеленский В.А., Алымов М.И., Анкудинов А.Б. и др. Перспективные материалы. 2009. № 6. С. 83.
Коршунов А.В. // Изв. Томского политехнического ун-та. 2011. Т. 318. № 3. С. 5.
Мостовщиков А.В., Ильин А.П., Чумерин П.Ю. и др. // ЖТФ. 2018. Т. 88. № 8. С. 1259.
Okamoto H. Desk Handbook: Phase Diagrams for Binary Alloys. Second Ed. Dhio, USA: ASM International, 2010.
Кубашевский О., Гопкинс Б.Э. Окисление металлов и сплавов. Пер. с англ. М.: Металлургия, 1965.
Parkinson G.S. // Surf. Sci. Rep. 2016. V. 71. Issue. 1. P. 272; https://doi.org/10.1016/j.surfrep.2016.02.001
Grosvenor A.P., Kobe B.A., McIntyre N.S. // Surf. Sci. 2004. V. 565. P. 151; https://doi.org/10.1016/J.SUSC.2004.06.210
Roosendaal S.J. Thesis. Passivation Mechanisms in the Initial Oxidation of Iron by Oxygen and Water Vapor. Universiteit Utrecht, 1999.
Karim W., Kleibert A., Hartfelder U. et al. // J. Sci Rep. 2016. V. 6. P. 18818;https://doi.org/10.1038/srep18818
Дзидзигури Э.Л. Дис. … д-ра техн. наук. Научно-методические основы исследования кристаллической структуры и свойств нанопорошков переходных металлов. М.: МИСиС, 2017.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика