Химическая физика, 2022, T. 41, № 6, стр. 85-90
Динамика возбужденных состояний интермедиатов Криге CH3CHOO в верхней атмосфере Земли
Ю. А. Дьяков 1, 2, *, С. О. Адамсон 1, П. К. Ванг 2, 3, 4, 5, А. С. Ветчинкин 1, Г. В. Голубков 1, 6, В. Д. Песков 1, А. И. Родионов 1, А. Г. Сыромятников 1, С. Я. Уманский 1, Д. В. Шестаков 1, М. Г. Голубков 1
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Исследовательский центр экологических изменений, Академия Синика
Тайбэй, Тайвань
3 Факультет аэронавтики и астронавтики Национального университета Ченг Кунг
Тайнань, Тайвань
4 Факультет науки об атмосфере, Тайваньский национальный университет
Тайбэй, Тайвань
5 Факультет атмосферы и океана, Висконсинский университет в Мадисоне
Мадисон, Висконсин, США
6 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: yuri_dyakov@mail.ru
Поступила в редакцию 10.01.2022
После доработки 15.02.2022
Принята к публикации 20.02.2022
- EDN: JGSHQH
- DOI: 10.31857/S0207401X22060036
Аннотация
Карбонилоксиды, или интермедиаты Криге, играют важную роль во многих физико-химических процессах, протекающих в атмосфере Земли. Интермедиаты Криге являются химически активными соединениями, легко вступающими в реакции с другими компонентами атмосферы, способствуя образованию OH- и CH3-радикалов, токсичных соединений азота и различных кислот. Традиционно в литературе рассматриваются реакции с участием только тех карбонилоксидов, которые являются наиболее стабильными в тропосфере при стандартных атмосферных условиях. В настоящей работе показано, что в мезосфере и ионосфере, где общая концентрация молекул мала, а интенсивность УФ-излучения и число свободных электронов велики, реакции с участием электронно-возбужденных состояний интермедиатов Криге CH3CHOO играют существенную роль. В этом случае следует учитывать особенности распада всех изомеров молекулы CH3CHOO.
1. ВВЕДЕНИЕ
Карбонилоксиды, известные как интермедиаты Криге, инициируют в атмосфере множество
важных химических процессов [1]. Обычно они образуются в результате озонолиза алкенов и являются крайне активными
химическими веществами. Имея в своем составе функциональную группу  , обладающую бирадикальными свойствами, карбонилоксиды вступают в реакцию с большим
количеством атмосферных молекул: с ненасыщенными углеводородами [2–6], частицами сажи, метаном [7], озоном [8, 9], водой [10–12], радикалами OH [13–17], а также молекулами SO2 и NO2, серной, азотной, соляной и другими кислотами [18–21]. Эти реакции наряду с диссоциацией исходных реагентов под действием излучения в
верхней атмосфере и ионосфере запускают каскады вторичных процессов [13, 22–32], приводящих к образованию активных молекул и ионов, влияющих на поглощение атмосферой
ультрафиолетового (УФ) излучения, ионизирующей радиации и радиоволн [33, 34]. Последнее, в частности, создает помехи для прохождения радиоизлучения гигагерцового
диапазона через D- и E‑слои ионосферы и увеличивает ошибки позиционирования глобальных
навигационных спутниковых систем и дистанционного зондирования [35–37]. В работе [7] было установлено, что взаимодействие интермедиатов Криге с метаном разрушает молекулы
этого парникового газа и вызывает образование радикалов OH, которые являются естественными
“очистителями” планеты от вредных антропогенных выбросов [14–16].
, обладающую бирадикальными свойствами, карбонилоксиды вступают в реакцию с большим
количеством атмосферных молекул: с ненасыщенными углеводородами [2–6], частицами сажи, метаном [7], озоном [8, 9], водой [10–12], радикалами OH [13–17], а также молекулами SO2 и NO2, серной, азотной, соляной и другими кислотами [18–21]. Эти реакции наряду с диссоциацией исходных реагентов под действием излучения в
верхней атмосфере и ионосфере запускают каскады вторичных процессов [13, 22–32], приводящих к образованию активных молекул и ионов, влияющих на поглощение атмосферой
ультрафиолетового (УФ) излучения, ионизирующей радиации и радиоволн [33, 34]. Последнее, в частности, создает помехи для прохождения радиоизлучения гигагерцового
диапазона через D- и E‑слои ионосферы и увеличивает ошибки позиционирования глобальных
навигационных спутниковых систем и дистанционного зондирования [35–37]. В работе [7] было установлено, что взаимодействие интермедиатов Криге с метаном разрушает молекулы
этого парникового газа и вызывает образование радикалов OH, которые являются естественными
“очистителями” планеты от вредных антропогенных выбросов [14–16].
На примере молекулы аминокислоты триптофана недавно было показано [38], что образующиеся из биологических молекул карбонилоксиды эффективно нейтрализуют электронное возбуждение молекул, возникающее вследствие поглощения УФ-фотонов, и тем самым препятствуют распаду молекулы на фрагменты, что повышает устойчивость биомолекул к ультрафиолетовому излучению. Ранее были проведены обширные исследования механизмов естественной защиты биомолекул, в частности триптофана, от повреждения коротковолновым излучением. Было установлено, что релаксация биомолекул из возбужденных электронных состояний в основное происходит преимущественно через конические пересечения электронных термов, возникающие при удалении атома водорода или одной из функциональных групп от остова молекулы [39–44]. Еще одним часто встречающимся механизмом релаксации молекул из возбужденного состояния в основное является перенос атома водорода с одной функциональной группы на соседнюю (так называемая реакция таутомеризации) с последующим поворотом и деформацией последней [43–46]. В случае крупных биомолекул, например триптофана [47], линий отрыва атома водорода или других фрагментов от функциональных групп при возбуждении УФ-фотонами в масс-спектре обнаружено не было. Отсутствовала и люминесценция, что указывает на возможные безызлучательную релаксацию, реакцию таутомеризации или образование промежуточных комплексов наподобие карбонилоксидов, описанных в работе [38].
В настоящей работе рассмотрены процессы, протекающие с участием электронно-возбужденной молекулы интермедиата Криге CH3CHOO. Данная молекула существует в виде двух возможных изомеров: syn-CH3CHOO и anti-CH3CHOO в зависимости от ориентации группы –O–O. Взаимное превращение этих изомеров друг в друга осуществляется через вращение вокруг связи C–O. В основном электронном состоянии S0 энергия, требуемая для такого вращения, довольно высока и превышает энергию, необходимую для распада обоих изомеров [25, 30]. Однако в литературе чаще рассматривается изомер syn-CH3CHOO, поскольку он более стабилен при обычных атмосферных условиях (стандартном давлении и влажности). В верхней атмосфере и ионосфере, где количество водяного пара и общая концентрация молекул воздуха малы, оба изомера приблизительно равны по стабильности и возможности образования. Кроме того, высокая интенсивность УФ-излучения и бóльшая концентрация свободных электронов на таких высотах увеличивают вероятность появления электронно-возбужденных молекул [48].
Цель данного исследования – определение механизмов релаксации электронно-возбужденных изомеров syn-CH3CHOO и anti-CH3CHOO интермедиата Криге в его основное состояние и возможных каналов их распада. Это позволяет установить роль данных изомеров в физических и химических процессах, протекающих в верхней атмосфере Земли.
2. МЕТОДИКА РАСЧЕТОВ
Расчеты энергии и оптимизация геометрической структуры syn- и anti-изомеров интермедиата Криге CH3CHOO выполнялись методом CASSCF в базисе 6-31++G(d,p). В активное пространство включались шесть высших занятых и шесть низших виртуальных орбиталей, по которым распределялись 12 электронов. Заполнение активного пространства подбиралось эмпирически, исходя из принципа поиска конфигурации с наименьшей потенциальной энергией для данного электронного состояния. Стоит отметить, что точность метода CASSCF невысока. Результаты расчета чувствительны к выбору активного пространства, поэтому требовать от него количественного совпадения со спектрометрическими или калориметрическими данными измерений смысла не имеет. Однако данный метод дает качественную картину поверхности потенциальной энергии (ППЭ) возбужденных электронных состояний.
Для обоих изомеров во всех электронных состояниях проводилась оптимизация геометрической структуры молекулы. При построении сечений ППЭ вдоль каналов отрыва атома кислорода или деформации по какому-то параметру соответствующие длины связей и некоторые углы между атомами фиксировались для возможности проведения расчетов. Далее проводилась оптимизация геометрии по остальным расстояниям и углам. Квантовохимические расчеты выполнены с использованием пакета программ MOLPRO-2012 [49].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как было сказано выше, syn- и anti-изомеры CH3CHOO отличаются пространственной ориентацией C–O–O-группы. Ранее было показано, что прямой поворот этой группы относительно оси C–C в основном электронном состоянии энергетически невыгоден. Барьер такой реакции достаточно высок (около 34 ккал/моль) и существенно превышает барьеры реакций, ведущих к переходу в другие изомеры или распаду. На рис. 1 для примера показаны каналы реакций, соответствующих изомеризации в метилдиоксиран и вращению группы –O–O вокруг оси C–C [30].
Рис. 1.
Схематичное изображение каналов взаимного превращения интермедиатов Криге syn-CH3CHOO и anti-CH3CHOO через вращение группы –O–O вокруг оси C–O и промежуточный изомер метилдиоксиран. Энергии приведены в ккал/моль. Данные взяты из работы [30].

Рассмотрим три низших электронных состояния молекулы CH3CHOO: S0, S1 и S2, рассчитанных методом CASSCF. На рис. 2 схематически показаны изменения геометрической структуры и электронного строения syn- и anti-изомеров CH3CHOO при их возбуждении на уровни S1 и S2. Изначально в состоянии S0 оба изомера имеют плоскость симметрии и различаются только ориентацией группы –O–O. После поглощения фотона и перехода в возбужденное состояние S1 или S2syn- и anti-изомеры трансформируются в интермедиат, в котором фрагмент –O–O направлен перпендикулярно плоскости молекулы с углом C–O–O, равным примерно 99°. При этом энергии уровней S0, S1 и S2 практически совпадают. Небольшие изменения величины угла C–O–O (~5°) приводят к пересечению пар состояний S0 и S1 или S1 и S2, т.е. имеют место конические пересечения электронных состояний. Точка пересечения состояний S0 и S1 лежит на 2–3 ккал/моль выше точки, соответствующей равновесной конфигурации электронно-возбужденного состояния. Близкую энергию относительно глобального минимума ППЭ состояния S2 имеет и точка пересечения состояний S1 и S2. Разность энергий между вертикально возбужденными в S1- и S2-состояния syn- и anti-изомеров и равновесным интермедиатом на порядок больше указанного значения (>30 ккал/моль). Можно ожидать, что ближайшие вышележащие электронные состояния рассматриваемого интермедиата Криге имеют примерно такое же электронное и геометрическое строение и их ППЭ могут вести себя так же, как и поверхности состояний S1 и S2. Это означает, что при возбуждении фотоном интермедиаты Криге CH3CHOO за счет поворота группы –O–O на 90° относительно плоскости молекулы почти сразу достигают точки конического пересечения электронных состояний и каскадно релаксируют в основное состояние S0. После этого они с примерно равной вероятностью переходят в один из изомеров: syn-CH3CHOO или anti-CH3CHOO.
Рис. 2.
Схематическое изображение процесса возбуждения интермедиатов Криге syn-CH3CHOO и anti-CH3CHOO из основного состояния S0 в электронно-возбужденные состояния S1 и S2 с последующей релаксацией в точку с наименьшим значением потенциальной энергии. Приведены структуры и значения потенциальной энергии молекулы CH3CHOO в точках минимума и конических пересечений термов S0, S1 и S1, S2. Показаны величины углов C–O–O для этих конфигураций. Значения энергии даны в ккал/моль.
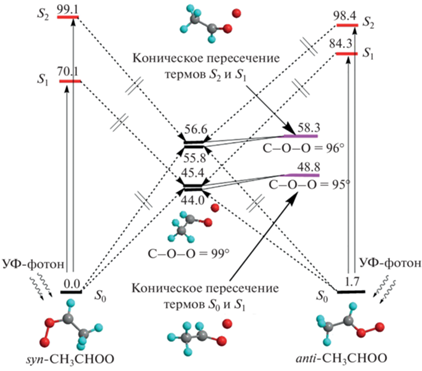
Предполагаемый механизм похож на релаксацию биомолекул в реакциях таутомеризации, описанную в работах [43, 44]. В этом случае релаксация происходит также после разворота функциональной группы на 90° с последующим искажением геометрической структуры молекулы. Однако внутримолекулярный перенос атомов между функциональными группами в нашем случае не требуется, что ускоряет процесс трансформации.
Учитывая особенности электронной структуры электронно-возбужденных молекул CH3CHOO, можно говорить о том, что в мезосфере и ионосфере наиболее эффективным способом трансформации между syn- и anti-изомерами CH3CHOO является их электронное возбуждение с последующей релаксацией. Следует отметить, что в этих условиях оба изомера образуются примерно в равной концентрации. При вращении группы –O–O вокруг оси C–O в сторону плоской конфигурации потенциальная энергия молекулы монотонно растет, достигая максимума при геометрии, соответствующей структурам syn- и anti-изомеров CH3CHOO. Однако при этом увеличивается длина связи O–O, что приводит к отрыву атома кислорода. Таким образом, эти конфигурации не являются устойчивыми.
В большом количестве органических молекул релаксация из возбужденного состояния в основное происходит через удлинение связей O–H, C–C или N–H, которое приводит к коническому пересечению электронных состояний и отрыву соответствующих фрагментов. Обсудим более подробно упомянутый выше канал отрыва атома кислорода от CH3CHOO. Для этого рассмотрим ППЭ реакции отрыва атома O от оптимизированной по геометрическим параметрам молекулы CH3CHOO. Ввиду сложности и низкой точности расчетов высоковозбужденных электронных состояний ограничимся рассмотрением данной реакции для состояния S1. Отметим, что канал реакции отрыва атома кислорода O(1D) возможен и для основного состояния S0 [30], однако порог реакции в данном случае превышает 50 ккал/моль, поэтому этот канал может реализоваться только при больших значениях внутренней энергии.
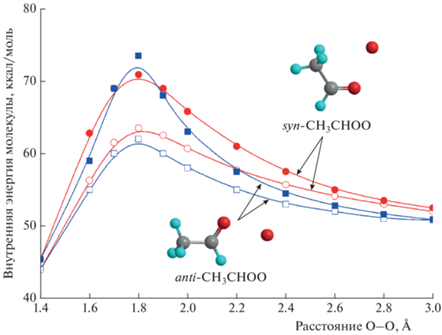
Профили ППЭ отрыва атома кислорода от молекулы CH3CHOO в состоянии S1 представлены на рис. 3. Видно, что по мере удлинения связи O–O в направлении, перпендикулярном плоскости симметрии молекулы, потенциальная энергия быстро растет. Это приводит к повороту в ту или другую сторону группы –O–O в направлении этой плоскости, а затем – к распаду по syn- или anti-каналу. Таким образом, реакция отрыва атома кислорода от интермедиата Криге CH3CHOO в S1-состоянии происходит в плоской конфигурации молекулы с барьером, отвечающим развороту из трехмерного состояния в плоское. Видно, что высота барьера составляет 70–74 ккал/моль, что сопоставимо с энергией вертикального возбуждения данной молекулы. Этот процесс возможен вследствие имеющегося у интермедиатов Криге значительного запаса внутренней энергии [30]. При больших длинах связи O–O состояния S0 и S1 пересекаются, т.е. отрыв атома кислорода приводит к коническому пересечению возбужденного и основного состояний так же, как и отрыв атома водорода в упомянутых выше биомолекулах [39–44]. Основная точка конического пересечения состояний S0 и S1 (см. рис. 2) лежит ниже барьера отрыва атома кислорода. Поэтому данный канал распада может проявиться только в том случае, когда поворот группы –O–O вокруг связи C–O по каким-то причинам затруднен.
Рис. 3.
Профили ППЭ реакции отрыва атома кислорода от молекулы CH3CHOO в электронном состоянии S1. Красные (темные) круги – распад по каналу syn-CH3CHOO, синие (темные) квадраты – распад по каналу anti-CH3CHOO. Геометрическая структура оптимизировалась для состояния S1. Светлые кружки и квадраты соответствуют энергии состояния S0 вдоль указанных выше каналов распада. Значения энергии даны в ккал/моль.
4. ЗАКЛЮЧЕНИЕ
В настоящей работе рассмотрены различные каналы мономолекулярной реакции с участием электронно-возбужденных syn- или anti-изомеров интермедиата Криге CH3CHOO. Показано, что в состояниях S1 и S2 оба изомера карбонилоксида CH3CHOO релаксируют в один и тот же интермедиат, в котором группа –O–O повернута перпендикулярно первоначальному положению. При этом небольшое уменьшение угла C–O–O (в пределах нескольких градусов) приводит молекулу в точку конического пересечения состояний S0 и S1 или S1 и S2, через которую молекула может неадиабатически перейти на нижележащий электронный уровень с преобразованием электронной энергии в колебательную (тепловую). После каскадного перехода в основное состояние интермедиата S0 следует равновероятный переход в конфигурации syn-CH3CHOO или anti-CH3CHOO за счет поворота группы –O–O вокруг оси связи C–O. Установлено, что в возбужденном электронном состоянии возможен отрыв атома кислорода от молекулы CH3CHOO.
Показано, что в мезосфере и ионосфере, где общая концентрация молекул мала, а интенсивность УФ-излучения и число свободных электронов велики, реакции с участием электронно-возбужденных состояний интермедиатов Криге CH3CHOO играют существенную роль. В этом случае следует учитывать особенности распада всех изомеров молекулы CH3CHOO, а не только тех, которые являются наиболее стабильными в тропосфере при стандартных атмосферных условиях.
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (регистрационный номер 122040500060-4), при финансовой поддержке Министерством науки и технологии Тайваня (гранты MOST 109-2111-M-001-001 и MOST 110-2111-M-001-005) и в рамках проекта поддержки высшего образования и развития университета Ченг Кунг Министерством образования Тайваня.
Список литературы
Criegee R., Wenner G. // Just. Lieb. Ann. Chem. 1949. V. 564. P. 9.
Khan M., Percival C., Caravan R. et al. // Env. Sci. Proc. Imp. 2018. V. 20. P. 437.
Taatjes C.A., Khan M.A.H., Eskola A.J. et al. // Env. Sci. Techn. 2019. V. 53. P. 1245.
Welz O., Eskola A.J., Sheps L. et al. // Ang. Chem. Intern. Ed. 2014. V. 53. P. 4547.
Chhantyal-Pun R., McGillen M.R., Beames J.M. et al. // Ang. Chem. Intern. Ed. 2017. V. 56. P. 9044.
Taatjes C.A., Welz O., Eskola A.J. et al. // Science. 2013. V. 340. P. 177.
Дьяков Ю.А., Адамсон С.О., Ванг П.К. и др. // Хим. физика. 2021. Т. 40. № 10. С. 22.
Taatjes C.A., Shallcross D.E., Percival C.J. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 1704.
Herron J.T., Martinez R.I., Huie R.E. // Intern. J. Chem. Kinet. 1982. V. 14. P. 201.
Chao W., Hsieh J.T., Chang C.H. et al. // Science. 2015. V. 347. P. 751.
Long B., Bao J.L., Truhlar D.G. // J. Amer. Chem. Soc. 2016. V. 138. P. 14409.
Sheps L., Scully A.M., Au K. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 26701.
Levy H. // Science. 1971. V. 173. P. 141.
Wang X.H., Bowman J.M. // J. Phys. Chem. Lett. 2016. V. 7. P. 3359.
Kidwell N.M., Li H.W., Wang X.H. et al. // Nature Chem. 2016. V. 8. P. 509.
Fang Y., Liu F., Barber V.P. et al. // J. Chem. Phys. 2016. V. 144. 061102.
Lelieveld J., Dentener F., Peters W. et al. // Atmos. Chem. Phys. 2004. V. 4. P. 2337.
Kanakidou M., Seinfeld J.H., Pandis S.N. et al. // Atmos. Chem. Phys. 2005. V. 5. P. 1053.
Hallquist M., Wenger J.C., Baltensperger U. et al. // Atmos. Chem. Phys. 2009. V. 9. P. 5155.
Foreman E.S., Kapnas K.M., Murray C. // Ang. Chem. Intern. Ed. 2016. V. 55. P. 10419.
Vereecken L., Harder H., Novelli A. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 14682.
Sharifi M., Kong F., Chin S.L. et al. // J. Phys. Chem. A. 2007. V. 111. P. 9405.
Wang Z., Dyakov Y.A., Bu Y. // J. Phys. Chem. A. 2019. V. 123. P. 1085.
Дьяков Ю.А., Пузанков А.А., Адамсон С.О. и др. // Хим. физика. 2020. Т. 39. № 10. С. 3.
Wang Q.Q., Dyakov Y.A., Wu D. et al. // Chem. Phys. Lett. 2013. V. 586. P. 21.
Li H., Fang Y., Kidwell N.M. et al. // J. Phys. Chem. A. 2015. V. 119. P. 8328.
Mauldin R.L., Berndt T., Sipila M. // Nature. 2012. V. 488. P. 193.
Дьяков Ю.А., Адамсон С.О., Ванг П.К. и др. // Хим. физика. 2021. Т. 40. № 5. С. 68.
Nguyen T.L., McCaslin L., McCarthy M.C. et al. // J. Chem. Phys. 2016. V. 145. 131102.
Mebel A.M., Zyubina T.S., Dyakov Y.A. et al. // Intern. J. Quant. Chem. 2005. V. 102. P. 506.
Zyubina T.S., Dyakov Y.A., Lin S.H. et al. // J. Chem. Phys. 2005. V. 123. 134320.
Zhou X.H., Liu Y.Q., Dong W.R. et al. // J. Phys. Chem. Lett. 2019. V. 10. P. 4817.
Голубков Г.В., Маслов Т.А., Бычков В.Л. и др. // Хим. физика. 2020. Т. 39. № 10. С. 47.
Kuverova V.V., Adamson S.O., Berlin A.A. et al. // Adv. Space Res. 2019. V. 64. P. 1876.
Голубков Г.В., Голубков М.Г., Манжелий М.И. // ДАН. 2012. Т. 447. № 5. С. 503.
Golubkov G.V., Manzhelii M.I., Berlin A.A. et al. // Atmosphere. 2020. V. 11. 650.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2021. Т. 40. № 3. С. 86.
Gerard V., Galopin C., Ay E. et al. // Food Chem. 2021. V. 359. 129949.
Ni C.K., Lee Y.T. // Intern. Rev. Phys. Chem. 2004. V. 23. P. 187.
Tseng C.M., Lee Y.T., Ni C.K. // J. Chem. Phys. 2004. V. 121. P. 2459.
Ni C.K., Tseng C.M., Lin M.F. et al. // J. Phys. Chem. B. 2007. V. 111. P. 12631.
Lin M.F., Tseng C.M., Dyakov Y.A. et al. // J. Chem. Phys. 2007. V. 126. 241104.
Dyakov Y.A., Ho Y.C., Hsu W.H. et al. // Chem. Phys. 2018. V. 515. P. 543.
Dyakov Y.A., Toliautas S., Trakhtenberg L.I. et al. // Chem. Phys. 2018. V. 515. P. 672.
Sobolewski A.L, Domcke W. // Phys. Chem. Chem. Phys. 2006. V. 8. P. 3410.
Yang Y.L., Ho Y.C., Dyakov Y.A. et al. // Phys. Chem. Chem. Phys. 2013. V. 15. P. 7182.
Tseng C.M., Dyakov Y.A., Huang H.C. et al. // J. Chem. Phys. 2010. V. 133. 074307.
Hsu H.C., Tsai M.T., Dyakov Y.A. et al. // Intern. Rev. Phys. Chem. 2012. V. 31. P. 201.
Werner H.J., Knowles P.J., Knizia G. et al. // Wiley Intern. Rev. Comp. Mol. Sci. 2012. V. 2. P. 242.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


