Химическая физика, 2023, T. 42, № 1, стр. 22-27
Эффект сверхмалых доз антиоксиданта ресвератрола при воздействии теплового стресс-фактора на структуру мембран митохондрий, выделенных из проростков гороха Pisum sativum L.
Н. Ю. Герасимов 1, *, О. В. Неврова 1, И. В. Жигачева 1, И. П. Генерозова 2, А. Н. Голощапов 1
1 Институт биохимической физики им. Н.М. Эммануэля Российской академии наук
Москва, Россия
2 Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: n.yu.gerasimov@gmail.com
Поступила в редакцию 29.12.2021
После доработки 17.04.2022
Принята к публикации 20.04.2022
- EDN: MOUZSB
- DOI: 10.31857/S0207401X23010041
Аннотация
Изучено действие растительного антиоксиданта ресвератрола на структуру мембран митохондрий, выделенных из проростков гороха Pisum sativum L., подвергнутых воздействию теплового стресс-фактора. В качестве структурных характеристик мембран использовали температурную зависимость микровязкости. Микровязкость определяли методом электронного парамагнитного резонанса спиновых зондов. Тепловой шок приводил к уменьшению кристалличности мембран митохондрий. Показано, что сверхмалые дозы ресвератрола возвращают структуру липидного бислоя митохондрий после воздействия теплового шока до состояния, свойственного нативным растениям.
ВВЕДЕНИЕ
Как известно, растения в природе подвергаются воздействиям многих биотических и абиотических факторов. Тепловой шок (ТШ) является одним из наиболее распространенных абиотических стрессовых факторов. Высокая температура может не только задерживать рост всего растения, листьев, корней, но и прорастание семян, а также скорость роста проростков. В ответ на действие любого стресс-фактора резко возрастают синтез и активность белков теплового шока (БТШ) [1]. Последние (БТШ) в клетке, подвергнутой стрессу, интенсивно связываются с белками, препятствуя их денатурации, и поддерживают поврежденные белки в состоянии, способном к последующему восстановлению [2–4], а также участвуют в процессах транспортировки белковых молекул через мембраны митохондрий и ядерную оболочку [5]. Изменение структуры мембранных белков часто приводит к изменению структуры липидного бислоя [6, 7]. Таким образом, тепловой шок, как и любой другой стресс-фактор, может влиять на структуру мембран митохондрий как напрямую, так и через воздействие БТШ.
Природный антиоксидант ресвератрол синтезируется в качестве защиты от биотических факторов, таких как паразитическое действие бактерий и грибов, а также от абиотических факторов, таких как окислительный стресс [8]. Ресвератрол как полифенольное соединение может оказывать непосредственное влияние на структуру и функцию митохондрий [9]. Растительные полифенолы взаимодействуют с белками, такими как сигнальные киназы, факторы транскрипции и ионные каналы [6], и регулируют окислительно-восстановительные процессы, аналогичные митохондриальным. На уровень пероксидного окисления липидов (ПОЛ) значительно влияют стресс-факторы, в результате чего могут изменяться структурные характеристики мембран, одной из которых является микровязкость [10, 11]. Действие антиоксидантов также приводит к изменению микровязкости мембран через систему регуляции пероксидного окисления липидов [12–14].
Таким образом, целью нашей работы было исследование влияния ресвератрола на структурные характеристики мембран митохондрий, выделенных из проростков гороха, подвергнутого тепловому шоку.
МАТЕРИАЛЫ И МЕТОДЫ
Работу проводили на митохондриях пятидневных этиолированных проростков гороха Pisum sativum L. сорта Флора 2. Семена гороха перед проращиванием промывали мыльной водой (хозяйственное мыло) и 0.01%-ным раствором КMnO4, а затем тщательно промывали дистиллированной водой в течение 2 мин. Проростки на 2 ч помещали в термостат при температуре 47 °С на влажной фильтровальной бумаге. Для поддержания влажности в термостате находились две чашки Петри с водой. Спустя 2 ч выделяли митохондрии из проростков гороха методом дифференциального центрифугирования в калий-фосфатном буфере, описанным в работе [15]. Для приготовления образца митохондрии разбавляли в среде выделения таким образом, чтобы содержание белка в конечном растворе составляло 2 мг белка на 1 мл суспензии митохондрий. Ресвератрол готовили последовательным разбавлением в среде выделения так, чтобы концентрации в образцах с митохондриями при конечном разбавлении составляли 5 ∙ 10–6 М и 5 ∙ 10–14 М.
Микровязкость липидного бислоя мембран определяли методом электронного парамагнитного резонанса (ЭПР) спиновых зондов. В качестве зондов использовали стабильные нитроксильные радикалы 2,2,6,6-тетраметил-4-каприлоилоксилпиперидин-1-оксил (зонд I) и 5,6‑бензо-2,2,6,6-тетраметил-1,2,3,4-тетрагидро-γ-карболин-3-оксил (зонд II):
В работе [16] показано, что зонд I преимущественно локализуется в поверхностном слое липидных компонент мембраны, а зонд II – в липидах, прилегающих к белкам, что позволяет по поведению зондов I и II в липидном бислое судить о липид-белковых взаимодействиях в мембранах. Для удобства изложения мы в последующем будем называть зонд I “липидным”, а зонд II – “белковым”.
Из полученных спектров ЭПР рассчитывали время корреляции вращательной подвижности (τс), характеризующее микровязкость компонентов мембраны, по формуле τс = 6.65 ∙ 10–10∆H+ × × [(I+/I–)0.5 – 1], приведенной в работе [17]. Регистрацию спектров ЭПР проводили в диапазоне температур 285–305 К (10–32 °C) на радиоспектрометре ER 200D-SRC фирмы “Brucker”.
Известное соотношение Стокса–Энштейна (см., например, [18]) связывает параметр τc и вязкость среды, окружающей зонд τc = ηV/kT, где V – объем радикала (его можно считать прямо пропорциональным молекулярному весу), η – динамическая вязкость среды, k – постоянная Больцмана и Т – абсолютная температура. Динамическая вязкость η связана с температурой следующим эмпирическим соотношением: η = А'eb/T [19], откуда следует ln τc = А'' + b/T + ln(1/T), где А', А'', b – константы. Исследуемый нами температурный интервал (от 285 до 305 К) достаточно узок, и на его протяжении ln(1/T) меняется очень незначительно по сравнению со слагаемым b/T, поэтому можно считать lnτс = a + b/T.
Исходя из этой точки зрения, график зависимости ln τc от 1/Т для таких структур должен представлять собой ломаную, точки излома которой являются точками структурных переходов [20]. Наклон этих прямых позволяет определить энергию активации перехода Eа = bR [21], где b – угловой коэффициент наклона соответствующего прямого участка, а R – универсальная газовая постоянная. Энергия активации соответствует энергии перестройки одного моля липидов мембран [21].
Статистическая обработка данных осуществлялась методами параметрической статистики с использованием пакетов компьютерных программ Microsoft® OfficeExcel и Origin® 6.1 при статистической надежности 95%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В работе было изучено изменение структуры мембран митохондрий, выделенных из проростков гороха Pisum sativum L., после воздействия на них теплового шока по сравнению с нативными растениями (контроль). Термоиндуцированные структурные переходы в прибелковых областях мембран митохондрий (рис. 1б) наблюдались при температурах от 23 до 26 °С (296–299 К), тогда как в контрольной группе – при температурах от 18 до 20 °С (291–293 К). При температурах свыше 26 °С (>299 К) зависимость ln τc от 1/Т для прибелковых областей после воздействия теплового шока лежала выше и имела меньший угол наклона, чем для нативных растений (рис. 1б). То есть с ростом температуры наблюдалась тенденция к увеличению микровязкости после воздействия ТШ по сравнению с нативными растениями.
Рис. 1.
Температурная зависимость микровязкости мембран митохондрий, выделенных из проростков гороха Pisum sativum L., в аррениусовских координатах (lnτс от 1/T, для удобства указана еще и Т): 1 – для контрольной группы, 2 – после воздействия теплового шока; а – “липидный” зонд, б – “белковый” зонд.

Графики зависимостей времен вращательной корреляции от температуры для липидной и прибелковой фаз мембран митохондрий после воздействия ТШ в областях температур, меньших 299 К, лежат ниже, чем для нативных растений (рис. 1). Поэтому можно предположить, что в данном диапазоне температур ТШ приводит к увеличению текучести как прибелковой, так и липидной фазы мембран. При этом структурный переход в липидной фазе сдвигается в область более низких температур (рис. 1а): 12–18 °С (285–291 К), относительно контроля. Данную структурную перестройку связывают с переходом липидного бислоя из кристаллического в жидкокристаллическое состояние [22, 23]. Сдвиг структурной перестройки в область более низких температур на фоне повышенной текучести указывает на увеличение “жидкостности” мембран (уменьшение кристалличности). Вследствие уменьшения кристалличности липидного бислоя растет подвижность липидных молекул [22] и падает способность мембраны сохранять определенную упорядоченность, структурность.
Это, в свою очередь, может приводить к нарушению функций мембранных белков и ферментов, что неблагоприятно скажется на функционировании митохондрий в целом. Температура фазового перехода и текучесть мембран существенно зависят как от длины углеводородных цепей, наличия и положения двойных связей [23, 24], так и от плотности упаковки липидов в бислое. Тепловой шок может приводить к увеличению размеров митохондрий, а также к уменьшению индекса ненасыщенности жирных кислот из-за увеличения уровня пероксидного окисления липидов [25]. В нашем случае вследствие увеличения размеров митохондрий увеличивалась площадь поверхности мембран, что приводило, по-видимому, к уменьшению плотности упаковки липидов и, следовательно, к увеличению текучести липидного бислоя (рис. 1), несмотря на уменьшение соотношения ненасыщенных к насыщенным жирным кислотам [25]. Затем вырабатываемые при тепловом шоке БТШ изменяли структуру мембранных белков, что, вероятно, приводило к консолидации липидов вокруг белков и ферментов за счет миграции липидов из липидной фазы. В результате этого увеличивалась микровязкость прибелковых областей мембран по сравнению с нативными растениями при температурах свыше 299 К. Вероятно, благодаря таким структурным перестройкам мембраны возможно нормальное функционирование митохондрий при высоких температурах.
Тепловой шок приводит к увеличению уровня пероксидного окисления липидов в мембране [25–27], поэтому было интересным исследовать действие антиоксиданта ресвератрола на структуру мембран митохондрий после воздействия теплового шока in vitro. Показано, что введение ресвератрола в дозе 5 ∙ 10–6 М приводило к сдвигу термоиндуцированных структурных переходов в липидной и прибелковой фазе мембран в область более высоких температур относительно мембран митохондрий после воздействия ТШ (рис. 2). При этом структурные перестройки в липидных областях (15–23 °С) возвращались к состоянию, свойственному нативным растениям (табл. 1).
Рис. 2.
Температурная зависимость микровязкости мембран митохондрий, выделенных из проростков гороха Pisum sativum L., подвергнутого тепловому шоку, в аррениусовских координатах (lnτс от 1/T, для удобства указана еще и Т): 1 – без ресвератрола, 2 – в присутствии ресвератрола в концентрации 5 ∙ 10–6 М; а – “липидный” зонд, б – “белковый” зонд.
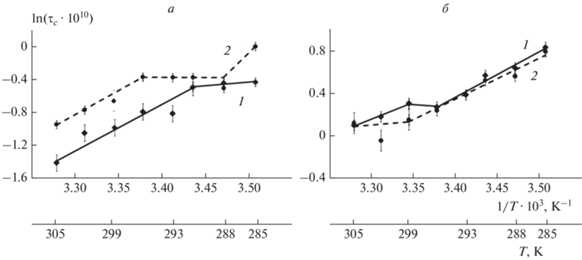
Таблица 1.
Термоиндуцированные структурные переходы в мембранах митохондрий проростков гороха Pisum sativum L. и энергии активации (Ea) соответствующих структурных состояний
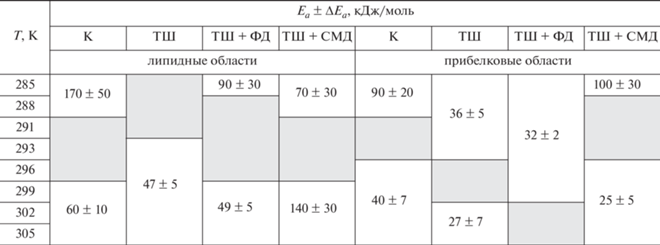
Примечание: К – контроль (нативные растения), ТШ – после воздействия теплового шока, ТШ + ФД – после воздействия теплового шока и ресвератрола в физиологической дозе 5 ∙ 10–6 М, ТШ + СМД – после воздействия теплового шока и ресвератрола в сверхмалой дозе 5 ∙ 10–14 М. Серые зоны соответствуют структурным перестройкам. Белые зоны – мембрана находится в определенном структурном состоянии с соответствующими Ea.
Стоит отметить, что энергии активации структурных состояний при высоких температурах (>296 К) в липидной фазе и при низких температурах (<296 К) в прибелковой фазе мембран оставались такими же, как и при ТШ (табл. 1). Кроме того, ресвератрол увеличивал микровязкость мембран после воздействия ТШ в липидной фазе (рис. 2а). По-видимому, тепловой шок приводил к окислительному стрессу, из-за чего жирнокислотные хвосты липидов мембран митохондрий окислялись. В результате окисления образовывались более короткие липиды, альдегиды и диеновые конъюгаты, которые, оставаясь в мембране, не давали липидам образовывать связанные структуры. Вследствие этого увеличивалась текучесть мембран. Ресвератрол, будучи антиоксидантом, значительно уменьшал скорость окисления липидов, не давая тем самым липидам распадаться на короткие фрагменты. Это приводило к увеличению структурированности мембран митохондрий, выделенных из проростков гороха, подвергнутого ТШ, вместе с тем – и к увеличению микровязкости липидной фазы. Введение физиологической дозы ресвератрола практически не изменяло микровязкость прибелковых областей мембран митохондрий после воздействия ТШ (рис. 2б) и лишь немного (на 2–4 °С) смещало структурный переход в область более высоких температур: 26–32 °С (299–305 К). Это означает, что кристалличность прибелковых областей мембран повышается. Такое смещение может оказаться полезным для функционирования митохондрий в условиях длительного воздействия высоких температур (свыше 32 °С).
Особый интерес представляло изучение действия биологически активных веществ в сверхмалых дозах (СМД). Эффект СМД в изменении микровязкости мембран может носить бимодальный и гетерогенный характер [28]. Бимодальность проявляется в том, что при уменьшении дозы, от физиологической (>10–8 М) до очень низкой (10–8–10–11 М), эффект от препарата исчезает, сменяясь так называемой “мертвой зоной”, где он отсутствует, и вновь усиливается при концентрациях ниже ∼10–12 М (СМД-эффект) [23]. Этот СМД-эффект часто носит гетерогенный характер, т.е. отличается от действия биологически активных веществ в физиологических доз [28]. Поэтому было также исследовано действие ресвератрола в концентрации 5 ∙ 10–14 М на структурные характеристики мембран митохондрий проростков гороха, подвергнутых тепловому шоку (рис. 3). Введение in vitro ресвератрола в сверхмалой дозе в митохондрии после воздействия ТШ приводило к сдвигу термоиндуцированных структурных переходов как в липидной, так и прибелковой фазе мембран до состояния нативных растений. При этом характер зависимости времен вращательной корреляции “липидного” и “белкового” зондов от температуры при введении антиоксиданта в сверхмалой дозе в митохондрии после ТШ был схожим с соответствующими зависимостями для контрольных групп (рис. 3). Следовательно, ресвератрол в сверхмалой дозе восстанавливал структуру мембран митохондрий, выделенных из проростков гороха, подвергнутого ТШ, до нормального состояния, свойственного нативным растениям. Таким образом, ресвератрол в концентрации 5 ∙ 10–14 М способен защищать растения от теплового шока.
Рис. 3.
Температурная зависимость микровязкости мембран митохондрий, выделенных из проростков гороха Pisum sativum L., подвергнутого тепловому шоку, в аррениусовских координатах (lnτс от 1/T, для удобства указана еще и Т): 1 – для нативных растений (контроль), 2 – без ресвератрола, 3 – в присутствии ресвератрола в концентрации 5 ∙ 10–14 М; а – “липидный” зонд, б – “белковый” зонд.

ЗАКЛЮЧЕНИЕ
Тепловой шок приводил к уменьшению кристалличности мембран митохондрий проростков гороха, о чем свидетельствует сдвиг термоиндуцированных структурных перестроек на фоне повышенной текучести мембран. Ресвератрол в сверхмалых дозах способен возвращать структурное состояние мембран митохондрий проростков гороха, подвергнутого тепловому шоку, к состоянию, свойственному нативным растениям. Поэтому мы предполагаем, что ресвератрол в сверхмалых дозах может защищать проростки гороха от теплового шока. В физиологических концентрациях исследуемый антиоксидант приводил к сдвигу термоиндуцированных структурных перестроек в мембранах митохондрий проростков гороха после воздействия теплового шока в сторону более высоких температур, что, вероятно, может оказаться полезным для нормальной работы митохондрий при длительном воздействии высоких температур (свыше 32 °С).
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (тема № 1201253310).
Список литературы
Feder M.E., Parsell D.A., Lindquist S.L. The stress response and stress proteins. Cell Biology of Trauma. Boca Raton: CRC Press, 1995. P. 177; https://doi.org/10.1201/9781003067801
Li Z., Srivastava P.K. // EMBO J. 1993. V. 12. № 8. P. 3143; https://doi.org/10.1002/j.1460-2075.1993.tb05983.x
Miyata Y., Yahara I. // J. Biol. Chem. 1992. V. 267. № 10. P. 7042; https://doi.org/10.1016/S0021-9258(19)50533-6
Муранов К.О., Полянский Н.Б., Клейменов С.Ю. и др. // Хим. физика. 2019. Т. 38. № 12. С. 33; https://doi.org/10.1134/S0207401X19120148
Horst M., Opplige W., Rospert S. et al. // EMBO J. 1997. V. 16. P. 1842; https://doi.org/10.1093/emboj/16.8.1842
Геннис Р. Биомембраны: Молекулярная структура и функции. М.: Мир, 1997.
Шишкина Л.Н., Козлов М.В., Повх А.Ю. и др. // Хим. физика. 2021. Т. 40. № 9. С. 57; https://doi.org/10.31857/S0207401X21090089
Жигачева И.В., Бинюков В.И., Русина И.Ф. и др. // Хим. физика. 2020. Т. 39. № 7. С. 41; https://doi.org/10.31857/S0207401X20070122
Okada S., Brennicke A. // Mol. Genet. Genomics. 2006. V. 276. № 1. P. 71; https://doi.org/10.1007/s00438-006-0119-7
Laczkó-Dobos H., Szalontai B. // Biochemistry. 2009. V. 48 № 42. P. 10120; https://doi.org/10.1021/bi9011034
Никоноров А.А. мл., Никоноров А.А. // Вестн. Ур. Мед. АН. 2011. Т. 1. № 2. С. 54.
Аристархова С.А., Архипова Г.В., Бурлакова Е.Б. и др. // Докл. АН СССР. 1976. Т. 228. С. 215.
Бурлакова Е.Б., Храпова Н.Г. // Успехи химии. 1985. Т. 54. № 9. С. 540; https://doi.org/10.1070/RC1985v054n09ABEH003121
Бурлакова Е.Б. Химическая и биологическая кинетика. Новые горизонты. Т. 2. М.: Химия, 2005. С. 10.
Прохорова М.И. Методы биохимических исследований. Л.: ЛГУ, 1982.
Бинюков В.И., Борунова С.Ф., Гольдфельд М.Г. и др. // Биохимия. 1971. Т. 36. № 6. С. 1149.
Вассерман А.М., Бучаченко А.Л., Коварский А.Л., Нейман И.Б. // Высокомолекуляр. соединения. А. 1968. Т. 10. С. 1930.
Кузнецов А.Н. Метод спинового зонда. М.: Наука, 1976.
Кухлинг Х. Справочник по физике. М.: Мир, 1983.
Chapman D. // Quart. Rev. Biophys. 1975. V. 8. № 2. P. 185; https://doi.org/10.1017/S0033583500001797
Shinitzky M., Inbar M. // Biochim. Biophys. Acta. 1976. V. 433. № 1. P. 133; https://doi.org/10.1016/0005-2736(76)90183-8
Комов В.П. Биохимия: учебник для вузов. М.: Юрайт, 2021.
Гендель Л.Я., Гольдфельд М.Г., Кольтовеp В.К. и дp. // Биофизика. 1968. Т. 13. № 6. С. 1114.
Панасенко О.О., Ким М.В., Гусев Н.Б. // Успехи биол. химии. 2003. Т. 43. С. 59.
Жигачева И.В., Бинюков В.И., Генерозова И.П. и др. // Физиология растений. 2022. Т. 69. № 1. С. 1; https://doi.org/10.31857/S0015330322010225
Веселов А.П. Дис. … д-ра биол. наук. Н. Новгород: ННГУ, 2001.
Смирнова А.Н., Швыдкий В.О., Шишкина Л.Н. // Хим. физика. 2021. Т. 40. № 7. С. 43; https://doi.org/10.31857/S0207401X21070104
Бурлакова Е.Б. // Вестн. РАН. 1994. Т. 64. № 5. С. 425.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика



