Химическая физика, 2023, T. 42, № 7, стр. 10-16
Связь строения нитроксильных радикалов с их локализацией в растворах термочувствительных полимеров
Е. М. Зубанова 1, *, Д. А. Рубцов 1, Е. Н. Голубева 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: kate_zub@mail.ru
Поступила в редакцию 16.01.2023
После доработки 16.02.2023
Принята к публикации 20.02.2023
- EDN: YGQTXS
- DOI: 10.31857/S0207401X23070191
Аннотация
Спектроскопия электронного парамагнитного резонанса (методика спинового зонда) была применена для выяснения влияния структуры молекул на примере нитроксильных радикалов на их локализацию в водных растворах термочувствительного поли-N-изопропилакриламида в ходе фазового перехода клубок–глобула. Показано, что гидрофобный зонд малого размера 4-гидроксибензоато-ТЕМПО практически полностью (до 95% от общего количества) захватывается образующейся в ходе фазового перехода глобулой, в то время как крупный зонд метил-5-доксилстеарат, содержащий длинный алкильный хвост, не заходит в полимерную глобулу.
1. ВВЕДЕНИЕ
Термочувствительные полимеры – высокомолекулярные соединения, которые претерпевают резкое, нелинейное изменение физических свойств, прежде всего растворимости или, в случае сшитого геля, объемных параметров в ответ на изменение температуры [1–3]. Классическим термочувствительным полимером является поли-N-изопропилакриламид (PNIPAM), который содержит в своем звене гидрофобные алкильные фрагменты и гидрофильные амидные группы [4]. При температурах ниже низшей критической температуры растворения (НКТР), равной 32 °С, этот полимер растворим в воде за счет образования водородных связей между молекулами воды и полимерными цепями [5]. По достижении НКТР водородные связи разрушаются, гидрофобные взаимодействия превалируют, что приводит к переходу полимерных цепей из состояния неориентированного клубка в компактную глобулу [6]. Данный переход лежит в физиологическом диапазоне температур, что позволяет использовать PNIPAM в биомедицине [1], например, в системах контролируемой доставки лекарств [7], тканевой инженерии [8] или в качестве покрытий и подложек для получения клеточных пластов [9].
Спектроскопия электронного парамагнитного резонанса (ЭПР) в рамках методик спинового зонда и спиновой метки активно применяется для определения свойств полимерных систем [10], в том числе для оценки подвижности цепей полимера [11–13], вязкости [14], микрополярности [15] и pH [16] в растворах и гелях. В случае растворов термочувствительных полимеров методика спинового зонда позволяет делать выводы о структуре и динамике неоднородностей, образующихся в растворах при повышении температуры за счет захвата зонда образующейся полимерной глобулой [17]. В качестве спиновых зондов обычно используют стабильные нитроксильные радикалы, так как их магнитно-резонансные (тензор сверхтонкого взаимодействия (СТВ), g-тензор) и динамические (время вращательной корреляции) параметры зависят от окружения зонда. Ранее с использованием нитроксильного радикала 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO) методика спинового зонда была применена как для определения НКТР в водных растворах PNIPAM [18] и его сополимеров [19], так и для оценки микрополярности и микродинамики образующихся в ходе фазового перехода клубок–глобула неоднородностей. Было показано, что спектр ЭПР радикала TEMPO в водном растворе PNIPAM, зарегистрированный выше НКТР, представляет собой сумму спектров радикалов во внешней водной среде и в полимерной глобуле, при этом доля зондов в глобуле составляет около 70% [18].
Одним из факторов, который определяет распределение нитроксильного радикала между гидрофобной полимерной глобулой и внешним водным раствором, является сродство к воде, т.е. гидрофильность или гидрофобность (лиофильность) зонда [20]. Так, гидрофильный радикал, 4-гидрокси-ТЕМПО [21] и положительно заряженный 4-триметиламино-ТЕМПО (CAT1) [20] практически не заходят в глобулы полиоксамеров и PNIPAM в ходе фазового перехода клубок–глобула. Размер зонда также может оказывать влияние на его локализацию в растворах термочувствительных полимеров и характеризовать размер глобул. Например, спин-меченые производные стеариновой кислоты заходят в объемные (около 20 нм) гидрофобные полости полимеров на основе полиэтиленгликоля [15, 22, 23].
Цель данной работы – выяснение влияния гидрофобности и размера нитроксильного радикала на его локализацию в водных растворах поли-N-изопропилакриламида в ходе фазового перехода клубок–глобула. Влияние гидрофобности зонда оценивали путем сравнения коэффициентов распределения амфифильного радикала TEMPO (log Pow = 1.79) [24] и более гидрофобного радикала 4-гидроксибензоато-TEMPO (4-HBT, log Pow = 2.63) [25] в системе глобула–водный раствор. Гидрофобный радикал, имеющий длинный алкильный заместитель – метиловый эфир 5-доксилстеариновой кислоты (5-DSM, log Pow = 6.12) был выбран для оценки влияния размера зонда. Производные доксил-стеариновой кислоты часто применяют для изучения структуры гидрофобных липидных систем, с которыми они образуют мицеллы [26]. Для получения индивидуальных спектров зондов в полимерных глобулах была использована методика подавления сигнала радикалов в водной фазе за счет спин-обменного взаимодействия с парамагнитными ионами меди (II) [27].
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Стабильные нитроксильные радикалы 4-гидрокси-2,2,6,6-тетраметилпиперидин-1-оксилбензоат, 2-этил-2-(15-метокси-15-оксопентадецил)-4,4-диметил-3-оксазоли-динилоксил, а также дигидрат хлорида меди (II) (CuCl2 · 2H2O) компании Sigma-Aldrich (USA) использовали без дополнительной очистки. Структурные формулы исследуемых радикалов, а также радикала TEMPO представлены на рис. 1а–в.
Рис. 1.
Структурные формулы нитроксильных зондов TEMPO (а), 4-гидроксибензоато-TEMPO (б), метиловый эфир 5-доксилстеариновой кислоты (в) и поли-N-изопропилакриламида (PNIPAM) (г).
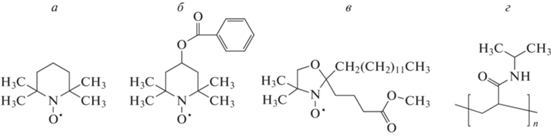
Поли-N-изопропилакриламид (PNIPAM), любезно предоставленный нам сотрудниками лаборатории катализа полимеризационных процессов НИИ физико-химических проблем БГУ (Минск, Беларусь), был синтезирован (рис. 1г) путем радикальной полимеризации с использованием AIBN в качестве инициатора [18]. Согласно данным гель-проникающей хроматографии средняя числовая молекулярная масса полимера составила Mn = 175.5 кДа, коэффициент полидисперсности D= 4.3.
Водные 10%-ные растворы PNIPAM готовили путем растворения необходимых количеств полимера в предварительно приготовленных ~0.2 мМ водных растворах радикалов 4-HBT и 5-DSM в течение 24 ч при температуре 4 °С. Образцы (8–10 мг) полученных растворов помещали в капилляры диаметром 2 мм и запаивали для предотвращения испарения воды. Для регистрации индивидуальных спектров зондов в глобулах в исследуемые растворы добавляли кристаллический дигидрат хлорида меди CuCl2 · 2H2O для получения 0.1 М растворов ионов Cu2+, как рекомендовано в работе [18].
Спектры ЭПР регистрировали с помощью радиоспектрометра X-диапазона EMX-500 при температурах 22–90 °С с использованием температурной приставки (Bruker, Germany). Точность термостатирования составила ±0.5 °С. Спектры регистрировали при мощности 0.8 мВт и амплитуде модуляции 0.02–0.08 мТл, развертка составила 8–12 мТл. При этих условиях не наблюдали искажение формы спектральных линий и насыщение сигнала.
Математическое моделирование спектров ЭПР проводили с использованием программного пакета Matlab и модуля EasySpin [28]. Моделирование спектров радикала 4-HBT и спектров радикала 5-DSM при температуре ниже 30 °С проводили в рамках модели свободного изотропного вращения, реализованной в EasySpin как функция “garlic”. Моделирование спектров радикала 4-HBT при температуре выше 30 °С проводили в рамках модели анизотропного заторможенного вращения [29], реализованной в EasySpin как функция “chili”. Форму линий спектра ЭПР описывали как конволюцию гауссовой и лоренцевой функций. В качестве начальных значений магнитно-резонансных параметров (тензоров СТВ и g-тензоров) радикала 4-HBT использовали данные из работы [30]. Соответствующие параметры радикала 5-DSM были оценены из экспериментальных спектров по расстоянию между крайними компонентами спектра ЭПР и положению центра сигнала. В случае радикала 5-DSM, помимо сверхтонкого расщепления на ядре 14N, при математическом моделировании спектров ЭПР учитывали сверхтонкое расщепление на ядрах 13С метильных заместителей и атомов углерода оксазолидинового кольца. Значение изотропной константы СТВ (0.6 мТл) на ядрах 13С в ходе моделирования не варьировали. Качество моделирования оценивали путем вычисления среднеквадратичного отклонения разностных спектров, которое для всех теоретических спектров составило менее 1%.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
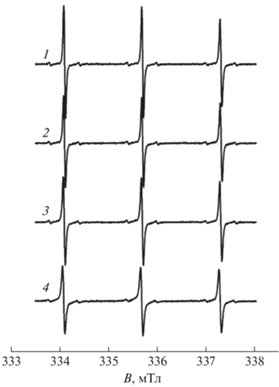
Спектры ЭПР радикалов 4-HBT и 5-DSM в 10%-ном водном растворе PNIPAM при комнатной температуре представляют собой триплет, обусловленный сверхтонким расщеплением на ядрах азота 14N, имеющих ядерный спин I = 1 (рис. 2). В спектрах радикала 5-DSM, помимо расщепления на ядрах азота, наблюдается дополнительное малоинтенсивное расщепление каждой компоненты, вызванное сверхтонким взаимодействием с ядрами 13С (I = 1/2). Форма линий спектров соответствует изотропному быстрому вращению нитроксильных радикалов в растворе (частицы типа A). Значения констант СТВ и времен вращательной корреляции, полученные путем моделирования экспериментальных спектров в рамках модели быстрого вращения, представлены в табл. 1.
Рис. 2.
Спектры ЭПР нитроксильных зондов в 10%-ном водном растворе PNIPAM, зарегистрированные при комнатной температуре (22 °С): 4-гидроксибензоато-ТЕМПО-бензоат (а), метиловый эфир 5-доксилстеариновой кислоты (б). Сплошные линии – экспериментальные спектры, кружочки – результаты моделирования.
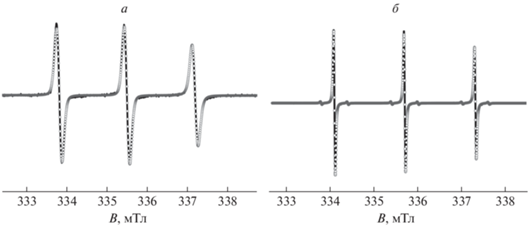
Таблица 1.
Магнитно-резонансные и динамические параметры спиновых зондов в растворе PNIPAM при разных температурах, полученные в результате математического моделирования спектров ЭПР и значения константы распределения зондов глобула–раствор
| Радикал | t, °C | Частицы типа А | Частицы типа Б | KD | |||||
|---|---|---|---|---|---|---|---|---|---|
| aiso, мТл | τcorr,iso, нс | aiso, мТл | τcorr, нс | ||||||
| iso | x | y | z | ||||||
| TEMPO* | 27 | 1.72 | 0.02 | – | – | – | – | – | 0 |
| TEMPO* | 80 | 1.72 | 0.002 | 1.60 | 0.7 | 20 | 0.3 | 1.3 | 20 |
| 4-HBT | 25 | 1.69 | 0.1 | – | – | – | – | – | 0 |
| 4-HBT | 90 | 1.68 | 0.01 | 1.63 | 1.9 | 1.0 | 2.0 | 10 | 140 |
| 5-DSM | 25 | 1.61 | 0.02 | – | – | – | – | – | 0 |
| 5-DSM | 90 | 1.61 | 0.01 | – | – | – | – | – | 0 |
На рис. 3 представлены спектры ЭПР радикала 4-HBT в 10%-ном водном растворе PNIPAM при различных температурах. При повышении температуры от 22 до 27 °С форма линий спектра 4-HBT практически не меняется. При температурах выше 27 °С наблюдается снижение амплитуды сигнала, затем, начиная с 32 °С, линии уширяются и при температурах выше 50 °С наблюдается расщепление крайней высокопольной компоненты на две. Согласно литературным данным [18], эти сигналы соответствуют радикалам в растворе (частицы типа А), детектируемым и ранее при более низких температурах, а также зондам в глобуле (частицы типа Б). Дальнейшее повышение температуры до 90 °С приводит к увеличению амплитуд компонент спектра, отвечающих зонду в полимерной глобуле, что, по-видимому, связано с увеличением подвижности зондов в полимерной глобуле. Похожее изменение формы линий спектров наблюдали при регистрации спектров ЭПР радикала TEMPO в растворах термочувствительных полимеров, в том числе PNIPAM [18] и его сополимеров [19].
Рис. 3.
Спектры ЭПР 4-гидроксибензоато-TEMPO в 10%-ном водном растворе PNIPAM, зарегистрированные при 25 (1), 31 (2), 32 (3), 50 (4) и 90 °С (5).
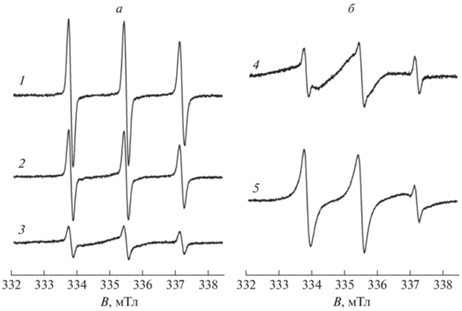
Регистрация спектров ЭПР радикала 4-HBT в водном растворе PNIPAM в присутствии ионов Cu2+ позволяет получить индивидуальный спектр зонда в полимерной глобуле (частицы типа Б). Так, благодаря уширению сигнала частиц типа А до базовой линии за счет спин-обменного взаимодействия с парамагнитными ионами их спектр практически исчезает. При этом спиновые зонды, локализованные в полимерных глобулах, недоступны для парамагнитных ионов, и именно их спектр можно зарегистрировать. Действительно, при температурах 22–27 °С спектр ЭПР зонда 4-HBT в водном растворе ионов Cu2+ не проявляется. Начиная с 29 °С в спектре ЭПР данной системы регистрируется малоинтенсивный триплет, амплитуда которого растет при дальнейшем повышении температуры. Спектр 4-HBT в 10%-ном водном растворе PNIPAM, зарегистрированный в присутствии ионов Cu(II) при 90 °С, представлен на рис. 4а. Видно, что он описан как спектр одной частицы в рамках модели анизотропного вращения нитроксида. Константа СТВ aiso составила 1.63 мТл, времена вращательной корреляции – τx = 1 нc, τy = 2 нс, τz = 10 нс. Времена вращательной корреляции относительно осей X и Y близки и наблюдается заторможенность вращения вокруг оси Z. Стоит отметить, что анизотропия вращения радикала 4-HBT в полимерной глобуле отличается от анизотропии вращения радикала TEMPO в аналогичной системе, описанной в работе [18]. В случае радикала TEMPO анизотропное вращение заторможено вокруг оси Х, времена вращательной корреляции радикала TEMPO в глобуле при 80 °С составили τx = 20 нc, τy = 0.3 нс, τz = 1.3 нс. По-видимому, радикалы по-разному ориентируются относительно полимерных цепей в глобуле. Гидрофобный фенильный фрагмент радикала 4-HBT может координироваться по алкильным фрагментам за счет дисперсионных взаимодействий, что будет приводить к более свободному вращению нитроксильного фрагмента.
Рис. 4.
Спектры ЭПР 4-гидроксибензоато-TEMPO в 10%-ном водном растворе PNIPAM, зарегистрированные при 90 °С: в присутствии (а) и в отсутствие (б) ионов Cu(II). Сплошные линии – экспериментальные спектры, точки – результаты моделирования.
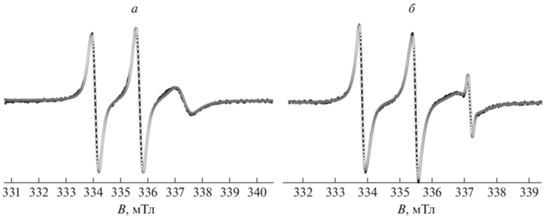
Полученные магнитно-резонансные и динамические параметры радикала 4-HBT в полимерной глобуле были использованы для моделирования экспериментальных спектров радикала 4-HBT в водном растворе PNIPAM при температурах выше НКТР как суммы спектров частиц типов А и Б. На рис. 4б представлен результат моделирования спектра, зарегистрированного при 90 °С. Доля частиц типа Б при этой температуре составляет 94%, в то время как для TEMPO аналогичное значение не превышает 70%. Полученные данные позволяют рассчитать константу распределения для спиновых зондов в системах глобула–раствор, KD, при температурах выше НКТР: при 90 °С KD составила 120 для 4-HBT и 20 – в случае TEMPO соответственно (табл. 1).
На рис. 5 представлены спектры ЭПР радикала 5-DSM в 10%-ном водном растворе PNIPAM, зарегистрированные в интервале температур 25–90 °С. Форма линий спектра практически не меняется при повышении температуры и во всем температурном диапазоне отвечает быстрому вращению нитроксильных радикалов, что также подтверждается математическим моделированием спектров ЭПР, зарегистрированных при разных температурах. Наблюдаемое незначительное уширение линий при температурах 50–90 °С, по-видимому, объясняется усилением спин-обменного взаимодействия при повышении температуры. Подобные эффекты, связанные с уширением линий спектров ЭПР нитроксидов в растворах с ростом температуры, неоднократно наблюдали ранее, в том числе для растворов радикала TEMPO в воде [19]. Таким образом, несмотря на высокую гидрофобность, зонд 5-DSM локализован в гидрофильной области системы PNIPAM–вода во всем температурном диапазоне, в отличие от липидных систем, в которых зонд локализуется в гидрофобных областях и характеризуется заторможенным вращением [26]. По-видимому, значительный размер зонда не позволяет ему зайти в свободный объем глобул PNIPAM из-за стерических затруднений.
4. ВЫВОДЫ
С использованием спектроскопии электронного парамагнитного резонанса показано, что локализация спиновых зондов в водных растворах термочувствительного поли-N-изопропилакриламида в ходе фазового перехода клубок–глобула определяется гидрофобностью зонда и его размером. Гидрофобный зонд малого размера (до 10 нм) 4-гидроксибензоато-ТЕМПО практически полностью (до 95% от общего количества) захватывается образующейся в ходе фазового перехода глобулой, в то время как крупный зонд, содержащий длинный алкильный хвост (метил-5-доксилстеарат), не заходит в полимерную глобулу. Полученные данные следует учитывать при выборе биологически активных веществ, используемых в системах доставки лекарств на основе поли-N-алкиламидов.
Работа выполнена с использованием оборудования, приобретенного за счет средств Программы развития Московского университета, и при финансовой поддержке грантом Российского научного фонда № 22-73-00062.
Список литературы
Ward M.A., Georgiou T.K. // Polymers (Basel). 2011. V. 3. № 3. P. 1215.
Gandhi A., Paul A., Sen S.O. et al. // Asian J. Pharm. Sci. 2015. V. 10. № 2. P. 99.
Khan A., Sajjad M., Shah L.A. et al. // Russ. J. Phys. Chem. B. 2021. V. 15. № S1. P. S109.
Heskins M., Guillet J.E. // J. Macromol. Sci. Part A – Chem. 1968. V. 2. № 8. P. 1441.
Kubota K., Shouei F., Ando I. // Polym. J. 1990. V. 22. № 1. P. 15.
Podewitz M., Wang Y., Quoika P.K. et al. // J. Phys. Chem. B. 2019. V. 123. № 41. P. 8838.
Cole M.A., Voelcker N.H., Thissen H. et al. // Biomaterials. 2009. V. 30. № 9. P. 1827.
Nash M.E., Healy D., Carroll W.M. et al. // J. Mater. Chem. 2012. V. 22. № 37. P. 19376.
Frolova A., Ksendzov E., Kostjuk S. et al. // Langmuir. 2021. V. 37. № 38. P. 11386.
EPR Spectroscopy. Applications in Chemistry and Biology / Eds. Drescher M., Jeschke G. Berlin: Springer, 2011. P. 67.
Иванова Т.А., Голубева.Е.Н. // Хим. физика. 2022. Т. 41. № 6. С. 35.
Shibryaeva L.S., Lyusova L.R., Karpova S.G. et al. // Russ. J. Phys. Chem. B. 2022. V. 16. № 2. P. 334.
Тертышная Ю.В., Подзорова М.В. // Хим. физика. 2020. Т. 39. № 1. С. 57.
Климович М.А., Сажина Н.Н., Радченко А.Ш. и др. // Хим. физика. 2021. Т. 40. № 2. С. 33.
Kurzbach D., Junk M.J.N., Hinderberger D. // Macromol. Rapid Commun. 2013. V. 34. № 2. P. 119.
Chumakova N.A., Golubeva E.N., Kuzin S.V. et al. // Polymers (Basel). 2020. V. 12. № 12. P. 3046.
Kurzbach D., Schömer M., Wilms V.S. et al. // Macromolecules. 2012. V. 45. № 18. P. 7535.
Zubanova E.M., Kostjuk S.V., Timashev P.S. et al. // Polymers (Basel). 2021. V. 13. № 21. P. 3829.
Zubanova E.M., Ivanova T.A., Ksendzov E.A. et al. // Polymers (Basel). 2022. V. 14. № 21. P. 4746.
Junk M.J.N., Jonas U., Hinderberger D. // Small. 2008. V. 4. № 9. P. 1485.
Junk M.J.N., Li W., Schlüter A.D. et al. // Angew. Chem. Intern. Ed. 2010. V. 49. № 33. P. 5683.
Persson K., Bales B.L. // J. Chem. Soc., Faraday Trans. 1995. V. 91. № 17. P. 2863.
Beghein N., Rouxhet L., Dinguizli M. et al. // J. Controlled Release. 2007. V. 117. № 2. P. 196.
Hunold J., Wolf T., Wurm F.R. et al. // Chem. Commun. 2019. V. 55. № 23. P. 3414.
Spagnuolo M., Jacobson A.R., Baveye P. // Environ. Toxicol. Chem. 2005. V. 24. № 10. P. 2435.
De Queirós W.P., de Sousa Neto D., Alonso A. // J. Controlled Release 2005. V. 106. P. 374.
Caldararu H., Caragheorgheopol A., Dimonie M. et al. // J. Phys. Chem. 1992. V. 96. P. 7109.
Stoll S., Schweiger A. // J. Magn. Reson. 2006. V. 178. № 1. P. 42.
Schneider D.J., Freed J.H. Spin Labeling: Theory and Applications. Boston (USA): Springer, 1989.
Jarocha L.E. // PhD Diss. 2014; https://doi.org/10.17615/1gb2-fr97
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика