Химия твердого топлива, 2019, № 1, стр. 67-70
ПОЛУЧЕНИЕ ГРАНУЛИРОВАННОГО АКТИВНОГО УГЛЯ ИЗ НЕФТЯНОГО ПЕКА И САЖИ ПРИ АКТИВАЦИИ
А. И. Сагитов 1, *, Б. С. Жирнов 1, **, А. О. Шведов 1, ***, П. В. Кугатов 1, ****
1 Филиал ФГБОУ ВО “Уфимский государственный нефтяной технический университет”
453250 Салават, Россия
* E-mail: sagitofff@gmail.com
** E-mail: jbc2@mail.ru
*** E-mail: shviedov1997@mail.ru
**** E-mail: kugpv@mail.ru
Поступила в редакцию 26.04.2018
После доработки 19.07.2018
Принята к публикации 24.10.2018
Аннотация
Получены образцы гранулированного (2–3 мм) активного угля методом щелочной активации смеси сажи и нефтяного пека (50/50) с последующей промывкой и сушкой (первая стадия). На второй стадии была проведена паровая активация приготовленных гранул при температурах 700–750°С. В результате были получены образцы с величиной угара 10–56%, удельная поверхность при этом увеличилась с 423 м2/г для образца, не подвергнутого парой активации, до 723 м2/г для образца с величиной угара 56% (прирост удельной поверхности составил 70%). Анализ зависимостей удельной поверхности и прочности от величины угара показал, что в процессе активации с водяным паром реагируют как пековый кокс, так и материал сажевых частиц. Принимая первый порядок реакции по водяному пару, были определены кажущиеся кинетические константы уравнения скорости реакции водяного пара с материалом углеродных гранул. Низкое значение энергии активации (202 кДж/моль) косвенно указывает на высокую реакционную способность полученных гранул, что позволяет проводить паровую активацию при температуре на 100–150°С ниже, чем в случае традиционных активных углей.
ВВЕДЕНИЕ
Известны два метода получения активных углей: физический и химический. Первый заключается в обработке ранее карбонизованного углеродного материала водяным паром при температуре 800–900°С; по второму методу, к исходному сырью добавляют дегидратирующую активирующую добавку и полученную смесь выдерживают при повышенных температурах, далее следуют стадии промывки и сушки [1, 2]. Иногда для увеличения удельной поверхности активный уголь, полученный методом химической активации, подвергают дополнительно физической активации, в этом случае можно говорить о смешанном типе активации [3, 4]. Очевидно, что использование этого метода должно быть оправданным, поскольку себестоимость подобного угля будет выше.
Ранее [5] был получен гранулированный активный уголь путем смешения нефтяного пека с сажей и измельченным гидроксидом калия, с последующей карбонизацией полученных гранул при температуре 800°С, промывкой и сушкой. Было показано, что в процессе активации микропоры образуются в структуре пекового кокса, формирующегося из связующего (нефтяного пека), в то время как частицы сажи (наполнителя) не участвуют в образовании микропор, являясь своего рода балластом. По этой причине полученный активный уголь можно дополнительно подвергнуть активации водяным паром, в результате чего микропоры могут образоваться и в материале сажевых частиц, что приведет к увеличению суммарной удельной поверхности.
Цель настоящего исследования – проведение паровой активации гранул активного угля, полученного из нефтяного пека и сажи методом щелочной активации на первой стадии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сырья использовали сажу марки П701 по ГОСТ 7885–86 [6], а также нефтяной пек с содержанием летучих 52.2 мас. % и содержанием нерастворимых в толуоле веществ 38.8 мас. %.
Образцы активного угля на первой стадии были получены путем смешения измельченного нефтяного пека, сажи и гидроксида калия (содержание воды 11 мас. %) в присутствии растворителя (толуола) и гранулирования полученной смеси (диаметр и длина полученных гранул составили, соответственно, 2 и 2.5 мм). Далее гранулы спекали при температуре 800°С в инертной атмосфере, после чего охлаждали до комнатной температуры. Образцы промывали путем кипячения в 5%-ном растворе соляной кислоты и далее – в дистиллированной воде до нейтральной реакции в промывных водах. Полученные образцы сушили при температуре 120–130°С в течение 6 ч. Более подробно методика получения образцов данного активного угля приведена в работе [5].
На второй стадии полученные образцы активировали водяным паром при температурах 700–750°С; также изменялось время активации (от 1 до 6 ч). Для активации брали навеску массой около 1 г, доведенную до постоянной массы. Гранулы помещали в кварцевую трубку, через которую пропускали азот с расходом 50 см3/мин и нагревали со скоростью 15–20 град/мин. После установления необходимой температуры в поток азота равномерно подавали водяной пар таким образом, чтобы его содержание в суммарном потоке газа составляло 75 ± 3 об. %. По завершении активации подачу водяного пара прекращали и гранулы охлаждали в токе азота до комнатной температуры. Процент угара определяли как отношение убыли массы в результате активации к исходной массе образца.
Для исследуемых образцов измеряли изотерму адсорбции бензола при 20°С динамическим методом [7]. Перед непосредственным измерением образцы тренировали в токе азота при 300°С в течение 1 ч. Из изотермы адсорбции была рассчитана эффективная удельная поверхность методом БЭТ, а также объем микропор и поверхность мезопор αS-методом [8]. В качестве стандарта для расчета параметров αS-методом использовали данные по адсорбции бензола на графитированной саже [9]. Для всех гранул определили механическую прочность на раздавливание на прочномере ПК-1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате активирования были получены образцы углеродных гранул, в которых величина угара изменялась в пределах 10–56 мас. %. Кривые зависимости угара от времени при трех разных температурах приведены на рис. 1. Выбранные температуры – довольно низкие для традиционного процесса активирования углеродного материала водяным паром, обычно температура активации составляет не менее 800°С [1, 2]. Необходимость активации при более низких температурах (700–750°С) объясняется следующими причинами:
Рис. 1.
Зависимость угара гранул от времени активации при температуре, °С: 700 (1), 725 (2), 750 (3).
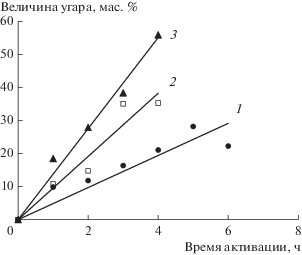
во-первых, были проведены предварительные эксперименты при 800°С и более, которые показали полное выгорание всего исходного материала;
во-вторых, можно ожидать повышенную реакционную способность данного углеродного материала благодаря присутствию соединений калия, являющегося типичным катализатором взаимодействия углерода с активирующими газами (О2, Н2О, СО2) [10–14]. На присутствие соединений калия указывает повышенная зольность материала (3–5%) [5] по сравнению с гранулами, полученными из сажи и нефтяного пека без добавки КОН, для них зольность составляла менее 1% [15].
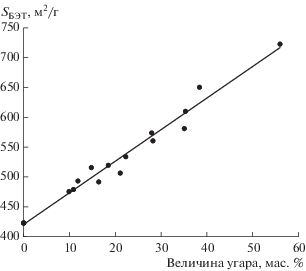
На рис. 2 показана зависимость эффективной удельной поверхности гранул от величины угара. Видно, что с увеличением угара гранул удельная поверхность линейно увеличивается до 723 м2/г при угаре 56%. Характерно, что все точки группируются возле прямой линии, что довольно часто встречается при активировании углеродных материалов [1]. Поскольку целью проведения паровой активации было дополнительное увеличение удельной поверхности, то необходимо выделить интервал величины угара, при котором достигается значимое увеличение поверхности по сравнению с образцом, полученным на первой стадии. Например, из рис. 2 следует, что при степени угара 30 и 50 мас. % прибавка к удельной поверхности относительно исходного образца составляет 37 и 62% соответственно (при максимальной степени угара 56 мас. % удельная поверхность выросла на 70%).
Поверхность образцов в результате активирования может развиваться как за счет увеличения количества пор в пековом коксе, полученном из связующего (нефтяного пека), так и в саже. Поскольку пековый кокс изначально содержит микропоры, образовавшиеся в результате щелочной активации на первой стадии, и, возможно, он частично блокирует доступ активирующего агента к частицам сажи, то можно ожидать преимущественное реагирование водяного пара именно с ним. Однако целью работы являлась паровая активация частиц сажи, что дало бы основной прирост удельной поверхности. В целом результаты экспериментов показали, что реагирование материала сажевых частиц с водяным паром при активации все же протекает.
Это подтверждается простым расчетом: в исходной смеси соотношение пек/сажа составляло 50/50. После щелочной активации на первой стадии при выходе продукта около 85 мас. % содержание пекового кокса в гранулах будет менее 50 мас. % из-за потери массы в результате выхода летучих веществ. Если бы с водяным паром реагировал только пековый кокс, то величина угара не превышала бы 40–45%, а полученный продукт представлял бы собой порошкообразный материал. Однако результаты экспериментов показывают, что были достигнуты угары, превышающие 40%, и при этом сохранялась достаточная механическая прочность образцов (рис. 3). Что касается прочности гранул на раздавливание, то она сохраняется довольно высокой даже при угарах, превышающих 50% (более 1 МПа), поэтому можно сделать вывод, что в процессе активации с водяным паром реагировал и пековый кокс, и сажа. Относительное участие данных компонентов в процессе выгорания будет зависеть от реакционной способности каждого и может быть определено экспериментально.
Рис. 3.
Зависимость объема микропор и прочности на раздавливание углеродных гранул от величины угара.
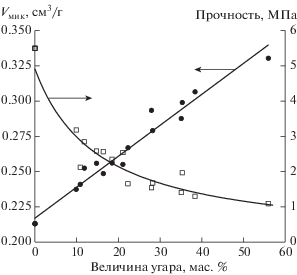
Также на рис. 3 показано изменение содержания микропор в образце от величины угара. В целом линейный характер данной зависимости напоминает график изменения удельной поверхности. Однако объем микропор является характеристикой, более адекватно описывающей пористую структуру микропористого материала, нежели удельная поверхность, определенная методом БЭТ. Последняя величина выражает величину поверхности материала, если он не содержит микропоры. Все полученные образцы содержали микропоры, что подтверждалось формой изотерм адсорбции, представляющие собой типичные изотермы I типа [8].
Если принять первый порядок реакции по водяному пару, степень превращения водяного пара может быть определена как
где k – кажущаяся константа скорости реакции, t – время активации.Используя экспериментальные данные в соответствии с линейной формой представленного уравнения, были построены графики зависимости ln(1/(1 – x)) = f(t) при трех температурах: 700, 725 и 750°С. Из угла наклона полученных прямых были определены кажущиеся константы скорости реакции. Далее из графика зависимости lnk от обратной температуры были рассчитаны кажущиеся энергия активации и предэкспоненциальный множитель в уравнении Аррениуса. По результатам расчета, Е = 202.2 кДж/моль, k0 = 1.13 ⋅ 106. Если сравнивать полученные данные с результатами исследования реакционной способности различных графитоподобных материалов, представленными в работе [16], то можно видеть, что рассчитанная энергия активации находится на нижней границе значений данной величины. Данный факт можно объяснить присутствием в структуре гранул соединений калия, оставшихся после промывки на первой стадии активации. При этом стоит учитывать, что полученные кинетические константы являются усредненными, поскольку, как было показано выше, в процессе активации выгорает и пековый кокс, и сажа. Данные величины могут быть использованы при расчете основного аппарата установки получения активного угля – печи активации (например, барабанной), что позволит определить величину угара полученного продукта.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что значительные величины угара (10–56%) достигаются при температурах значительно ниже традиционных для процесса активации углеродных материалов водяным паром. При угаре 30 мас. % и более удельная поверхность гранул активного угля увеличивается на 30–70%, поэтому применение смешанного метода активации более эффективно по сравнению со щелочной активацией.
Проведенный анализ по величине угара и прочности гранул показал, что в процессе активации с водяным паром реагируют как пековый кокс, так и сажа.
Определены кажущиеся кинетические константы уравнения скорости реакции водяного пара с материалом углеродных гранул. Низкое значение энергии активации (202 кДж/моль) косвенно указывает на высокую реакционную способность полученных гранул, что позволяет проводить паровую активацию при температуре, на 100–150°С ниже, чем в случае традиционных активных углей.
Список литературы
Кинле Х., Бадер Э. Активные угли и их промышленное применение. Пер. с нем. Л.: Химия, 1984. 216 с.
Marsh H., Rodríguez-Reinoso F. Activated carbon. London: Elsevier, 2006. 554 p.
Бутырин Г.М. Высокопористые углеродные материалы. М.: Химия, 1976. 192 с.
Wu M., Zha Q., Qiu J., Han X., Guo Y., Li Z., Yuan A., Sun X. // Fuel. 2005. V. 84. № 14–15. P. 1992. https://doi.org/ doi 10.1016/j.fuel.2005.03.008
Кугатов П.В., Баширов И.И., Жирнов Б.С., Ахметова И.И., Порошин А.С. // Журн. прикл. химии. 2016. Т. 89. № 6. С. 725. [Kugatov P.V., Bashirov I.I., Zhirnov B.S., Akhmetova I.I., Poroshin A.S. // Rus. J. App. Chem. 2016, vol. 89, no 6, p. 886. https://doi.org/10.1134/S1070427216060069]
ГОСТ 7885-86. Углерод технический для производства резины. Технические условия. Введ. 1988-01-01. М.: Изд-во стандартов, 1988. 19 с.
Rubinshtein A.M., Afanasyev V.A. // Bull. Acad. Sci. USSR. Division of chemical science. 1956. V. 5. № 11. P. 1329. https://doi.org/ doi 10.1007/BF01177698
Грег С., Синг К. Адсорбция, удельная поверхность, пористость / Пер. с англ. 2-е изд-е. М.: Мир, 1984. 306 с.
Isirikyan A.A., Kiselev A.V. // J. Phys. Chem. 1961. V. 65. № 4. P. 601. doi 10.1021/j100822a004
McKee D.W. // Carbon. 1982. V. 20. № 1. P. 59. https://doi.org/ doi 10.1016/0008-6223(82)90075-6
Mims C.A., Chludzinski J.J., Pabst Jr. J.K., Baker R.T.K. // J. Catalys. 1984. V. 88. № 1. P. 97. https://doi.org/ doi 10.1016/0021-9517(84)90054-X
Зекель Л.А., Краснобаева Н.В. // ХТТ. 2003. № 6. С. 60.
Wu Y., Wang J., Wu S., Huang S., Gao J. // Fuel Proc. Techn. 2011. V. 92. № 3. P. 523. https://doi.org/ doi 10.1016/j.fuproc.2010.11.007
Wu X., Wang J. // Fuel Proc. Technol. 2017. V. 159. P. 9. https://doi.org/ doi 10.1016/j.fuproc.2017.01.001
Кугатов П.В., Баширов И.И., Жирнов Б.С. // Электронный научный журнал “Нефтегазовое дело”. 2015. № 2. С. 281. [Kugatov P.V., Bashirov I.I., Zhirnov B.S., Akhmetova I.I., Poroshin A.S. // Electronic scientific journal “Oil and Gas Business”. 2015. № 2. P. 281. doi 10.17122/ogbus-2015-2-281-306]
Жирнов Б.С. Кинетические исследования и моделирование промышленных химико-технологических процессов с участием углерода. Уфа: Изд-во ГУП ИНХП РБ, 2010. 188 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива