Химия твердого топлива, 2019, № 2, стр. 63-70
ВЛИЯНИЕ ИНИЦИИРУЮЩЕЙ ДОБАВКИ CuSO4 НА ИЗМЕНЕНИЕ ХАРАКТЕРИСТИК ПРОЦЕССОВ ОКИСЛЕНИЯ И ПИРОЛИЗА БУРЫХ УГЛЕЙ
К. Б. Ларионов 1, *, И. В. Мишаков 1, 2, **, А. А. Ведягин 1, 2, ***, В. Е. Губин 1, ****
1 Томский политехнический университет
634050 Томск, Россия
2 ФГБУН Институт катализа имени Г.К. Борескова СО РАН
630090 Новосибирск, Россия
* E-mail: laryk070@gmail.com
** E-mail: mishakov@catalysis.ru
*** E-mail: vedyagin@catalysis.ru
**** E-mail: gubin@tpu.ru
Поступила в редакцию 07.05.2018
После доработки 03.09.2018
Принята к публикации 24.10.2018
Аннотация
Исследованы процессы окисления и пиролиза бурых углей, содержащих 5 мас. % инициирующей добавки (CuSO4). Эксперимент выполнен методом термогравиметрии при скорости нагрева 2.5°С/мин в атмосфере воздуха и азота. Проведена оценка характеристик процесса в режиме пиролиза и окисления и определена энергия активации процесса по методу Coats–Redfern. Установлено, что добавление инициирующего агента CuSO4 приводит к существенному снижению начальной температуры процессов окисления и пиролиза, что способствует смещению реакции в низкотемпературную область. Максимальное изменение температуры инициирования реакции (ΔTi) в режиме окисления составило 35°С, в режиме пиролиза (ΔTd) – 50°С. Установлено, что введение CuSO4 приводит к снижению энергии активации горения на 7.1 кДж/моль и для процесса пиролиза ΔЕа составляет 10 кДж/моль. Наблюдалось сокращение времени пребывания образца в пределах возгонки летучих веществ: для окисления Δti составило 12 мин, для пиролиза Δtd – 18 мин. По данным масс-спектрометрического анализа, в продуктах реакции окисления и пиролиза модифицированных образцов обнаружено присутствие SO2 (пики при 230 и 320°С), что объясняется химическим взаимодействием сульфата меди с компонентами бурого угля.
ВВЕДЕНИЕ
В настоящее время уголь играет важнейшую роль в энергетической отрасли крупнейших стран мира [1]. По данным мировой энергетической статистики, за последние пятнадцать лет потребление угля возросло на 15.3%, что говорит о востребованности данного вида ресурса. Одним из эффективных способов использования угля является его каталитическое сжигание в топках энергетических котлов [2]. Данное технологическое решение позволяет обеспечить максимальную конверсию топлива в продукты полного окисления и снизить температуру протекания реакции без образования открытого пламени [3]. Понижение температуры окисления твердого топлива минимизирует содержание оксидов азота и серы, уходящих в составе газофазных продуктов [4], а также исключает зашлаковывание экранных труб котла путем отвода золы в стабильном агрегатном состоянии.
Большинство исследований в области каталитического окисления твердого топлива направлено на использование оксидов различных металлов, способствующих снижению начальной температуры и ускорению реакции [5–7]. Найдено, что введение оксидных добавок приводит к существенному снижению температуры зажигания высвобождаемых летучих веществ одновременно с увеличением скорости горения коксового остатка.
В работе [8] наряду с различными оксидами было рассмотрено влияние нитратов и хлоридов металлов на процесс окисления бурых углей. Введение данных солей также способствует заметному снижению температуры зажигания летучих веществ и повышению скорости процесса окисления в целом. Было установлено, что инициирующие добавки на основе солей и их оснований оказывали наибольшее влияние на процесс окисления углей в отличие от металлооксидных промоторов.
В [9] было проведено исследование влияния минеральной добавки в виде Сu(NO3)2 на изменение параметров процесса окисления бурого угля. Показано, что внесение инициирующего промотора способствовало ускорению высвобождения летучих веществ и снижению температуры их последующего зажигания. Высказано предположение, что повышение интенсивности процесса окисления угля при использовании добавки-предшественника связано с разложением соли на начальном этапе нагрева образца (до 200°С). Термическая деструкция частиц твердого топлива способствует снижению диффузионного сопротивления и ослаблению молекулярной матрицы за счет интенсификации подвода кислорода.
В настоящей работе рассматривается влияние инициирующей добавки CuSO4 на изменение характеристик процесса окисления и пиролиза бурых углей.
ЭКСПЕРИМЕНТАЛЬНАЯ И АНАЛИТИЧЕСКАЯ ЧАСТИ
В работе использовались образцы бурых углей Бородинского (образец 1) и Балахтинского (образец 2) разрезов Канско-Ачинского угольного бассейна. Крупнодисперсные образцы исходных углей (5–10 мм) измельчались в барабанной мельнице в течение 8 ч при равном соотношении массы мелющих тел и массы измельчаемого материала. После помола образцы фракционировались на ситах с размером ячеек 80 мкм.
В табл. 1 представлены данные технического и элементного анализов исследуемых типов углей, выполненных с использованием стандартных методик [10]. Массовая доля основных элементов в составе образцов (С, H, N, S, O) была определена с помощью анализатора элементного состава Euro EA 3000 (EuroVector, Италия). Видно, что исследуемые образцы во многом сходны при небольшой разнице в содержании летучих веществ и углерода. Схожесть образцов 1 и 2 прослеживается и в морфологии частиц, что видно из микрофотографий, представленных на рис. 1. Снимки выполнены с использованием растрового электронного микроскопа JSM-6460LV (JEOL, Япония) c ионным сфокусированным пучком. Частицы исследуемых углей имеют неправильную многогранную форму с неоднородной поверхностью и множеством углублений и трещин.
Инициирующая добавка CuSO4 вводилась в состав образцов методом пропитки по влагоемкости [11]. Содержание сульфата меди в приготовленном образце после сушки составляло 5 мас. %. Предварительное растворение сульфата меди осуществлялось в водно-спиртовом растворе (объемное соотношение H2O/C2H5OH = 50 : 50). При полном растворении соли раствор был по каплям нанесен на подготовленные порошки угля с помощью механического дозатора. Полученные образцы выдерживались в сушильном шкафу при 105°С в течение 20 ч.
Исследование процессов окисления и пиролиза образцов углей проводилось с помощью синхронного термического анализатора STA 449 C Jupiter (Netzsch, Германия). Эксперименты осуществлялись в одинаковых условиях при скорости нагрева 2.5°С/мин в корундовом тигле с перфорированной крышкой в интервале температур 25–600°С. Загрузка образца составляла ~25 мг. В режиме пиролиза использовался инертный газ азот, а в качестве окислительной среды – смесь воздуха (60 мл/мин) и азота (10 мл/мин). В последнем случае азот использовался в качестве защитного газа для обеспечения надежной работы анализатора и корректной регистрации полученных данных. Для образцов серии 1 было выполнено качественное определение состава продуктов окисления с помощью приставки STA в виде квадрупольного масс-спектрометра QMS 403 D Aeolos (Netzsch, Германия). Все эксперименты проводились при атмосферном давлении.
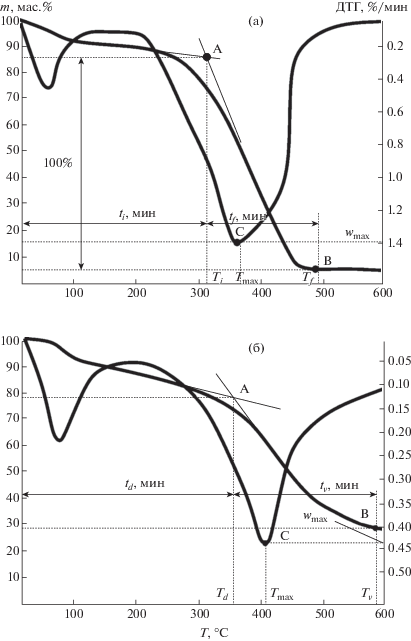
Определение параметров процессов окисления и пиролиза проводилось графическим способом (рис. 2) с помощью полученных ТГ- и ДТГ-кривых. Точка А на ТГ-кривой характеризует температуру начала процесса окисления (Тi) и пиролиза (Td) исследуемых углей; точка B относится к окончанию процесса потери массы за счет окисления (рис. 1, а; Tf) или пиролиза (рис. 1, б; ${{T}_{v}}$). Точка С на ДТГ-кривой соответствует максимальному значению скорости процесса (wmax), достигаемой при температуре Тmax. Также было проведено вычисление значений энергии активации окисления и пиролиза образцов с использованием метода Coats–Redfern [7].
Рис. 2.
Определение характеристик процесса окисления (а) и пиролиза (б) немодифицированного образца 1.
В основе данного метода лежит следующее соотношение:
где α – степень конверсии угля; T – температура, К; R – универсальная газовая постоянная, Дж/(моль ⋅ К); A – предэкспоненциальный множитель, 1/мин; Ea – энергия активации, Дж/моль; β – скорость нагрева, К/мин. Решение данного уравнения и определение основных кинетических показателей осуществлялось путем аппроксимации экспериментальной зависимости в координатах ln(–ln(1 – α)/T2) от 1/T.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
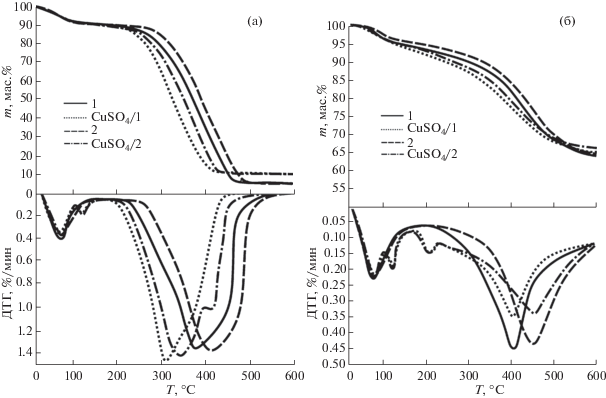
На рис. 3 представлены результаты термического анализа (ТГ- и ДТГ-кривые) образцов бурых углей в атмосферах воздуха (окисление) и азота (пиролиз). Видно, что введение сульфата меди в состав образца приводит к заметному изменению характера процесса по сравнению с немодифицированным углем.
ТГ- и ДТГ-кривые образцов сравнения, полученные в режиме окисления (рис. 3, а), имеют схожий характер. Процесс в данном случае можно условно разделить на четыре стадии. Первая связана с удалением влаги (до 100°С); вторая (100–295°С) характеризуется возгонкой летучих веществ в результате термической деструкции частиц топлива. На третьей и четвертой стадиях (295–505°С) процесса окисления происходит зажигание высвобождаемых летучих соединений с последующим горением твердой фазы образца (горючей массы). Исследуемые типы углей характеризуются высоким содержанием летучих соединений (табл. 1), поэтому третья и четвертая стадии окисления (при заданных экспериментальных условиях) протекают параллельно, о чем свидетельствует широкий пик на ДТГ-кривой (рис. 3, а). В свою очередь, процесс пиролиза образцов (рис. 3, б) можно описать двумя основными фазами: удалением внешней влаги и выходом летучих веществ и горючих газов: CO, H2 и CH4 [14].
Полученные результаты ТГА (рис. 3) свидетельствуют о том, что нанесение инициирующей добавки CuSO4 на бурый уголь способствует повышению интенсивности высвобождения летучих соединений, а также снижению начальной температуры их воспламенения. Результатом активирующего действия добавки является заметное смещение процесса окисления в низкотемпературную область.
Из анализа ДТГ-кривых (рис. 3, а) модифицированных образцов следует, что смещение температурных пиков сопровождается возрастанием скорости протекания реакции. Важно отметить, что для процессов окисления и пиролиза модифицированных образцов характерно появление дополнительного пика в районе 120°С, что связано с дегидратацией соли CuSO4 ⋅ 5Н2О и образованием моногидрата CuSO4 ⋅ Н2О.
Несмотря на существенное различие в характере ДТГ-кривых, полученных для процесса пиролиза образцов сравнения и модифицированных образцов (рис. 3, б), положение температурных пиков остается практически неизменным. В то же время заметим, что полосы на ДТГ-кривых для пиролиза модифицированных образцов заметно расширены по сравнению с исходными углями. В температурном диапазоне 190–230°С наблюдается появление дополнительной полосы, что может объясняться деструкцией нанесенных частиц сульфата меди.
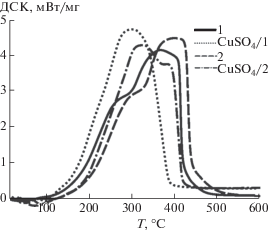
Отметим, что положение экзотермических максимумов на ДСК-кривых для процесса окисления (рис. 4) практически совпадает со значениями Tmax, соответствующими максимальной скорости протекания реакции (вычисленными из данных ДТГ, рис. 3).
Наблюдаемые на рис. 4 экзотермические эффекты связаны с выделением теплоты на стадиях окисления летучих веществ и коксового остатка [12]. ДСК-кривые процесса окисления исходных образцов 1 и 2 характеризуются бимодальной формой, что позволяет достаточно четко различить отдельные стадии. Вносимая в состав угля инициирующая добавка усиливает тенденцию к слиянию двух отдельных стадий тепловыделения в одну. Так, для образца CuSO4/2, имеющего температурный сдвиг ΔTmax = 104°C, второй пик в области 400°С преобразуется в характерное “плечо”, которое характеризует реакцию окисления образующегося коксового остатка. В то же время, для образца с большим содержанием летучих веществ (CuSO4/1, табл. 1) ДСК-кривая имеет единственный максимум выделения тепла, смещенный в область низких температур: ΔTmax = 92°C.
На рис. 5 приведены масс-спектрометрические профили, соответствующие появлению СО2 (m/z = 44) и SO2 (m/z = 64) в составе газофазных продуктов на примере серии образцов 1, пребывающих в окислительной среде.
Сравнение полученных результатов масс-спектрометрического анализа показывает, что для образца СuSO4/1 максимум выделения СО2 имеет температурный сдвиг ΔТmax, совпадающий с таковым на ДТГ-кривой (рис. 3, а). При этом наибольшая интенсивность образования СО2, в отличие от образца сравнения, приходится на стадию окисления высвобождаемых летучих компонентов. Важно отметить, что снижение температуры начала процесса окисления модифицированного образца совпадает с образованием пика выделения SO2 (рис. 5), смещение в низкотемпературную область которого, вероятнее всего, происходит в результате частичной деструкции CuSO4 в интервале температур 160–240°С.
На рис. 6 представлены ТГ-, ДТГ- и МС-профили термического разложения промотора CuSO4, нанесенного на инертный носитель в виде α-Al2O3 с массовым содержанием 5%. Видно, что потеря массы исследуемой добавки CuSO4 при термическом воздействии в рассматриваемом диапазоне температур (45–600°С) составляет 1.5%, что обусловлено дегидратацией соли в интервале температур 80–220°С.
Рис. 6.
ТГ-, ДТГ- и МС-профили термического разложения добавки СuSO4 ⋅ 5H2O, нанесенной на инертный носитель α-Al2O3, с выделением SO2 в окислительной среде.
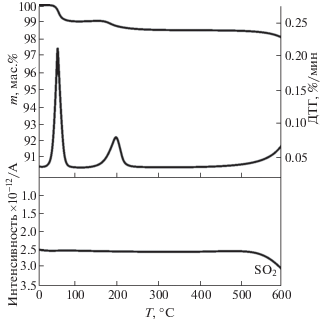
При этом в области более высоких температур (свыше 550°С) наблюдается потеря массы добавки, которая связана с термическим разложением добавки, что подтверждается началом выделения SO2, отраженном на МС-профиле процесса (рис. 6).
Частичное разложение сульфата меди в низкотемпературной области процесса окисления можно объяснить химическим взаимодействием CuSO4 и углеродного субстрата, обладающего хорошими восстановительными свойствами [13].
Взаимодействие сульфата меди с бурым углем можно разделить на две составляющие: реакция CuSO4 с кислородосодержащими функциональными группами угля (1) [14] и химическое взаимодействие в результате тесного контакта с твердой фазой – коксовым остатком – (2):
(1)
${\text{CuS}}{{{\text{O}}}_{4}} + {{{\text{C}}}_{x}}{{{\text{H}}}_{y}} \to {\text{CuO}} + {\text{S}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O,}}$(2)
$2{\text{С uS}}{{{\text{O}}}_{4}} + {\text{C}} \to 2{\text{CuO}} + 2{\text{S}}{{{\text{O}}}_{2}} + {\text{C}}{{{\text{O}}}_{2}}.$Таким образом, частичная деструкция CuSO4 с выделением SO2 способствует активации окисления летучих соединений, в результате чего наблюдается интенсивное выделение СО2 при более низкой температуре.
В результате анализа экспериментальных данных были определены параметры для процессов окисления и пиролиза бурых углей (табл. 2).
Таблица 2.
Характеристики процесса в режиме окисления и пиролиза
| Параметр | 1 | CuSO4/1 | 2 | CuSO4/2 |
|---|---|---|---|---|
| Окисление | ||||
| Температура начала окисления, Ti , °С | 295 | 265 | 310 | 275 |
| Время начала окисления, ti, мин | 108 | 96 | 114 | 78 |
| Температура окончания окисления, Tf , °С | 485 | 425 | 505 | 440 |
| Время окисления горючей массы, tf , мин | 76 | 64 | 78 | 66 |
| Максимальная скорость реакции окисления, wmax, мас. %/мин | 1.30 | 1.43 | 1.32 | 1.40 |
| Пиролиз | ||||
| Температура начала пиролиза, Td, °С | 350 | 305 | 360 | 310 |
| Время начала пиролиза, td, мин | 130 | 112 | 134 | 114 |
| Температура окончания пиролиза, ${{T}_{v}}$, °С | 590 | 550 | 600 | 545 |
| Время прохождения процесса пиролиза, ${{t}_{v}}$, мин | 96 | 98 | 96 | 94 |
| Максимальная скорость реакции пиролиза, wmax, мас. %/мин | 0.45 | 0.35 | 0.43 | 0.33 |
Сопоставление данных табл. 2 показывает, что внесение инициирующей добавки CuSO4 способствует значительному снижению начальной температуры окисления Ti и возгонки летучих соединений Td. В результате модифицирования наблюдается сдвиг обоих процессов в низкотемпературную область, о чем свидетельствует снижение значений Тf и ${{T}_{v}}$. При этом максимальное изменение наблюдается для образцов, процесс разложения которых протекает в инертной среде (45 и 50°С для образцов CuSO4/1 и CuSO4/2, соответственно). В то же время снижение начальной температуры для модифицированных образцов в окислительной среде составило 30°С (CuSO4/1) и 35°С (CuSO4/2).
Наблюдаемая разница в значениях ΔTi и ΔTd для образцов 1 и 2 может быть объяснена различным содержанием летучих соединений в составе бурого угля (табл. 1). Отметим, что полученный результат согласуется с данными работы [6], где было рассмотрено влияние оксидов металлов на кинетические характеристики окисления углей различной степени метаморфизма.
Установлено, что внесение инициирующей добавки также ведет к сокращению времени протекания процесса в режиме окисления Δtf на 12 мин. В то же время общая продолжительность процесса пиролиза практически не меняется ($\Delta {{t}_{v}}$ близко к нулю).
Результаты расчетов по методу Coats-Redfern показали, что введение сульфата меди во всех случаях приводит к снижению наблюдаемой энергии активации процесса (Ea). Из табл. 3 следует, что значение энергии активации для образцов сравнения 1 и 2 во всех рассматриваемых процессах близки и составляют 57.3 и 58.7 (окисление), 32.6 и 33.3 (пиролиз), соответственно. Вычисленные значения Eа хорошо согласуются с литературными данными [15].
Таблица 3.
Энергия активации процесса в режиме окисления и пиролиза
| Образец | Энергия активации Ea | ∆Ea |
|---|---|---|
| кДж/моль | ||
| Окисление | ||
| 1 | 57.3 | 5.4 |
| CuSO4/1 | 51.9 | |
| 2 | 58.7 | 7.1 |
| CuSO4/2 | 51.6 | |
| Пиролиз | ||
| 1 | 32.6 | 9.5 |
| CuSO4/1 | 23.1 | |
| 2 | 33.3 | 10.0 |
| CuSO4/2 | 23.3 | |
Отметим, что внесение инициирующей добавки во всех случаях приводит к снижению энергии активации процесса, причем максимальное падение Eа (∆Ea = 10 кДж/моль), как и следовало ожидать, соответствует режиму пиролиза модифицированных углей, для которых зафиксировано наибольшее изменение температуры начала процесса (табл. 2).
ЗАКЛЮЧЕНИЕ
Исследование влияния инициирующей добавки CuSO4, вводимой в состав бурых углей в количестве 5 мас. %, показало существенное снижение начальной температуры возгонки летучих соединений, независимо от среды, в которой испытывались образцы. Наибольшее изменение начальной температуры процесса наблюдалось для термодеструкции модифицированных образцов в инертной среде (режим пиролиза). При этом наибольший эффект проявлялся для образцов серии 2, отличающихся меньшим содержанием летучих веществ.
В результате снижения начальной температуры возгонки летучих соединений отмечается уменьшение энергии активации. При сокращении времени окисления горючей массы образца происходит увеличение средней скорости протекания реакции, что способствует общему сдвигу процесса в область более низких температур. Наблюдаемый эффект, по-видимому, связан с дегидратацией и частичным гидролизом кристаллогидрата CuSO4 ⋅ 5Н2О, о чем свидетельствует появление SO2 в продуктах реакции в интервале температур 160–240°С в результате взаимодействия добавки с углеродным субстратом. Дегидратация CuSO4 ⋅ 5Н2О и его дальнейшая деструкция в порах углеродной матрицы способствует интенсификации процессов массо- и теплопереноса, тем самым ускоряя протекание реакции.
Список литературы
Королев А.В., Ломакина Н.С. // Современные наукоемкие технологии. 2013. № 8. С. 125.
Симонов А.Д., Федоров И.А., Дубинин Ю.В., Языков Н.А., Яковлев В.А., Пармон В.Н. // Катализ в промышленности. 2012. № 3. С. 50.
Пармон В.Н., Симонов А.Д., Садыков В.А., Тихов С.Ф. // Физика горения и взрыва. 2015. Т. 51. № 2. С. 5. [Combustion, Explosion and Shock Waves, 2015, vol. 51, Issue 2, p. 143. 10.1134/S001050821502001X.]
Liu Y., Che D., Xu T. // Fuel Process. Technol. 2002. V. 79. № 2. P. 157.
Zou C., Zhao J., Li X., Shi R. // J. Therm. Anal. Calorim. 2016. V. 126. P. 1469.
Gong X., Guo Z., Wang Z. // Combust. Flame. 2010. V. 157. P. 351.
Yin K., Zhou Y.M., Yao Q.Z., Fang C., Zhang Z.W. // Reac. Kinet. Mech. Cat. 2012. V. 106. № 2. P. 369.
Zhao G.W., Yu W.Q., Xiao Y.H. // Adv. Mater. Res. 2011. V. 236. P. 660.
Larionov K.B., Mishakov I.V., Slyusarskiy K.V., Bolgova D.A., Lavrinenko S.V. // MATEC Web of Conferences. 2017. V. 141. 01026.
Slyusarskiy K.V., Larionov K.B., Osipov V.I., Yankovsky S.A., Gubin V.E., Gromov A.A. // Fuel. 2017. V. 191. P. 383.
Токарева И.В., Мишаков И.В., Ведягин А.А., Корнеев Д.В., Петухова Е.С., Саввинова М.Е. // Композиты и наноструктуры. 2014. Т. 6. № 3. С. 158.
Ozbas K.E., Kök M.V., Hicyilmaz C. // J. Therm. Anal. Calorim. 2003. V. 71. P. 849.
Shaikhutdinov Sh.K., Avdeeva L.B., Novgorodov B.N., Zaikovskii V.I., Kochubey D.I. // Catal. Lett. 1997. V. 47. № 1. P. 35.
Zhang L., Hu S., Chen Q., Xiao L., Shatir A. Syed-Hassan S.S.A., Jiang L., Wang Y., Su S., Xiang J. // Fuel. 2017. V. 189. P. 178.
Fangxian L., Shizong L., Youzhi C. // J. Therm. Anal. Calorim. 2009. V. 95. P. 633.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива