Химия твердого топлива, 2019, № 3, стр. 66-72
МОДЕЛИРОВАНИЕ СТРУКТУРЫ И РАСЧЕТ ЭНЕРГИИ ВЗАИМОДЕЙСТВИЯ ФРАГМЕНТОВ МАКРОМОЛЕКУЛ ЦЕЛЛЮЛОЗЫ
А. М. Гюльмалиев 1, *, Р. З. Сафиева 2, 3, **, В. А. Винокуров 2, ***, О. П. Паренаго 1, ****
1 ФГБУН Институт нефтехимического синтеза имени А.В. Топчиева РАН
119991 Москва, Россия
2 Российский государственный университет нефти и газа (национальный исследовательский университет)
имени И.М. Губкина
119991 Москва, Россия
3 Некоммерчерское Партнерство “Технопарк Губкинского университета”
119296 Москва, Россия
* E-mail: Gyulmaliev@ips.ac.ru
** E-mail: safieva@mail.ru
*** E-mail: vinoc_ac@mail.ru
**** E-mail: parenago.o@ips.ac.ru
Поступила в редакцию 24.10.2018
После доработки 19.11.2018
Принята к публикации 06.02.2019
Аннотация
Методами квантовой химии проведен расчет энергетических параметров элементарного звена и димера макромолекулы целлюлозы (целлобиозы), а также моделирование структур и расчет энергии взаимодействия фрагментов макромолекул нативной целлюлозы. Установлено, что транс-конформация целлобиозы на 6.7 ккал/моль устойчивее, чем цис-конформация. Различия в расчетных и реальных (по литературным данным) ИК-спектрах целлюлозы связаны наличием внутри- и межмолекулярных водородных связей в нативной структуре. Показано, что взаимодействие отдельных фрагментов макромолекул целлюлозы из восьми мономерных звеньев обусловлено проявлением внутримолекулярных водородных связей. Установлено, что энергии межмолекулярных взаимодействий ∆Е существенно зависят от природы концевых групп Х во фрагменте макромолекулы целлюлозы и для X = –Н, –СООН, –COH составляют –26, 49 и –32 ккал/моль соответственно. Регулирование структуры взаимодействующих фрагментов макромолекул целлюлозы достигается заменой атомов водорода гидроксильных или концевых групп ее макромолекул на функциональные группы, не образующие внутримолекулярные водородные связи и затрудняющие ее самоорганизацию в фибриллярные структуры. Показано, что лучшими реагентами для реакций комплексобразования с целлюлозой будут соединения с большим сродством к электрону или с отрицательной энергией нижней вакантной молекулярной орбитали.
Достоинством целлюлозы как потенциального компонента композитных материалов являются биоразлагаемость и ценные структурно-механические свойства. В последнее время особое внимание уделяют нанофибриллярной целлюлозе [1–3] из-за ее повышенной прочности, что обусловлено внутри- и межмолекулярными водородными связями макромолекул целлюлозы. При этом для обеспечения эффективного взаимодействия макромолекул фибриллярной наноцеллюлозы с матрицей дисперсионной среды решаются задачи, обеспечивающие последовательное замещение водной фазы исходных гидрогелей наноцеллюлозы на олеофильную, которая достигается подбором соответствующих растворителей, а также химическим модифицированием наноцеллюлозы, что может обеспечить ее гидрофобизацию. Эти задачи носят общий характер, они значимы при изготовлении нанокомпозитных полимерных материалов на основе наноцеллюлозы для применения в разных областях (строительной, нефтяной, конструкционной, авиационной и автомобильной, медицинской и др.). Наноцеллюлоза может входить в состав биоразлагаемых смазочных композиций в качестве органического загустителя. Известно [4, 5] об изготовлении биоразлагаемых пластичных смазок на основе наноцеллюлозы и растительных масел, что имеет исключительное значение для их возможного применения при низких температурах. В настоящее время в научной литературе опубликованы экспериментальные данные по структуре и свойствам целлюлозы и ее производных, интерпретация которых должна проводиться на основе фундаментальных представлений о структуре и свойствах вещества с привлечением современных методов квантовой химии.
Нативная целлюлоза – это полужесткоцепной аморфно-кристаллический полимер гидрофильной природы, имеющий сложную надмолекулярную структуру, простейший элемент которой – элементарная фибрилла. Фибрилла, в свою очередь, является ассоциатом макромолекул и имеет длину менее 1 мкм и поперечный диаметр 1.5–3.5 нм. Макромолекула целлюлозы представляет собой линейную цепочку, состоящую из последовательности элементарных пиранозных звеньев, в которой звенья D-глюкозы соединяются 1,4-β-гликозидными связями, но повернуты относительно друг друга на 180 град.
Таким образом, рассмотрение целлюлозы как представителя полужесткоцепного гидрофильного полимера в терминах химии высокомолекулярных соединений, с одной стороны, и аппарата квантовой химии, с другой, может оказаться полезным для характеристики возможных структур, образующихся при взаимодействии фрагментов макромолекул целлюлозы, спектральных свойств и влияния на них модификации целлюлозы с помощью соответствующих реагентов.
Следует отметить работу [8], в которой рентгеновский фотоэлектронный спектр (XPS) валентной зоны целлюлозы и лигнина интерпретируется на основе квантово-химических расчетов по методу функционала плотности (DFT). Показано, что в структуре валентной зоны до 10 эВ преобладает кислород, а в спектре при энергиях связи выше 13 эВ значителен вклад углерода. Авторы делают вывод о том, что анализ валентной зоны по данным метода DFT обеспечивает мощную основу для детальной интерпретации спектральных данных и позволяет глубже понять первопричины формирования спектров. В работе [9] методом DFT исследована электронная структура димеров целлюлозы и хитозана. Определены геометрические параметры структуры и различные дескрипторы реакционной способности, что представляется ценным при анализе реакционной способности этих соединений в различных реакциях нуклеофильного и электрофильного характера. В работе [10] для исследования электронной структуры модельных соединений целлюлозы и лигнина успешно применяются полуэмпирические квантово-химические методы – CNDO/2 и MINDO/3.
Цель данной работы заключается в моделировании методами квантовой химии и молекулярной механики конформационных структур как единичных фрагментов макромолекул целлюлозы, так и образующихся структур между фрагментами различных макромолекул целлюлозы, состоящих из нескольких линейных цепочек, включая исследование внутри- и межмолекулярных взаимодействий.
Для определения геометрических параметров, распределения электронной плотности и энергетических характеристик элементарного звена и димера целлюлозы (целлобиозы) применили квантово-химический метод функционала плотности DFT B3LYP/6-31G(d) с полной оптимизацией геометрических параметров и расчетом частот нормальных колебаний. Построение фрагмента линейной цепочки макромолекулы целлюлозы проводили поэтапно: на первом этапе создавали геометрическую структуру элементарного звена целлюлозы, в котором разорванные связи, обеспечивающие трансляцию элементарного фрагмента в составе макромолекулы, компенсировались атомами водорода или другим атомом X. Далее для оценки влияния водородных связей на конформацию единичных макромолекул и их взаимодействие между собой рассматривали структурные фрагменты макромолекулы целлюлозы как модельные структуры “линейной цепочки”, состоящие из 8 и 16 элементарных звеньев. Моделирование взаимодействия проводили для 2–4 линейных цепочек. Для расчетов конформации использовали метод молекулярной механики UFF (Universal Force Field), который позволяет по компьютерной программе [11] находить минимум полной энергии и проводить оптимизацию геометрических параметров.
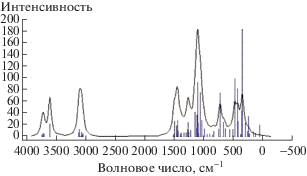
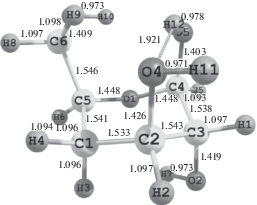
Результаты расчетов геометрических параметров, распределения электронной плотности и энергетических характеристик элементарного звена целлюлозы (рис. 1), полученные методом функционала плотности DFT B3LYP/6-31G(d), приведены в таблице.
Таблица 1.
Результаты расчета электронной структуры элементарного фрагмента целлюлозы методом DFT B3LYP/6-31G(d)
| Порядок связей в структурном фрагменте | Малликеновский эффективный заряд на атомах | Значение термодинамического параметра |
|---|---|---|
 |
С1 = –0.318 | CV = 41.7 кал/моль К |
| С2 = 0.085 | S = 99.3 кал/моль К | |
| С3 = 0.092 | Z = 122.3 ккал/моль | |
| С4 = 0.294 | E0 = –611.739968 а.е.* | |
| С5 = 0.112 | E = –611.729380 а.е. | |
| С6 = –0.050 | H = –611.728436 а.е. | |
| О1 = –0.508 | G = –611.775604 а.е. | |
| О2 = –0.631 | Eelec = –611.9348497 а.е. | |
| О3 = –0.622 | Ев.з. = –7.0 Эв | |
| О4 = –0.634 | Ен.в.. = 1.5 Эв | |
| О5 = –0.644 |
Вычислены энергии:
где ${{E}_{{elec}}}$ – электронная энергия молекулы, ZPE – энергия нулевых колебаний, ${{E}_{{vib}}}$ – колебательная энергия молекулы при температуре Т = 298 К, ${{E}_{{rot}}}$ – вращательная энергия, ${{E}_{{transl}}}$ – поступательная энергия, Н – энтальпия, S – энтропия, G – cвободная энергия Гиббса.Как видно из таблицы, максимальный отрицательный заряд имеют атомы кислорода гидроксильных групп, способные образовывать водородные связи. Значения термодинамических параметров могут быть использованы для оценки вероятности протекания реакций модификации структуры с помощью различных функциональных групп. Также приведены энергии верхней занятой Ев.з и нижней вакантной Ен.в молекулярных орбиталей. Значение Ен.в > 0 означает, что пребывание электрона на этой орбитали энергетически невыгодно и, попав на нее при возбуждении, электрон будет стремится покинуть молекулу, т.е. молекула будет являться донором электрона. Следовательно, целлюлоза может вступать в реакции с электрофильными центрами молекул – акцепторами электронов: участвовать в реакциях нуклеофильного замещения и образовывать комплексы с донорно-акцепторной связью [13].
Путем расчета частот нормальных колебаний с использованием вторых производных подтверждено, что точки стационарности, определенные при оптимизации геометрии, являются минимумами энергии, что отражено на рис. 1 в виде колебательного спектра в средней ИК-области. Анализ расчетного ИК-спектра целлюлозы показывает, что валентным колебаниям связей соответствуют следующие области волновых чисел (см–1): 3598 – связи О–Н, 3078 – связи С–Н и 1030 – связи С–С. Волновые числа в области 1500 см–1 и ниже соответствуют сложным комбинированным колебаниям связей глюкопиранозного кольца и деформационным колебаниям С–Н-, С–О- и О–Н-связей. Сравнительный анализ расчетного и представленных в многочисленных работах российских и зарубежных авторов экспериментальных ИК-спектров для различных видов целлюлозы [12–17] показывает, что из-за множества факторов, в первую очередь, больше из-за различия в конформации макромолекул, чем в кристалличности структуры полимера, наблюдаются существенные различия в реальных спектрах целлюлозы, при этом полосы поглощения в экспериментальных спектрах могут быть смещены относительно указанных в расчетном спектре [15].
Поэтому для трактовки экспериментальных данных, в том числе спектральных, важна теоретическая оценка энергетических характеристик макромолекул целлюлозы, а именно: энергии внутримолекулярных водородных связей, которые влияют на термодинамическую гибкость линейной цепочки, и межмолекулярных взаимодействий между цепочками за счет водородных связей. Оценку этих величин проводили на модельных структурах “линейной цепочки”, состоящей из элементарных звеньев n = 8 Н–(С6Н10О5)8–Н и n = 16 Н–(С6Н10О5)16–Н соответственно. Расчеты проводили по методу “молекулярной механики” с параметризацией UFF (Universal Force Field) по компьютерной программе [11], с оптимизацией геометрических параметров. Метод применим для расчета поверхности потенциальной энергии молекул с включением практически всех атомов периодической системы элементов и учетом их валентного состояния (гибридизации валентных оболочек) и атомного окружения. Для расчета полной энергии молекулы Е используются уравнения, содержащие набор параметров, включающих растяжение связей, деформацию валентных и торсионных углов, а также ван-дер-ваальсовых взаимодействий:
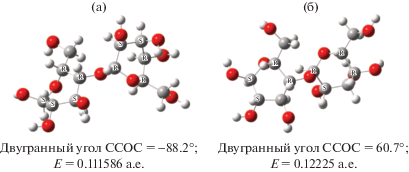
При расчете разности энергий двух состояний ΔЕ допущенные погрешности в расчетной схеме “устраняются”. На рис. 2 приведены результаты расчета вращения звеньев в димере линейной части макромолекулы целлюлозы (или целлобиозе) относительно С–О-связи по торсионному углу. Найдены два минимума по энергии: первый минимум E = 0.111586 a.e. соответствует транс-конформации, второй E = 0.12225 a.e. – цис-конформации. Разность энергии конформаций ∆Е = = Е(цис) – Е(транс) показывает, что транс-конформация на 6.7 ккал/моль устойчивее, чем цис-конформация.
Оценку энергий межмолекулярных взаимодействий в качестве примера проводили на модельных структурах “линейной цепочки”, состоящей из n = 8 и 16 элементарных звеньев: Н–(С6Н10О5)8–Н и Н–(С6Н10О5)16–Н. Оптимизированные структуры исходной “линейной цепочки” при n = 8 (соответствует четырем димерам) и 16 (соответствует восьми димерам) представлены соответственно на рис. 3, а и б. Полная энергия при n = 8 при минимуме равна Е1 = 0.7540808 а.е. Как видно из рис. 3, в обоих случаях наблюдается “скручивание” линейной структуры за счет формирования внутримолекулярных водородных связей с формированием более устойчивых в энергетическом отношении конформаций. При скручивании длина структурного фрагмента из восьми звеньев укоротилась от 40 до 27Å. Как показано на рис. 4, а, длины внутриводородных связей ${\text{Н }} \cdots {\text{О }}$ в местах скручивания линейной структуры составляют 1.7–2.5 Å. При этом существенно искажается структура 6-членного кольца. В линейной (“нескрученной”) части молекулы расстояние между мостиковыми кислородными атомами составляет $4.6 \cdots 5.4\,{{\AA}}$, а в местах образования водородной связи – $2.6 \cdots 3.0\,{{\AA}}$. Длины связей мостикового кислорода с углеродными атомами практически не меняются и составляют 1.43 Å. Приведенный пример показывает, что наблюдаемые конформации фрагментов макромолекулы целлюлозы из-за большого размера моделируемой системы атомов и наличия одинарных С–О–С химических гликозидных связей между соседними звеньями элементарных фрагментов и внутримолекулярных взаимодействий описываются многочисленными локальными минимумами с соответствующей геометрией и мало отличаются по энергии. Переходы между ними могут осуществляться по “термическому” механизму. Следовательно, экспериментально измеряемые физико-химические величины, особенно спектральные данные, будут чувствительными к температурным изменениям.
Рис. 3.
Оптимизированные структуры “линейных цепочек”, состоящие из: восьми (а) и шестнадцати (б) элементарных звеньев: Н–(С6Н10О5)8–Н, Н–(С6Н10О5)16–Н.
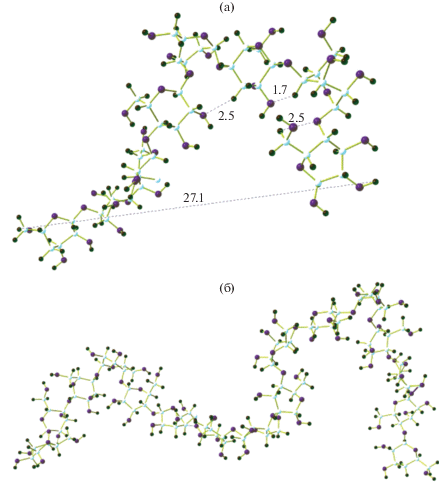
Рис. 4.
Влияние концевых групп X = –Н, –СООН, –COH в структурных фрагментах Х–(С6Н10О5)8–Х на энергию межмолекулярных взаимодействий ∆Е в их димерах [Х–(С6Н10О5)8–Х]2.
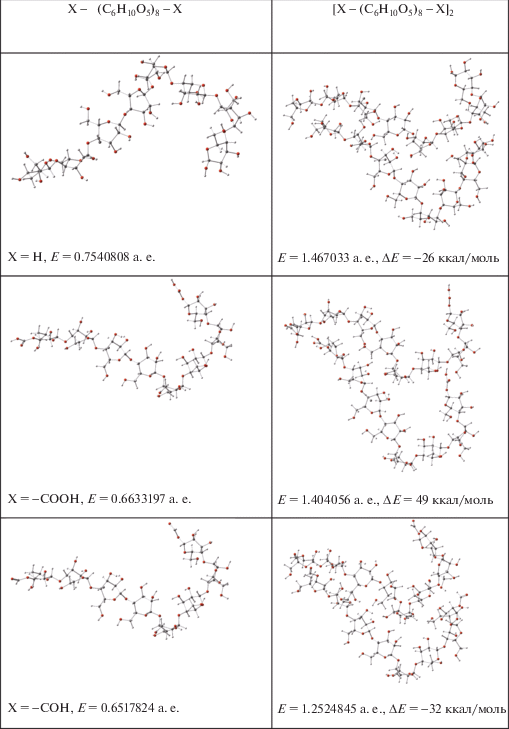
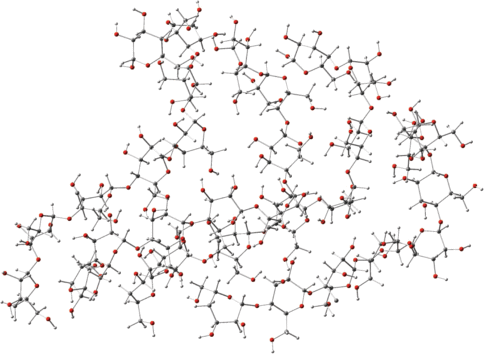
Рис. 5.
Оптимизированная структура четырех взаимодействующих фрагментов молекул целлюлозы с брутто-формулами Н–(С6Н10О5)8–Н.
Проведено моделирование взаимодействия двух и четырех структурных фрагментов макромолекулы целлюлозы, состоящих из восьми элементарных звеньев (или четырех димеров) между собой. В рамках рассмотренной модели исследовано влияние концевых групп X = –Н, –СООН, –COH в структурных фрагментах Х–(С6Н10О5)8–Х на энергию межмолекулярных взаимодействий ∆Е в их димерах [Х–(С6Н10О5)8–Х]2. Энергия межмолекулярных взаимодействия вычислялась по формуле
На рис. 4 представлена оптимизированная структура двух взаимодействующих фрагментов макромолекул с брутто-формулами Х–(С6Н10О5)8–Х, где X = –Н, –СООН, –COH, приведены энергии фрагментов Е и энергии межмолекулярных взаимодействий ∆Е. Как следует из данных рис. 4, энергии межмолекулярных взаимодействий ∆Е существенно зависят от природы концевых групп и при X = –Н, –СООН, –COH составляют –26, 49 и –32 ккал/моль соответственно.
На рис. 5 представлена оптимизированная структура четырех взаимодействующих модельных молекул с полной энергией Е4 = 2.834858 а.е. Энергия межмолекулярных взаимодействий составляет
Как видно из приведенных данных, энергия межмолекулярных взаимодействий не аддитивно зависит от числа взаимодействующих фрагментов.
ВЫВОДЫ
Проведенные модельные исследования энергетических и геометрических параметров структурных фрагментов макромолекулы целлюлозы на основе квантово-химических расчетов показывают, что:
различия расчетного и экспериментальных ИК-спектров нативной целлюлозы обусловлены главным образом различиями в конформации ее макромолекул и как следствие формировании надмолекулярной структуры различной формы;
для предотвращения структурного перехода в конформацию клубка необходимо обеспечить замену атомов водорода гидроксильных или концевых групп макромолекулы целлюлозы на функциональные группы, не образующие внутримолекулярные водородные связи и затрудняющие ее самоорганизацию в фибриллярные структуры;
лучшими реагентами для реакций комплексобразования с целлюлозой будут соединения с большим сродством к электрону или с отрицательной энергией нижней вакантной молекулярной орбитали.
Эти выводы получили подтверждение во многих статьях, в которых приводятся практические рекомендации, направленные на химическую модификацию целлюлозы [18–20] с помощью реакций этерификации, ацилирования и др.
Список литературы
Bledzki A.K., Gassan J. // Prog. Polymer Sci. 1999. V. 24. № 2. P. 221. http://dx.doi.org/https://doi.org/10.1016/S0079-6700(98)00018-5
Mohanty A.K., Misra M., Hinrichsen G. // Macromolec. Mater. Eng. 2000. V. 276. № 1. P. 1. https://doi.org/ https://doi.org/10.1002/(SICI)1439-2054(20000301)
Moon R.J., Martini A., Nairn J., Simonsen J., and Youngblood J. // Chem. Soc. Rev. 2011. V. 40. № 7. P. 3941. http://dx.doi.org/https://doi.org/10.1039/C0CS00108B
Martin-Alfonso J.E., Nunez N., Valencia C., Franco J.M., Diaz M.J. // J. Industr. Eng. Chem. 2011. № 17. P. 818. https://doi.org/https://doi.org/10.1016/j.jiec.2011.09.003
Sanchez R., Franco J.M., Delgado M.A., Valencia C., Gallegos C. // Carbohydrate Polymers. 2011. V. 83. P. 151. https://doi.org/https://doi.org/10.1016/j.carbpol.2010.07.033
Nevell T.P., Zeronian S.H. Cellulose chemistry and its applications. New York: Wiley, 1985.
Battista O.A. // Industr. Eng. Chem. 1950. V. 42. № 3. P. 502. https://doi.org/10.1021/ie50483a029
Thomas Haensel, Markus Reinmöller, Pierre Lorenz, Wichard J. D. Beenken, Stefan Krischok, Syed Imad-Uddin Ahmed // Cellulose. 2012. V. 19. Issue 3. P 1005. https://doi.org/https://doi.org/10.1007/s10570-012-9681-9
Feride Akman // Cellulose Chem. Technol. 2017. V. 51. № 3–4. P. 253.
Кочева Л.С. Структурная организация и свойства лигнина и целлюлозы травянистых растений семейства злаковых. Автореф. дис. … д-ра хим. наук. Архангельск, АГТУ. 2008. 42 с.
GAMESS v.7.1. Granovsky A.A. (http: //classic.chem.msu.su /gran/ games /index.html)
Иванов-Омский В.И., Герасюта С.М., Иванова Е.И. // Изв. Санкт-Петербургской лесотехнической академии. 2017. Вып. 218. С. 199. https://doi.org/10.21266/2079-4304.2017.218.199-210
Kačuráková M., Wilson R.H. // Carbohydrate Polymers. 2001. V. 44. № 4. P. 291. http://dx.doi.org/https://doi.org/10.1016/S0144-8617(00)00245-9
Ali M. et al. // Polymer. 2001. V. 42. № 7. P. 2893. https://doi.org/https://doi.org/10.1016/S0032-3861(00)00691-1
Нугманов О.К., Григорьева Н.П., Лебедев Н.А. // Химия растительного сырья. 2013. № 1. С. 40.
Langkilde F.W., Svantesson A. // J. Pharmaceut. Biomed. Anal. 1995. V. 13. № 4–5. P. 409. https://doi.org/https://doi.org/10.1016/0731-7085(95)01298-Y
Jiang J.H. et al. // Anal. Chem. 2002. V. 74. № 14. P. 3555. https://doi.org/10.1021/ac011177u
Peng B.L., Dhar N., Liu H.L., Tam K.C. // Canad. J. Chem. Eng. 2011. V. 89. № 5. P. 1191. https://doi.org/https://doi.org/10.1002/cjce.20554
Eichhorn S. J. et al. Current international research into cellulose nanofibres and nanocomposites // J. Mater. Sci. 2010. V. 45. № 1. P. 1. https://doi.org/https://doi.org/10.1007/s10853-009-3874-0
Dufresne A. // Current Opinion in Colloid & Interface Sci. 2017. V. 29. P. 1. https://doi.org/10.1016/j.cocis.2017.01.004
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива