Химия твердого топлива, 2019, № 5, стр. 58-62
ДИФФЕРЕНЦИАЛЬНО-СКАНИРУЮЩАЯ КАЛОРИМЕТРИЯ АНТРАЦИТА, ГРАФИТА И СОЛЕЙ КАЛЬЦИЯ
А. Н. Лопанов 1, *, Н. С. Кобзева 1, **, Е. А. Фанина 1, ***, Н. В. Нестерова 1
1 ФГБОУ ВО Белгородский государственный технологический университет имени В.Г. Шухова
308012 Белгород, Россия
* E-mail: alopanov@yandex.ru
** E-mail: chemiezem@yandex.ru
*** E-mail: evgenia-@mail.ru
Поступила в редакцию 17.12.2018
После доработки 17.04.2019
Принята к публикации 03.06.2019
Аннотация
Установлено, что смещение равновесия в сторону образования карбида кальция для системы графит–оксид кальция можно наблюдать при температуре 900°С, что обусловлено образованием летучего вещества – оксида углерода (II). Максимум разложения карбоната кальция при добавлении антрацита снижается с 813 до 780°С, эндотермический эффект образования карбида кальция проявляется в области 1350°С. Для смеси хлорида кальция с антрацитом или графитом в стехиометрических количествах при 1100°С наблюдали образование карбида кальция и четыреххлористого углерода. Образование карбида кальция подтверждено химическими реакциями продуктов пиролиза с водой (выделение ацетилена) и расчетами потери массы термогравиметрической кривой.
ВВЕДЕНИЕ
Углерод образует большое количество модификаций, отличающихся по надмолекулярной структуре, строению, величинам энергий связи между атомами. Так, высказано предположение, что углерод может образовать напряженные молекулярные структуры с общей формулой Сn, которые достаточно устойчивы и могут существовать длительное время без изменений, что показано методами молекулярного моделирования [1, 2]. В напряженных формах углерода энтальпия образования больше нуля и может достигать величин 11 – 33 кДж/кг. Энергия, выделяющаяся при переходе напряженного углерода в стабильную фазу графита, значительна, по удельным энергетическим характеристикам напряженный углерод может конкурировать с системами водородной энергетики.
Основная задача создания технологии напряженного углерода – разработка методов его получения, но в технологии напряженного углерода не решены фундаментальные проблемы, такие как стабилизация напряженных углеродных модификаций, определение условий, при которых происходит изменение орбитальной симметрии в процессе превращения веществ. Несмотря на термодинамическую неустойчивость напряженного углерода, некоторые соединения могут быть достаточно стабильны, так как при переходе в наиболее выгодное энергетическое состояние не всегда сохраняется орбитальная симметрия электронных состояний. Еще в 1965 г. Р. Вудворд и Р. Хоффман подтвердили гипотезу, что реакция протекает легко, когда существует соответствие между характеристиками орбитальной симметрии реагентов и продуктов реакции [3]. Если такого соответствия нет, реакция идет с трудом, что важно для кинетики превращения напряженного углерода в графит. Принцип можно сформулировать для синхронных процессов: как правило, в синхронных реакциях сохраняется орбитальная симметрия молекулярных связей. Синтезируя напряженный углерод, содержащий тройные связи, происходит изменение типа гибридизации, что сказывается на энергии химической связи углерод–углерод (графит – тип гибридизации sp2, напряженный углерод – тип гибридизации sp). Например, для аллотропной модификации углерода–алмаза при температуре более 2100 K превращение в графит происходит за секунды. Алмаз является термодинамически нестабильным соединением, но устойчив в стандартных условиях [4].
В карбиде кальция связь между атомами углерода напряжена, поэтому авторы статьи поставили своей целью выявление закономерностей взаимодействия графита, антрацита с солями кальция CaCl2, CaCO3 при температурах до 1400°С. Указанные закономерности обусловлены изменением параметров орбитальной симметрии атомов углерода, что можно использовать в технологии напряженного углерода, синтезируемого через карбиды металлов. Более того, переходные формы углерода, классификация которых предложена в [5], находят широкое применение во многих технологических процессах, в частности в технологии получения карбидов при взаимодействии угля (антрацита), другого углеродного вещества с металлами или оксидами. Работа актуальна и для совершенствования технологии карбида кальция. Несмотря на то, что технология карбида кальция достаточно исследована, оптимизация технологического процесса, расширение сырьевой базы углеродных веществ являются важными направлениями. Карбид кальция – это сырье для производства ацетиленовой сажи, продуктов органического синтеза, применяется в металлургии, сельском хозяйстве при производстве регулятора роста растений, объемы его производства растут ежегодно.
Термическая обработка углеродных веществ и изменение энергии связи между атомами углерода при синтезе карбидов. Как правило, первичная стадия технологии карбидов связана с термической обработкой углеродных веществ, поэтому процессы, протекающие при высокой температуре углеродных веществ (антрацита), имеют большое значение. Пиролиз углей достаточно хорошо исследован, обзор по пиролизу углей, начиная с 30-х годов прошлого столетия, выполнен Т.А. Кухаренко [6]. Автор ссылается на работы Райли, Ван-Кревелена, Уиллера (H.L. Riley, D.W. van Krevelen, R.V. Wheeller), в которых исследован пиролиз углей в вакууме. Термический анализ донецких углей впервые выполнен в [7], где показано, что антрациты имеют достаточно монотонные дифференциальные кривые, а выход летучих заканчивается при температуре 850–900°С. Следует отметить, что измерения, выполненные в раннем периоде развития термогравиметрического метода анализа, не проводились в атмосфере инертных газов и в режиме дифференциально-сканирующей калориметрии.
Разработаны различные технологии карбидов металлов, различающихся структурой, количеством примесей [8]. Так, в дуговом разряде с графитовыми электродами можно получать карбиды кальция, железа, кремния, титана, вольфрама [9]. Карбид кремния высокой чистоты получают термическим разложением полиметилсилана в атмосфере инертного газа аргона при относительно невысоких температурах [10, 11]. Для получения карбида кремния высокой чистоты применяют ацетилен и кремний [12, 13].
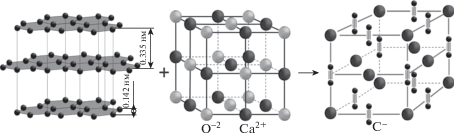
Физические и химические свойства карбидов исследованы и систематизированы по различным признакам. Все структурные типы карбидов разделяют на четыре группы в соответствии с расположением атомов углерода в кристаллической решетке – карбиды с изолированными атомами углерода, изолированными парами атомов углерода, цепями из атомов углерода, сетками из атомов углерода [14]. В отдельных случаях карбиды классифицируют по химическим свойствам в реакциях взаимодействия с водой – если в процессе реакции выделяется ацетилен, то их рассматривают как продукты замещения атомов водорода в ацетилене (карбиды щелочноземельных металлов). При выделении метана (карбиды бериллия и алюминия) – это продукты замещения атомов водорода в метане. Для карбидов редкоземельных элементов характерны реакции с выделением смеси углеводородов, а при взаимодействии карбида магния с водой образуется метилацетилен [15]. Как указано, классификация карбидов должна отражать характер химических связей, но в большинстве работ отсутствуют параметры, связанные с орбитальной симметрией химических связей, отражающих возможность получения и устойчивость напряженных структур углерода. Например, при синтезе карбида кальция из графита и оксида кальция между атомами углерода образуются напряженные тройные связи, что сказывается на энтальпии образования соединений (рис. 1). Сравнивая энтальпии образования различных карбидов – BeC2, Аl3C4, MgC2, CaC2, BaC2, равные –240; –196; –88; –59; –51 кДж/моль, соответственно [14], можно отметить, что в соединениях с напряженной тройной химической связью между атомами углерода энтальпия образования выше, чем в соединениях, которые можно рассматривать как продукты замещения атомов водорода в метане. Энтальпии образования метана и ацетилена соответственно –74.85; +226.75 кДж/моль [16]. В метане реализовано состояние с наименьшей энергией химических связей, соответствующих sp3-гибридизации электронного облака атома углерода. Следовательно, если химическая связь между атомами углерода напряжена, то энтальпия образования карбидов металлов увеличивается, что можно использовать в дальнейшем в технологии получения напряженного углерода.
ОБЪЕКТЫ, МЕТОДЫ ИССЛЕДОВАНИЯ, АППАРАТУРА
Для проведения измерений применяли синхронный термический анализатор “STA 449 F1 Jupiter” с разрешением сигнала по гравиметрии (ТГ) 0.025 мкг. Измерения проводили в атмосфере аргона в режиме дифференциально-сканирующей калориметрии (ДСК). Скорость нагрева образцов составляла 10 град/мин. Перед основным измерением снимали кривые коррекции – ДСК и ТГ, при измерении которых в держателе образца находился тигель без вещества. В качестве объектов исследования использовали спектральный графит С-3 с содержанием углерода более 99%, ТУ 3497-001-51046676-2008(ООО “НПО Графит гарант”) [17], антрацит с зольностью 4.0% ( табл. 1, 2). Карбонат кальция, хлорид кальция использовали квалификации “химический чистый”.
Таблица 2.
Содержание примесей в спектральном графите С-3 [17]
| Наименование примеси | Содержание примеси, % |
|---|---|
| Бор (B) | 5 ⋅ 10–4 |
| Железо (Fe) | 2 ⋅ 10–4 |
| Марганец (Mn) | 2 ⋅ 10–5 |
| Медь (Cu) | 6 ⋅ 10–5 |
| Кальций (Ca) | 5 ⋅ 10–5 |
| Кремний (Si) | 4 ⋅ 10–4 |
| Алюминий (Al) | 5 ⋅ 10–5 |
| Титан (Ti) | 1 ⋅ 0–4 |
| Ванадий (V) | 2 ⋅ 10–5 |
| Никель (Ni) | – |
| Серебро (Ag) | – |
| Магний (Mg) | 4 ⋅ 10–5 |
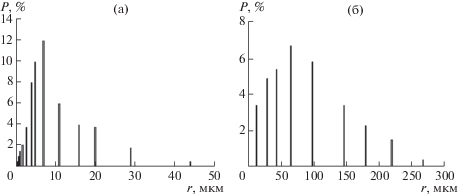
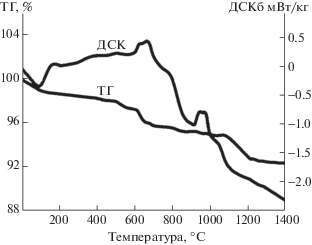
Распределение частиц по размерам определяли на лазерном анализаторе частиц “Микросайзер 201 С” (рис. 2). Основная доля фракций по размерам для графитов и антрацитов находится в пределах 1–15; 5–150 мкм соответственно. Перед проведением основного эксперимента проводили съемку кривых ДСК, ТГ антрацита. На антраците кривые ДСК и ТГ имеют сложный вид (рис. 3). Эндотермический эффект при 80–180°С соответствует потере сорбционной и связанной воды (до 2 мас. %). Далее до 600°С следует последовательность сложных превращений, соответствующих возможному выходу летучих веществ и реакций органических компонентов антрацита. Вероятно, что эндотермический эффект при температурах 850–950°С в атмосфере аргона обусловлен изменением структуры углеродной массы антрацита. Если в изотермических условиях в вакууме потеря массы прекращается при температуре 850–900°С [7], то при скорости нагрева 10 град/мин в атмосфере аргона потеря массы антрацита прекращается при температуре 1200°С. Установлено, что процесс термической деструкции каменных углей заключается в отщеплении атомных групп из боковых цепей элементарных структурных единиц с одновременным протеканием процесса поликонденсации в ядерной части, росте размеров углеродных сеток и упорядочении их пространственного положения [18].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
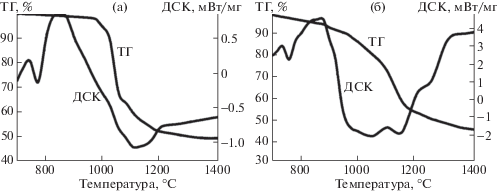
На рис. 4 представлены кривые ДСК и ТГ графита и антрацита в смеси с карбонатом кальция в области температур 700–1400°С. Массовая доля карбоната кальция составляла 67.5%, что несколько меньше, чем по стехиометрии (73.5%) в соответствии с формальной схемой процессов:
Рис. 4.
Дифференциально-сканирующая калориметрия графитов (а) и антрацитов (б) c карбонатом кальция.
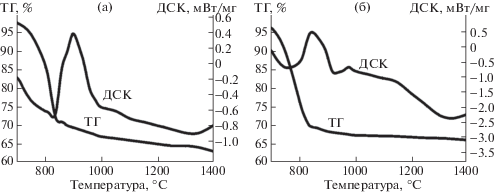
Меньшее количество карбоната кальция, взятое для исследования, обусловлено тем, что тепловые эффекты, связанные с химическим взаимодействием оксида кальция и графита, при большем содержании CaCO3 менее выражены и труднее поддаются интерпретации.
В смеси карбонат кальция–графит эндотермический эффект, соответствующий разложению CaCO3, начинается при температуре 700°С, достигает пика при 813°С и заканчивается при температуре 880°С (рис. 4, а). Существенно, что потеря массы продолжается вплоть до 1400°С, кривая ДСК резко снижается при температуре 880°С, что может быть вызвано не только увеличением теплоемкости компонентов, но и эндотермической реакцией образования карбида кальция. Как правило, в промышленности карбид кальция получают при температуре более 1900°С, но как следует из анализа кривых ДСК, ТГ смещение равновесия в сторону образования карбида кальция можно наблюдать при температуре 900°С, что вызвано образованием летучего вещества – оксида углерода (II). Вероятно, в соответствии с правилами смещения равновесия, в вакууме процесс получения карбида кальция можно реализовать при более низких температурах.
В отличие от системы графит–карбонат кальция, в случае замены графита на антрацит, максимум разложения карбоната кальция снижается с 813 до 780°С, эндотермический эффект образования карбида кальция проявляется более отчетливо в области 1350°С. Для антрацита в атмосфере аргона потеря массы заканчивается при 1200°С, но в смеси с карбонатом кальция потеря массы продолжается при более высоких температурах вследствие образования оксида углерода (II).
Для смеси графит–хлорид кальция (рис. 5, а) наблюдали два эндотермических эффекта при температурах 768, 1100°С, соответствующих плавлению хлорида кальция и образованию карбида кальция по формальной схеме:
Потеря массы, соответствующая началу реакции, наблюдается при температуре 900°С. В указанной области температур процесс перехода жидкого хлорида кальция в пар незначителен, так как температура кипения хлорида кальция равна 1600°С [16]. Максимум эндотермического эффекта, как указано выше, лежит в области 1100°С, что на 500°С ниже, чем температура кипения хлорида кальция. Вероятно, при указанных температурах происходит диссоциация четыреххлористого углерода (температура разложения четыреххлористого углерода – 500–600°С), но суммарная формальная схема процесса не меняется.
В отличие от системы графит–хлорид кальция в смеси антрацит–хлорид кальция, (рис. 5 , б) наблюдали начало потери массы, соответствующей образованию карбида кальция, при 850°С. Кривая ТГ имела более пологий вид – на два эндотермических эффекта при температурах 1013, 1131°С накладывается широкий эндотермический эффект образования карбида кальция.
Существует общая закономерность изменения кривых ДСК, заключающаяся в их снижении при температурах свыше 900–1000°С. Указанная особенность обусловлена несколькими причинами. Во-первых, увеличением теплоемкости веществ с повышением температуры [2]. Во-вторых, происходит образование новой структуры, в которой углерод меняет вид орбитальной симметрии и образует напряженные химические связи между атомами углерода (рис. 1). Процесс образования напряженных структур углерода требует энергетических затрат, что проявляется на кривых ДСК.
В целом, можно отметить, что формальные схемы образования карбида кальция достаточно обоснованы, так как при взаимодействии продуктов пиролиза с водой наблюдали выделение ацетилена.
ВЫВОДЫ
1. Проведенное исследование важно для понимания процесса получения карбида кальция, а также расширения сырьевой базы технологии карбида кальция. В частности, показана возможность получения карбида кальция и четыреххлористого углерода при взаимодействии хлорида кальция с графитом, антрацитом при температуре 1100°С.
2. На антрацитах кривые ДСК и ТГ имеют сложный вид, что свидетельствует о последовательности превращений, соответствующих выходу летучих веществ и химических реакций органических компонентов антрацита.
3. Установлено, что смещение равновесия в сторону образования карбида кальция для системы графит–оксид кальция можно наблюдать при температуре 900°С, что обусловлено образованием летучего вещества – оксида углерода (II).
4. Максимум разложения карбоната кальция при добавлении антрацита снижается с 813 до 780°С, эндотермический эффект образования карбида кальция проявляется в области 1350°С.
5. Образование карбида кальция подтверждено химическими реакциями продуктов взаимодействия графита, антрацита с солями кальция и водой – наблюдалось выделение ацетилена, и расчетами потери массы по термогравиметрической кривой.
Список литературы
Лопанов А.Н., Фанина Е.А. // ХТТ. 2015. № 2. С. 41. [Solid Fuel Chemistry, 2015, vol. 49. no. 2, P. 99. DOI: 10.3103/S036152191502007X]https://doi.org/10.7868/S0023117715020073
Лопанов А.Н. Молекулярное моделирование переходных форм углерода. Циклоэнергетика: монография. Белгород. Изд-воБГТУ. 2013. 183 с.
Woodward R.B., Hoffmann R. The Conservation of Orbital Symmetry / Verlag Chemie and Academic Press. Weinheimand New York. 1970. 177 p.
Некрасов Б.В. Основы общей химии. В 2 т. СП(б): изд. “Лань”. 2003. Т. 1. С. 499.
Касаточкин В.И. // Переходные формы углерода. М.: Наука, 1969. С. 7.
Кухаренко Т.А. Химия и генезис ископаемых углей. М.: Госгортехитздат, 1960. С. 211–229.
Климов Б.К., Канавец П.И., Чибисова К.И. Термический анализ торфа и каменных углей // Тр. 1-го Всесоюзн. Совещ. по термографии. М.–Л.: Изд-во АН СССР, 1955. С. 57.
Стормс Э. Тугоплавкие карбиды. М.: Атомиздат, 1970. 304 с.
Подгорный В.И., Белашев Б.З., Осауленко Р.Н. // Журн. техн. физики. 2013. Т. 83. Вып. 7. С. 77.
Борунова А.Б., Стрелецкий А.Н., Мудрецова С.Н. // Коллоидный журн. 2011. Т. 73. № 5. С. 599.
Симоненко Е.П., Симоненко Н.П., Дербенев А.В. // Журн. Неорган. химии. 2013. Т. 58. № 10. С. 1279.
Pitcher M.W., Joray S.J., Bianconi P.A. // Advanced Materials. V. 16. № 4. 2004. P. 706.
Bunsell A.R., Piant A. // J. Materials Science. 2006. V. 41. P. 823.
Косолапова Т.Я. Карбиды. М.: Металлургия, 1968. 300 с.
Краткая химическая энциклопедия. М.: Советская энциклопедия, Т. III. 1964. С. 424.
Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Химия, 1978. С. 128, 162.
Графит спектральный [Электронный ресурс] // ООО НПО Графит Гарант.URL:http://grafit-garant.ru/grafit/us / (дата обращения 25.01.2019).
Глущенко И.М. Термический анализ твердых топлив. М.: Металлургия, 1968. 192 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива