Химия твердого топлива, 2020, № 1, стр. 63-70
АДСОРБЦИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ НА ГРАНУЛИРОВАННОМ АКТИВИРОВАННОМ УГЛЕ
С. А. Кулайшин 1, *, М. Д. Веденяпина 1, **, Л. Р. Шарифуллина 2, ***, А. Л. Лапидус 1, ****
1 ФГБУН Институт органической химии имени Н.Д. Зелинского РАН
119991 Москва, Россия
2 ФГБВОУ ВО “Академия гражданской защиты МЧС России”
141435 Химки, Россия
* E-mail: S.Kulaishin@mail.ru
** E-mail: mvedenyapina@yandex.ru
*** E-mail: alishari@yandex.ru
**** E-mail: albert@ioc.ac.ru
Поступила в редакцию 29.07.2019
После доработки 17.09.2019
Принята к публикации 04.10.2019
Аннотация
Изучены адсорбция типичного гербицида 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) из его водного раствора на гранулированном активированном угле (ГАУ), кинетика адсорбции 2,4-Д на ГАУ, а также его порометрические характеристики и микроструктура. Показана высокая адсорбционная способность 2,4-Д на ГАУ.
ВВЕДЕНИЕ
Использование органических веществ, применяемых для борьбы с сорной растительностью, приводит к их широкому распространению в поверхностных и подземных водах [1]. Одним из эффективных способов извлечения подобных загрязнителей природных и сточных вод является использование активированных углей с высокой адсорбционной емкостью [2–5]. Ранее в работе [6] были исследованы три образца гранулированного активированного угля с целью доочистки сточных вод на очистных сооружениях города Ганновера (Германия). При использовании основного метода очистки не происходит полного удаления тяжелых металлов и биологически активных органических соединений [6]. Так при использовании метода очистки флотацией растворенного воздуха (Dissolved air floatation, DAF) показатель химического потребления кислорода (ХПК, chemical oxygen demand, COD), определяющий содержание биологически активных органических веществ, снижается только на 27%. Высокий показатель ХПК авторы связывают с содержанием веществ, не подверженных биоразложению, поэтому необходимо использование дополнительной очистки. Одним из эффективных методов для дополнительной очистки является метод адсорбции [2–5]. К биологически активным органическим веществам относятся лекарственные препараты, красители, гербициды. Адсорбенты, исследованные в работе [6], показали свою высокую адсорбционную активность по отношению к тяжелым металлам и биологически активным соединениям. Для адсорбции 2,4-Д был исследован образец GAC-2 (ГАУ), обладающий развитой удельной поверхностью и большим объемом пор. По данным работы [7], адсорбенты с такими характеристиками наиболее подходящие для адсорбции биологически активных органических молекул. Известно [8], что поверхностные группы гидроксидов железа на поверхности активированных углей способствуют адсорбции тяжелых металлов. Однако в литературе практически отсутствуют данные по адсорбции биологически активных соединений с использованием активированных углях, содержащих поверхностные группы гидроксидов железа. В связи с этим целью данной работы было исследование образца ГАУ для адсорбции типичного гербицида 2,4-дихлорфеноксуксусной кислоты (2,4-Д).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали 2,4-Д фирмы “Sigma-Aldrich Chemie”:
Был использован гранулированный активированный уголь (ГАУ) фирмы “Wasserchemie” GmbH & Co. KG (производства Германии).
Величину удельной поверхности и пористую структуру ГАУ определяли на объемной вакуумной статической установке ASAP 2020M “Micromeritics” с использованием низкотемпературной адсорбции азота при 77 K. Текстурные характеристики образцов рассчитывали из изотерм адсорбции–десорбции с применением сервисной DFT-программы “Micromeritics” к прибору ASAP-2020М.
Для приготовления растворов 2,4-Д использовалась дистиллированная вода. Адсорбцию 2,4-Д (с0 = 25–200 мг/л) на углях проводили в конической колбе при постоянном перемешивании на магнитной мешалке (150 об/мин) при комнатной температуре. Концентрацию гербицида после адсорбции (се) определяли методом УФ-спектроскопии по поглощению при 283 нм на приборе Hitachi U-1900.
Наличие функциональных групп на поверхности ГАУ определяли методом ИК-спектроскопии при помощи ИК-фурье-спектрометра Bruker Alpha. Образец в протертом виде массой 1 мг смешивали с KBr (из монокристалла) и помещали под пресс, затем пластинку с прессованным веществом исследовали на пропускание ИК-излучения.
Структура поверхности углей изучалась методом электронной микроскопии. Оптимизация аналитических измерений проведена в рамках описанного ранее подхода [9]. Перед съемкой образцы помещали на поверхность алюминиевого столика диаметром 25 мм, фиксировали при помощи проводящей липкой ленты. Морфология образцов исследовалась в нативных условиях, чтобы исключить поверхностные эффекты от напыления проводящего слоя [10]. Микроструктуру образцов изучали методом сканирующей электронной микроскопии с полевой эмиссией (FE-SEM) на электронном микроскопе Hitachi SU8000. Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 2–15 кВ и рабочем расстоянии 8–11 мм. ЭДС-исследование образцов было осуществлено с помощью энерго-дисперсионного спектрометра Oxford Instruments X-max.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
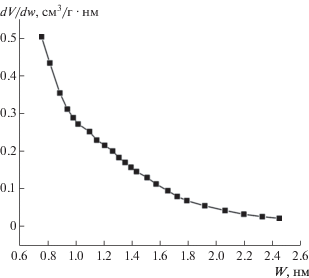
Распределение пор по методу Хорвата–Кавазое, рассчитанное из показателей низкотемпературной адсорбции азота (рис. 1), указывает на преобладание микропор в образце со средним размером пор 0.8 нм. По результатам низкотемпературной адсорбции азота на ГАУ в области средних давлений обнаруживается петля гистерезиса, что указывает на наличие мезопор в образце. График распределения пор расчитан по методу Баррета–Джойнера–Халенды (BJH) и представлен на рис. 2. Изотерма адсорбции азота (N2, 77 K) на рис. 2 относится к изотерме I-го типа. По виду и положению петли гистерезиса на изотерме адсорбции азота можно сделать предположение о щелевидной форме пор. По методу БЭТ, площадь поверхности составила 1513.7 м2/г, что предполагает высокую адсорбционную емкость. Данные порометрического анализа ГАУ представлены в табл. 1.
Рис. 2.
Изотерма адсорбции – 1, десорбции – 2 азота (77 K) и график распределения пор по методу BJH.
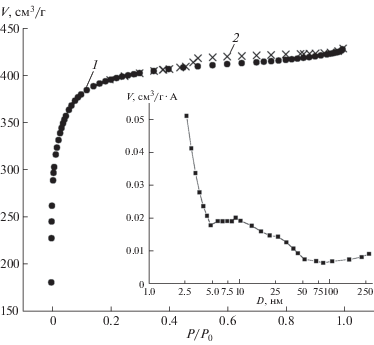
Таблица 1.
Удельная поверхность и структура пор ГАУ, определенная методом низкотемпературной адсорбции азота (N2, 77 K)
| Характеристика поверхности ГАУ | Численное значение |
|---|---|
| Размер пор, нм | 0.8–2.0 |
| Средний размер пор с учетом щелевых пор, нм | 0.8 |
| Объем микропор, см3/г | 0.64 |
| Общая поверхности по БЭТ, м2/г | 1513.7 |
| Поверхность микропор, м2/г | 1552 |
| Внешняя поверхность, м2/г | 85 |
Наличие функциональных групп на поверхности ГАУ определяли по ИК-спектру (рис. 3). Согласно литературным данным [11–16], поглощение при 3433 см–1 – валентные колебания О–Н в адсорбированной воде. Область пиков 1780–1535 см–1 отвечает валентным колебаниям С=О в кетонах; 1073 см–1 – плоскостные деформационные колебания C–H, монозамещенных, 1,3-, 1,2,3- и 1,3,5-замещенных соединений, полосы 842–670 см–1 – вне плоскостные деформационные колебания C–H.
На рис. 4 приведена фотография, полученная при микроскопическом исследовании образца. Поверхность ГАУ имеет структуру в виде глобул, образованных частицами от 50 до 500 нм. Видны полости между глобулами, а также входы в мезопоры размером от 50 до 150 нм.
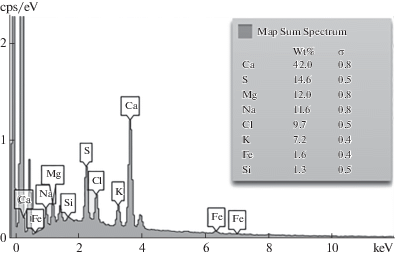
При исследовании адсорбента методом энергодисперсионной поверхностной спектроскопии (ЭДС) было определено присутствие железа на его поверхности (рис. 5).
Кинетику адсорбции изучали по изменению концентрации 2,4-Д во времени. Величину адсорбции q (масса адсорбированного гербицида, приходящаяся на 1 г адсорбента) рассчитывали по формуле
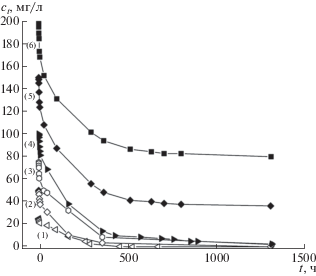
где mc – масса ГАУ, г; $v$ – объем раствора, л; c0 и ct – концентрации гербицида в начале эксперимента и в момент времени t в течение опыта, мг/л. На рис. 6 представлено падение концентрации 2,4-Д для различных исходных концентраций гербицида (25–200 мг/л) для массы ГАУ, равной 0.025 г. Адсорбция субстрата при данных условиях протекает сравнительно медленно, так же как и в работе [4], равновесное значение его концентрации достигается по прошествию около 1200 ч.Рис. 6.
Падения концентрации 2,4-Д в растворе при исходной концентрации c0 = 25 (1), 50 (2), 75 (3), 100 (4), 150 (5), 200 (6) мг/л в ходе адсорбции на ГАУ (0.025 г).
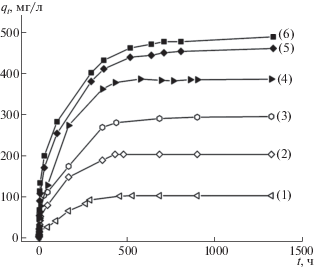
На рис. 7 приведена кинетика адсорбции 2,4-Д, рассчитанная из данных, представленных на рис. 6. Кинетические кривые адсорбции 2,4-Д на ГАУ обнаруживают вначале быстрый рост, а затем приближение к некоторому предельному значению адсорбции (qe), более высокому для больших начальных концентраций субстрата. Анализ кинетических кривых проводили предполагая протекание адсорбции по псевдопервому и псевдовторому порядку. Уравнение первого порядка в дифференциальной форме (уравнение Лагергрена [17, 18]):
где ${{k}_{{1~}}}$ – константа скорости адсорбции псевдопервого порядка, ч–1 и qt – значение адсорбции в момент времени t, ч. После интегрирования при начальном условии qe = 0, выражение (1) принимает видРис. 7.
Кинетика адсорбции 2,4-Д на ГАУ (0.025 г) при концентрациях c0 = 25 (1), 50 (2), 75 (3), 100 (4), 150 (5), 200 (6) мг/л.
В такой линейной форме уравнение псевдопервого порядка может быть применено для визуального анализа экспериментальных данных. Однако в интегральной нелинейной форме (2) уравнение псевдопервого порядка позволяет анализировать опытные данные, не прибегая ни к каким специальным преобразованиям:
В дальнейшем все вычисления проводили для нелинейных форм кинетических уравнений. Из уравнения (2) величины ${{q}_{e}}$ и ${{k}_{1}}$ рассчитывали при помощи функции minerr, программы Mathcad-14 [19]. В табл. 2 приведены значения параметров уравнения (1) для шести значений исходной концентрации 2,4-Д. Высокие значения коэффициентов корреляции указывают на удовлетворительное соответствие уравнения псевдопервого порядка экспериментальным данным.
Таблица 2.
Кинетические параметры адсорбции 2,4-Д на ГАУ для mадс = 0.025 г
| c0, мг/л | Псевдопервый порядок | Псевдовторой порядок | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ${{q}_{e}}$, мг/г | ${{k}_{1}} \cdot {{10}^{{ - 3}}}$,1/ч | ${{R}^{2}}$ | ${{q}_{e}}$, мг/г | $b$, ч | ${{k}_{2}} \cdot {{10}^{{ - 5}}}$, г/(мг · ч) | $h,~\,{\text{мг/}}({\text{г}} \cdot {\text{ч}})$ | ${{R}^{2}}$ | Δq, мг/г | |
| 25 | 108 | 5.3 | 0.995 | 146 | 218 | 3.1 | 0.7 | 0.994 | 38 |
| 50 | 190 | 13 | 0.987 | 217 | 57 | 8.1 | 3.8 | 0.988 | 27 |
| 75 | 277 | 8.7 | 0.977 | 324 | 91 | 3.4 | 3.6 | 0.98 | 47 |
| 100 | 370 | 8.4 | 0.995 | 419 | 87 | 2.7 | 4.7 | 0.996 | 49 |
| 150 | 429 | 11 | 0.988 | 471 | 57 | 3.7 | 8.2 | 0.992 | 42 |
| 200 | 438 | 15 | 0.981 | 469 | 38 | 5.6 | 12.3 | 0.986 | 31 |
Была проведена проверка выполнимости уравнения псевдовторого порядка [18]:
где ${{k}_{2}}$ – константа скорости адсорбции псевдовторого порядка. Проверку проводили расчетным анализом нелинейной интегральной формы, полученной интегрированием уравнения (3):Выражение (4) для удобства использования в Mathcad преобразовали в выражение
используемое для расчета функцией minerr в виде где $y = {{q}_{t}}$; $a = {{q}_{e}}$; $b = 1{\text{/}}{{k}_{2}}{{q}_{e}}$; x = t.В табл. 2 приведены кинетические параметры адсорбции 2,4-Д, рассчитанные для псевдовторого порядка.
Высокие коэффициенты корреляции показывают, что и это уравнение может удовлетворительно описывать кинетику процесса. Как и для уравнения псевдопервого порядка, расчетные величины ${{q}_{e}}$ увеличиваются с ростом c0.
При этом для псевдовторого порядка они оказываются на 27–49 мг/г выше, чем для псевдопервого. С увеличением c0 константы $b$ убывают, как и константы ${{k}_{2}}$. Из параметров уравнения (3) по уравнению (4) были рассчитаны начальные скорости адсорбции 2,4-Д, мг/(г · ч) для различных значений c0:
Прослеживается (табл. 2) монотонное увеличение h с ростом c0, что подтверждает соответствие уравнения (3) исследуемому процессу. Коэффициенты корреляции для уравнения псевдовторого порядка выше, чем для уравнения псевдопервого порядка (табл. 2), однако эта зависимость проявляется не для всех концентраций, поэтому необходимо провести анализ расчетных данных с использованием моделей Ленгмюра, Фрейндлиха и Темкина.
Из величин ${{q}_{e}}$, приведенных в табл. 2, были рассчитаны изотермы адсорбции по трем моделям: Ленгмюра (6) (рис. 8), Фрейндлиха (7) и Темкина (8), уравнения которых приведены ниже
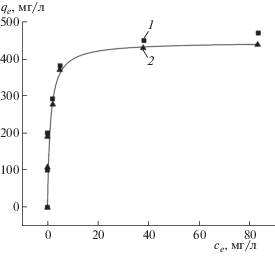
где ${{q}_{m}}$ – максимальная емкость монослоя (мг/г) и ${{b}_{L}}$ – адсорбционный коэффициент.Рис. 8.
Изотерма адсорбции 2,4-Д на ГАУ: 1 – экспериментальные показатели, 2 – расчетные показатели.
Изотерма Фрейндлиха описывается уравнением
где ${{K}_{F}}$ – коэффициент распределения или адсорбционный коэффициент, л/г.Изотерма Темкина выражается уравнением
где ${{b}_{T}}$ – адсорбционный коэффициент, Дж/моль, $R$ – универсальная газовая постоянная – 8.314 Дж/(моль · K); A – константа, л/г; T – абсолютная температура, K.Анализ изотермы адсорбции 2,4-Д на ГАУ также проводили при помощи системы Mathcad. Рассчитанные параметры уравнений (6)–(8) приведены в табл. 3, из которой следует, что изотерма с высокой точностью может быть описана изотермами Ленгмюра (6) и Фрейндлиха (7) и в меньшей степени – изотермой Темкина (8). Кинетика адсорбции соответствует первому порядку, так как расчетные данные для первого порядка имеют наибольшую степень корреляции для рассчитанных уравнений Ленгмюра, Фрейндлиха и Темкина. Полученная изотерма адсорбции, построенная по экспериментальным данным, совпадает с изотермой, построенной по расчетным данным уравнения первого порядка (рис. 8). Крутой наклон на изотерме Ленгмюра (рис. 8) в области Генри позволяет сделать вывод о высокой степени взаимодействия адсорбированных молекул с поверхностью адсорбента [20].
Таблица 3.
Параметры изотерм адсорбции Ленгмюра, Темкина и Фрейндлиха
| Изотерма Ленгмюра | Изотерма Темкина | Изотерма Фрейндлиха | |||
|---|---|---|---|---|---|
| ${{q}_{m}}$, мг/г | 445 | ${{b}_{t}}$, Дж/моль | 30 | ${{K}_{F}}$, л/г | 286 |
| ${{b}_{L}}$, л/мг | 0.867 | $A$, л/г | 4.31 | 1/n | 0.104 |
| ${{R}^{2}}$ | 0.94 | ${{R}^{2}}$ | 0.86 | ${{R}^{2}}$ | 0.9 |
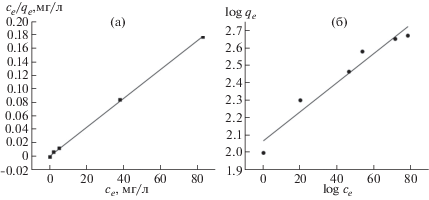
В качестве дополнительной проверки применимости полученных экспериментальных данных с рассчитанными по уравнениям Ленгмюра и Фрейндлиха построим изотермы адсорбции Ленгмюра и Фрейндлиха в координатах линейной формы уравнений. Для этого необходимо поделить обе части уравнения Ленгмюра на qe, а для уравнения Фрейндлиха – прологарифмировать обе части уравнения [20]. Получаем изотермы, представленные на рис. 9, из которого видно, что полученные экспериментальные данные с высокой степенью точности могут быть описаны уравнением Ленгмюра (рис. 9,а), так как полученная изотерма наиболее близка к рассчитанным значениям этого уравнения. И в меньшей степени она может быть описана по уравнению Фрейндлиха (рис. 9,б).
В образце ГАУ преобладают микропоры и незначительное количество мезопор. Адсорбция протекает практически только в микропорах со среднимих размером 0.8 нм. Этим, по-видимому, и можно объяснить длительное время установления адсорбционного равновесия.
ЗАКЛЮЧЕНИЕ
Полученные результаты показывают, что образец ГАУ обладает большей величиной адсорбционной емкости, чем ранее изученный образец активированного угля из скорлупы кокосового ореха (АУКО) [4]. Данный факт может быть связан с большей величиной удельной поверхности образца ГАУ по методу БЭТ (АУКО – 1070.4 м2/г, ГАУ – 1513.7 м2/г), а также с большим объемом микропор образца ГАУ в сравнении с образцом АУКО. Лимитирующей стадией процесса адсорбции является адсорбция в микропорах, а мезо- и макропоры, как и в случае с образцом АУКО, практически отсутствуют [4].
Таким образом, образец ГАУ применим не только для адсорбции ионов тяжелых металлов, но и для адсорбции молекул 2,4-Д из водной среды.
Список литературы
Carol J. Burns, Gerard M.H. Swaen // Crit. Rev. Toxicol. 2012. V. 42. I. 9. P. 768.
Haydar S., Ferro-Garcia M.A., Rivera-Utrilla J., Joly J.P. // Carbon. 41. 2003. P. 387.
Mahmoud M. Abdel daiem, José Rivera-Utrilla, Ma-nuel Sánchez-Polo, Raúl Ocampo-Pérez // Sci. Total Environ. V. 537. 2015. P. 335.
Веденяпина М.Д., Шарифуллина Л.Р., Кулайшинa С.А., Веденяпин А.А., Лапидус А.Л. // ХТТ. 2017. № 2. С. 51. [Solid Fuel Chemistry, 2017, vol. 51. no. 2, p. 115. DOI: 10.3103/S0361521917020100].https://doi.org/10.7868/S0023117717020104
Kun Y., Lianghong Z., Jingjing Y., Daohui L. // Sci. Total Environ. V. 618. 2018. P. 1677.
Mohammad-pajooh E., Turcios A.E., Cuff G., Weichgrebe D., Rosenwinkel K., Vedenyapina M.D., Sharifullina L.R. // J. Environ. Manage. V. 228. 2018. P. 189.
Pastrana-Martínez L.M., López-Ramón M.V., Fontecha-Cámara M.A., Moreno-Castilla C. // Water Res. V. 44. 2010. P. 879.
Liu X., Wang Y. // Mater. Chem. Phys. V. 222. 2019. P. 369.
Качала В.В., Хемчян Л.Л., Кашин А.С., Орлов Н.В., Грачев А.А., Залесский С.С., Анаников В.П. // Успехи химии. 2013. Т. 82. С. 648.
Кашин А.С., Анаников В.П. // Изв. АН. Сер. Хим. 2011. № 12. 2551.
Mishra V., Balomajumder C., Agarwal V.K. // Clean – Soil Air Water. 2010. V. 38. P. 1062.
Ahmad A.A., Hameed B.H. // J. Hazard. Mater. 2009. V. 172. P. 1538.
Yang J., Qiu K. // Chem. Eng. 2010. V. 165. P. 209.
Prahas D., Kartika Y., Indrawati N., Ismaji S. // Chem. Eng. 2008. V. 140. P. 32.
Nabais J.M.V., Laginhas C.E.C., Carrott P.J.M., Ribeiro Carrott M.M.L. // Fuel Proc. Technol. 2011. V. 92. P. 234.
Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
Shahvan T. // Chem. Eng. Res. and Des. 2015. V. 95. P. 172.
Shahvan T. // J. Environ. Chem. Eng. 2014. V. 2. P. 1001.
Веденяпина М.Д., Борисова Д.А., Ракишев А.К., Веденяпин А.А. // ХТТ. 2014. № 5. С. 51. [Solid Fuel Chemistry, 2014, vol. 48. no. 5. p. 323. DOI: 10.3103/S0361521914050139]https://doi.org/10.7868/S0023117714050132
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. НСК.: Наука, 1999. Гл. 4. 470 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива