Химия твердого топлива, 2020, № 3, стр. 50-54
ПОЛУЧЕНИЕ ГУМАТСОДЕРЖАЩИХ УДОБРЕНИЙ НА ОСНОВЕ ПРИРОДНОГО СЫРЬЯ
У. Ж. Джусипбеков 1, *, Г. О. Нургалиева 1, З. К. Баяхметова 1, **, А. К. Шакирова 1
1 АО “Институт химических наук имени А.Б. Бектурова”
050010 Алматы, Казахстан
* E-mail: ics_rk@mail.ru
** E-mail: zamirabkz@mail.ru
Поступила в редакцию 14.10.2019
После доработки 27.11.2019
Принята к публикации 10.02.2020
Аннотация
Изучено влияние соотношений исходных компонентов, температуры и продолжительности реакции на процесс взаимодействия гумата натрия (ГумNa) с кислотными реагентами и определены оптимальные условия процесса получения гуматсодержащих удобрений: Т:Ж = 1:3–4, t = 40–60°С, τ = 30–40 мин. Выявлено, что в результате взаимодействия в исследуемых гетерогенных системах образуются гумат аммония, а также нитраты натрия и аммония.
В последние годы одним из приоритетных направлений является создание технологий переработки твердого углеводородного сырья с получением ряда химических продуктов, таких как гуматсодержащие соединения различного назначения. Разнообразие свойств гуминовых соединений вследствие наличия в них разных функциональных групп обусловило возможность их использования во многих отраслях как самостоятельного вещества, так и в качестве одного из компонентов различных целевых продуктов.
Гуминовые вещества – это природные соединения, которые входят в состав торфа, бурых углей, почв и сапропелей. В зависимости от стадии углефикации, петрографического состава и степени окисленности они имеют определенные различия по элементному составу, степени конденсированности молекул, количеству функциональных групп, молекулярной массе, соотношению гидрофобных и гидрофильных фрагментов. Полифункциональный характер гуминовых кислот и их солей определяет широкое применение их в качестве регуляторов структурно-механических свойств и устойчивости дисперсных систем, биологически активных веществ, ионообменников и комплексообразователей [1]. Важная характеристика вещества – его химические свойства, т.е. способность вступать в реакции с другими соединениями. Спектр реакций, в которые могут вступать гуминовые вещества, очень широк, особенно это касается их наиболее реакционноспособной части – гуминовых кислот [2]. Гуминовая кислота – наиболее подвижная и реакционноспособная компонента гуминовых веществ, активно участвующая в химических процессах, протекающих в экосистемах [3].
По мнению авторов [4], их биологическая активность связана с наличием в их молекулах свободных радикалов, способных тормозить окисление. Исходя из изложенного следует, что гуминовые кислоты являются реакционноспособными соединениями и обладают широким спектром биологического действия.
Гуминовые соединения активно взаимодействуют с различными катионами металлов, образуя комплексы, прочность которых зависит от типа катиона. При этом могут протекать окислительно-восстановительные процессы и образовываться комплексы с переносом заряда, что свидетельствует о лабильной структуре гуминовых соединений. Данная структура стабилизируется межмолекулярными взаимодействиями, обусловленными наличием полярных групп и особенностями углерод-углеродных связей в циклах и линейных структурах [5]. В результате проведенных исследований установлено, что использование гуминовых препаратов, получаемых на основе торфа, в качестве биологически активных кормовых добавок с высокой антиоксидантной активностью, способных повышать иммунитет сельскохозяйственных животных весьма перспективно [6]. Обычной практикой в сельском хозяйстве является внесение в почву минеральных удобрений, что приводит к дополнительным потерям гумуса из-за повышения активности почвенной микрофлоры при недостатке органического вещества. Положительный баланс органического и минерального вещества в почве достигается при комплексном применении минеральных и органических либо органоминеральных удобрений [7]. Представленная методика позволит хозяйствам осуществлять мониторинг плодородия почв, для чего предлагается использовать гуминовые вещества в качестве органических удобрений для достижения бездефицитного баланса гумуса севооборотов различной структуры, исходя из их специализации и конъюнктуры рынка, что обеспечит стабильное производство сельскохозяйственной продукции [8]. Гуминовые добавки улучшают плодородие и структуру почвы, являются источником питательных веществ и микроэлементов для растений. Они также влияют на физиологические, метаболические процессы в почве и на процессы развития растений [9]. Кроме того, гуминовые вещества вызывают активацию плазматической мембраны в растениях. Исследования в работе [10] показали, что фракции гуминовых веществ с высокой и низкой молекулярной массой способствуют открытию устьиц. Помимо увеличения состава органического вещества в почве они играют важную роль в восстановлении окружающей среды путем фиторемедиации и восстановления растительности в бесплодной почве. Другой эксперимент [11] показал многочисленные преимущества применения гуминовых веществ для растений, включая корневое дыхание, активность ферментов и устойчивость к абиотическому стрессу, такому, как соленость и экстремальные значения рН. Эти вещества могут иммобилизовать и нейтрализовать тяжелые металлы, способствуя процессу детоксикации почвы. Однако их основное использование заключается в повышении усвоения питательных веществ и микроэлементов, включая их биодоступность, и, как следствие, увеличение роста, урожайности и качества продукта. По этим причинам использование гуминовых кислот в качестве агентов, улучшающих свойства почвы и влияющих на количество и качество сельскохозяйственных культур, может стать перспективным направлением развития современного сельского хозяйства [12].
Цель исследования – изучение влияния природы кислотных реагентов на процесс взаимодействия гумата натрия с фосфорной, азотной и смесью кислот при различных соотношениях компонентов, температурах и времени.
МЕТОДЫ ИССЛЕДОВАНИЙ
Для выполнения экспериментов используют гумат натрия, полученный из бурого угля Ой-Карагайского месторождения Республики Казахстан, способом щелочной экстракции гидроксидом натрия, который имеет следующий состав (мас. %): гуминовые кислоты (НАdaf) 82.0; массовая доля аналитической влаги (Wа) 10.0; зольность аналитической пробы (Аа) 8.0; С 32.38; Н 2.97; О 30.60; N 1.28; битумы 0.60. В качестве реагентов использовали Н3РО4 27.6%, НNO3 30% и смесь кислот.
Гуматную композицию получали при взаимодействии гумата натрия с кислотами Н3РО4 27.6%, НNO3 30% и их смесью при соотношении фосфорной кислоты к азотной, равном 4 : 1. Опыты проводили при соотношении исходных компонентов Т : Ж = 1 : 2–4, времени 10–60 мин и температуре 20–60°С. После завершения процесса остаточную кислотность пульпы нейтрализуют аммиачным водным раствором до рН 3.5–4.0. Введение в систему нейтрализующего агента влияет положительно на растворимость продуктов гуматной композиции. Далее пульпу сушат при 75–80°С для дальнейшего определения содержания P2O5, общего азота и выхода гуминовых соединений в гуматной композиции [13–15].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При взаимодействии гумата натрия с минеральными кислотами установили, что при увеличении соотношения Т : Ж выход гуминовых кислот уменьшается, а содержание P2O5 и азота увеличивается (табл. 1). Например, при температуре 60°С через 60 мин взаимодействия гумата натрия с Н3РО4, при увеличении соотношения Т : Ж от 1 : 2 до 1 : 4 выход гуминовых соединений уменьшается от 31.41 до 28.14%, содержание Р2О5 общ повышается от 39.67 до 42.81%, азота – от 1.26 до 1.67%. Аналогичные изменения наблюдались для НNO3 и смеси кислот. По-видимому, это связано с разбавлением суспензии и улучшением условий диффузии фосфат- и нитрат-ионов к поверхности гумата натрия. Кроме того, образующийся в результате взаимодействия гумат аммония препятствует процессу ретроградации Р2О5.
Таблица 1.
Изменение выхода гуминовых соединений, содержания общего Р2О5 и азота в зависимости от соотношения Т : Ж
| Кислотный реагент | Соотношение Т : Ж | ||
|---|---|---|---|
| 1:2 | 1:3 | 1:4 | |
| Выход гуминовых соединений, мас. % | |||
| Н3РО4 | 31.41 | 30.22 | 28.14 |
| НNO3 | 42.21 | 36.48 | 34.11 |
| Н3РО4 + НNO3 | 33.16 | 31.73 | 30.23 |
| Содержание Р2О5, мас. % | |||
| Н3РО4 | 39.67 | 41.40 | 42.81 |
| НNO3 | – | – | – |
| Н3РО4 + НNO3 | 36.05 | 37.06 | 38.51 |
| Содержание азота, мас. % | |||
| Н3РО4 | 1.26 | 1.53 | 1.67 |
| НNO3 | 6.46 | 6.48 | 6.49 |
| Н3РО4 + НNO3 | 4.02 | 4.54 | 4.73 |
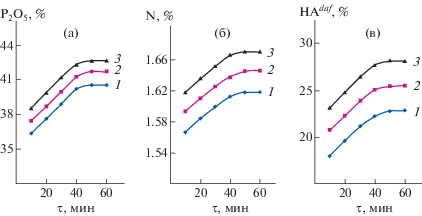
Полученные результаты (рис. 1) показывают, что при повышении температуры с 20 до 60°C содержание P2O5, азота и гуминовых соединений возрастает, что связано с понижением вязкости суспензии и увеличением скорости взаимодействия исходных компонентов. Из рис. 1 следует, что при изменении времени от 10 до 60 мин содержание P2O5, азота и выход гуминовых соединений также увеличивается. Например, при 60°С содержание Р2О5 повышается от 36.57 до 42.81%, азота – от 1.61 до 1.67%, выход гуминовых соединений – от 23.17 до 28.14%. Это связано с уменьшением вязкости среды и возрастанием скорости взаимодействия исходных компонентов, а также улучшением условий диффузии фосфат- и нитрат-ионов к поверхности гумата натрия.
Рис. 1.
Изменение содержания P2O5, азота и выхода гуминовых соединений в зависимости от времени при разных температурах (Т : Ж = 1 : 4): 1 – 20°С, 2 – 40°С, 3 – 60°С (а – содержание P2O5, б – содержание азота, в – выход гуминовых соединений).
В табл. 2 приведены результаты элементного анализа исходного гумата натрия и гуматной композиции. Экспериментальные данные показали, что под влиянием кислоты происходит усиление окислительно-гидролитической деструкции органической массы по ряду: Н3РО4 < (H3PO4 + HNO3) < < HNO3, при этом атомные отношения О/С увеличиваются от 0.54 до 0.74. Установлено, что под действием фосфорной кислоты образуются гуматы аммония с преобладанием в структуре циклопарафиновых соединений (Н/С = 1.19–1.79), а при использовании HNO3 (Н/С = 1.67–2.41) и смеси кислот (Н/С = 1.35–2.14) – алифатические [16]. Под воздействием кислот в органической части продукта происходят процессы гидролиза и окисления.
Таблица 2.
Элементный состав исходного гумата натрия и гуматной композиции (Т : Ж = 1 : 4, t 60°С, τ 60 мин)
| Образец | Содержание элемента, мас. % | Атомные отношения | ||||
|---|---|---|---|---|---|---|
| С | Н | N | O | Н/С | О/С | |
| Гумат натрия | 34.48 | 38.00 | 1.15 | 26.0 | 1.11 | 0.76 |
| Гумат натрия + кислотные реагенты | ||||||
| Н3РО4 | 29.60 | 52.91 | 1.60 | 15.89 | 1.79 | 0.54 |
| НNО3 | 22.62 | 54.74 | 5.85 | 16.77 | 2.41 | 0.74 |
| Н3РО4 + НNО3 | 24.80 | 53.18 | 4.90 | 17.11 | 2.14 | 0.68 |
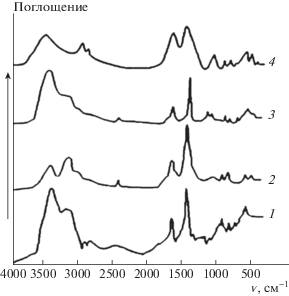
ИК-спектры полученных продуктов приведены на рис. 2. Для полученных гуматных композиций определены полосы поглощения гумата аммония. Так в области 3420–3390 см–1 – валентные колебания ОН-групп, при 1640–1630 см–1 и 1400 см–1 – сильные полосы поглощения карбоксильных групп, в области 1300 и 1130 см–1 – средняя интенсивность полосы поглощения деформационных колебаний спиртовых ОН-групп [17]. Полосы поглощения в области 1070–1060, 940–930 и 870 см–1 относятся к колебаниям ${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$-иона, в области 530–500 см–1 – ${\text{HPO}}_{4}^{{2 - }}$-иона, дублет в области 830–810 см–1 – ${\text{NO}}_{3}^{ - }$-иона, в области 3130 см–1 – к ${\text{NH}}_{4}^{ + }$-иона.
Рис. 2.
ИК-спектры гуматных композиции: 1 – ГумNa, 2 – ГумNa + Н3РО4, 3 – ГумNa+НNО3, 4 – ГумNa + (Н3РО4 + НNО3).
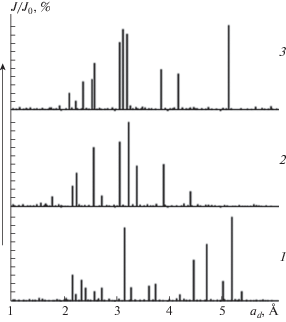
По результатам рентгенофазового анализа (рис. 3) можно говорить об образовании рентгеноаморфного гумата аммония, который снижает интенсивность дифракционных максимумов, что подтверждают данные ИК-спектрального анализа.
Рис. 3.
Рентгенограммы гуматных композиции: 1 – ГумNa + Н3РО4, 2 – ГумNa + НNО3,3 – ГумNa + + (Н3РО4 + НNО3).
На основании экспериментальных данных были установлены оптимальные условия (табл. 3) взаимодействия гумата натрия с Н3РО4, НNO3 и их смесью, при которых достигается наиболее высокое содержание общего пентаоксида фосфора, азота и выхода гуминовых соединений.
Таблица 3.
Оптимальные условия взаимодействия гумата натрия с кислотами
| Кислотный реагент | Соотно-шение Т : Ж | Темпера-тура, °С | Время, мин |
|---|---|---|---|
| Н3РО4 | 1 : 4 | 60 | 40 |
| НNO3 | 1 : 3 | 40 | 30 |
| Н3РО4 + НNO3 | 1 : 4 | 40 | 40 |
Анализ полученных экспериментальных данных позволяет сделать вывод о том, что исследованы процессы взаимодействия гумата натрия с растворами фосфорной, азотной кислот и их смесью. Изучено влияние соотношений исходных компонентов, температуры и продолжительности реакции на процесс взаимодействия гумата натрия с кислотными реагентами и определены оптимальные условия процесса: Т : Ж = 1 : 3–4, t = 40–60°С, τ = 30–40 мин. Установлено, что процессы взаимодействия гумата натрия с кислотами зависят от природы кислотного реагента, при этом при взаимодействии гумата натрия с фосфорной кислотой образуются циклопарафиновые структуры, а при взаимодействии азотной и смеси кислот – алифатически структурные гуматы аммония. При взаимодействии гумата натрия с кислотами и их смесью образуются хорошо растворимые в воде гумат аммония, дигидрофосфат натрия, а также нитраты аммония и натрия, из-за гидролиза и окисления органической части гумата под действием кислот.
Список литературы
Сивакова Л.Г., Лесникова Н.П., Ким Н.М., Ротова Г.М. // Вестн. Кузбасского гос. тех. ун-та. 2011. № 3. С. 439.
Якименко О.С., Терехова В.А. // Почвоведение. М.: Наука, 2011. 1423 с.
Платонов В.В., Чуносов С.Н. // Матер. Междунар. науч. конф. “Научные основы внедрения новых технологий в эпоху нового возрождения”. Ашхабад: Изд-е АГТУ, 2010. С. 214.
Дубищев А.В., Меньших Л.Е., Гафаров Х.С. // Матер. VIII междунар. конф. “Медико-социальная экология личности: состояние и перспективы”. Минск: Изд-е БГУ, 2010. С. 414.
Савченко И.А., Корнеева И.Н., Плаксин Г.В., Лукша Е.А., Гончаров Д.С. // Современные проблемы науки и образования. 2013. № 3. С. 256.
Веприкова Е.В., Кузнецова С.А. // Матер. VI Всеросс. науч. конф. с международным участием “Гуминовые вещества в биосфере”. Сыктывкар: Изд-е Коми НЦ УрО РАН, 2014. С. 362.
Червонобаб Н.Л. Способ получения органоминерального удобрения пролонгированного действия. Пат. 2496752 РФ // Б.И. 2013. № 15. С. 3.
Сорокин Н.Т., Сорокин К.Н., Новиков Н.Н., Никитин В.С. // Вестн. РГАТУ. 2016. № 2 (30). С. 258.
Palanivell P.S., Susilawati K.R., Osumanu H.D., Muhamad N.P. // Sci. World J. 2013. № 13. P. 195.
Saito B.A., Seckler M.E. // Brazil. J. Chem. Eng. 2014. V. 31. № 3. P. 201.
Huculak-Mączka M.O., Hoffmann J.H., Hoffmann K.T. // Humic substances in the environment. 2017. V. 18. P. 347.
Orlando L.F., Hernandez A.F., Rafael H.S. // Agronomy for Sustainable Development. Springer Verlag/EDP Sciences/INRA. 2015. № 35 (1). P. 481.
Межгосударственный стандарт ГОСТ 9517–76 (СТ СЭВ 4787-84). Угли бурые и каменные. Методы определения выхода гуминовых кислот. М.: Изд-во стандартов, 1987. 5 с.
Межгосударственный стандарт ГОСТ 11014–81. Угли бурые, каменные, антрацит и горючие сланцы. Ускоренный метод определения влаги. М.: Изд-во стандартов, 1988. 5 с.
Межгосударственный стандарт ГОСТ 11022–90 (ИСО 1171-81, СТ СЭВ 493-89, СТ СЭВ 1461-78). Топливо твердое минеральное. Методы определения зольности. М.: Изд-во стандартов, 1991. 8 с.
Кельман Ф.Н., Бруцкус Е.Б., Ошерович Р.Х. Методы анализа при контроле производства серной кислоты и фосфорных удобрений. М.: Наука, 1963. 360 с.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966. 411 с.
Франк-Каменецкий В.А. Руководство по рентгеновскому исследованию минералов. Л.: Недра, 1975. 399 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива


