Химия твердого топлива, 2020, № 3, стр. 14-26
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ УСТАНОВОК КОМБИНИРОВАННОГО ПРОИЗВОДСТВА ЖИДКИХ УГЛЕВОДОРОДОВ И ЭЛЕКТРОЭНЕРГИИ НА ОСНОВЕ УГЛЯ
А. М. Клер 1, *, Э. А. Тюрина 1, **, А. С. Медников 1, ***
1 ФГБУН Институт систем энергетики имени Л.А. Мелентьева СО РАН (ИСЭМ СО РАН)
664033 Иркутск, Россия
* E-mail: kler@isem.irk.ru
** E-mail: tyurina@isem.irk.ru
*** E-mail: mednikov@isem.irk.ru
Поступила в редакцию 03.10.2019
После доработки 17.10.2019
Принята к публикации 10.02.2020
Аннотация
Рассмотрены различные аспекты синтеза углеводородов бензиновой фракции из метанола, получаемого на энерготехнологических установках синтеза метанола из угля. Дано обоснование и описание используемых методов и подходов при моделировании процессов синтеза углеводородов, базирующихся на принципах равновесной термодинамики, а также процессов фазового разделения многофракционных смесей. Рассмотрены условия сопряжения блока синтеза углеводородов с энерготехнологическими установками синтеза метанола из угля. На основе результатов исследований блока синтеза углеводородов из метанола, включающих подробные материальный и тепловой балансы, оценены условия экономической эффективности переработки метанола, производимого из угля, в жидкие углеводороды в одной установке.
ВВЕДЕНИЕ
Одно из перспективных направлений использования угля – его переработка в более качественное топливо [1, 2]. Одна из технологий, осуществляющих такую переработку, – это технология производства метанола на основе газификации угля с получением синтез-газа и каталитического синтеза из этого газа метанола [3, 4]. Это связано с высокой производительностью процессов синтеза метанола по сравнению с синтезом углеводородов по конкурирующей технологии Фишера–Тропша, обусловленной высокой селективностью процесса, что снижает затраты на разделение продуктов синтеза, привлекательностью метанола как ценного химического сырья и экологически чистого топлива. Отметим, что в процессах газификации угля и синтеза метанола выделяется достаточно большое количество высокотемпературного тепла. При больших масштабах производства метанола наиболее целесообразное направление утилизации этого тепла – это производство электроэнергии [5–9].
В мире на протяжении нескольких лет ведутся исследования в области комбинированного производства синтетических топлив и электроэнергии. Исследователи используют различные методы, инструменты, критерии и т.д. для выполнения различных поставленных задач. Авторы [10] исследовали эффективность комбинированного производства на примере когенерационной системы метанол/электроэнергия из угля, используя в качестве критерия оценки энергосберегающий фактор для определения потерь энергии и эксергии в системах комбинированного производства. В [11] рассмотрено влияние рабочих характеристик (соотношений пар/уголь, О2/уголь, СО2/уголь и концентрации СО2) газогенератора на общую производительность установки комбинированного производства метанола и электроэнергии из угля. Исследования проводили путем математического моделирования с использованием ПО Aspen Plus. В работе [12] оценили выбросы парниковых газов в процессе работы когенерационной установки производства метанола и электроэнергии из угля. Новая полигенерационная установка производства метанола и электроэнергии на основе газификации биомассы с использованием энергии солнца была предложена в [13, 14]. Энергия солнца используется в качестве внешнего тепла для процесса газификации. Полученный синтез-газ используется в процессе синтеза метанола. Не вступивший в реакцию синтез-газ и тепло используются в парогазовом цикле для выработки электроэнергии.
Комбинированные технологии производства электроэнергии и метанола из угля исследовались в ИСЭМ СО РАН, в результате чего были разработаны математические модели подсистем газификации, синтеза и энергетической, установки в целом, найдены оптимальные соотношения между производством метанола и электроэнергии, состав дутья в газогенераторы и ряд других технологических параметров, определены основные экономические характеристики установки [15, 16].
Отметим, что метанол как топливо наряду с достоинствами имеет и недостатки. Хотя продукты его сгорания содержат значительно меньшие объемы вредных веществ, чем продукты сгорания жидких углеводородных топлив и даже природного газа, сам метанол более токсичен, чем другие виды жидкого и газообразного топлива. В связи с меньшей, чем у других топлив, теплотой сгорания на единицу массы возрастают затраты на его транспортировку, особенно железнодорожным и автомобильным транспортом. Метанол – сильный растворитель, инициирует быструю коррозию, что затрудняет его использование в качестве моторного топлива. Так, без замены топливной системы двигателя могут использоваться топливные смеси, содержащие не более 15% метанола.
Таким образом, учитывая значительные затраты, необходимые для переоборудования двигателей и создания систем хранения и распределения метанола, переработка метанола в бензин может оказаться более экономичным путем использования метанола в качестве моторного топлива. Неселективное превращение метанола в различные углеводороды можно осуществить на различных катализаторах кислотной природы. Большой интерес представляет открытие сотрудниками фирмы Mobil нового класса избирательных в отношении размеров и геометрии молекул цеолитов, которые катализируют селективное превращение метанола при 370°С и 1.5 МПа в смесь алифатических и ароматических углеводородов, выкипающих преимущественно в пределах бензиновой фракции (С5–С10). По сравнению с известной технологией Sasol бензин, получаемый в процессе Mobil, без добавки тетраэтилсвинца имеет октановое число по исследовательскому методу 90–95, качество этого бензина лучше, а выход выше. Кроме того, в процессе Mobil не требуется удаление из смеси продуктов кислородосодержащих соединений [17, 18].
Необходимо отметить, что химическая энергия исходного метанола не полностью переходит в энергию бензиновой фракции. Часть ее выделяется в виде тепла, а часть содержится в попутно получающихся газообразных углеводородах – метане, этане, бутане. В результате бензиновая фракция обладает примерно лишь 70% исходной химической энергии метанола. Однако рациональным сочетанием таких схемных решений, как рецикл газообразных углеводородов в пределах Mobil-процесса и их рецикл в блок газификации угля, можно существенно повысить долю химической энергии бензиновой фракции.
Для оценки технико-экономических показателей Mobil-процесса и рационального сочетания этого процесса с синтезом метанола из угля требуется разработка математических моделей основных элементов технологии и блока синтеза бензиновой фракции из метанола в целом. Создание таких математических моделей и является целью настоящей работы. Кроме того, в работе определяются рациональные способы сопряжения блока синтеза метанола с блоком синтеза углеводородов и экономические показатели комбинированного процесса.
Следует отметить, что результаты исследований, представленные в данной статье, являются продолжением исследований, описанных в [19]. Ранее полученные результаты были использованы в качестве основных исходных данных.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ БЛОКА СИНТЕЗА УГЛЕВОДОРОДОВ ИЗ МЕТАНОЛА
Технологическая схема получения бензина из метанола (блока производства бензина) представляет собой схему на основе Mobil-процесса [18], которая включена в технологическую схему энерготехнологической установки (ЭТУ) комбинированного производства метанола и электроэнергии из угля (рис. 1). Подробные результаты исследований ЭТУ производства метанола и электроэнергии представлены в работе [19].
Рис. 1.
Схема ЭТУ комбинированного производства углеводородов и электроэнергии: g – потоки газа, a – потоки воздуха, w – потоки питательной воды, ls – потоки пара низкого давления, hs – потоки пара высокого давления, ch – потоки углеводородной смеси, dme – потоки диметилового эфира, CH3OH – потоки метанола; I – блок газификации, II – блок синтеза метанола, III – энергетический блок, IV – блок производства бензина; 1 – система подготовки и подачи топлива, 2 – система разложения воздуха, 3 – газификатор, 4 – система охлаждения продуктов газификации, 5 – система очистки продуктов газификации, 6 – компрессор синтез-газа, 7 – регенеративное газо-газовое тепло теплообменник, 8 – реакторы для синтеза метанола, 9 – конденсатор, 10 – сепаратор сырого метанола, 11 – дроссель, 12 – система теплообменников, 13 – реактор дегидратации метанола в диметиловый эфир, 14 – реактор синтеза углеводородов, 15 – холодильник-конденсатор, 16 – сепаратор, 17 – компрессор, 18 – расширительная турбина, 19 – камера сгорания газовой турбины, 20 – газовая турбина, 21 – воздушный компрессор, 22 – котел-утилизатор, 23 – паровая турбина, 24 – конденсатор паровой турбины.
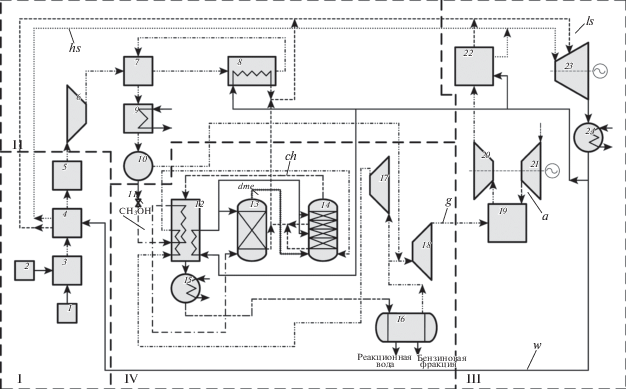
Технологическая схема блока производства бензина. Mobil-процесс включает следующие основные этапы:
нагрев и испарение жидкого метанола;
каталитический синтез из метанола диметилового эфира (СН3ОСН3);
каталитический синтез на цеолитовых катализаторах ароматических и парафиновых углеводородов;
конденсация бензиновой фракции и реакционной воды;
разделение углеводородных газов, реакционной воды и бензиновой фракции.
Испарение метанола, поступающего из блока синтеза метанола при температуре 303 K, происходит в системе теплообменников охлаждения продуктов синтеза углеводородов (12). Затем метанол поступает в реактор 13, где осуществляется каталитическая дегидратация метанола в диметиловый эфир. При этом выделяется тепло, которое идет на нагрев питательной воды, поступающей из энергетического блока энерготехнологической установки синтеза метанола, и получение из этой воды пара низкого давления. Реакция протекает быстро и практически близка к равновесию. Продукты реакции, содержащие диметиловый эфир, метанол и воду, поступают в реактор 14. Здесь происходят реакции дегидратации диметилового эфира в низшие олефины и превращения низших олефинов в смесь ароматических, парафиновых и циклопарафиновых углеводородов на цеолитовых катализаторах. В реакторе также образуется пар низкого давления за счет тепла реакций. Продукты реакций последовательно охлаждаются в системе теплообменников 12, в холодильнике-конденсаторе 15 и поступают в сепаратор 16, где разделяются на жидкую бензиновую фракцию, углеводородные газы и реакционную воду, в которой растворены также непрореагировавшие метанол и диметиловый эфир. Вода подается в блок газификации ЭТУ синтеза метанола для производства пара, идущего на дутье в газогенераторы, что позволяет использовать химическую энергию остаточного метанола и диметилового эфира, не проводя их дорогостоящее разделение с водой. Большая часть углеводородных газов направляется в реактор 14, а меньшая – поступает на конверсию в блок газификации ЭТУ. Выделение двух контуров рециркуляции связано со следующими соображениями. Рециркуляция несконденсировавшихся углеводородных газов из сепаратора на вход реактора второй ступени увеличивает выход бензиновой фракции и уменьшает выход углеводородных газов. Однако, как показали расчеты, при слишком большой доле рециркуляции (более 90%) поступление дополнительных углеводородных газов на вход реактора второй ступени уже не увеличивает выход бензиновой фракции, а вызывает лишь дополнительный рост затрат, связанных с бесполезной прокачкой газов, поэтому часть углеводородных газов, которая не может прореагировать в реакторе второй ступени, целесообразно направить на парокислородную конверсию для производства дополнительного синтез-газа. В результате увеличится производство метанола и, соответственно, выход бензиновой фракции. Очевидно, что при этом произойдет некоторый рост капитальных вложений в установку синтеза метанола. Однако следует иметь в виду, что большая часть капиталовложений в ЭТУ синтеза метанола связана с производством синтез-газа из угля и его очисткой. Капиталовложения на дополнительную конверсию газа рециркуляции будут невелики, поскольку очистка получаемого при этом синтез-газа не требуется.
Следует отметить, что часть химической энергии рециркулируемого газа пойдет на увеличение выработки электроэнергии. Кроме того, увеличится выработка электроэнергии за счет пара, получаемого из тепла, выделяемого в реакторах блока синтеза углеводородов. В итоге в ЭТУ синтеза углеводородов по сравнению с ЭТУ синтеза метанола увеличится выработка электроэнергии и сократится производство жидкого топлива, измеряемого в энергетическом эквиваленте.
Математические модели реакторов блока синтеза углеводородов. В данной работе моделирование химических реакторов базируется на соотношениях равновесной термодинамики [16]. Их использование обусловлено отсутствием у авторов работы уравнений химической кинетики для каталитических реакторов, реализующих Mobil-процесс. В этих условиях единственной альтернативой является использование равновесной термодинамики. При этом снижается точность моделирования, но резко сокращается объем требуемой информации. Однако и в рамках термодинамического подхода есть возможность ввести поправку на неидеальность, сопоставляя показатели энергетической эффективности идеальных и реальных процессов.
Термодинамическое описание процессов, протекающих в химических реакторах, должно включать следующие зависимости.
1. Уравнения материальных балансов для каждого химического элемента
(1)
$\delta _{i}^{M} = \sum\limits_{l = 1}^L {{{K}_{{li}}}y_{l}^{{{\text{вх}}}} - \sum\limits_{j = 1}^J {{{K}_{{ji}}}y_{j}^{{{\text{вых}}}} = {\text{0}},} } \quad I = 1, \ldots ,I.$2. В предположении, что процесс в реакторе идет при постоянных давлении и температуре и газовая смесь может рассматриваться как смесь идеальных газов, в точке термодинамического равновесия должен достигаться минимум функции Гиббса, зависящий от температуры, давления и мольного содержания компонентов газовой смеси:
(2)
$G({{T}^{{{\text{вых}}}}},{{P}^{{{\text{вых}}}}},y_{1}^{{{\text{вых}}}}, \ldots ,y_{J}^{{{\text{вых}}}}).$Как известно, минимизация функции многих переменных при соблюдении ограничений в форме равенств сводится к поиску стационарной точки функции Лагранжа [15]. Формулировка задач равновесной термодинамики на языке математического программирования рассмотрена в [16].
Пусть имеется исходная задача
при условияхФункция Лагранжа для этой задачи имеет вид
Стационарная точка этой функции определяется системой уравнений, требующих, чтобы все частные производные этой функции по x и uj, j = 1, …, m, равнялись нулю.
Здесь x – n-мерный вектор оптимизируемых параметров, uj – множитель Лагранжа, относящийся к ограничению – равенству ${{h}_{j}}(x) = 0$.
Исходя из сказанного, система уравнений, определяющих стационарную точку, имеет следующий вид:
(6)
$\frac{{\partial L}}{{\partial {{x}_{i}}}} = \frac{{\partial f(x)}}{{\partial {{x}_{i}}}} - \sum\limits_{j = 1}^m {{{u}_{j}}\frac{{\partial {{h}_{j}}(x)}}{{\partial {{x}_{i}}}} = 0,} \quad i = 1, \ldots ,n,$Применительно к задаче
(8)
$\min G({{T}^{{{\text{вых}}}}},{{P}^{{{\text{вых}}}}},y_{1}^{{{\text{вых}}}}, \ldots ,y_{J}^{{{\text{вых}}}})$(10)
$\frac{{\partial L}}{{\partial y_{j}^{{{\text{вых}}}}}} = \frac{{\partial G}}{{\partial y_{j}^{{{\text{вых}}}}}} - \sum\limits_{i = 1}^I {{{u}_{i}}{{K}_{{ji}}} = 0,} \quad j = 1, \ldots ,J,$(11)
$\frac{{\partial L}}{{\partial {{u}_{i}}}}\, = \,\delta _{i}^{M}\, = \,\sum\limits_{l = 1}^L {{{K}_{{li}}}y_{l}^{{{\text{вх}}}}\, - \,\sum\limits_{j = 1}^J {{{K}_{{ji}}}y_{j}^{{{\text{вых}}}}} \, = \,0,} \quad i = 1, \ldots ,I.$Введем обобщенный J+I-мерный вектор Z, такой, что
(12)
$Z = \left( {\left. {\begin{array}{*{20}{c}} {y_{1}^{{{\text{вых}}}}} \\ \ldots \\ {y_{J}^{{{\text{вых}}}}} \\ {{{u}_{1}}} \\ \ldots \\ {{{u}_{I}}} \end{array}} \right)} \right..$Введем обобщенную векторную J+I-мерную функцию $\delta Z(y_{1}^{{{\text{вых}}}}, \ldots ,y_{J}^{{{\text{вых}}}},{{u}_{1}}{\text{,}} \ldots ,{{u}_{I}}) = \delta Z(Z)$ вида
(13)
$\delta Z = \left( {\left. {\begin{array}{*{20}{c}} {\frac{{\partial L}}{{\partial y_{1}^{{{\text{вых}}}}}}} \\ \ldots \\ {\frac{{\partial L}}{{\partial y_{J}^{{{\text{вых}}}}}}} \\ {\frac{{\partial L}}{{\partial {{u}_{1}}}}} \\ \ldots \\ {\frac{{\partial L}}{{\partial {{u}_{I}}}}} \end{array}} \right)} \right..$Условия (10), (11) преобразуются к виду
Для решения системы уравнений (14) эффективен итерационный метод Ньютона, одна итерация которого определяется следующим рекуррентным соотношением:
(15)
${{Z}^{t}} = {{Z}^{{t - 1}}} + {{\lambda }^{t}}{{\left\{ {\frac{{\partial (\delta Z({{Z}^{{t - 1}}}))}}{{\partial Z}}} \right\}}^{{ - 1}}}\delta Z({{Z}^{{t - 1}}}),$Следует подчеркнуть, что первые J компонентов вектора Z (т.е. мольные расходы компонентов газовой смеси на выходе из реактора) не могут быть отрицательными. Обычно начальные приближения этих величин задаются положительными.
Выбор компонентов вектора ${{\lambda }^{t}}$ следует проводить таким образом, чтобы первые компоненты вектора Z всегда были положительными, хотя и могли стремиться к нулю при стремлении числа итераций t к бесконечности. Для определения ${{\lambda }^{t}}$ используются следующие правила:
1) $\lambda _{i}^{t} = \lambda $, если i > J, где 0 < $\lambda $$ \leqslant $ 1,
2) $\lambda _{i}^{t} = \lambda $, если i $ \leqslant $ J и i-й компонент вектора $\Theta $, ${{\Theta }_{i}}$ $ \geqslant $ 0,
где
(16)
$\Theta = {{Z}^{{t - 1}}} + \lambda {{\left\{ {\frac{{\partial (\delta Z({{Z}^{{t - 1}}}))}}{{\partial Z}}} \right\}}^{{ - 1}}}\delta Z({{Z}^{{t - 1}}}),$3) ${{\lambda }^{t}} = - \frac{{Z_{i}^{{t - 1}}}}{{2({{\Theta }_{i}} - Z_{i}^{{t - 1}})}},$ если ${{\Theta }_{i}}$ < 0.
При таком выборе ни один мольный расход не будет отрицательным. Если некоторый компонент вектора $\Theta $, ${{\Theta }_{i}}$, $i \leqslant J$, будет отрицательным, то шаг ${{\lambda }_{i}}$ подбирается таким образом, чтобы выполнялось условие
Опыт показал, что итерационный метод Ньютона с приведенным способом выбора шага имеет достаточно высокую сходимость.
Решение системы (10)–(11) дает идеальное (полное) равновесное состояние. В действительности процесс в реакторах не доходит до равновесного состояния. Учесть это можно введением специального коэффициента, характеризующего близость состава газовой смеси на выходе из реактора к идеальному. Для этого к ограничениям (11) следует добавить дополнительное ограничение вида
(19)
$\delta _{{J + 1}}^{M} = \eta \sum\limits_{s \in {{S}^{{\text{ц}}}}} {y_{s}^{{{\text{ид}}}}{{q}_{s}} - \sum\limits_{s \in {{S}^{{\text{ц}}}}} {{{y}_{s}}{{q}_{{s,}}}} } $Таким образом, расчет процесса в реакторе проводится в два этапа. Первоначально рассчитывается идеальный процесс, а затем с использованием полученной в результате информации производится расчет реального процесса, определяемый точкой частичного равновесия, получаемой в результате решения задачи (10)–(11). Коэффициент идеальности процесса может быть определен из сопоставления выхода целевых продуктов в идеальном и реальном процессах (например, с привлечением известных из литературы составов продуктов на выходе из действующих реакторов).
Количество тепла, выделившееся или поглощенное в ходе изобарно-изотермического процесса в химическом реакторе, можно определить из выражения
(20)
${{\Omega }^{T}} = \sum\limits_{l = 1}^L {H_{l}^{{{\text{вх}}}}({{T}^{{{\text{вх}}}}})y_{l}^{{{\text{вх}}}} - \sum\limits_{j = 1}^J {H_{j}^{{{\text{вых}}}}({{T}^{{{\text{вых}}}}})y_{j}^{{{\text{вых}}}}} } ,$Определение функции Гиббса. В данной работе функция Гиббса газовой смеси определяется в предположении справедливости идеально-газового приближения из выражения
Причем, как известно, энтальпия газовой смеси – аддитивная величина, равная сумме энтальпий входящих в нее компонентов
где $H_{j}^{0}$ – энтальпия образования j-го компонента при стандартных условиях, $c_{j}^{p}$– средняя теплоемкость j-го компонента в температурном интервале от T0 до T.Энтропия газовой смеси определялась из следующей зависимости:
Как известно, энтропия идеальной газовой смеси – величина также аддитивная и равна сумме энтропий отдельных компонентов, но в отличие от энтальпии смеси, зависящей только от изменения температуры, зависит также от давления, поэтому энтропия отдельного компонента рассчитывается следующим образом:
(25)
$S_{j}^{p} = S_{j}^{0}y_{j}^{{{\text{вых}}}} - R\ln \left( {\frac{{Py_{j}^{{{\text{вых}}}}}}{{{{P}_{0}}\sum\limits_{j = 1}^J {y_{j}^{{{\text{вых}}}}} }}} \right),$Для определения указанных величин использовались данные стандартных термодинамических величин из [20].
Расчет процесса конденсации многофракционной смеси. Как уже отмечалось, продукты синтеза углеводородов после реактора последовательно охлаждаются в ряде теплообменников. Причем процесс охлаждения сопровождается переходом части продуктов реакции из газообразного в жидкое состояние. Расчет равновесного состава смеси веществ с определением количества каждого вещества в жидкой и газообразной фазах (при фиксированных температуре и давлении) сводится к решению системы уравнений, включающей:
1) уравнения материального баланса для каждого вещества
2) уравнения для парциальных давлений (закон Дальтона)
3) уравнения закона Рауля
(29)
$x_{j}^{{\text{ж}}} = \frac{{y_{j}^{{\text{ж}}}}}{{\sum\limits_{j = 1}^J {y_{j}^{{\text{ж}}}} }},$Для решения системы (26)–(29), как и системы (1)–(2), эффективен метод Ньютона. Причем, поскольку количество вещества как в газообразной, так и жидкой фазах не может быть отрицательным, целесообразно выбирать шаги в этом методе соответственно с правилами (16), (17).
Суммарная энтальпия смеси при температуре T и давлении P определяется из выражения
(30)
${{H}^{\Sigma }} = \sum\limits_{j = 1}^J {(y_{j}^{{\text{ж}}}h_{j}^{{\text{ж}}} + y_{j}^{{\text{г}}}h_{j}^{{\text{г}}}),} $Причем
(31)
$h_{j}^{{\text{г}}} = h_{j}^{{\text{ж}}}(P_{j}^{r}) + {{r}_{j}}(P_{j}^{r}) + c_{j}^{{\text{р}}}(T - T_{j}^{{{\text{нас}}}}),$Для определения значений величин, входящих в (30), (31), были разработаны программы расчета теплофизических свойств индивидуальных углеводородов, участвующих в реакциях, на основе [21, 22]. Из-за отсутствия подробных теплофизических свойств для расчета давления насыщенного пара индивидуальных углеводородов, входящих в состав продуктов реакций синтеза, использовались эмпирические зависимости его от температуры насыщения. При определении теплот парообразования использовалось правило Трутона, согласно которому стандартная теплота парообразования пропорциональна абсолютной температуре кипения жидкости. Так как теплота парообразования зависит от давления, при котором происходит испарение углеводородов, для вычисления теплот парообразований индивидуальных углеводородов использовалась эмпирическая зависимость от их критической температуры. Таким же образом для определения энтальпии жидких углеводородов использовалась эмпирическая зависимость от температуры насыщения и относительной плотности жидких углеводородов при стандартных условиях. Результаты сравнения теплофизических свойств, полученных по эмпирическим зависимостям, с известными экспериментальными данными показывают небольшой процент ошибки, порядка 1–3% для различных углеводородов.
Следует отметить, что если из системы (26)–(29) определить распределение веществ смеси между жидкой и газообразной фазами при различных температурах (например, Т1 и Т2, причем Т1 > Т2), а затем из выражения (30) найти энтальпии смеси при этих температурах H1 и H2, то разность $\delta {\kern 1pt} H = {{H}_{1}} - {{H}_{2}}$ будет равна количеству тепла, выделяемому при охлаждении смеси от температуры Т1 до температуры Т2. Если указанные расчеты провести с достаточно малым шагом во всем диапазоне охлаждения смеси, то может быть построена функция выделения тепла при охлаждении смеси в зависимости от температуры. Фазовый состав, определенный в конце процесса охлаждения (т.е. при минимальной температуре), позволяет установить состав жидкой и газовой фаз, в том числе состав бензиновой фракции и состав рециркулирующих газов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как уже отмечалось, реактор первой ступени (рис. 2) предназначен для реализации первого этапа синтеза углеводородов из метанола – дегидратации метанола в диметиловый эфир. Известно, что эта реакция при условиях процесса – давлении 1.5 МПа и температуре 643 К – идет практически до равновесного состояния. Метанол из установки синтеза метанола поступает при температуре 303 К. Расчеты проводили при расходе метанола из установки синтеза метанола из угля, равном 79 кг/с. Процесс нагрева метанола до температуры реакции происходит в системе теплообменников. Материальный баланс участников реакции на входе и выходе реактора первой ступени:
В реакторе происходит выделение тепла реакции порядка 20.9 МДж/с, которое идет на производство пара низкого давления, поступающего в энергоблок ЭТУ на выработку электроэнергии.
После реактора первой ступени синтеза углеводородов из метанола продукты реакции поступают во второй реактор, где осуществляются реакции дегидратации диметилового эфира в низшие олефины С2–С6 (этилен, бутен, пропен, пентен и гексен) на цеолитовых катализаторах и затем превращение низших олефинов в смесь ароматических, парафиновых и изопарафиновых углеводородов. Состав участников реакции по группам углеводородов и их основные характеристики приведены в табл. 1. Материальный баланс реактора синтеза углеводородов второй ступени дан в табл. 2. Состав продуктов реакций по группам углеводородов с водой и без воды, соответственно:
Таблица 1.
Состав и основные характеристики участников реакций синтеза углеводородов из метанола
| Группа, вещество | Химическая формула | Молекулярная масса, кг | Температура кипения при 760 мм рт. ст., °С | Критическая температура, °С | Критическое давление, атм |
|---|---|---|---|---|---|
| Ароматические углеводороды: | |||||
| бензол | С6Н6 | 78.108 | 80.2 | 289.5 | 51.8 |
| толуол | С7Н8 | 92.134 | 110.63 | 320.6 | 43.0 |
| этилбензол | С8Н10 | 106.16 | 136.18 | 346.4 | 39.4 |
| м-ксилол | С8Н10 | 106.16 | 139.1 | 345.6 | 37.0 |
| п-ксилол | С8Н10 | 106.16 | 138.35 | 344.4 | 36.2 |
| о-ксилол | С8Н10 | 106.16 | 144.41 | 358.3 | 38.1 |
| пропилбензол | С9Н12 | 120.186 | 159.22 | 364.6 | 32.4 |
| тетраметилбензол | С10Н14 | 134.212 | 196.85 | 402.5 | 29.6 |
| Парафины: | |||||
| метан | СН4 | 16.042 | –161.5 | –82.1 | 47.3 |
| этан | С2Н6 | 30.068 | –88.6 | 32.3 | 49.8 |
| пропан | С3Н8 | 44.094 | –42.1 | 96.8 | 43.4 |
| бутан | С4Н10 | 58.12 | –0.5 | 152.8 | 37.2 |
| пентан | С5Н12 | 72.146 | 36.07 | 197.2 | 34.1 |
| гексан | С6Н14 | 86.172 | 68.74 | 234.7 | 30.6 |
| гептан | С7Н16 | 100.197 | 98.43 | 267.0 | 27.8 |
| октан | С8Н18 | 114.223 | 125.66 | 296.2 | 25.5 |
| нонан | С9Н20 | 128.249 | 150.8 | 322.1 | 23.4 |
| декан | С10Н22 | 142.275 | 174.1 | 345.2 | 21.4 |
| Олефины: | |||||
| этилен | С2Н4 | 28.052 | –103.7 | 9.6 | 52.4 |
| пропен | С3Н6 | 42.078 | –47.7 | 91.4 | 46.9 |
| бутен-1 | С4Н8 | 56.104 | –6.2 | 147.4 | 41.0 |
| пентен-1 | С5Н10 | 70.13 | 30.1 | 201.0 | 40.4 |
| гексен-1 | С6Н12 | 84.156 | 63.5 | 130.0 | 5.63 |
| Изопарафины: | |||||
| изобутан | С4Н10 | 58.12 | –11.72 | 135.0 | 38.2 |
| 2-метилбутан | С5Н12 | 72.146 | 27.85 | 187.7 | 33.9 |
| 2-метилпентан | С6Н14 | 86.172 | 60.27 | 224.9 | 30.9 |
| триптан | С7Н16 | 100.197 | 80.88 | 258.3 | 30.1 |
| Диметиловый эфир | C2H6O | 46.067 | –23.65 | 126.9 | 53.0 |
| Метанол | CH4O | 32.042 | 64.5 | 240.0 | 81.1 |
| Вода | H2O | 18.015 | 100.0 | 374.12 | 221.2 |
Таблица 2.
Материальный баланс реактора второй ступени синтеза углеводородов
| Группа, вещество | Вход | Рециркуляция | Выход | |||
|---|---|---|---|---|---|---|
| кг/с | кмоль/с | кг/с | кмоль/с | кг/с | кмоль/с | |
| Ароматические углеводороды: | ||||||
| бензол | – | – | – | – | 1.31 | 0.0167 |
| толуол | – | – | – | – | 1.35 | 0.0146 |
| этилбензол | – | – | – | – | 1.32 | 0.0124 |
| м-ксилол | – | – | – | – | 1.35 | 0.0128 |
| п-ксилол | – | – | – | – | 1.34 | 0.0126 |
| о-ксилол | – | – | – | – | 1.34 | 0.0126 |
| пропилбензол | – | – | – | – | 1.3 | 0.0108 |
| тетраметилбензол | – | – | – | – | 1.33 | 0.01 |
| Парафины: | ||||||
| метан | – | – | 16.5 | 1.029 | 18.35 | 1.144 |
| этан | – | – | 1.82 | 0.0607 | 2.03 | 0.0674 |
| пропан | – | – | 1.46 | 0.033 | 1.62 | 0.0367 |
| бутан | – | – | 0.08 | 0.00135 | 1.5 | 0.0256 |
| пентан | – | – | – | – | 1.4 | 0.0195 |
| гексан | – | – | – | – | 1.36 | 0.0157 |
| гептан | – | – | – | – | 1.32 | 0.0132 |
| октан | – | – | – | – | 1.30 | 0.0114 |
| нонан | – | – | – | – | 1.28 | 0.01 |
| декан | – | – | – | – | 1.27 | 0.009 |
| Олефины: | ||||||
| этилен | – | – | 0.63 | 0.0225 | 1.11 | 0.0397 |
| пропен | – | – | 0.25 | 0.006 | 1.22 | 0.0290 |
| бутен-1 | – | – | – | – | 1.2 | 0.0214 |
| пентен-1 | – | – | – | – | 1.19 | 0.0170 |
| гексен-1 | – | – | – | – | 1.18 | 0.0140 |
| Изопарафины: | ||||||
| изобутан | – | – | – | – | 1.48 | 0.0254 |
| 2–метилбутан | – | – | – | – | 1.43 | 0.0198 |
| 2-метилпентан | – | – | – | – | 1.34 | 0.0155 |
| триптан | – | – | – | – | 1.28 | 0.0118 |
| Диметиловый эфир | 45.94 | 1.0 | – | – | 1.05 | 0.0228 |
| Метанол | 16.09 | 0.5 | – | – | 1.38 | 0.0432 |
| Вода | 17.97 | 1.0 | – | – | 43.79 | 2.43 |
ароматические углеводороды 13.3%, легкие газы 2.8%, парафины 18.7%, олефины 7.4%, диметиловый эфир 1.3%, метанол 1.7%, вода 54.8%;
без воды, ароматические углеводороды 29.5%, легкие газы 6.1%, парафины 41.35%, олефины 16.35%, диметиловый эфир 2.9%, метанол 3.8%.
Распределение теплот сгорания по группам углеводородов следующее: ароматические углеводороды 28%, легкие газы 7%, парафины 44%, олефины 17%, диметиловый эфир 2%, метанол 2%.
Учитывается, что после реактора продукты реакции охлаждаются и частично конденсируются. При этом вода и бензиновая фракция разделяются в сепараторе. Процесс разделения происходит за счет разности плотностей в жидкой фазе бензиновой фракции и воды. В реакторе второй ступени также происходит выделение тепла (111 МДж/c), идущего на получение пара низкого давления, поступающего в энергоблок на выработку электроэнергии. Результаты расчета материального баланса реактора второй ступени, представленные в табл. 2, хорошо согласуются с известными из литературных источников данными по составу продуктов синтеза в Mobil-процессе [18] и позволяют сделать вывод о достаточной эффективности разработанных математических моделей реакторов синтеза углеводородов.
Изменение фазового состава продуктов реакций синтеза углеводородов, поступающих из реактора второй ступени, в процессе охлаждения происходит за счет изменения давления насыщенных паров индивидуальных углеводородов и их количественного соотношения (табл. 3).
Таблица 3.
Изменение фазового состава в процессе охлаждения продуктов синтеза углеводородов (кмоль/с)
| Группа, вещество | Температурный уровень | |||||||
|---|---|---|---|---|---|---|---|---|
| 460 K | 400 K | 360 K | 300 K | |||||
| Ж | Г | Ж | Г | Ж | Г | Ж | Г | |
| Ароматические углеводороды: | ||||||||
| бензол | 0.0001 | 0.0166 | 0.0146 | 0.0021 | 0.0161 | 0.0006 | 0.0167 | 0 |
| толуол | 0.0002 | 0.0144 | 0.0138 | 0.0009 | 0.0144 | 0.0002 | 0.0146 | 0 |
| этилбензол | 0.0003 | 0.0121 | 0.0121 | 0.0004 | 0.0124 | 0.0001 | 0.0124 | 0 |
| м-ксилол | 0.0004 | 0.0123 | 0.0124 | 0.0004 | 0.0127 | 0 | 0.0128 | 0 |
| п-ксилол | 0.0004 | 0.0122 | 0.0123 | 0.0004 | 0.0126 | 0 | 0.0126 | 0 |
| о-ксилол | 0.0005 | 0.0121 | 0.0123 | 0.0003 | 0.0126 | 0 | 0.0126 | 0 |
| пропилбензол | 0.0005 | 0.0103 | 0.0107 | 0.0002 | 0.0108 | 0 | 0.0108 | 0 |
| тетраметилбензол | 0.0012 | 0.0087 | 0.0098 | 0 | 0.01 | 0 | 0.01 | 0 |
| Парафины: | ||||||||
| метан | 0 | 1.144 | 0 | 1.144 | 0 | 1.144 | 0 | 1.144 |
| этан | 0 | 0.0674 | 0 | 0.0674 | 0 | 0.0674 | 0 | 0.0674 |
| пропан | 0 | 0.0367 | 0 | 0.0367 | 0 | 0.019 | 0 | 0.0367 |
| бутан | 0 | 0.0256 | 0.0128 | 0.0129 | 0.0189 | 0.0067 | 0.0241 | 0.0015 |
| пентан | 0 | 0.0195 | 0.0133 | 0.0062 | 0.017 | 0.0025 | 0.0195 | 0 |
| гексан | 0.0001 | 0.0156 | 0.0132 | 0.0025 | 0.015 | 0.0008 | 0.0157 | 0 |
| гептан | 0.0001 | 0.0131 | 0.0121 | 0.0011 | 0.0129 | 0.0003 | 0.0132 | 0 |
| октан | 0.0002 | 0.0112 | 0.1091 | 0.0005 | 0.0114 | 0 | 0.0114 | 0 |
| нонан | 0.0004 | 0.0096 | 0.0098 | 0.0002 | 0.01 | 0 | 0.01 | 0 |
| декан | 0.0006 | 0.0084 | 0.0088 | 0 | 0.009 | 0 | 0.009 | 0 |
| Олефины: | ||||||||
| этилен | 0 | 0.0397 | 0.0032 | 0.0365 | 0.0062 | 0.0334 | 0.0147 | 0.025 |
| пропен | 0 | 0.0290 | 0.0067 | 0.0223 | 0.0127 | 0.0163 | 0.0225 | 0.0066 |
| бутен-1 | 0 | 0.0214 | 0.0099 | 0.0115 | 0.0151 | 0.0063 | 0.0214 | 0 |
| пентен-1 | 0 | 0.0170 | 0.0115 | 0.0055 | 0.0147 | 0.0023 | 0.0170 | 0 |
| гексен-1 | 0 | 0.0140 | 0.0111 | 0.003 | 0.0131 | 0.001 | 0.0140 | 0 |
| Изопарафины: | ||||||||
| изобутан | 0 | 0.0254 | 0.0111 | 0.0144 | 0.0173 | 0.008 | 0.0254 | 0 |
| 2-метилбутан | 0 | 0.0198 | 0.0133 | 0.0065 | 0.017 | 0.0027 | 0.0198 | 0 |
| 2-метилпентан | 0 | 0.0155 | 0.0121 | 0.0035 | 0.0143 | 0.0012 | 0.0155 | 0 |
| триптан | 0 | 0.0118 | 0.0113 | 0.0015 | 0.0124 | 0.0005 | 0.0118 | 0 |
| Диметиловый эфир | 0 | 0.0228 | 0.0112 | 0.0115 | 0.019 | 0.004 | 0.0228 | 0 |
| Метанол | 0.0001 | 0.0431 | 0.033 | 0.0107 | 0.04 | 0.0027 | 0.0432 | 0 |
| Вода | 0.02 | 2.41 | 2.201 | 0.23 | 2.38 | 0.047 | 2.43 | 0 |
| Суммарный расход, кг/с | 1.04 | 98.67 | 66.7 | 33 | 74.71 | 29.99 | 76.61 | 23.09 |
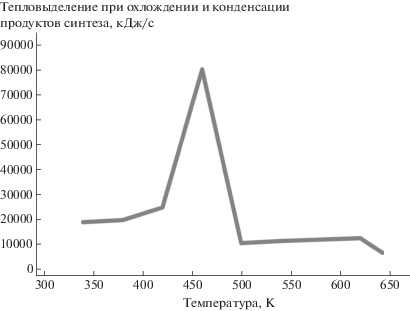
При охлаждении продуктов синтеза углеводородов сначала конденсируются преимущественно высококипящие фракции с низким давлением насыщенных паров. Как видно из табл. 3, в конце процесса охлаждения (при температуре 300 K) полностью в газообразном состоянии будут находиться метан, этан, пропан и частично бутан, этилен, пропилен. Именно они и входят в состав рециркуляционных газов. На рис. 2 представлено тепловыделение по температурным интервалам в процессе охлаждения и конденсации продуктов синтеза.
Из табл. 3 и рис. 2 видно, что в интервале температур 420–460 K наблюдается максимальное тепловыделение, поскольку в данном интервале температур происходит наибольшее изменение фазового состава (переход из газообразной в жидкую фазу) в процессе охлаждения продуктов синтеза углеводородов.
В табл. 4 показан тепловой баланс блока синтеза, из которого видно, что часть выделившегося в блоке тепла идет на нагрев и испарение метанола, поступающего в блок, другая часть идет на нагрев газов рециркуляции, которые после сепаратора направляются в реактор второй ступени синтеза. Остальное тепло идет на производство пара, который поступает в энергоблок ЭТУ для получения электроэнергии. Величина этого тепла определяется с учетом распределения тепловыделения по температурным интервалам. Тепло, которое не может быть использовано для получения пара в связи с низким температурным уровнем, идет на нагрев охлаждающей воды.
Таблица 4.
Тепловой баланс блока синтеза углеводородов, МДж
| Показатель | Приход | Расход |
|---|---|---|
| Тепло химических реакций | ||
| в реакторе 1 ступени | 21 | – |
| в реакторе 2 ступени | 110 | – |
| Тепло охлаждения и конденсации продуктов синтеза | 195 | – |
| Тепло на нагрев и испарение метанола | – | 120 |
| Тепло на нагрев газов рециркуляции на реактор 2-ой ступени | – | 25 |
| Тепло на нагрев питательной воды и образование пара | – | 144 |
| Тепло на нагрев охлаждающей воды | – | 37 |
| ИТОГО | 326 | 326 |
В табл. 5 приведены сравнительные технико-экономические показатели ЭТУ синтеза метанола и ЭТУ синтеза углеводородов. Данные установки различаются наличием или отсутствием блока синтеза углеводородов и дополнительного конвертора газов рециркуляции. Видно, что рецикл углеводородных газов в ЭТУ синтеза метанола повышает его выход примерно на 4%. За счет использования тепла, выделяющегося в блоке синтеза углеводородов при реакциях и охлаждении продуктов синтеза, для производства пара, идущего на выработку электроэнергии, ее производство увеличивается примерно на 18% по сравнению с ЭТУ синтеза метанола.
Таблица 5.
Основные технико-экономические показатели ЭТУ синтеза метанола и ЭТУ синтеза углеводородов
| Показатель | Размерность | ЭТУ синтеза углеводородов | ЭТУ синтеза метанола |
|---|---|---|---|
| Годовой расход топлива | тыс. т у.т. | 1735 | |
| Годовое производство: электроэнергии | млн кВт · ч | 1846 | 1561 |
| метанола | тыс. т | 1950 | 1875 |
| тыс. т у.т. | 1400 | 1352 | |
| бензина | тыс. т | 756 | – |
| тыс. т у.т. | 1170 | – | |
| Капиталовложения: | |||
| в блок газификации | млн долл. | 348 | 348 |
| в блок синтеза метанола | млн долл. | 302 | 297 |
| в блок синтеза углеводородов | млн долл. | 152 | – |
| в энергоблок | млн долл. | 303 | 287 |
| в установку | млн долл. | 1105 | 932 |
| Цена: | |||
| топлива | долл./т у.т. | 20 | |
| электроэнергии | цент/кВт · ч | 6 | |
| метанола | долл./т у.т. | – | 306 |
| бензина | долл./т у.т. | 383 | – |
| Термический КПД производства | % | 60 | 67 |
Выполненные в данной работе расчеты технологической схемы позволили определить выход полезного продукта (бензина), дополнительный рост производства электроэнергии, увеличение капиталовложений в блоки ЭТУ синтеза метанола. Капиталовложения в блок синтеза углеводородов оценивались экспертно в диапазоне 10–20% от стоимости ЭТУ синтеза метанола. Цена бензина определялась при фиксированном уровне внутренней нормы возврата капитальных вложений, равном 14%.
Как видно из табл. 5, цена бензина получается при этом на 25% выше цены метанола в энергетически эквивалентном количестве. Однако с учетом более высоких потребительских качеств бензина как топлива переработка метанола в бензин в рамках одного предприятия может быть рациональна.
ЗАКЛЮЧЕНИЕ
1. Результаты исследований процесса синтеза жидких углеводородов достаточно хорошо согласуются с известными из литературных источников данными по составу продуктов синтеза в Mobil-процессе. Это позволяет сделать вывод о достаточной эффективности разработанных математических моделей реакторов синтеза углеводородов и выбранных методов и подходов, основанных на использовании принципов равновесной термодинамики.
2. При включении в ЭТУ синтеза метанола из угля блока синтеза жидких углеводородов из метанола повышается выход метанола на величину порядка 5% и выработка электроэнергии на 15–20% за счет использования рецикла остаточных углеводородных газов в блок газификации ЭТУ и использования тепла, выделяющегося в реакторах синтеза углеводородов и охлаждения продуктов синтеза, для производства дополнительной электроэнергии в энергоблоке ЭТУ.
3. При принятых уровнях капиталовложений в блок синтеза углеводородов цена производимого в ЭТУ синтеза углеводородов бензина на 25% выше цены метанола, производимого на ЭТУ синтеза метанола из угля, в энергетически эквивалентном количестве. Однако с учетом более высоких потребительских качеств бензина как топлива переработка метанола в бензин в рамках одного предприятия может быть рациональна.
4. Основной экономический эффект от переработки метанола в бензин может быть получен за счет повышения потребительских качеств производимого искусственного жидкого топлива и роста его цены на единицу энергии.
Список литературы
Li Ch., Bai H., Lu Yu., Bian J., Dong Ya., Xu H. // Journal of Cleaner Production. 2018. V. 188. P. 1004.
Xu X., Liu Yu., Zhang F., Di W., Zhang Yu. // Catalysis Today. 2017. V. 298. P. 61.
Wang Ch., Li Ya., Xu C., Badawy T., Sahu A., Jiang Ch. // Fuel. 2019. V. 248. P. 76.
Lv L., Zhu L., Li H., Li B. // J. Taiwan Inst. Chem. Eng. 2019. V. 97. P. 346.
Pirola C., Bozzano G., Manenti F. Chapter 3 – Fossil or Renewable Sources for Methanol Production / A. Basile, F. Dalena // Methanol. Elsevier Ltd. 2017. P. 53.
Higman C. GSTC Syngas Database: 2017 Update. http://worldctx.com/wp-content/uploads/HigmanGSTC2017.pdf. 2017.
Ghasemzadeh K., Sadati Tilebon S.M., Basile A. Chapter 3 – Coproduction of Electrical Energy and Methanol in IGCC Plants / A. Basile, F. Dalena // Methanol. Elsevier Ltd. 2018. P. 399.
Sheldon D. // Johnson Matthey Technol. Rev. 2017. V. 61. № 3. P. 172.
Dalena F., Senatore A., Marino A., Gordano A., Basile M., Basile A. Chapter 1 – Methanol Production and Applications: An Overview / A. Basile, F. Dalena // Methanol. Elsevier Ltd. 2017. P. 3.
Guang-jian L., Zheng L., Ming-hua W., Wei-dou N. // Appl. Energy. 2010. V. 87. № 9. P. 2854.
Qin Z., Bhattacharya S., Tang K., Zhang Z. // Energy Conversion and Management. 2019. V. 184. P. 362.
Śliwińska A., Burchart-Korol D., Smoliński A. // Sci. Total Environment. 2017. V. 574. P. 1571.
Bai Zh., Liu Q., Gong L., Lei J. // Appl. Energy. 2019. V. 243. P. 91.
Bai Zh., Liu Q., Gong L., Lei J. // Energy Procedia. 2018. V. 152. P. 1045.
Оптимизационные исследования энергетических установок и комплексов / Под ред. А.М. Клера, Э.А. Тюриной. Новосибирск: Академическое изд-во “Гео”, 2016.
Эффективные методы схемно-параметрической оптимизации сложных теплоэнергетических установок: разработка и применение / Под ред. А.М. Клера. Новосибирск: Академическое изд-во “Гео”, 2018.
Wan Zh., Li G., Wang Ch., Yang H., Zhang D. // Catalysis Today. 2018. V. 314. P. 107.
Grimmer H.R., Thiagarajan N., Nitschke E. // Studies in Surface Science and Catalysis. 1988. V. 36. P. 273.
Kler A.M., Tyurina E.A., Mednikov A.S. // Energy. 2018. V. 165. P. 890.
Жоров Ю.М. Термодинамика химических процессов. Нефтехимический синтез, переработка нефти, угля и природного газа. М.: Химия, 1985.
NIST Chemistry WebBook. http://webbook.nist.gov/.
Vargaftik N.B. Handbook of Physical Properties of Liquids and Gases. Springer-Verlag Berlin Heidelberg, 1975.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива