Химия твердого топлива, 2020, № 4, стр. 21-27
КИНЕТИКА КАВИТАЦИИ СРЕДНЕЙ ФРАКЦИИ КАМЕННОУГОЛЬНОЙ СМОЛЫ
Н. Ж. Балпанова 1, *, А. Тусипхан 1, **, А. М. Гюльмалиев 2, Ф. Ма 3, А. Ж. Кызкенова 4, Д. Е. Айтбекова 1, З. С. Халикова 1, Г. Г. Байкенова 5, 6, М. И. Байкенов 1, 6
1 Карагандинский государственный университет имени акад. Е.А. Букетова
100028 Караганда, Республика Казахстан
2 ФГБУН Институт нефтехимического синтеза имени А.В. Топчиева РАН
11999 Москва, Россия
3 Синьцзянский университет
830046 СУАР, Урумчи, Китайская Народная Республика
4 Карагандинский государственный медицинский университет
100012 Караганда, Республика Казахстан
5 Карагандинский экономический университет Казпотребсоюза
100009 Караганда, Республика Казахстан
6 Южно-Уральский государственный университет
454080 Челябинск, Россия
* E-mail: nazerke_90@mail.ru
** E-mail: almas_kz_22@mail.ru
Поступила в редакцию 23.12.2019
После доработки 29.01.2020
Принята к публикации 30.03.2020
Аннотация
Исследована кинетика средней фракции с температурой кипения 230–300°С каменноугольной смолы в присутствии нанокатализатора Fe3O4. Рассчитаны константы скоростей кавитационной обработки каменноугольной смолы с использованием метода Симпсона с оптимизацией случайного поиска, а также кажущаяся энергия активации процесса кавитации средней фракции каменноугольной смолы. Показано влияние температуры, продолжительности обработки, нанокатализатора Fe3O4 на выход полиароматических углеводородов.
Как известно [1, 2], к перспективным направлениям переработки тяжелого углеводородного сырья относится использование различных физических методов (кавитация, механохимия и др.), которые могут воздействовать на химико-технологические процессы деструкции и гидрирования. Известно, что кавитация используется только для крекинга углеводородов, входящих в состав нефтяного сырья. В настоящее время существует несколько сообщений о возможности использования явления кавитации для интенсификации крекинга первичной каменноугольной смолы [3, 4]. Однако сведения об использовании кавитации при крекинге средней фракции каменноугольной смолы, содержащей смесь полиароматических углеводородов (ПАУ), и исследовании кинетики кавитации в литературе незначительны. Каменноугольная смола, полученная из угля, отличается от первичной каменноугольной смолы (ПКС) высоким содержанием ПАУ и низким содержанием фенолов. Надо отметить, что ПКС получают в условиях, исключающих высокотемпературный пиролиз угля, а каменноугольную смолу – при высокотемпературном пиролизе угля.
Ранее [5–7] была исследована кинетика гидрогенизации тяжелого и твердого углеводородного сырья, при этом для расчета кинетических параметров были использованы жесткие типы систем дифференциальных уравнений. Однако для химической кинетики сложных химических реакций характерно наличие быстро и медленно меняющихся переменных. За счет стадий реакций, которые протекают с различными скоростями, решение прямых кинетических задач осложняется жесткостью систем дифференциальных уравнений, описывающих механизм этих реакций [8]. В связи с этим для определения кинетических параметров кавитационной обработки средней фракции каменноугольной смолы нами были использованы метод оптимизации случайного поиска [9] и интегральный метод Симпсона [10].
Цель работы заключается в использовании интегрального метода с оптимизацией параметров кинетической модели кавитационной переработки средней фракции каменноугольной смолы с температурой кипения 230–300°С, состоящей из смеси ПАУ. Для достижения поставленной цели экспериментальные данные обрабатывались методом оптимизации случайного поиска и интегральным методом Симпсона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования кинетики кавитационной обработки в качестве исходного сырья была использована средняя фракция 230–300°С, полученная из высокотемпературной каменноугольной смолы. Физико-химические характеристики высокотемпературной каменноугольной смолы представлены в табл. 1.
Таблица 1.
Физико-химические характеристики высокотемпературной каменноугольной смолы
| Показатель | Высокотемпературная каменноугольная смола |
|---|---|
| Объемная доля воды, % | 4 |
| Плотность при 20°С, кг/м3 | 1190 |
| Фракционный состав, массовая доля (от безводной смолы), %: | |
| до 180°С | ∼1 |
| 180–230°С | 13 |
| 230–270°С | 10 |
| 270–300°С | |
| конечная температура 300°С | |
| всего отгона, % | 18 |
| температура отгона кипения, °С: | ∼40 |
| в парах | 320 |
| в жидкости | 400 |
| Выход пека, % | 60 |
| Массовая доля веществ, не растворимых в толуоле (α-фракция), % | 6–10 |
| Массовая доля веществ, не растворимых в хинолине (α1-фракция), % | 4–6 |
| Зольность, % | Не > 0.3 |
| Содержание фенолов, % | 2–5 |
| Содержание нафталина, % | 7–12 |
Общие фенолы из каменноугольной смолы экстрагировали 75%-ным водным раствором этанола. Фенолы имеют подвижный атом водорода в гидроксильной группе, которая является источником водорода. Фенолы в водных растворах диссоциируются по кислотному типу, а вода является слабой кислотой, в связи с этим, чтобы исключить влияние общих фенолов на кавитацию, предварительно провели экстракцию общих фенолов 75%-ным водным раствором этанола из каменноугольной смолы. В работе [11] показано влияние воды как источника активного водорода на кавитационную обработку углей Кузнецкого бассейна, которая изменяет химический состав угольных частиц за счет протекания окислительно-гидролитических реакций, находящейся в условиях кавитации в сверхкритическом состоянии.
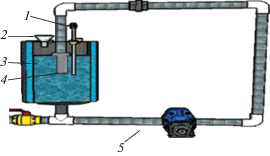
Кавитационную обработку средней фракции каменноугольной смолы проводили на установке гидродинамического нагрева (ГДН) (рис. 1), где реактор термостатировался. В реактор подавали смесь следующего состава: средняя фракция каменноугольной смолы 4 л, вода 0.4 л и нанокатализатор Fe3O4 0.3%, которая предварительно перемешивалась перед подачей в реактор. Через определенное время отбиралась проба, из которой отделялась вода с помощью делительной воронки. Кавитационную обработку средней фракции каменноугольной смолы проводили в атмосфере газообразного азота. Начальное давление азота в реакторе составило 1.0 МПа. Идeнтификaцию проводили мeтодом хромато-масс-спектрометрического (ХМС) анализа. В ходе опытов температуру варьировали от 65 до 80°С, продолжительность эксперимента составляла от 0 до 30 мин. Кавитационную обработку проводили в присутствии нанокатализатора Fe3O4. Условия проведения ХМС-анализа средней фракции каменноугольной смолы и синтеза нанокатализатора приведены в работе [12].
Рис. 1.
Схема установки гидродинамического нагревателя: 1 – термопара, 2 – отверстие для заполнения жидкостью (исходное сырье) реактора, 3 – реактор, 4 – гидродинамический нагреватель, 5 – насос.
Компонентный состав средней фракции каменноугольной смолы, полученной из высокотемпературной каменноугольной смолы, представлен в табл. 2.
Таблица 2.
Компонентный состав средней фракции каменноугольной смолы (tкип 200–3000°С, плотность при 20°С 1050 кг/м3)
| Вещество | Структурная формула вещества | tкип, °С | С, мас. % |
|---|---|---|---|
| Нафталин |  |
218 | 8.55 |
| 1-Метилнафталин | 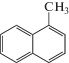 |
244.6 | 17.33 |
| 2-Метилнафталин | 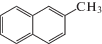 |
241.1 | 8.75 |
| Дифенил |  |
254.25 | 5.69 |
| 1,7-диметилнафталин | 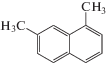 |
263 | 4.42 |
| 1,6-Диметилнафталин | 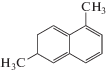 |
265 | 2.55 |
| Аценафтен | 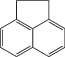 |
279 | 19.94 |
| Карбазол | 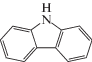 |
341.5 | 13.65 |
| Флуорен |  |
297.9 | 13.82 |
| Антрацен |  |
340–355 | 5.3 |
Анализ газообразных продуктов после кавитационнной обработки средней фракции 230–300°С проводили на хроматографе “Кристаллюкс 4000М” (Россия) с детекторным модулем 2 ДТП/ПИД, на колонке СаА 1–3 м, d-3 мм для постоянных газов и на колонке Porapak R 1–3 м, d-3 мм для углеводородных газов. Газожидкостный хроматографический (ГЖХ) анализ жидких составляющих проводился на хроматографе “Кристаллюкс 4000М” с детектором ПИД на колонке DB – 5 ms 30 mm ⋅ 0.250 mm ⋅ 0.50 μm с программированием температуры термостата 120–280°С. В ГЖХ-методе использовалась база данных компонентного состава, созданная на основе результатов ХМС-анализа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предлагаемый метод расчета кинетических параметров был использован для процесса гидродинамического нагрева средней фракции 230–300°С каменноугольной смолы, из которой предварительно были извлечены общие фенолы. На рис. 2 представлена схема ГДН средней фракции каменноугольной смолы 230–300°С в присутствии нанокатализатора Fe3O4.
Рис. 2.
Схема гидродинамического нагрева средней фракции 230–300°С каменноугольной смолы в присутствии нанокатализатора Fe3O4.
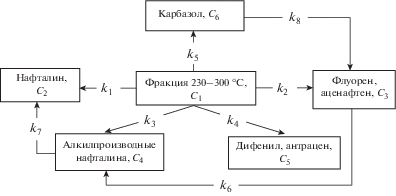
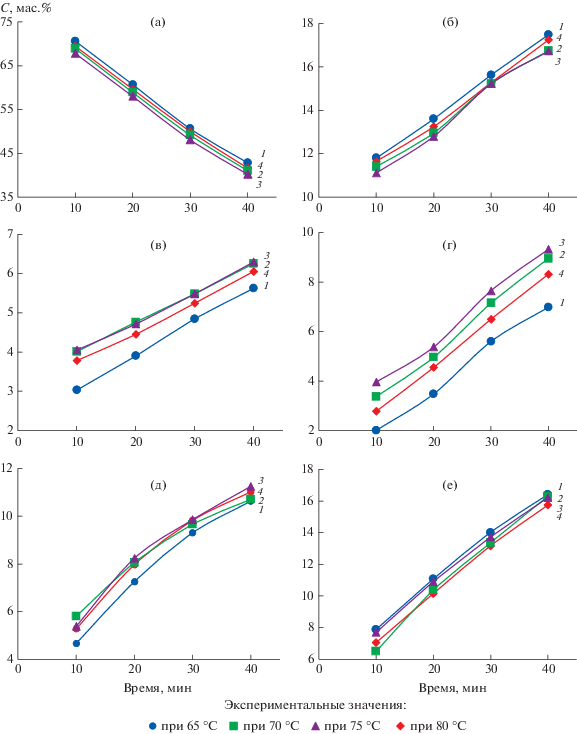
Результаты, полученные в ходе кинетических экспериментов по изучению влияния продолжительности и температуры на изменение выхода ПАУ в процессе обработки средней фракции каменноугольной смолы с помощью ГДН, представлены на рис. 3, из которого видно, что увеличение продолжительности и температуры процесса обработки с помощью ГДН средней фракции каменноугольной смолы приводит к повышению количества ПАУ. Однако следует учесть, что исходная концентрация полициклических углеводородов (табл. 2) выше, чем при обработке фракции каменноугольной смолы с помощью ГДН при 10 мин, за исключением выхода нафталина. Увеличение выхода нафталина с 8 до 12% с повышением температуры и продолжительности обработки в присутствии нанокатализатора Fe3O4, по-видимому, связано с реакцией деалкилирования метилпроизводных нафталина (рис. 3,д), что показывает выход газообразных продуктов, полученных после кавитационной обработки каменноугольной смолы, %: метан 9.5, водород 12.7, углекислый газ 4.04, этилен 0.3, этан 0.5, оксид углерода 3.31, пропан 1.0, н-бутан 0.14 и азот 72.0. Увеличение выхода ПАУ с возрастанием времени (с 20 до 40 мин) и температуры (с 65 до 80°С) в присутствии нанокатализатора Fe3O4 связано с протеканием крекинга, а также изомеризации. Полученные результаты сопоставимы с данными по каталитической гидрогенизации смеси ПАУ, приведенными в [12].
Рис. 3.
Влияние продолжительности и температуры на изменение концентрации ПАУ в процессе кавитации средней фракции каменноугольной смолы. Продукты реакции: фракция 230–300°С (а), смесь флуорена и аценафтена (б), карбазол (в), смесь антрацена и дифенила (г), нафталин (д), алкилпроизводные нафталина (е). Расчетные значения выходов: 1 – при 65, 2 – при 70, 3 – при 75, 4 – при 80°С.
На основе кинетической схемы (рис. 2) была создана кинетическая модель кавитационной обработки средней фракции 230–300°С, которая представлена в виде системы дифференциальных уравнений:
Следует отметить, что отклонения расчетных данных от экспериментальных составляет 5.8%. Рассчитанные константы скоростей приведены в табл. 3.
Таблица 3.
Константы скоростей кавитационной обработки смеси ПАУ средней фракции 230–300°С
| Константа скоростей, мин–1 | t, °С | |||
|---|---|---|---|---|
| 338 | 343 | 348 | 353 | |
| k1 | 0.00169 | 0.00243 | 0.00322 | 0.00386 |
| k2 | 0.000576 | 0.000809 | 0.001 | 0.0015 |
| k3 | 0.001042 | 0.003 | 0.00328 | 0.004 |
| k4 | 0.003783 | 0.00586 | 0.00676 | 0.00684 |
| k5 | 0.0139 | 0.0097 | 0.0094 | 0.0094 |
| k6 | 0.0199 | 0.0193 | 0.0192 | 0.0183 |
| k7 | 0.00652 | 0.0075 | 0.0038 | 0.007 |
| k8 | 0.16 | 0.1633 | 0.1624 | 0.163 |
В табл. 3 показано, что лимитирующей скоростью конверсии смеси полиароматических углеводородов в средней фракции каменноугольной смолы является реакция преобразования в смесь флуорена и аценафтена. Наибольшее значение константы скорости характерно для стадии преобразования карбазола в смесь флуорена и аценафтена.
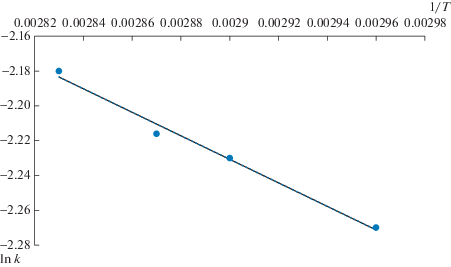
Зависимость константы скорости суммарного превращения смеси ПАУ от обратной температуры показана на рис. 4.
Энергия активации была рассчитана по уравнению Аррениуса. Величина кажущейся энергии активации суммарного превращения смеси ПАУ, найденная графически (рис. 4), равна 5.62 кДж/моль. По рассчитанным значениям можно предположить, что процесс ГДН смеси ПАУ средней фракции 230–300°С контролируется скоростью диффузии.
Таким образом, в результате проведенных кинетических исследований процесса ГДН средней каменноугольной фракции в присутствии наноразмерного катализатора Fe3O4 (в интервале температур от 65 до 80°С и продолжительности от 0 до 30 мин) была предложена схема превращения смеси ПАУ, которая позволяет описывать все химические превращения компонентов в реакционной смеси. Рассчитаны константы скорости и кажущаяся энергия активации процесса ГДН смеси ПАУ в средней фракции. Установлено, что лимитирующей скоростью превращения смеси полиароматических углеводородов является реакция преобразования средней фракции в смесь флуорена и аценафтена. Показано, что дифференциально-кинетические уравнения адекватно описывают экспериментальные данные.
Список литературы
Нестеренко А.И., Берлизов Ю.С. // Химия и технология топлив и масел. 2007. № 6. С. 43. [Chemistry and technology of fuels and oils, 2007, vol. 43, no. 6, p. 515.]
Дудкин Д.В., Кульков М.Г., Шестакова Е.Н., Якубенок А.А., Новиков А.А. // Химия и технология топлив и масел. 2012. № 2. С. 39. [Chemistry and technology of fuels and oils, 2012, vol. 48, no. 2, p. 143.]
Байкенов М.И., Амерханова Ш.K., Байкенова Г.Г., Шляпов Р.М., Туктыбаева А.Е. // ХТТ. 2013. № 1. С. 28. [Solid fuel chemistry, 2013, vol. 47, no. 1, p. 27. https://doi.org/10.3103/S0361521912060031
Ма Ф., Байкенов М.И., Амерханова Ш.K., Шляпов Р.М., Уали А.С. // ХТТ. 2011. № 5. С. 67. [Solid fuel chemistry, 2013, vol. 45, no. 5, p. 353. https://doi.org/10.3103/S0361521912060031
Балпанова Н.Ж., Гюльмалиев А.М., Панкин Ю.Н., Айтбекова Д.Е., Ма Ф., Су К., Кайкенов Д.А., Байкенова Г.Г., Борсынбаев А.С., Байкенов М.И. // ХТТ. 2019. № 5. С. 68. [Solid fuel chemistry, 2019, vol. 53, no. 5, p. 319. https://doi.org/10.3103/S0361521919050021
Гюльмалиев А.М., Головин Г.С., Гладун Т.Г. Теоретические основы химии угля. М.: Изд-во МГУ, 2003. 556 с.
Малолетнев А.С., Кричко А.А., Гаркуша А.А. Получение синтетического жидкого топлива гидрогенизацией углей. М: Недра, 1992. 128 с.
Яблонский Г.С., Спивак С.И. Математические модели химической кинетики. М.: Знание, 1977. 64 с.
Вержбицкий В.М. Основы численных методов. М.: Высшая школа, 2002. 840 с.
Рейзлин В.И. Численные методы оптимизации. Томск: Изд-во Томск. политех. ун-та, 2011. 105 с. URL. http://window.edu.ru/resource/650/75650/files/OPTIMISATION.pdf (дата обращения 18.12.2019).
Патраков Ю.Ф., Федорова Н.И., Семенова С.А. // ХТТ. 2007. № 4. С. 2. [Solid fuel chemistry, 2007, vol. 41, no. 4, p. 195.]
Yizhao Li, Fengyun Ma, Xintai Su, Chao Sun, Jianchao Liu, Zhiqiang Sun, YanglongHou // Catalysis Communications. 2012. № 26. P. 231.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива