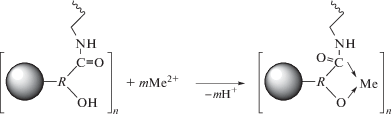Химия твердого топлива, 2020, № 4, стр. 49-56
ВЛИЯНИЕ РАЗЛИЧНЫХ ФАКТОРОВ НА СОРБЦИЮ МЕТАЛЛОВ (Co2+, Ni2+) МОДИФИЦИРОВАННЫМ ГУМАТОМ НАТРИЯ
У. Ж. Джусипбеков 1, *, Г. О. Нургалиева 1, А. К. Шакирова 1, **, З. К. Баяхметова 1, А. С. Таубаева 1
1 АО “Институт химических наук имени А.Б. Бектурова”
050010 Алматы, Казахстан
* E-mail: ics_rk@mail.ru
** E-mail: Sh_ainura1029@mail.ru
Поступила в редакцию 14.10.2019
После доработки 15.11.2019
Принята к публикации 30.03.2020
Аннотация
Рассмотрены сорбционные свойства модифицированного сорбента этилендиамин гумата (ЭДА-Г) по отношению к ионам металлов Co2+ и Ni2+. Представлены результаты влияния нормы сорбента (0.05–2.0 г), времени процесса (15–120 мин) и концентрации металлов (0.005, 0.05, 0.5 г/л). Выявлено опережающее извлечение кобальта(II) в растворах с низкой и средней концентрацией металлов (0.005–0.05 г/л), а никеля(II) – в растворах с высокой концентрацией катионов (0.5 г/л). На основании данных физико-химических методов анализа можно предположить, что при сорбции металлов Cо(II) и Ni(II) сорбентом происходит процесс комплексообразования с сорбентом.
Гуминовые вещества (ГВ) – природные органические соединения, в состав которых входит от 50 до 90% органического вещества торфа, углей, являются смесью высокомолекулярных веществ сложного строения, замещенных различными функциональными группами, и относятся к экологически чистым, не токсичным, дешевым органическим соединениям природного происхождения с сорбционными свойствами [1, 2]. Благодаря своему химическому строению гуминовые вещества могут подвергаться химической модификации, обеспечивать способность образовывать стабильные комплексы с катионами тяжелых металлов [3]. Одним из эффективных путей создания новых сорбентов на основе гуминовых соединений (ГС) является проведение химической модификации таким способом, после которого усиливаются уже имеющиеся свойства и появляются новые.
В литературе представлены методы метилирования ГВ. Модификацию проводили с использованием метилирующих агентов: диазометана [4, 5], метилиодида в присутствии окиси серебра, метанола в присутствии HСl или BF3 [6] и диметилсульфата [7]. При помощи диазометана в эфирном растворе происходило метилирование как фенольных гидроксилов, так и карбоксильных групп. Варьируя методы метилирования и последующей обработки производного, определяли содержание карбоксильных, фенольных и спиртовых групп в структуре ГВ. В работах [8, 9] проводили опыты метилирования с помощью диметилсульфата, что приводило к модификации фенольных и спиртовых групп в ГВ. При метилировании метанолом протекает реакция по их карбоксильным группам.
Модификацию ГВ проводили триметилсилилированием с последующей регистрацией и обработкой 29Si-ЯМР-спектров [10]. Согласно экспериментальным данным, реакция триметилсилилирования ГВ протекает с замещением силильной группы протонов в различных функциональных группах (–OH, =NH, –NH2, –SH, –COOH). Это приводит к дезинтегрированию ГВ. Модификация ГВ путем силилирования позволяет регистрировать ЯМР-спектры с более высоким разрешением пиков [11].
В работе [12] поглощающий композит получали полимеризацией в водном растворе акриловой кислоты и акриламида с использованием N,N'-метилен-бисакриламида в качестве агента поперечной сшивки и персульфата аммония в качестве инициатора в присутствии гумата натрия и каолина. Исследовали скорость набухания и влияние различных солевых растворов и рН внешних растворов на абсорбцию воды сверх поглощающими композитами. Результаты показали, что композиты, содержащие 20% гумата натрия, а также 30% каолина, проявляют максимальную абсорбцию воды – 450 и 39 г/л в 0.9%-ном растворе NaCl.
Многочисленными исследованиями была проведена модификация ГК синтетическими полимерами. Реакции привитой сополимеризации и сополиконденсации являются основными методами введения синтетических полимеров в состав природных полимеров [13, 14]. Были проведены работы по прививке виниловых мономеров, таких как акрилонитрил, метилметакрилат акриловой кислоты, акриламид, простые виниловые эфиры, на гуминовую кислоту (ГК). Прививку осуществляли путем сополимеризации в водно-органической и водной среде при разных рН, в присутствии перекисных или окислительно-восстановительных инициаторов, тем самым создавая на ГК активные центры, на которых происходит полимеризация мономеров. Полученные привитые сополимеры ГК – эффективные структурообразователи почв, оказывают высокий ростостимулирующий и удобряющий эффект [15]. В работе [16] изучена сополиконденсация ГК с малеиновым ангидридом в различных диполярных апротонных растворителях в присутствии минеральных кислот. Сополимеры малеинового ангидрида могут вступать в различные химические реакции благодаря высокой реакционной способности ангидридных групп.
В настоящее время наибольший интерес вызывают модифицированные формы гуминовых соединений, которые могут эффективно связывать тяжелые металлы, образуя нерастворимые комплексные соединения [17]. В связи с этим исследования комплексообразования и сорбционных свойств гуминовых соединений с тяжелыми металлами весьма актуальны.
Соединение кобальта и никеля относится к растворимым солям, а ионы Co2+, Ni2+ токсичны и способны к концентрированию и накоплению в живых организмах. В связи с этим необходима очистка воды, в том числе сточных вод, от указанных катионов.
МЕТОДЫ АНАЛИЗА
В исследовании были использованы известные методы определения физико-химических свойств сорбентов: инфракрасная спектроскопия (ИКС), атомно-абсорбционная спектрофотометрия (ААС), сканирующая электронная микроскопия (СЭМ).
ИК-спектры снимали на инфракрасном спектрофотометре “Perkin Elmer Spectrum 100” и на двухлучевом спектрофотометре “Specord M-80” в спектральной области 225–4000 см–1. Образцы для исследования готовили по стандартной методике запрессовки с KBr. Перед снятием ИК-спектров исследуемое вещество в количестве 0.4–1.0 мг вводилось в навеску бромистого калия и прессовалось в таблетку.
Электронные микроскопические снимки образцов были выполнены на СЭМ фирмы JEOL (Япония) марки “JXA-8230” и на модели FEI “QUANTA 250 FEG” (Нидерланды), в котором одновременно работает EDAX-устройство (рентгеноспектральный микроанализатор). EDAX-устройство может работать одновременно на СЭМ, который сочетает в себе элементный и структурный анализы.
Выход гуминовых кислот в исследуемых образцах определяли по ГОСТу 9517-94 [18], зольность – ГОСТу 11022-95 [19], влагу – ГОСТу 11014-2001 [20].
Определение содержания металлов в растворах проводили на ААС фирмы “Perkin Elmer AAnalyst 400 ” (США) и марки “ICE 3000 Series” (США).
ХАРАКТЕРИСТИКА ОБЪЕКТОВ ИССЛЕДОВАНИЯ И ИСХОДНЫЕ МАТЕРИАЛЫ
Для работы использовали гумат натрия, полученный экстракцией из бурого угля Шубаркульского месторождения (Республика Казахстан, Алматинская обл.) со следующими характеристиками: выход гуминовых кислот (НАdaf) – 55.3%; влажность (W а) – 18.9%; зольность (Аа) – 25.8%; средний показатель отражения витринита (Ro,r) составляет 1.12%, (σR) – 0.04%; высшая теплота сгорания на влажное беззольное состояние ($Q_{s}^{{daf}}$) – 22.9 МДж/кг; выход летучих веществ на сухое беззольное состояние (Vdaf) – 46%.
Модификацию гумата натрия проводили с применением этилендиамина при температуре 30°C и продолжительности процесса 48 ч. Получен модифицированный этилендиамином гумат (ЭДА-Г) со следующими характеристиками, мас. %: выход гуминовых кислот (НАdaf) 54.0; влажность (W а) 18.0; зольность (Аа) 28.0. По классификации IUPAK, модифицированный сорбент имеет пористую структуру с удельной поверхностью, равной 450 м2/г; общим объемом пор 0.23 см3/г; диаметром пор 25.1 нм, что указывает на наличие в пористой структуре образца достаточного количества микропор. Механическая прочность модифицированного сорбента ЭДА-Г (D) равна 89%. Полученный сорбент выдерживает три цикла регенерации без потери физико-химических и сорбционных свойств.
Для изучения сорбционных свойств полученного сорбента были выбраны соли металлов Co(CH3COO)2 · 4H2O и NiSO4 · 6H2O. К определенному объему раствора соли с определенной концентрацией металлов, которая варьировалась от 0.005 до 0.5 г/л, прибавляли навески сорбента (0.05; 0.10; 0.25; 0.50; 1.0; 1.5; 2.0 г), соотношение Т : Ж = 1 : 50, и встряхивали в водяном встряхивателе при комнатной температуре 25°С в течение 15–120 мин. Далее содержимое флаконов центрифугировали в течение 30 мин при 6000 об/мин и затем фильтровали. Остаточную концентрацию металлов в фильтрате определяли на атомно-абсорбционном спектроскопе (ААС).
Степень сорбции (R, %) находили по разности исходной и равновесной концентрации растворов металлов, которую определяли на ААС и рассчитывали по формуле
где Cо – начальная концентрация ионов металла в растворе, мг/л; Ср – концентрация ионов металла в растворе после взаимодействия с сорбентом, мг/л.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Представлены результаты по изучению процесса сорбции катионов Co2+ и Ni2+ гуматом натрия, модифицированным этилендиамином, в водной среде.
Исследовано влияние нормы сорбента (0.05–2.0 г), времени процесса (15–120 мин) и концентрации металлов (0.005; 0.05; 0.5 г/л) на сорбционную способность модифицированного сорбента ЭДА-Г по отношению к ионам двухвалентных металлов.
В табл. 1 и на рис. 1 представлены результаты по влиянию нормы сорбента и времени на степень сорбции катионов Cо(II) и Ni(II) в растворе с их содержанием 0.005 г/л. Согласно полученным результатам, повышение нормы сорбента и времени процесса способствует возрастанию сорбционной способности модифицированного гумата по отношению к сорбируемым катионам. Так, при сорбции ионов Co2+ из раствора с концентрацией 0.005 г/л Co2+ и норме сорбента 0.05 г на 100 г очищаемого раствора в течение 15 мин процесса сорбируется 70.0% катионов (табл. 1). Резкое увеличение степени сорбции до 96% наблюдается при норме сорбента 0.5 г уже при 15 мин процесса. Наибольшее значение степени сорбции в растворе (97.3%) достигается также при норме сорбента 2 г за 15 мин процесса.
Таблица 1.
Влияние нормы сорбента и времени на степень сорбции ионов Cо(II) при концентрации кобальта 0.005 г/л
| Норма сорбента, г | Степень сорбции, % | |||
|---|---|---|---|---|
| 15 мин | 30 мин | 60 мин | 120 мин | |
| 0.05 | 70.0 | 74.0 | 79.0 | 80.0 |
| 0.10 | 98.6 | 98.7 | 98.8 | 98.8 |
| 0.25 | 96.0 | 97.0 | 98.5 | 98.8 |
| 0.50 | 96.0 | 97.5 | 98.6 | 98.9 |
| 1.0 | 97.0 | 97.8 | 98.5 | 99.0 |
| 1.5 | 97.0 | 98.0 | 99.0 | 99.1 |
| 2.0 | 97.3 | 98.4 | 99.1 | 99.4 |
Рис. 1.
Влияние нормы сорбента и времени на степень сорбции ионов Ni(II) при концентрации никеля 0.005 г/л.
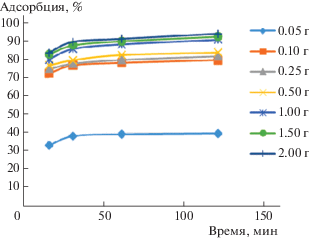
Из рис. 1 видно, что при сорбции ионов Ni2+ из раствора с их концентрацией 0.005 г/л Ni2+ за 15 мин и норме сорбента 0.05 г на 100 г очищаемого раствора степень сорбции составляет 33.5%, при норме сорбента 0.5 г – 76.5%, а при 2 г – 83.9%.
Из полученных данных следует, что в исследуемых условиях сорбент ЭДА-Г проявляет предпочтительную сорбционную способность по отношению к катионам Co2+.
Влияние нормы сорбента и времени на сорбционную способность ЭДА-Г в растворе с более высокой концентраций ионов Co2+ и Ni2+ (0.05 г/л) представлено на рис. 2. Полученные результаты свидетельствуют о том, что с повышением нормы сорбента и времени степень сорбции катионов кобальт (II) увеличивается (рис. 2,а). Например, в течение 15 мин при норме сорбента 0.05 г на 100 г очищаемого раствора степень сорбции катионов Co2+ составляет 44.0%, а через 30, 60 и 120 мин соответственно достигает 46.0, 53.0, 62.0% (рис. 2,а). При дальнейшем повышении нормы сорбента до 0.5 г и времени от 15 до 30 мин степень сорбции увеличивается и составляет соответственно 82.0 и 84.0%, а при 60–120 мин достигает 87.6–91.0%. Степень сорбции кобальта значительно повышается при норме сорбента 2 г на 100 г раствора и за 15 мин процесса составляет 97.3%, за 30–60 мин – 98.4–99.1%, а за 120 мин увеличивается до 99.4%.
Рис. 2.
Влияние нормы сорбента и времени на степень сорбции ионов Cо(II) и Ni(II) при концентрации 0.05 г/л: Cо(II) – (а), Ni(II) – (б).
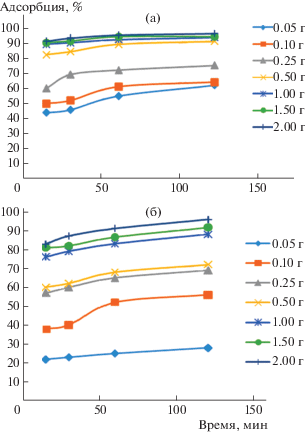
Как видно из рис. 2,б, кривые сорбции ионов никеля (II) в исследуемом растворе (СNi = 0.05 г/л) с повышением времени возрастают. Одновременное повышение нормы сорбента и времени процесса увеличивает степень сорбции ионов Ni2+. Так, при повышении нормы сорбента от 0.1 до 2 г и времени от 15 до 120 мин степень сорбции увеличивается с 72.6 до 94.2%. Причем высокая степень извлечения Ni2+ наблюдается уже при 15–30 мин процесса. Например, за 15 мин и норме сорбента 0.05 г степень сорбции составляет 22.0%, а за 30, 60 и 120 мин достигает соответственно 23.0; 25.0; 28.5%. При повышении нормы сорбента до 0.5 г и времени от 15 до 30 мин степень сорбции увеличивается и составляет соответственно 61.5 и 63.5%, а при 60–120 мин достигает 68.5–71.5%. Степень сорбции значительно повышается при норме сорбента 2 г и в течение 15 мин процесса и достигает 83.9%, при 30–60 мин – 89.8–92.5%, а при 120 мин степень сорбции увеличивается до 94.2%. Проведенные исследования также показали опережающее извлечение новым сорбентом ионов Cо(II) по сравнению с ионами Ni(II).
Влияние нормы сорбента и времени на сорбционную способность ЭДА-Г в растворе с еще более высокой концентраций ионов Co2+ и Ni2+ (0.5 г/л) представлено на рис. 3. Исследование процесса сорбции катионов Cо(II) и Ni(II) из раствора с более высокой концентрацией Co2+ (0.5 г/л) выявило, что с увеличением расхода сорбента и времени процесса степень извлечения катионов сорбентом повышается. Так, при 15 мин процесса степень сорбции модифицированным сорбентом равна 5.0% и при 120 мин – 14.0% (рис. 3,а), а в случае использования нормы сорбента 2.0 г в течение 15 мин степень сорбции составляет 60.0% и при 120 мин процесса степень сорбции достигает 70.0%. Что же касается сорбции катионов Ni2+, то при 15 мин процесса степень сорбции модифицированным сорбентом равна 15.0%, а при 120 мин – 21.0% (рис. 3,б), а в случае использования нормы сорбента 2.0 г в течение 15 мин степень сорбции составляет 79.0%, далее при 120 мин процесса степень сорбции достигает 88.6%.
Рис. 3.
Влияние нормы сорбента и времени на степень сорбции ионов Cо(II) и Ni(II) при концентрации 0.5 г/л: Cо(II) – (а), Ni(II) – (б).
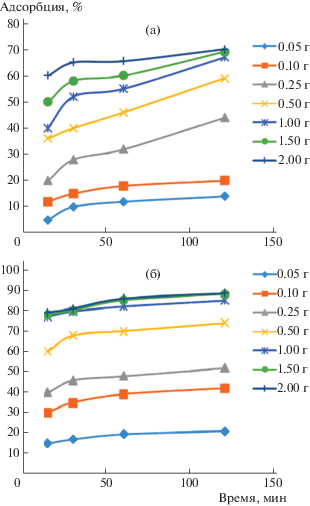
За 15 мин процесса при расходе модифицированного сорбента 0.5 г на 100 г раствора степень сорбции ионов Ni2+ на 10% больше, чем катионов в Со, а при норме сорбента 2 г на 100 г раствора – на 19%. Данная закономерность сохраняется во всем исследуемом интервале времени и соотношении Т : Ж.
Исходя из полученных результатов следует, что в концентрированном по содержанию катионов растворе (0.5 г/л) модифицированный сорбент проявляет предпочтительную сорбционную способность по отношению к катионам Ni2+.
Анализ полученных результатов показал, что наибольшая степень сорбции кобальта и никеля проявляется в металлсодержащих растворах низких и средних концентраций. Например, при норме сорбента 2 г на 100 г очищаемого раствора за 15 мин степень сорбций из растворов с ССо = = 0.005 и 0.05 г/л равна 97.3%, а из раствора с ССо = 0.5 г/л – 60%. Данная закономерность сохраняется и при очистке никельсодержащих растворов.
Таким образом, сорбционная способность модифицированного сорбента в значительной мере зависит от концентрации сорбируемых катионов. Причем в низкоконцентрированных растворах (0.005 и 0.05 г/л) сорбент ЭДА-Г оказывает предпочтительную сорбционную способность по отношению к катионам Со2+, а в концентрированных растворах (0.5 г/л) – по отношению к катионам Ni2+.
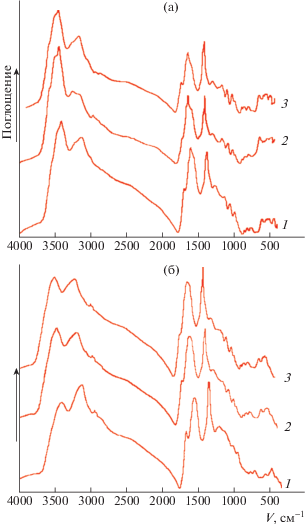
Анализ ИК-спектров образцов, выделенных из кобальт- и никельсодержащих растворов, показал присутствие на всех спектрах интенсивных полос поглощения в области 3414–3418 см–1 (рис. 4) и 3102–3225 см–1 в спектрах гумата никеля (рис. 4,б), характерных для колебаний NH- и ОН-групп. При этом с ростом концентрации металлов в растворе происходит перераспределение интенсивности этих частот, что обусловлено усилением водородных связей. Кроме того, в спектрах исследуемых образцов со стороны низких частот прописываются новые полосы поглощения: 3111.5 см–1 для гумата кобальта и 2944 см–1 для гумата никеля, характерные для валентных колебаний алифатических СН2-групп (кривые 3).
На ИК-спектрах кобальтсодержащего гумата полосы поглощения с частотами 2940 см–1 (рис. 4,а, кривая 2) и 2920 и 2939 см–1 (кривая 3) соответствуют валентным колебаниям атомов водорода, связанных с углеродом в метиленовых группах. Слабовыраженная частота 1704 см–1, относящаяся к колебанием карбоксильной группы, смещается в область низких частот 1611, 1613, 1618 и 1384 см–1 с усилением интенсивности. Эти полосы поглощения характеризуют асимметричные и симметричные колебания карбоксилат-аниона. Кроме того, в ИК-спектрах образцов имеется ряд характеристических полос валентных колебаний νС–О (1258, 1271 см–1) и νС–N (1085, 1087, 1088, 1142 см–1). Появление в спектре кобальтсодержащего гумата частот 411, 412, 416 см–1, характерных валентным колебаниям связи νMe–O, а также полос поглощения 512, 517 и 525 см–1, соответствующих колебаниям связи νMe–N, указывает на сорбцию ионов кобальта ЭДА-Г-сорбентом и подтверждает образование связи νCo–О в образовавшихся комплексах.
На ИК-спектрах никельсодержащих образцов, выделенных при разных концентрациях никеля(II), характеристическая полоса поглощения при 1705 см–1 относится к карбоксильной группе (рис. 4,б, кривая 1), которая с ростом концентрации катионов Ni2+ исчезает (кривые 2, 3), но при этом в спектре образцов появляются новые частоты 1593, 1598 и 1384 см–1, относящиеся к ионизированной форме карбоксильной группы, т.е. к карбоксилат-аниону. Не исключено, что две полосы поглощения 1593 и 1598 см–1 могут относиться и к деформационным колебаниям N–Н-групп. Наличие интенсивных полос поглощений 1088, 1252, 1276 см–1 связано с колебаниями С–N-связи алифатических аминов, обеспечивающее убедительные доказательства присутствия аминогрупп в исследуемых образцах. Кроме того, в ИК-спектрах образцов ЭДА-Г-сорбента, выделенного после сорбции катионов Ni2+, фиксируются новые частоты 536, 537, 538, 619, 620 см–1, характерные колебаниям связей νМе–N и νМе–О, интенсивность которых усиливается с ростом концентрации никеля в растворе (кривые 2, 3). Анализ ИК-спектров подтверждает образование никельсодержащего комплекса.
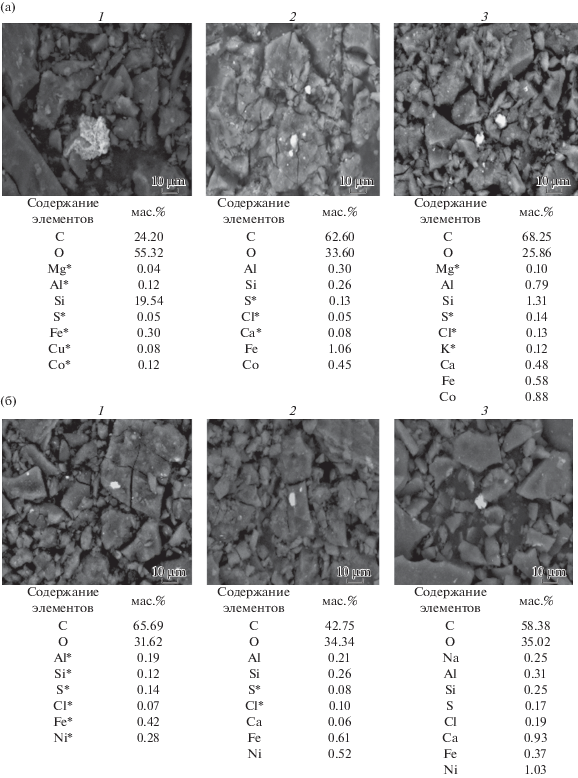
Электронно-микроскопические снимки образцов, выделенных после сорбции при норме сорбента 2.0 г и времени 120 мин процесса при разных концентрациях катионов (Со2+, Ni2+), представлены на рис. 5.
На микрофотографии образца ЭДА-Г-Cо с ростом концентрации катиона Со2+ происходит увеличение щелевидных пор и изменение формы поверхности сорбента, возрастает зернистость сорбента (рис. 5,а). Морфология поверхности представляет собой укрупненные и мелкие частицы темного цвета. Элементный состав ЭДА-Г-Co-образцов показывает, что содержание кобальта составляет 0.12; 0.45; 0.88 вес. %.
На электронно-микроскопическом снимке образца ЭДА-Г-Ni с увеличением концентрации никеля(II) на поверхности возрастает доля крупных кристаллов. На поверхности увеличиваются щели и трещины (рис. 5,б). Данные элементного состава показали, что в исследуемых образцах содержание никеля составило 0.28; 0.52; 1.03 вес. %.
На основании литературных и экспериментальных данных и привлечением методов сканирующей электронной микроскопии и ИК-спектроскопического анализа выявлено, что связывание модифицированных гуматов с ионами тяжелых металлов (комплексообразование) происходит за счет донорно-акцепторного взаимодействия атома азота аминной группы и атома кислорода гидроксильной ОН-группы по следующей схеме:
Таким образом, выявлено, что процесс сорбции ионов Co2+ и Ni2+ модифицированным этилендиамин гуматом (ЭДА-Г) зависит от нормы сорбента, времени процесса и концентрации катионов. Установлены закономерности сорбции катионов от исследуемых факторов. Показано, что степень сорбции ионов тяжелых металлов модифицированным сорбентом увеличивается: Co2+ > Ni2+. Методами сканирующей электронной микроскопии и ИК-спектроскопического анализа установлено комплексообразование модифицированным сорбентом с ионами тяжелых металлов и представлен механизм процесса. Выявлено, что связывание ЭДА-Г-сорбента с катионами происходит за счет донорно-акцепторного взаимодействия атома азота аминной группы и атома кислорода гидроксильной ОН-группы.
Список литературы
Будаева А.Д., Золтоев Е.В., Хантургаева Г.И., Жамбалова Б.С. // Химия в интересах устойчивого развития. 2008. № 2. С. 251.
Erdogan S.A., Baysal A.K., Akba O.R., Hamamci C.T. // Polish of Environ. Stud. 2007. № 5. P. 706.
Novak J.P., Kozler J.S., Janus P.J., Cezikova J.S., Tokarova V.S., Madronova L.A. // React. Funct. Polym. 2001. V. 47. P. 213.
Arsenie I.S., Boren H.T., Allard B.A. // Sci. Total Environ. 1992. V. 116. P. 275.
Almendros G.S., Dorado J.E. // European Journal of Soil Science. 1999. V. 50. P. 294.
Noyes T.I., Leenheer J.A. // Geological survey water-supply paper. 1994. P. 208.
Stevenson F.J., Goh K.M. // Soil Sci. 1972. V. 113. № 5. P. 397.
Arsenie I.S., Boren H.D., Allard B.B. // Sci. Total Environ. 1992. V. 116. P. 286.
Briggs G.C., Lawson G.J. // Fuel. 1970. V. 49. P. 101.
Herzog H.D., Burba P.S., Buddrus J.V. // Anal.Chem. 1996. V. 354. № 3. P. 402.
Dec J.F., Haider K.G., Shaffer A.A. // Environ. Sci. Technol. 1997. V. 31. P. 3134.
Hua Shui-bo, Zheng Yi-an, Wang Ai-qin // Polym. Mater. Sci. Technol. 2008. № 7. P. 204.
Аккулова З.Г., Утегенова А.С., Жубанов Б.А., Амирханова А.К., Карабаев К.У. // Изв. HAH PK. Сер. хим. 2004. № 5. С. 231.
Утегенова А.С., Аккулова З.Г., Амирханова А.К., Жакина А.Х., Сулейменова А.А. // Материалы международной науч. конф. “Взаимодействие гуминовых кислот с простыми виниловыми эфирами”. Караганда: Изд-е КарГУ, 2005. С. 326.
Сафанов С.А., Ахмедов К.С. Гуминовые удобрения, теория и практика их применения. М.: Наука, 1967. 125 с.
Касаточкин В.И., Нефедова Л.Н., Ларина Н.К. // ХТТ. 1971. № 5. С. 97.
Жернакова З.М., Деева Н.Н., Печерских Е.Г., Поляков Е.В. // Вода: химия и экология. 2011. № 6. С. 91.
Межгосударственный стандарт ГОСТ 9517-94 (ИСО 5073-85). Топливо твердое. Методы определения выхода гуминовых кислот. М.: Изд-во стандартов, 1996. 9 с.
Межгосударственный стандарт ГОСТ 11022-95 (ИСО 1170-97). Топливо твердое минеральное. Методы определения зольности. М.: Изд-во стандартов, 2007. 6 с.
Межгосударственный стандарт ГОСТ 27314-91 (ИСО 589-81). Топливо твердое минеральное. Методы определения влаги. М.: Изд-во стандартов, 2007. 10 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива