Химия твердого топлива, 2020, № 4, стр. 3-7
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАТИВНЫХ И МОДИФИЦИРОВАННЫХ ГУМИНОВЫХ КИСЛОТ
С. И. Жеребцов 1, *, Н. В. Малышенко 1, **, К. С. Вотолин 1, ***, К. М. Шпакодраев 1, ****, З. Р. Исмагилов 1, *****
1 ФГБУН Федеральный исследовательский центр угля и углехимии СО РАН
650000 Кемерово, Россия
* E-mail: sizh@yandex.ru
** E-mail: profkemsc@yandex.ru
*** E-mail: kostvot@mail.ru
**** E-mail: shpakodraevkm@mail.ru
***** E-mail: zinfer1@mail.ru
Поступила в редакцию 10.03.2020
После доработки 24.03.2020
Принята к публикации 30.03.2020
Аннотация
Получены образцы нативных и модифицированных пероксидом водорода гуминовых кислот (ГК), выделенных из бурых углей Тисульского месторождения Канско-Ачинского бассейна. Образцы ГК охарактеризованы инструментальными методами: элементным и техническим анализом, ЭПР-спектроскопией. Модифицирование ГК влияет на структурно-групповой состав и уменьшает содержание парамагнитных центров (ПМЦ). Методом фитотестирования на примере семян сортовой пшеницы “Ирень” проведена оценка биологической активности (БА) нативных и модифицированных гуминовых кислот. Наибольшая БА проявляется при концентрации ГК 0.005%. Выявлена тенденция снижения биологической активности при уменьшении содержания ПМЦ.
ВВЕДЕНИЕ
Гуминовые кислоты – природные высокомолекулярные соединения нерегулярного строения, содержащиеся в торфе, бурых и окисленных каменных углях, почве, донных отложениях. Полученные из разных источников ГК различаются по элементному составу, степени конденсированности, замещенности ароматических ядер, соотношению гидрофильных и гидрофобных фрагментов. В состав макромолекул ГК входят различные функциональные группы: карбонильные, карбоксильные, гидроксильные. Благодаря уникальности своего строения ГК способны вступать в окислительно-восстановительные реакции, реакции комплексообразования и ионного обмена с катионами металлов, что в свою очередь определяет широкий спектр их применения [1]. Как сорбенты катионов различных металлов ГК применяются для борьбы с химическими загрязнениями, очистки промышленных стоков, детоксикации загрязненных почв и т.д. Они используются для ремедиации и рекультивации деградированных почв, улучшая их структуру и повышая плодородие. В последнее время возрос интерес к применению гуминовых кислот и препаратов на их основе в сельском хозяйстве в качестве стимуляторов роста растений. В результате повышается урожайность культур, резистентность к заболеваниям, сокращается поступление тяжелых металлов и радионуклидов в растения. В настоящее время накоплен большой экспериментальный опыт, свидетельствующий о положительном влиянии биологической активности (БА) гуминовых веществ на урожайность и качество сельскохозяйственных культур [2]. Обнаружена полуколичественная взаимосвязь БА и содержания парамагнитных центров (ПМЦ) [3], хиноидных групп и фенольных гидроксилов, степени ароматичности (fa) [4, 5]. Показано, что соотношение гидрофильно-гидрофобных фрагментов в структуре ГК – один из определяющих факторов их биологической активности [6]. Однако взгляды на природу биологической активности ГК неоднозначны и противоречивы. В настоящее время нет четкого понимания, какие структурные параметры ГК являются определяющими для проявления биологической активности.
В последнее время большой интерес исследователей направлен на химическое модифицирование гуминовых кислот, дающее возможность получить препараты на их основе с ценными свойствами, превосходящими свойства исходных ГК. С помощью направленного химического модифицирования за счет изменения функционально-группового состава можно повысить сорбционную способность, биологическую активность, регулировать окислительно-восстановительные свойства [7, 8]. Модификация ГК может быть использована для исследования структуры, а также для установления связи структура—свойство. Для модифицирования применяются различные реакции, например окислительно-восстановительные, гидролиза, алкилирования, ацилирования и т.д. Проведение реакций гидробромирования ГК, введение в их структуру индолсодержащих фрагментов способствует повышению БА [8, 9]. В работе [10] исследована биологическая активность природных и модифицированных ГК и показано, что окисленные перманганатом калия, а также алкилированные метилом ГК – самые эффективные по сравнению с исходными гуминовыми кислотами. Ранее было показано [7, 11, 12], что окисление гуминовых кислот пероксидом водорода увеличивает содержание карбонильных, карбоксильных, кислородосодержащих алкильных фрагментов. В результате этого повышается сорбционная способность ГК по отношению к катионам металлов (Cu2+,, Zn2+, Co2+, Mn2+). Модифицирование пероксидом водорода снижает содержание ПМЦ в гуминовых кислотах по сравнению с исходными, так как Н2О2 как источник ОН-радикалов и кислорода может приводить к гибели органических радикалов [13].
Цель настоящей работы – изучение зависимости биологической активности от содержания ПМЦ нативных и модифицированных пероксидом водорода гуминовых кислот, выделенных из бурых углей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения гуминовых кислот использовали образцы бурого угля Тисульского месторождения Канско-Ачинского бассейна (БУТС) и его окисленной в пласте формы (БУТСО). Гуминовые кислоты выделяли из угля обработкой раствором гидроксида натрия и последующим осаждением соляной кислотой [14]. Характеристики образцов исследуемых бурых углей и полученных из них гуминовых кислот приведены в табл. 1. Окисленный уголь отличается более высокой степенью ароматичности (С/Н = 1.72) и более высоким выходом гуминовых кислот.
Таблица 1.
Технический и элементный анализ исследуемых образцов, %
| Образец | W a | Ad | V daf | Cdaf | Hdaf | (O + N +S)daf по разности | С/Н атом. | $({\text{HA}})_{t}^{{daf}}$ |
|---|---|---|---|---|---|---|---|---|
| БУТС | 8.0 | 6.1 | 48.1 | 64.3 | 4.7 | 31.0 | 1.1 | 21.3 |
| БУТСО | 13.5 | 46.6 | 90.8 | 55.1 | 2.7 | 42.2 | 1.7 | 60.9 |
| ГК БУТС | 4.9 | 9.2 | – | 59.1 | 4.9 | 36.0 | 1.0 | – |
| ГК БУТСО | 7.0 | 15.2 | – | 61.6 | 5.4 | 33.0 | 1.0 | – |
Модифицирование гуминовых кислот пероксидом водорода проводилось следующим образом: к определенному объему растворов, содержащих 5 г гумата натрия, при постоянном перемешивании на магнитной мешалке из бюретки добавляли по каплям с одинаковой скоростью пероксид водорода (С = 32%, V = 5, 10, 15 мл), после добавления Н2О2 перемешивали еще 5 мин и осаждали ГК соляной кислотой.
Полученные осадки отфильтровали, промывали водой до pH дистиллированной воды, высушивали при температуре 70°С до постоянного веса.
Спектры ЭПР исследуемых образцов регистрировали при комнатной температуре на ЭПР-спектрометре “BrukerEMX-m40X” на частоте 9.86 ГГц. Условия записи ЭПР-спектров для всех образцов идентичны: уровень мощности 1.8–1.9 мВт, частота модуляции 100 кГц. Для определения количества органических парамагнитных центров (ПМЦ) в качестве стандарта использовали ионы Mn2+ в оксиде магния MgO. Характеристики ЭПР-спектров рассчитывали с помощью программы BrukerWinEPR.
Для установления зависимости “структура–свойство” были проведены тесты (фитотестирование) [15, 16] с использованием сортовых семян пшеницы “Ирень”. Определение биологической активности ГК в виде гуматов натрия (ГумNa), концентрация 0.01, 0.005 и 0.0005%, полученных как из исходных, так и модифицированных пероксидом водорода гуминовых кислот, проводили в соответствии с ГОСТ 12038-84 и ГОСТ 54221-2010 [17, 18]. Для этого семена проращивали при постоянной температуре 20°С в темноте в специальных растильнях – лотках. Биологическую активность нативных и модифицированных ГК оценивали по величине интегрального индекса фитоактивности (ИФ) с учетом трех тест-функций: энергии прорастания семян (ЭП), длины корня (ДК) и высоты проростка (ВП). Величина ИФ является обобщающим индексом, отражает отклонения от контроля и вычисляется как средняя величина суммы показателей ЭП, ДК и ВП, выраженная в долях единицы:
Повторность эксперимента трехкратная: по 50 семян в каждом лотке для каждого вида ГК и столько же для контроля. Для контрольного теста использовалась дистиллированная вода. ЭП, ВП и ДК, а также количество корней (КК) замеряли на 5 сут.
Относительная ошибка во всех экспериментах составляла 3–5% для уровня значимости α = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
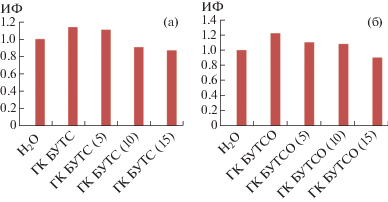
В табл. 2 приведены экспериментальные данные по определению биологической активности гуминовых кислот посредством фитотестирования, в процессе которого были установлены не только эффекты, стимулирующие развитие растений, но и подавление тех или иных тест-функций. Одним из факторов, влияющих на биологическую активность, является концентрация используемых гуминовых препаратов. При концентрации 0.005% наблюдается наибольшее значение ИФ для всех исследуемых образцов гуминовых препаратов (табл. 2).
Таблица 2.
Величины тест-функций и интегральный индекс фитоактивности гуминовых препаратов
| № | Образец | Концентрация, % | КК | ДК | ВП | ЭП | ИФ | ПМЦ × 10–18, спин/г |
|---|---|---|---|---|---|---|---|---|
| % к контролю | ||||||||
| 1 | ГумNa БУТС | 0.005 | 115 | 118 | 109 | 115 | 1.14 | 7.57 |
| 2 | ГумNa БУТС | 0.0005 | 102 | 96 | 108 | 107 | 1.04 | – |
| 3 | ГумNa БУТС | 0.001 | 102 | 94 | 100 | 93 | 0.96 | – |
| 4 | ГумNa БУТС (5) | 0.005 | 113 | 104 | 118 | 112 | 1.11 | 3.77 |
| 5 | ГумNa БУТС (10) | 0.005 | 107 | 91 | 88 | 93 | 0.91 | 3.12 |
| 6 | ГумNa БУТС (15) | 0.005 | 103 | 83 | 78 | 101 | 0.87 | 2.87 |
| 7 | ГумNa БУТСО | 0.005 | 104 | 123 | 138 | 106 | 1.22 | 0.87 |
| 9 | ГумNa БУТСО | 0.0005 | – | 101 | 103 | 108 | 1.04 | – |
| 10 | ГумNa БУТСО (5) | 0.005 | 101 | 101 | 125 | 103 | 1.10 | 0.56 |
| 11 | ГумNa БУТСО (10) | 0.005 | 99 | 105 | 120 | 98 | 1.08 | 0.29 |
| 12 | ГумNa БУТСО (10) | 0.0005 | – | 101 | 103 | 108 | 1.04 | – |
| 13 | ГумNa БУТСО (15) | 0.005 | 101 | 85 | 79 | 107 | 0.90 | 0.28 |
При этом следует отметить положительное влияние ГК на энергию прорастания семян, длину корней и высоту проростков. Более высокая биологическая активность свойственна гуматам, полученным из естественно-окисленной формы бурого угля (ГумNa БУТСО), применение которого дает максимальные значения высоты проростка и длины корня (38 и 23% к контролю). На примере модифицированных ГумNa БУТСО показано, что уменьшение концентрации гуминовых препаратов от 0.005 до 0.0005% также приводит к снижению ИФ.
Химическое модифицирование, изменяя функционально-групповой состав гуминовых кислот [19], должно оказывать влияние на биологическую активность ГК. Действительно, как видно из табл. 2, применение модифицированных пероксидом водорода ГК приводит к уменьшению значений тест-функций и индекса фитоактивности для всех исследуемых образцов по сравнению с нативными.
При этом наблюдается незначительное уменьшение количества корней. При обработке семян препаратами ГумNa БУТС (10), ГумNa БУТС (15), ГумNa БУТСО (15) индекс фитоактивности ниже ИФ в контрольных опытах с водой (рис. 1). Значения всех тест-функций ДК, ВП и ЭП в этих опытах ниже контрольных.
Рис. 1.
Индекс фитоактивности нативных и модифицированных гуминовых кислот, полученных из бурых углей БУТС (а) и БУТСО (б).
В табл. 2 также представлено содержание ПМЦ исследуемых образцов нативных и модифицированных гуминовых кислот. Оценивая связь биологической активности ГК с парамагнитными свойствами, следует отметить о наличии тенденции снижения значений ИФ с понижением содержания ПМЦ в процессе модификации гуминовых кислот пероксидом водорода. Нативные гуминовые кислоты с более высоким уровнем парамагнетизма наиболее биологически активны. Линейная зависимость имеет довольно низкие коэффициенты детерминации R2 = 0.6 для ГК БУТС и 0.7 для ГК БУТСО (рис. 2).
Рис. 2.
Зависимость индекса фитоактивности от содержания ПМЦ нативных и модифицированных пероксидом водорода гуминовых кислот, полученных из бурых углей БУТС (а) и БУТСО (б).
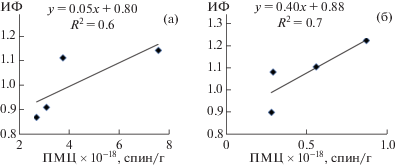
Вероятно, связь между содержанием ПМЦ и биологической активностью не является простой и однозначной. Есть мнение, что парамагнетизм ГК обусловлен синергическим эффектом взаимодействия ароматических систем полисопряжения и водородных связей, образованных функциональными группами [20], и определяется содержанием хиноидных групп и фенольных гидроксилов [4]. Таким образом, направленная химическая модификация ГК может изменить функционально-групповой состав ГК, а контроль содержания ПМЦ позволит оценить биологическую активность ГК.
Список литературы
Stevenson F.J. Humus Chemistry. Second Edition. N.Y.: John Wiley & Sons. Inc. 1994. 496 p.
Senesi E.N., Miano T.M. Humic substances in global environment and implication on humin health. Amsterdam: Elsevier Sci., 1994. 910 p.
Чуков С.Н., Талашкина В.Д., Надпорожская М.А. // Почвоведение. 1995. № 2. С. 169.
Кухаренко Т.А. // ХТТ. 1976. № 2. С. 24.
Жеребцов С.И., Малышенко Н.В., Вотолин К.С., Андроханов В.А., Соколов Д.А., Дугаржав Ж., Исмагилов З.Р. // ХТТ. 2019. Т. 53. № 3. С. 19. [Solid Fuel Chemistry. 2019. Vol. 53, no. 3. p. 145. https://doi.org/10.3103/S0361521919030121.]https://doi.org/10.1134/S0023117719030137
Бямбагар Б., Кушнарев Д.Ф., Федорова Т.Е., Новикова Л.Н., Яковлева Ю.Н., Островская Р.М., Пройдаков А.Г., Калабин Г.А. // ХТТ. 2003. № 1. С. 83.
Жеребцов С.И., Малышенко Н.В., Смотрина О.В., Брюховецкая Л.В., Исмагилов З.Р. // Химия в интересах устойчивого развития. 2016. Т. 24. № 3. С. 399. https://doi.org/10.15372/KhUR20160316
Лебедева Г.Ф., Яркова Т.А., Платонов В.В., Проскуряков В.А., Чернышева Н.И. // ЖПХ. 2005. Т. 78. Вып. 8. С. 1384.
Яркова Т.А. // ХТТ. 2011. № 4. С. 49.
Dobbss L.B., Canellas L.P., Olivares F.L. Aguiar N.O., Peres L.E., Azavedo M., Spaccini R., Picollo A., Facanha A.R. // J. Agric. Food Chem. 2010. V. 58. № 6. P. 3681.
Малышенко Н.В., Жеребцов С.И., Смотрина О.В., Брюховецкая Л.В., Исмагилов З.Р. // Химия в интересах устойчивого развития. 2015. Т. 23. № 4. С. 451. https://doi.org/10.15372/KhUR20150415
Жеребцов С.И., Малышенко Н.В., Брюховецкая Л.В., Исмагилов З.Р. // Коксихимия. 2017. № 11. С. 43.
Нонхибел Д., Уолтон Дж. Химия свободных радикалов. М.: Мир, 1977. 606 с.
Тайц Е.М., Андреева И.А. Методы анализа и испытания углей. М.: Недра, 1983. 301 с.
Воронина Л.П., Якименко О.С., Терехова В.А. // Агрохимия. 2012. № 6. С. 50.
Вавилов П.П., Гриценко В.В., Кузнецов В.С. Практикум по растениеводству. М.: Колос, 1983. 352 с.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М.: Издательство стандартов, 1984. 30 с.
ГОСТ Р 54221-2010. Гуминовые препараты из бурых и окисленных каменных углей. Методы испытания. М.: Стандартинформ, 2012. 10 с.
Жеребцов С.И., Малышенко Н.В., Брюховецкая Л.В., Лырщиков С.Ю., Никитин А.П., Исмагилов З.Р. // Кокс и химия. 2018. Т. 61. № 10. С. 28. [Coke and Chemistry. 2018. Vol.61, no. 10. p. 396. https://doi.org/10.3103/S1068364X18100083.]
Наумова Г.В., Стригуцкий В.П., Жмакова Н.А., Овчинникова Т.Ф. // ХТТ. 2001. № 2. С. 3.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива


