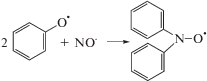Химия твердого топлива, 2020, № 5, стр. 71-78
ВЛИЯНИЕ ОКИСЛИТЕЛЯ НА ВОЗГОРАНИЕ УГЛЕЙ
Д. В. Мирошниченко 1, *, В. Н. Назаров 1, **, Ю. В. Николайчук 1
1 Национальный технический университет “Харьковский политехнический институт”
61002 Харьков, Украина
* E-mail: dvmir79@gmail.com
** E-mail: PIREN66@yandex.ru
Поступила в редакцию 30.05.2019
После доработки 29.07.2019
Принята к публикации 25.11.2019
Аннотация
Предложены схемы возможных химических реакций взаимодействия органической массы углей с продуктами разложения нитрита натрия при определении температур возгорания неокисленного (восстановленного), исследуемого и окисленного угля согласно ДСТУ 7611:2014 “Уголь каменный. Метод определения окисленности и степени окисленности”. Проведены исследования по определению температуры возгорания 170 проб неокисленных углей различных типов Украины, РФ, Канады, Австралии, Чехии, Польши и Индонезии и дана оценка влияния состава, строения и свойств этих углей на величину температуры возгорания. Установлена тесная взаимосвязь температуры возгорания неокисленных углей с содержанием в них органического (Cdaf) и ароматического (Cар) углерода, структурным параметром δ, характеризующим степень ненасыщенности структуры ОМУ, а также показателями отражения витринита (Rо) и выхода летучих веществ (V daf).
ВВЕДЕНИЕ
Для определения склонности углей к окислению и самовоспламенению, а также для установления степени их окисленности были предложены лабораторные методы, которые базируются на различии физических и химических свойств окисленных и неокисленных углей. В настоящее время указанные показатели определяют согласно ДСТУ 7611:2014 “Уголь каменный. Метод определения окисленности и степени окисленности”. Сущность метода состоит в нагревании навески угля в смеси с твердым окислителем в приборе специальной конструкции. В качестве окислителя используют нитрит натрия или смесь его с нитратом калия. Требования, предъявляемые к окислителям, изложены в [1].
Образец испытуемого воздушно-сухого угля крупностью менее 0.15 мм в количестве 0.5 г смешивают с 0.25 г тщательно высушенного измельченного нитрита натрия и помещают в пробирку с газоотводной трубкой. Пробирку с реакционной смесью нагревают в электрической печи со скоростью 4.5–5°C/мин. По достижении определенной температуры в пробирке создаются условия для прохождения бурной реакции окисления, сопровождающейся взрывообразным выделением газов и резким повышением давления, а в отдельных случаях появлением пламени. Эту температуру отмечают и принимают за температуру воспламенения (возгорания) испытуемого угля. Опыт повторяют, за результат принимают среднее значение из двух опытов. При этом для определения температуры возгорания неокисленного (восстановленного) угля (tзв) смешивают 0.5 г угля с 0.25 г нитрита натрия и 0.0125 г бензидина; температуры возгорания испытуемого угля (tз) – 0.5 г угля с 0.25 г нитрита натрия; температуры возгорания окисленного угля (tзо) – 2.0 г угля предварительно обрабатывают 1.0 см3 перекиси водорода, смесь выдерживают в течение 24 ч в темном месте до полного испарения окислителя. От сухого окисленного образца угля отбирают навеску массой 0.5 г и смешивают с 0.25 г нитрита натрия [1].
Механизм взаимодействия углей с окислителем нитритом натрия до настоящего времени еще не выяснен. В данной статье сделана попытка рассмотреть наиболее вероятные химические реакции, которые могут происходить с угольной загрузкой под воздействием окислителя и нагревания.
По современным научным представлениям, среднестатистическая элементарная структурная единица макромолекул витринитов углей разной степени метаморфизма (содержание углерода от 70.5 до 89.0%) гибридная, т.е. построена из ароматического ядра и связанных с ним в качестве боковых цепей гидроароматическими, гетероциклическими и алифатическими группами атомов. При этом как с боковыми цепями, так и с ядерной частью структурных единиц макромолекул веществ углей химически связаны те или иные кислородсодержащие функциональные группы [2, 14]. Для спекающихся каменных углей 24–28% кислорода витринитов приходится на гидроксильные группы, около 8% – на карбонильные группы и 11–13% – на карбоксильные. В сумме это составляет 43–49%, и такой кислород, по мнению ряда авторов, считается реакционноспособным в отличие от нереакционноспособного, к которому относят кислород мостикового типа, а также его атомы, входящие в состав различных гетероциклических структур [1, 2, 14].
Анализ спектров ЯМР витринитов каменных углей показал наличие значительного количества мостиковых метиленовых групп, меньшего метильных групп и значительно меньшего алифатических группировок, содержащих третичные атомы углерода [6]. В ядерной части макромолекул как правило насчитывается от 2 до 5 ароматических колец различного строения [2, 14].
Большинство из перечисленных атомных группировок способно вступать в реакцию с продуктами разложения нитрита натрия. Наиболее высокой реакционной способностью макромолекул витринитов углей обладают структуры фенолов. Способность фенолов углей легко окисляться отмечали многие исследователи [1, 2, 7, 10, 15]. Тронов – основатель фенольной теории окисления углей, считал, что “из всех изученных органических веществ первое место по активности при окислении занимают фенолы” [11]. С учетом этой позиции предложена следующая последовательность возможных химических реакций окисления углей под воздействием нитрита натрия, приводящая к их воспламенению.
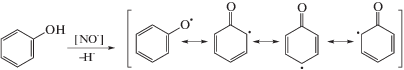
Окислитель нитрит натрия плавится при температуре 271°С, а при дальнейшем нагревании разлагается, генерируя парамагнитные окислы азота [12], по схеме:
Появление в смеси с углем реакционноспособных свободных радикалов вызывает развитие процессов окисления продуктов термической деструкции угля, многие из которых протекают по цепному свободно-радикальному механизму [13, 15].
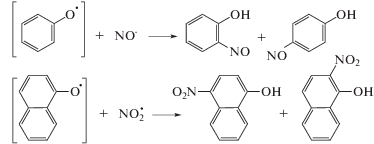
Атака радикалов окислителя начинается на фенольный гидроксил, что приводит к отрыву атомов водорода и образованию стабильных фенокси-радикалов [3]:
Последние могут легко димеризоваться, диспропорционировать, давать продукты замещения атомов водорода в ароматическом кольце и глубоко окисляться до двухатомных фенолов и хинонов [1, 3, 15].
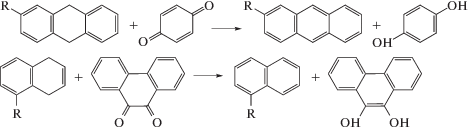
По мнению авторов, наиболее важную роль на последующих стадиях процессов окисления и самоокисления углей играют образовавшиеся хиноны.
Последние, как известно, – продукты окисления фенолов, считаются сильными окислителями для некоторых классов органических соединений [3, 5]. Под воздействием хинонов особенно легко протекают реакции дегидрирования циклических углеводородов и переход их в ароматические структуры, что является окислением. В литературе приведены значения окислительно-восстановительных потенциалов некоторых наиболее распространенных хинонов [5], анализ которых показывает, что подобные соединения с хиноидной структурой и высоким потенциалом вполне могут выступать в качестве окислителей для оставшейся неокисленной части макромолекул угля. Накопление хиноидных структур в элементарных единицах макромолекул витринитов скорее всего будет способствовать развитию процессов самоокисления:
Ароматические ядра молекул фенолов также отличаются высокой реакционной способностью. Под влиянием электронов гидроксильных групп электронная плотность ароматических колец повышается, в результате чего облегчается прохождение реакций с различными электрофильными частицами и радикалами, в том числе с парамагнитными окислами азота. При этом образуется смесь различных изомерных нитрозо- и нитросоединений согласно представленным схемам реакций:
Продукты нитрования – ароматические нитросоединения, традиционно являются сильными окислителями, обладающими большим запасом химической энергии [1] и активно участвующими в реакциях дегидрирования и самоокисления угля.
Подобные превращения возможны не только в конденсированных ароматических ядрах, но и в боковых алифатических структурах. Так, атака нитрозо-радикалов по вторичному атому азота может привести к появлению арильных радикалов [4]:
Сформировавшиеся арильные радикалы в свою очередь могут образовывать новые парамагнитные группировки, например дизамещенные нитроксильные радикалы:
Выделяющийся в реакциях атомарный водород может взаимодействовать между собой и с оксидами азота, что приводит к обрыву цепей отдельных реакций, однако накопившаяся азотистая кислота, как и нитрит натрия, в условиях опыта разлагается пополняя реакционную смесь новыми свободными радикалами:
Таким образом, повсеместное дегидрирование различных атомных группировок макромолекул угля под воздействием “своих” сформировавшихся окислителей – основа процесса самоокисления угля, который имеет циклический характер, так как сами окислители восстанавливаются при этом до первоначальных структур и становятся способными к новым процессам окисления.
Насколько интенсивно пройдут дальнейшие реакции самоокисления угля, закончится ли данный процесс воспламенением испытуемого образца зависит от температуры нагревания, химического строения и степени метаморфизма макромолекул угля, а также от соотношения скоростей экзотермических реакций окисления и отвода тепла в окружающее пространство [8, 9, 13]. Если скорость химических реакций будет существенно превышать скорость отвода тепла, то произойдет прогрессивное саморазогревание смеси, которое завершится тепловым самовоспламенением или взрывом [1, 7, 16].
Для определения температуры возгорания неокисленного (восстановленного) угля в реакционную смесь вместе с окислителем добавляют бензидин – типичный ароматический амин. Добавка бензидина, обладающего восстановительными свойствами, в опытах определения температуры возгорания неокисленного (восстановленного) угля сводится к нейтрализации действия избытка свободных радикалов в реакционной смеси, что позволяет получать значения температур возгорания, наиболее близкие к таковым для свежих неокисленных углей.
Для ускоренного окисления углей в лаборатории чаще всего используют перекись водорода или азотную кислоту. Доказано, что на первом этапе в результате воздействия указанных окислителей на поверхности угля формируются кислородсодержащие функциональные группы: карбоксильные и гидроксильные (фенольные и спиртовые) [17]. Более продолжительное действие окислителей приводит ко второму этапу окисления, при котором гидроксильные группы веществ угля образуют с окислителем гидропероксиды. Такие реакции с участием 30%-ной перекиси водорода протекают по схеме: ${\text{R}}{\kern 1pt} - {\kern 1pt} {\text{OH}} + {\text{HOOH}} \to {\text{R}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{H}} + {{{\text{H}}}_{2}}{\text{O}}$, где R – углеродсодержащие вещества угля.
Гидропероксиды – неустойчивые соединания, при нагревании и в присутствии свободных радикалов легко разлагаются. Разложение обычно начинается гомолитическим разрывом связи О–О, которая наименее прочная в молекулах гидроперекисей. Энергия этой связи – 143 кДж/моль [18]:
Можно предположить, что бурное разложение гидропероксидов окисленного угля начинается под воздействием внесенного в него нитрита натрия (точнее продуктов его разложения), что вызывает цепные реакции окисления продуктов деструкции угля. Эти многочисленные экзотермические реакции приводят к выделению значительного количества тепла. Образец угля быстро разогревается, происходит его возгорание. Температура возгорания такого предварительно окисленного перекисью водорода угля, как правило, наиболее низкая.
Температура возгорания (воспламенения) – это наименьшая температура, при которой происходит резкое увеличение скорости экзотермических объемных реакций, приводящее к возникновению пламенного горения и/или взрыва. Такая температура требуется для достижения необходимой энергии активации реакции горения [19].
В работах [1, 8, 9, 13] показано, что важнейшим фактором, влияющим на температуру возгорания неокисленных углей, является степень их метаморфизма.
Диапазон значений температур возгорания (tзв) неокисленных коксующихся углей, согласно работе [1], приведен в табл. 1.
Следует отметить, что предложенный в [1] диапазон изменения температур возгорания неокисленных углей имеет незаполненные интервалы на температурной шкале. Значения температур возгорания от 340 до 350, от 360 до 365, от 370 до 375°С не соответствуют ни одной марке угля, что может быть вызвано, недостаточным количеством исследованных проб углей. Кроме того, нет сведений о показателях качества марок углей в использованной автором классификации. Например, в каком диапазоне показателей отражения витринита, выхода летучих веществ или толщины пластического слоя находились исследованные угли каждой конкретной марки?
С учетом сказанного, а также внедрения метода определения окисленности в схему контроля качества углей на коксохимических производствах Украины были изучены факторы, влияющие на температуру возгорания неокисленных углей (tзв) на основе исследования углей различных типов.
Были исследованы 170 углей разных типов, в том числе: 50 проб углей Украины; 78 – РФ и 42 – дальнего зарубежья (США, Канада, Австралия, Чехия, Польша, Индонезия) [20–22].
В табл. 2–4 приведены максимальные, минимальные и средние значения показателей технологических свойств, петрографических характеристик, элементного состава и структурных параметров исследованных проб углей. Структурные параметры рассчитывали по формулам работ [20–22].
Таблица 1.
Значения температур возгорания неокисленных углей разных марок
| Марка | Температура возгорания неокисленного угля, tзв, °С |
|---|---|
| Г | 320–340 |
| Ж | 350–360 |
| К | 365–370 |
| ОС | 375–380 |
Таблица 2.
Технологические свойства исследованных проб углей
| Значение | Технический анализ, % | Температура возгорания неокисленного угля, tзв, °С | |||
|---|---|---|---|---|---|
| Wа | Ad | $S_{t}^{d}$ | Vdaf | ||
| Максимальное | 3.8 | 12.4 | 3.26 | 43.4 | 418 |
| Минимальное | 0.2 | 3.7 | 0,13 | 16.7 | 341 |
| Среднее | 1.4 | 8.4 | 0.83 | 30.0 | 384 |
Таблица 3.
Петрографическая характеристика исследованных проб углей
| Значение | Средний показатель отражения витринита, % | Петрографический состав (без учета минеральных примесей), % | ||||
|---|---|---|---|---|---|---|
| Максимальное | 1.60 | 99 | 4 | 77 | 10 | 79 |
| Минимальное | 0.53 | 20 | 0 | 1 | 0 | 1 |
| Среднее | 1.04 | 71 | 1 | 26 | 2 | 27 |
Таблица 4.
Элементный состав и структурные параметры исследованных проб углей
| Значение | Элементный состав, % | Структурный параметр | |||||
|---|---|---|---|---|---|---|---|
| Cdaf | Hdaf | Ndaf | $S_{t}^{d}$ | ${\text{O}}_{d}^{{daf}}$ | δ | Сар, % | |
| Максимальное | 91.19 | 6.42 | 2.99 | 3.26 | 10.75 | 10.42 | 35.19 |
| Минимальное | 80.79 | 4.64 | 0.85 | 0.13 | 1.31 | 7.62 | 14.30 |
| Среднее | 86.81 | 5.43 | 1.95 | 0.83 | 4.96 | 9.18 | 23.03 |
Таблица 5.
Коэффициенты парной корреляции r и значения ${\text{|}}r{\text{|}}\sqrt {n - 1} $ исследованных взаимосвязей
| Показатель | V daf, % | Vt, % | ΣОК, % | R0, % | Cdaf, % | Hdaf, % | ${\text{O}}_{d}^{{daf}}$, % | δ | Сар, % |
|---|---|---|---|---|---|---|---|---|---|
| r | –0.915 | –0.389 | 0.410 | 0.917 | 0.914 | –0.637 | –0.113 | 0.880 | 0.910 |
| ${\text{|}}r{\text{|}}\sqrt {n - 1} $ | 10.763 | 3.827 | 4.051 | 7.878 | 10.901 | 6.106 | 1.218 | 9.949 | 7.974 |
Для исследованной выборки рассчитывали коэффициенты парной корреляции между показателями свойств углей и величиной температуры возгорания tзв (табл. 5).
Значимость коэффициентов корреляции r проверяли путем сравнения абсолютной величины произведения ${\text{|}}r{\text{|}}\sqrt {n - 1} $ с его критическим значением (H) при заданной надежности вывода (P) [23]. Критическое значение H при вероятности Р = 0.999 для 170 проб составляет 3.291.
В табл. 5 показаны значения коэффициентов корреляции r и указанного произведения ${\text{|}}r{\text{|}}\sqrt {n - 1} $ для каждой изученной взаимосвязи. Как видно из приведенных данных, наибольшие значения коэффициентов корреляции (r = 0.88–0.915) установлены между температурой возгорания и показателями Cdaf, Сар, δ, R0, Vdaf, характеризующими состав, строение и свойства органической массы угля (ОМУ). Для указанных взаимосвязей характерны также максимальные значения произведения ${\text{|}}r{\text{|}}\sqrt {n - 1} $, что свидетельствует об их высокой надежности.
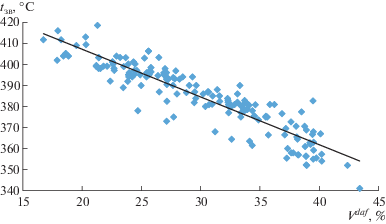
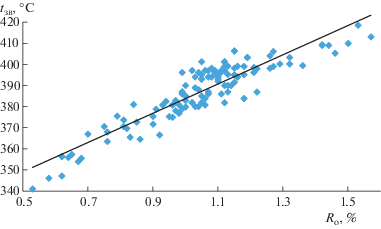
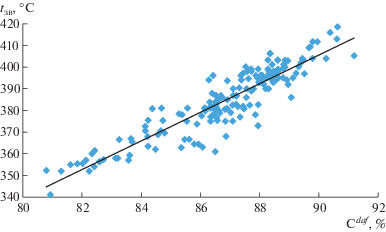
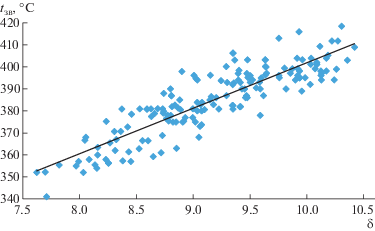
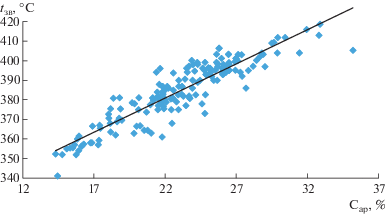
На рис. 1–5 приведены графические зависимости температуры возгорания tзв от основных показателей свойств углей. Анализируя графические зависимости, можно констатировать, что они носят линейный характер.
В табл. 6 приведены математические уравнения (1)–(5) и статистическая оценка зависимостей температуры возгорания от исследованных показателей свойств углей. Анализ полученных уравнений и их статистической оценки показывает, что изученные взаимосвязи характеризуются высокими коэффициентами корреляции (0.88–0.92) и детерминации (77.4–84.2%).
Таблица 6.
Математические уравнения и их статистическая оценка
| Номер уравне-ния | Вид уравнения | Статисти-ческая оценка* | |
|---|---|---|---|
| r | D, % | ||
| (1) | tзв = –2.2691Vdaf + 452.59 | 0.91 | 83.7 |
| (2) | tзв = 69.31Rо + 314.47 | 0.92 | 84.2 |
| (3) | tзв = 6.6134Cdaf – 189.63 | 0.91 | 83.7 |
| (4) | tзв = 20.673δ + 195.16 | 0.88 | 77.4 |
| (5) | tзв = 3.4929Cар + 304.04 | 0.91 | 82.7 |
Исходя из показателей, с которыми закоррелирована величина tзв, можно сделать вывод, что последняя является параметром, зависящим от содержания углерода и степени упорядоченности структуры органической массы неокисленного угля. Повышение ее абсолютной величины связано с ростом в угле содержания общего (Cdaf) и ароматического (Cар) углерода, а также степени ненасыщенности (δ) его структуры.
Величина температуры возгорания также возрастает с ростом величины показателя отражения витринита и снижением выхода летучих веществ угля.
По разработанным математическим уравнениям (1) и (2) были рассчитаны значения температур возгорания коксующихся углей разных марок в рамках вновь введенного в Украине ДСТУ 3472:2015 “Угли бурые, каменные и антрацит. Классификация”. В табл. 7 приведены расчетные значения температур возгорания, а также их интервалы для марок и групп коксующихся углей.
Таблица 7.
Значения температур возгорания марок и групп коксующихся углей в рамках ДСТУ 3472:2015
| Марка угля | Обозначение | Показатель отражения витринита, Rо, % | Выход лету-чих веществ, V daf, % | Температура возгорания, tзв, °С | |||
|---|---|---|---|---|---|---|---|
| марка | группа | по (2) | по (1) | объединенный интервал | |||
| Газовый | Г | Г1 | 0.60–0.69 | 38–44 | 356–362 | 353–366 | 353–366 |
| Г2 | 0.70–0.79 | 36–42 | 363–369 | 357–371 | 357–371 | ||
| Газовый жирный отощенный | ГЖО | 0.80–0.89 | 33–39 | 370–376 | 364–378 | 364–378 | |
| Газовый жирный | ГЖ | 0.80–0.89 | 33–38 | 370–376 | 366–378 | 366–378 | |
| Жирный | Ж | 0.90–1.19 | 28–36 | 377–397 | 371–389 | 371–397 | |
| Коксовый | К | К1 | 1.04–1.19 | 28–30 | 387–397 | 385–389 | 385–397 |
| К2 | 1.20–1.49 | 18–28 | 398–418 | 389–412 | 389–418 | ||
| Отощенный спекающийся | ОС | 1.50–1.69 | 14–22 | 418–432 | 403–421 | 403–432 | |
В отличие от приведенной табл. 1 градации температуры возгорания неокисленных коксующихся углей в зависимости от их марочной принадлежности, в табл. 7 дополнительно приведены значения показателей качества (Rо и Vdaf) угля каждой марки или группы, а также ликвидированы “пробелы” в значениях температур возгорания между отдельными марками и группами каменных углей во всем температурном диапазоне.
На основании проведенных исследований можно сделать следующие выводы:
впервые комплексно проанализированы и показаны схемы возможных химических реакций взаимодействия вещества угля с продуктами разложения нитрита натрия в процессе определения температуры возгорания угля;
установлено что величина tзв – технологический параметр, зависящий от состава и степени упорядочения органической массы неокисленного угля. Повышение величины температуры возгорания вызвано ростом в угле содержания общего (C daf) и ароматического (Cар) углерода, а также степени ненасыщенности (δ) его структуры. Соответственно, увеличение выхода летучих веществ и снижение показателя отражения витринита приводит к снижению температуры его возгорания;
рассчитаны значения температур возгорания коксующихся углей отдельных марок и групп в рамках ДСТУ 3472:2015 “Уголь каменный. Метод определения окисленности и степени окисленности”.
Список литературы
Веселовский В.С. Химическая природа горючих ископаемых. М.: АН СССР, 1955. 424 с.
Нестеренко Л.Л., Бирюков Ю. В., Лебедев В.А. Основы химии и физики горючих ископаемых. Киев: Вища шк., 1987. 360 с.
Робертс Дж., Касерио М. Основы органической химии. М.: Мир, 1968. Т. 2. 550 с.
Кери Ф., Сандберг Р. Углубленный курс органической химии. М.: Химия, 1981. Т. 1. 520 с.
Лейрд Т. Хиноны. Общая органическая химия. Кислородсодержащие соединения. М.: Химия, 1982. Т. 2. 856 с.
Глущенко И.М. Теоретические основы технологии горючих ископаемых. М.: Металлургия, 1990. 296 с.
Кучер Р.В., Бутузова Л.Ф., Компанец В.А. Структура ископаемых углей и их способность к окислению. Киев: Наук. думка, 1980. 168 с.
Butuzova L., Krzton A., Saranchuk V., et al. // Fuel. 1994. V. 73. P. 945.
Бутакова В.И., Попова В.К., Посохов Ю.М., Кузнецова Н.П. // Кокс и химия. 2013. № 7. С. 2 [Coke and Chemistry. 2013. V. 56. № 7. P. 225. DOI: 10.3103/S1068364X13070028].
Тронов Б.В. О механизме окисления каменного угля кислородом воздуха // Изв. Томского индустриального ин-та, 1940. Т. 60. Вып. 3. С. 11.
Тронов Б.В. // ЖПХ. 1940. Т. 13. № 7. С. 1053.
Девис Д., Перрет М. Свободные радикалы в органическом синтезе. М.: Мир, 1980. 206 с.
Саранчук В.И., Ошовский В.В., Власов Г.А. Физико-химические основы переработки горючих ископаемых. ДонГТУ. Східний видавничий дім, 2001. 304 с.
Улановский М.Л. // Кокс и химия. 2012. № 7. С. 5 [Coke and Chemistry. 2012. V. 55. № 7. P. 256. DOI: 10.3103/S1068364X12070095]
Саранчук В.И., Русчев Д., Семененко В.К. Окисление и самовозгорание твердого топлива. Киев: Наук. думка, 1994. 264 с.
Rosema H., Guan H. // Fuel. 2001. V. 80. P. 7.
Кузин Н.А. // Адсорбция и адсорбенты. 1974. № 2. С. 10.
Нейланд О.Я. Органическая химия. М.: Высш. шк., 1990. 752 с.
Корольченко А.Я., Корольченко А.А. Пожаро-взрывоопасность веществ и материалов и средства их тушения. М.: Асс. “Пожнаука”, 2004. Ч. 1. 713 с.
Головко М.Б., Дроздник И.Д., Мирошниченко Д.В., Кафтан Ю.С. // Кокс и химия. 2012. № 6. С. 9 [Coke and Chemistry. 2012. V. 55. № 6. P. 204. DOI: 10.3103/S1068364X12060038]
Мирошниченко Д.В., Головко М.Б. // Кокс и химия. 2014. № 3. С. 32 [Coke and Chemistry. 2014. V. 57. № 3. P. 117. DOI: 10.3103/S1068364X14030041]
Мирошниченко Д.В. // Кокс и химия. 2003. № 4. С. 3–7.
Румшинский Л.З. Математическая обработка результатов эксперимента: справочное пособие. М.: Наука, 1971. 192 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива