Кинетика и катализ, 2019, T. 60, № 1, стр. 118-128
Влияние допирования щелочными элементами и условий синтеза на генезис фазового состава алюмохромых катализаторов
В. В. Чесноков 1, Н. Н. Болдырева 1, *, Л. С. Довлитова 1, Д. А. Зюзин 1, В. Н. Пармон 1, 2
1 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
2 ФГАОУ ВО Новосибирский национальный исследовательский государственный университет,
Факультет естественных наук
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: boldnn@catalysis.ru
Поступила в редакцию 14.05.2018
После доработки 28.09.2018
Принята к публикации 26.05.2018
Аннотация
Методами дифференцирующего растворения (ДР) и рентгеновской дифракции (РФА) исследовано влияние модифицирующих добавок и условий синтеза на генезис фазового состава алюмохромовых катализаторов. В качестве добавок вводили соли калия (KNO3) и лития (LiCl). Показано, что на формирование фаз оказывает влияние индивидуальная природа добавок. Несмотря на расположение в одной группе периодической системы, катионы калия и лития по-разному реагируют с фазой γ-Al2O3 в носителе: литий образует с окристаллизованной крупнодисперсной формой γ-Al2O3 твердый раствор LixAl1, а калий преимущественно остается на поверхности мелкодисперсной формы Al2O3 и частично образует с ней алюминат калия. Взаимодействие катионов лития с активным компонентом Сr(VI) катализатора приводит к образованию хромата лития аналогично реакции катиона калия с ${\text{CrO}}_{4}^{{2 - }}.$ Однако часть катионов лития внедряется в структуру твердого раствора замещения Cr(III) в γ-Al2O3, образуя твердые растворы внедрения (Al1Crx1–x2Liy1–y2).
ВВЕДЕНИЕ
Процессы дегидрирования углеводородов занимают важное место в химической промышленности. Дегидрированием получают ненасыщенные соединения, используемые в качестве мономеров при производстве синтетического каучука и пластмасс, в синтезе высокооктановых компонентов бензина и других важных химических продуктов. В настоящее время более половины мирового рынка промышленных катализаторов дегидрирования парафинов С3–С5 занимают нанесенные катализаторы на основе Cr2O3/Al2O3 с Al2O3 в качестве носителя [1–6].
Для улучшения свойств нанесенного катализатора используют разного рода добавки-промоторы [7, 8]. Действие вводимых соединений во многом определяется природой добавляемых веществ, методами введения добавок, их количеством, условиями термообработки и т.д. Все эти факторы обуславливают особенности взаимодействия добавленных элементов с носителем и активным компонентом катализатора. Добавки с носителем нередко образуют твердые растворы и соединения постоянного или переменного состава. Так, например, добавка катионов цинка в алюмохромовые системы приводит к образованию цинк-алюминиевой шпинели, из-за чего концентрация Cr(III) в объеме носителя уменьшается и повышается содержание активных мелкодисперсных частиц оксида хрома на поверхности носителя [10]. Присутствие катионов калия и циркония способствует увеличению концентраций водорастворимой формы шестивалентного хрома, в результате чего селективность катализатора растет [8]. Промотирование щелочноземельными элементами повышает термическую стабильность и улучшает механическую прочность носителя [7]. При введении катионов магния в оксид алюминия происходит формирование твердых растворов катионного типа. При температурах выше 900°С взаимодействие катиона-модификатора с носителем протекает обычно по твердофазному механизму.
Целью настоящей работы было изучение особенностей влияния на фазовый состав алюмохромовых катализаторов допирования катионами лития. По физико-химическим свойствам литий занимает особое положение среди щелочных металлов, являясь переходным к щелочноземельным элементам. Наибольшее сходство наблюдается у катионов лития и магния вследствие близости их ионных радиусов (0.78 и 0.74 Å соответственно), в то время как ионные радиусы катионов лития и калия существенно различаются (0.78 и 1.33 Å соответственно) [9]. В нашем исследовании мы применяли предварительное модифицирование литием как носителя γ-Al2O3, так и катализатора Cr2O3/γ-Al2O3. Предполагалось, что ионы лития так же, как ионы магния, будут внедряться в структуру оксида алюминия, затрудняя растворение оксида хрома в объеме носителя. В результате будет увеличиваться доля активного в дегидрировании мелкодисперсного Cr2O3 на поверхности катализатора. Кроме того, ожидалось, что присутствие лития, подобно калию, повысит концентрацию высокоокисленной формы хрома Cr(VI) за счет образования растворимых хроматов, что также приведет к росту активности катализатора. Для сравнения также было изучено взаимодействие добавок калия с носителем γ-Al2O3. Выбор солей KNO3 и LiCl связан с поиском ответа на вопрос, как ведут себя эти соли в процессе приготовления катализаторов.
Структуру алюмохромовых катализаторов сложно изучать традиционными физическими методами в связи с образованием высокодисперсных аморфных фаз [5, 11, 12]. В настоящей работе для изучения генезиса фазового состава промотированного катализатора Cr2O3/γ-Al2O3 был применен оригинальный разработанный в Институте катализа СО РАН химический метод фазового анализа – метод дифференцирующего растворения (ДР). Метод ДР дает возможность определять состав образующихся фаз и их распределение на поверхности и в объеме исследуемых объектов, получать уникальные данные о наличии и составе вещества малых фаз, аморфных модификаций фаз и фаз переменного состава. Результаты ДР-анализа можно сравнивать с данными других методов фазового анализа, однако чаще приходится констатировать лишь их согласованность на качественном уровне, поскольку, в отличие от метода ДР, результаты традиционных физических методов фазового анализа почти никогда не позволяют находить количественное содержание детектируемых фаз [13, 14].
Весьма перспективно использование метода ДР совместно с традиционным рентгенофазовым анализом (РФА), так как они хорошо дополняют друг друга и дают возможность получить достаточно полную информацию о фазовом составе исследуемого твердого объекта: о его кристаллических и рентгеноаморфных фазах [16–18].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
Для синтеза алюмохромового катализатора и промотированных образцов катализатора и носителя применяли оксид алюминия γ-Al2O3 (марка А-1) производства Рязанской катализаторной фабрики. Процесс приготовления образцов носителя состоял из стадий пропитки по влагоемкости дисперсного порошка γ-Al2O3 водными растворами CrO3, хлорида лития или нитрата калия. Порошок сушили при 150°С и прокаливали при 650°С в течение часа. Модифицированные литием алюмохромовые образцы получали пропиткой исходных форм катализатора хлоридом лития. Влияние температуры прокалки, времени термического воздействия и нанесения добавки калия на γ-Al2O3 изучали на калий-модифицированных образцах γ-Al2O3. Для этого проводили основное прокаливание при 650°С в течение часа и дополнительное при температуре 700°С в течение 4 и 8 ч. Концентрации вводимых элементов приведены в табл. 1.
Таблица 1.
Состав пропитанных образцов и температура их прокалки
| № образца | Состав образца, массовая доля элемента и носителя, %* | Температура прокалки, °C |
|---|---|---|
| 1 | 4.1% Li(25 г LiCl) + 95.9% γ-Al2O3 | 650 |
| 2 | 3% K(7.8 г KNO3) + 97% γ-Al2O3 | 650 |
| 3 | 5.5% K (14.2 г KNO3) + 94.5% γ-Al2O3 | 650 |
| 4 | 9.7% K (25.1 г KNO3) + 90.3% γ-Al2O3 | 650 |
| 5 | 9.7% K (25.1 г KNO3) + 90.3% γ-Al2O3 | 700 |
| 6 | 4% Cr (7.7г CrO3) + 96% γ-Al2O3 | 650 |
| 7 | 7.4% Cr (14.2 г CrO3) + 92.6% γ-Al2O3 | 650 |
| 8 | 10.4% Cr (20 г CrO3) + 89.6% γ-Al2O3 | 650 |
| 9 | 1% Li (6.1 г LiCl) + 12.3% Cr (23.6 г CrO3) + 87.7% γ-Al2O3 | 650 |
| 10 | 1.8% Li (11 г LiCl) + 11.6% Cr (22.3 г CrO3) + 86.6% γ-Al2O3 | 650 |
| 11 | 3.3% Li (20.2 г LiCl) + 10.4% Cr (20 г CrO3) + 86.3% γ-Al2O3 | 650 |
| 12 | 4.5% Li (27.5 г LiCl) + 9.5% Cr (18.2 г CrO3) + 86% γ-Al2O3 | 650 |
Рентгенофазовый анализ
Рентгенофазовый анализ (РФА) выполняли на дифрактометре HZG-4C (“Freiberger Prazisionsmechanik”, ГДР) с использованием излучения CuKα с длиной волны 1.54184 Å сканированием по точкам. Интервал сканирования 2θ = 10°–75°, шаг сканирования 0.1°, накопление в точке 10 с. Размер области когерентного рассеяния (ОКР) рассчитывали по формуле Селякова–Шеррера по интегральной полуширине дифракционных пиков 4.4.0 шпинельной структуры оксида алюминия; параметр элементарной ячейки определяли из положений пиков 4.4.0.
Метод дифференцирующего растворения
Исследования методом дифференцирующего растворения проводили на приборе “Стехиограф”, созданном в Институте катализа СО РАН, в режиме стехиографического титрования [13, 14]. Динамический режим титрования заключается в плавном повышении концентрации растворителя с помощью двух программированных насосов, работающих в паре по следующему алгоритму: первый насос начинал вводить по капиллярам в проточный реактор дистиллированную воду с максимальной скоростью, дальше по линейному закону его скорость затухала до нуля. Второй насос начинал работу с нулевой скорости и по тому же линейному закону увеличивал скорость до максимальной, доставляя в реактор водный раствор 3 M HCl. Далее, если не включать первый насос после его остановки, второй будет работать с максимальной скоростью до конца растворения вещества, вводя в реактор с пробой только 3 М HCl. Если проба в этих растворителях (H2O и 3 M HCl) не растворилась полностью, первый насос нужно настроить на ввод следующего более сильного растворителя (в нашем эксперименте это водный раствор 3.6 M HF) и запустить его в работу с нарастанием скорости. При этом второй насос начнет замедляться до своей остановки. Такой алгоритм работы насосов обеспечивает управление процессом растворения: можно менять природу растворителя, его концентрацию и время растворения выбранным растворителем. Так, в нашем эксперименте начинали растворение в дистиллированной воде, затем в нее плавно, по линейному закону, добавляли хлористоводородную кислоту (HCl), повышая ее концентрацию за 30 мин до 3 M. Далее меняли состав растворителя с 3 M HCl на фтористоводородную кислоту HF, доводя за 15 мин ее концентрацию до 3.6 М, после чего растворение продолжалось одной 3.6 М HF. Одновременно с увеличением концентрации растворителя поднимали температуру от 22 до 90°С. В качестве детектора-анализатора “Стехиографа” использовали атомно эмиссионной спектрометр с индуктивно-связанной плазмой PST (“BAIRD”, США). Поток растворенной пробы из реактора по капиллярам направляли непосредственно в плазму спектрометра. Элементный состав образующегося раствора измеряли каждые 3 с по аналитическим линиям (нм): Al – 308.2, K – 766.4, Li – 670.7, Cr – 267.7. Нижний предел обнаружения определяемых элементов (мкг/см3) был следующим: Al – 0.02, Cr – 0.01, K – 0.1, Li – 0.001. Программное обеспечение “Стехиографа” позволяет представлять результаты в виде кинетических кривых растворения каждого отдельного элемента (Эх) из состава образца в координатах “мМоль Эх–время”, которые выводятся на экране компьютера спектрометра. В таком виде кинетические кривые представляют собой источник информации о процессе растворения каждого отдельного элемента пробы. Для получения данных о фазах в растворенном веществе все кинетические кривые элементов распределяли по парам, находили значения концентраций каждого из элементов пары (Э1 и Э2) в один и тот же момент времени, а затем рассчитывали их атомные соотношения (моль Э1 : моль Э2). На основании полученных данных строили стехиограммы – зависимости атомных соотношений от времени. Наличие на этих графиках прямолинейных участков с одинаковым значением отношения моль Э1 : моль Э2 априори указывает на растворение на этом отрезке времени только одной фазы. По специальной программе расчетов фаз в методе ДР эту фазу можно определить количественно. Погрешность измерения концентрации элементов (мМоль) прибором PST составляла ±1–5 отн. %. Соответственно, погрешность определения атомных соотношений элементов Э1 и Э2 или, что то же самое, стехиометрических коэффициентов в эмпирических формулах фаз, равна ±0–5 отн. %. Погрешность измерения массовых долей фаз (%) в образце зависит от диапазона концентраций этих фаз: чем он ниже, тем больше погрешность. Так, для диапазона концентраций фаз 0.1–0.5% относительная погрешность оказывается равной 20%, для диапазона 0.5–5% составляет 10%, для диапазона 10–49% не превышает 1–3%.
Выбор условий проведения ДР-анализа, а также алгоритм расчета атомных соотношений элементов в исследуемых образцах и построения стехиограмм подробно описаны в [14, 15]. Поскольку кислород, водород, азот, хлор и некоторые другие легкие элементы методом атомно-эмиссионной спектрометрии (АЭС-ИСП) не детектируются, стехиометрические формулы фаз представлены в тексте в их фрагментарной (неполной) форме. Например, соединения хрома (Cr2O3 и CrO3) мы обозначаем как фрагментарную формулу (без кислорода) – Cr1 или Cr; соединение Li2CrO4 – как Li2Cr1; LiCl – как Li или Li1 и т.п.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фазовый состав образцов γ-Al2O3 и KNO3 + γ-Al2O3
По данным РФА используемая нами исходная форма оксида алюминия марки А-1, высушенная при 150°С, содержит фазы γ-Al2O3, гиббсита и байерита. Другие фазы оксида алюминия методом РФА не обнаруживаются, возможно, из-за их низких концентраций. Прокаливание носителя А-1 при 650°С приводит к разложению фаз гидроксидов алюминия (гиббсита и байерита) и уменьшению параметра элементарной ячейки а γ-Al2O3 (рис. 1), что может свидетельствовать о наличии смеси фаз оксида алюминия различных модификаций. При этом показатель дисперсности ОКР остается неизменным (45 Å). Пропитка раствором КNO3 носителя практически не меняет параметров его ячейки и ОКР. Небольшие изменения значений этих двух параметров у образцов КNO3 + γ-Al2O3 связаны только с температурой прокалки (табл. 2).
Рис. 1.
Дифрактограммы образцов γ-Al2O3 марки А-1: 1 – исходный, в котором Al(OH)3 (G) – гиббсит и Al(OH)3 (В) – байерит; 2 – прокаленный при 650°С.
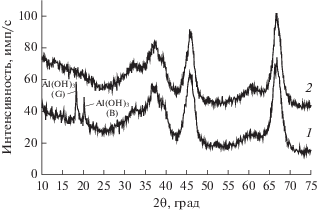
Таблица 2.
Рентгенографические характеристики для проб носителя γ-Al2O3 (A-1) и образцов KNO3 + γ-Al2O3
| Образец | Температура прокалки, °С | Размер ОКР, Å | Параметр элементарной ячейки, Å |
|---|---|---|---|
| γ-Al2O3 исходный | 150 | 45 | 7.923 |
| γ-Al2O3 прокаленный | 650 | 45 | 7.916 |
| 9.7% K (25.1 г KNO3) + 90.3% γ-Al2O3 | 150 | 45 | 7.923 |
| 3% K (7.8 г KNO3) + 97% γ-Al2O3 | 650 | 50 | 7.912 |
| 5.5% K (14.2 г KNO3) + 94.5% γ-Al2O3 | 650 | 50 | 7.914 |
| 9.7% K (25.1 г KNO3) + 90.3% γ-Al2O3 | 650 | 50 | 7.913 |
| 9.7% K (25.1 г KNO3) + 90.3% γ-Al2O3 | 700 | 55 | 7.915 |
Данные РФА образцов КNO3 + γ-Аl2O3, высушенных при 150°С, свидетельствуют о присутствии фаз γ-Al2O3, гидроксидов алюминия, а также двух калийсодержащих фаз – γ-KNO3 (база данных ICSD#36113) и KNO3 (база данных ICSD#28077). В состав прокаленных при 650°С образцов КNO3 + γ-Al2O3 входят только фазы γ-Al2O3 и γ-KNO3 (база данных ICSD#36113). Фазы тригидроксидов у прокаленных образцов γ‑Al2O3 и КNO3 + γ-Al2O3 методом РФА не найдены. Также этот метод не выявил фаз взаимодействия калия и алюминия. Лишь у прокаленных при 700°С в течение 8 ч образцов обнаружено взаимодействие калия и алюминия, в результате которого формируются несколькo возможных форм: Al2K6O6 (ICSD#74968), Al6K0.67O9.33 (ICSD#92707), AlKO2 (ICSD#88774) [20].
Данные ДР-анализа для калийсодержащих образцов 9.7% K + γ-Al2O3 (150°С); 9.7% K + γ-Al2O3 (650°С) и 3% K + γ-Al2O3 (650°С) представлены на рис. 2. Они совпадают с результатами метода РФА, дополняя последние сведениями о рентгеноаморфных фазах.
Рис. 2.
Кинетические кривые растворения фаз в образцах KNO3 + γ-Al2O3: а – 9.7% K (150°С); б – 9.7% K (650°С); в – 3% K (650°С). Условия растворения: начало – H2О, 1 – HCl (1.2 М → 3 M), 2 – 3 М HCl → → 3.6 M HF.
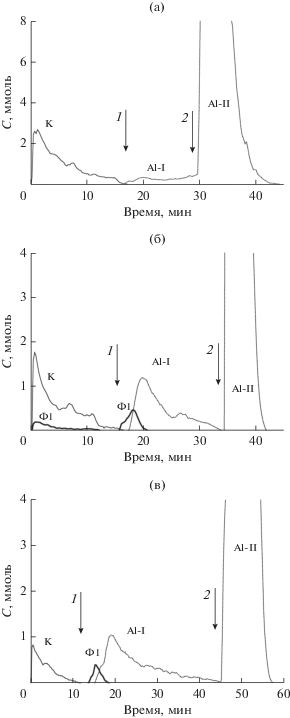
Профиль кинетических кривых растворения фаз позволяет утверждать, что в высушенном при 150°С калийсодержащем образце (рис. 2а) специфического взаимодействия между нитратом калия и носителем нет, так как выход калийсодержащей фазы в растворитель не зависит от выхода алюминийсодержащих фаз. На кинетической кривой выхода калийсодержащей фазы наблюдаются два максимума, которые характеризуют две формы исходного реагента – KNO3 и γ-KNО3. Для алюминий содержащих фаз выявляются две формы с различной скоростью растворения – Al-I и Al-II (рис. 2а). Форма Al-II растворяется в более жестких условиях (в присутствии плавиковой кислоты), поэтому ее можно идентифицировать с крупнодисперсной фазой γ-Al2О3. Форма Al-I растворима в водном растворе HCl и представляет собой фазы тригидроксидов и легкорастворимых оксидов. В высушенном при 150°С калийсодержащем образце форма Al-I проявляется менее выраженно, чем в прокаленных образцах.
Как видно из профиля кинетических кривых растворения фаз на рис. 2б и 2в алюминий содержащие фазы в прокаленных образцах также существуют в двух формах – Al-I и Al-II. На этих кривых уже достаточно явно проявляется максимум, связанный с растворением формы Al-I. Можно полагать, что прокалка носителя марки А-1 при 650°С приводит к превращению имеющихся в нем гидроксидов и легкорастворимых оксидов в хорошо растворимую высокодисперсную форму Al2O3. Кроме того, при высокой температуре происходит разделение крупнодисперсных и мелкодисперсных форм Al2О3: последние перемещаются из объема носителя на его поверхность, также образуя форму Аl-I. В состав прокаленных образцах в большом количестве входит и калийсодержащая фаза, локализованная на поверхности Al-I. На основании данных ДР и РФА калийсодержащую фазу следует отнести к фазе γ-KNO3.
Прямолинейные участки стехиограмм, построенные по результатам анализа ДР-растворов для образцов, прокаленных при 650°С, соответствуют фазе K1Al1 (Ф1), предположительно являющейся фазой KAlO2. Профиль кинетических кривых растворения фаз характеризует распределение фазы Ф1 в прокаленных образцах с содержанием калия 9.7% (рис. 2б) и 3% (рис. 2в). Стехиографические расчеты, сделанные по результатам ДР-анализа вышеуказанных образцов, показывают, что количество фазы Ф1 пропорционально концентрации калия в образцах. При содержании калия в образце не выше 3% фаза Ф1 оказывается локализованной только на поверхности носителя А-I (рис. 2в), а при [K] = = 9.7% она дополнительно смешивается с фазой γ-KNO3 (рис. 2б).
С повышением температуры прокалки до 700°С процесс твердофазного взаимодействия усиливается. Так, у прокаленных при 700°С в течение 8 ч образцов методом РФА обнаружены фазы взаимодействия калия с алюминием, одна из которых – фаза KAlO2 [20].
Количественное содержание найденных фаз в алюмокалиевых образцах по данным ДР-анализа представлено в табл. 3.
Таблица 3.
Результаты ДР-анализа образцов KNO3 + γ-Al2O3
| Температура прокалки, °С | Массовая доля нанесенного K, % | Фазовый состав, отн. % | |||
|---|---|---|---|---|---|
| K → KNO3 + + γ-KNO3 | Ф1 → KAlO2 | Al-I → γ-Al2O3 мелкодис-персная | Al-II → γ-Al2O3 крупнодис-персная | ||
| 150 | 9.7 | 21.1 | – | 5.4 | 73.5 |
| 650 | 9.7 | 15.2 | 7.4 | 20.3 | 57.1 |
| 650 | 3.0 | 4.6 | 2.1 | 19.8 | 73.5 |
| 700 (4 ч) | 9.7 | 3.2 | 27.0 | 22.2 | 47.6 |
| 700 (8 ч) | 9.7 | 2.0 | 28.1 | 21.8 | 48.1 |
Фазовый состав образцов CrO3 + γ-Al2O3, прокаленных при 650°С
По данным РФА образец CrO3 + γ-Al2O3 (650°С) содержит фазу γ-Al2O3. Кроме того, в образце 10.4% Cr (20г CrO3) + 89.6% γ-Al2O3 найдена отдельная фаза Cr2O3. В остальных образцах концентрация оксида хрома(III), по-видимому, ниже предела обнаружения методом РФА. Параметр элементарной ячейки γ-Al2O3 относительно исходного носителя увеличивается в зависимости от количества введенного хрома, размер ОКР при этом не изменяется.
Из профиля кинетических кривых растворения фаз на рис. 3 видно, что алюмохромовые образцы являются многофазными. Методом ДР установлено, что в состав всех образцов CrO3 + γ-Al2O3 (650°С) входит два вида твердых растворов (Ф2 и Ф3). Фаза Ф2 находится на поверхности фазы Ф3 и содержание хрома в ней значительно выше, чем в фазе Ф3 (табл. 4). Фазовый состав образцов по результатам метода ДР на примере образцов № 6 (4 Cr) и № 8 (10.4% Cr) показан на рис. 3а и 3б.
Рис. 3.
Кинетические кривые растворения фаз, содержащихся в образцах CrO3 + γ-Al2O3 (650°С): a – образец № 6 (4% Cr), б – образец № 8 (10.4% Cr).
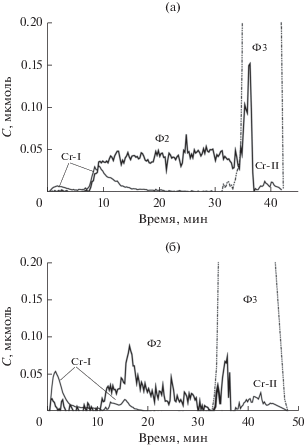
Таблица 4.
Количества фаз (отн. %) в образцах CrO3 + γ-Al2O3 650°С по данным метода ДР
| № образца | Условия растворения и фазы | |||
|---|---|---|---|---|
| H2О → 1.2 M HCl → 3 M HCl | 3 M HCl + 3.6 M HF | |||
| Cr-I → Cr(VI) → → CrO3 | Ф2 → твердый раствор Cr(III) в Al-I | Ф3 → твердый раствор Cr(III) в Al-II | Cr-II → Cr(III) → → Cr2O3 | |
| 6 (4% Cr) | 19.7 | 25.2 (Cr0.17Al1) | 51.2 (Cr0.03Al1) | 3.9 |
| 7 (7.4% Cr) | 21.8 | 20.2 (Cr0.15Al1) | 52.9 (Cr0.05Al1) | 5.1 |
| 8 (10.4% Cr) | 23.2 | 9.5 (Cr0.14Al1) | 55.7 (Cr0.07Al1) | 11.6 |
В работах [16, 17] было установлено, что в начале процесса растворения хромсодержащих объектов в раствор выходят водорастворимые соединения хрома(VI). На рис. 3 это фаза Cr-I (вероятно CrO3). Согласно исследованиям [16, 17] хром(VI) может образовывать водорастворимые хроматы с примесными элементами. Фаза Cr-I находится как на поверхности фазы Ф2, так и в ее приповерхностных слоях, химически связываясь с оксидом алюминия в мономеры, димеры и полимеры разной ядерности. Сама фаза Ф2 представляет собой твердый раствор хрома(III) в Al-I. Фаза Ф3 является фазой твердого раствора соединений хрома(III) в фазе Al-II. Фаза Cr-II – это фаза окристаллизованного оксида хрома(III). Атомные отношения катионов хрома и алюминия в твердых растворах Ф2 и Ф3 приведены в табл. 4.
Фазовый состав образцов LiCl + γ-Al2O3, прокаленных при 650°С
По данным РФА ни для одного из образцов LiCl + γ-Al2O3 не наблюдается появление дополнительных дифракционных пиков, характерных для литийсодержащих фаз. Тем не менее, с ростом количества введенного лития наблюдается изменение соотношения интенсивностей дифракционных пиков, что указывает на внедрение ионов лития в вакантные позиции исходной шпинельной структуры γ-Al2O3. Количество введенного лития не оказывает влияния на размеры областей когерентного рассеяния и параметры элементарной ячейки, которые для всех образцов составляют 55 и 7.925 Å соответственно.
Результаты определения фазового состава образца LiCl + γ-Al2O3 (650°С) с содержанием лития 4.1% методом ДР представлены на рис. 4. На рис. 4а приведены кинетические кривые растворения лития и алюминия и стехиограмма Li : Al. Из стехиограммы следует, что литий и алюминий в образце находятся в двух формах. Начальный участок стехиограммы (до 30 мин) непрямолинейный, с высоким соотношением Li : Al, что указывает на присутствие в образце литийсодержащей фазы без алюминия (Li-I), вероятно, остатков LiCl. Участок стехиограммы после 30 мин прямолинейный, соотношение Li : Al = = 0.07 : 1. Это свидетельствует о том, что литий и алюминий образуют твердый раствор Li0.07Al1. Кроме перечисленных фаз в образце обнаруживается еще и фаза Al-I – высокодисперсный оксид алюминия, на поверхности которого находится фаза свободного хлорида лития. Кинетические кривые растворения всех найденных фаз представлены на рис. 4б.
Рис. 4.
Кинетические кривые растворения Li и Al и стехиограмма моль Li/моль Al (а); кинетические кривые растворения фаз в образце 4.1% Li (25 г LiCl) + γ-Al2O3 (650°С) (б).
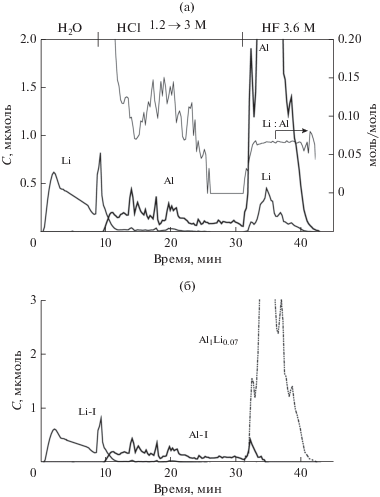
Данные, полученные методом ДР, согласуются с результатами РФА, указывающими на образование твердого раствора без уточнения его состава. Методом ДР был определен состав твердого раствора как Li0.07Al1 и, кроме того, обнаружены фазы LiCl и высокодисперсного γ-Al2O3.
Фазовый состав образца LiCl + CrO3 + γ-Al2O3, прокаленного при 650°С
В изученных образцах с концентрацией хрома от 9.5 до 12.3% и прокаленных при 650°С, количество лития менялось от 1 до 4.5% (табл. 1). По результатам метода ДР качественный фазовый состав во всех образцах идентичен, поэтому на рис. 5 представлены кинетические кривые растворения обнаруженных фаз и условия растворения на примере образца № 12 (табл. 1) с максимальным количеством лития.
Рис. 5.
Кинетические кривые растворения фаз, обнаруживаемых в образце 4.5% Li + 9.5% Cr + γ-Al2O3 (№ 12), прокаленном при 650°С: Ф5 – фаза Li2CrO4; Ф4 – фаза твердого раствора Al1Cr0.17; Ф6 – фаза твердого раствора переменного состава Al1Cr0.06–0.15Li0.05–0.15.
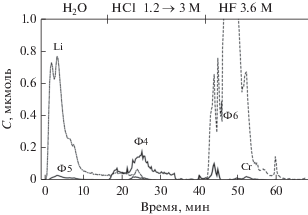
Как видно из рис. 5, исследуемый образец является многофазным, состоящим из трехкомпонентного твердого раствора переменного состава (Ф6), в котором атомное соотношение Cr : Al варьируется от 0.06 : 1 до 0.15 : 1, а атомное соотношение Li : Al изменяется от 0.05 : 1 до 0.15 : 1. На поверхности твердого раствора Ф6 расположена фаза Ф4, сформированная из твердого раствора Cr(III) в высокодисперсной форме Al2О3, модифицированная Cr(VI). Присутствие в этой фазе катионов Cr(VI) в высокой степени окисления было установлено ранее в работах [16, 17]. В образце обнаружены также еще три фазы – легкорастворимая фаза Li (LiCl), фаза взаимодействия лития с хромом(VI) – фаза Ф5 (Li2CrО4), и фаза Cr (Cr2O3). Методом РФА в этих образцах найдена только фаза Cr2O3.
В табл. 5 приведены количественные результаты полного фазового состава для образцов LiCl + CrO3 + γ-Аl2O3.
Таблица 5.
Фазовый состав образцов LiCl + CrO3 + γ-Al2O3, прокаленных при 650°С, по данным метода ДР
| № образца | Найденные фазы и их количества, отн. % | ||||
|---|---|---|---|---|---|
| Li (LiCl) | Ф5 (Li2CrО4) | Ф4 (Al1Cr0.17) | Ф6 (Al1Crx1–x2Liy1–y2) | Cr (Cr2O3) | |
| 9 | 0.2 | 1.9 | 6.7 | 90.0 | 1.2 |
| 10 | 0.6 | 4.9 | 8.7 | 85.0 | 0.8 |
| 11 | 2.7 | 3.9 | 9.9 | 82.9 | 0.6 |
| 12 | 6.1 | 4.4 | 11.5 | 77.0 | 1.0 |
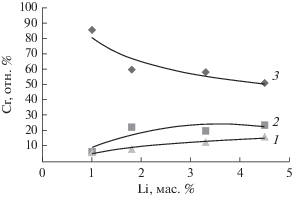
Количественные данные распределения хрома по фазам для всех образцов LiCl + CrO3 + γ-Аl2O3 (№ 9–12), прокаленных при 650°C, представлены на рис. 6 в виде графиков изменения содержания хрома в фазах в зависимости от количества введенного в образцы лития. С возрастанием [Li] до 4.5% увеличивается количество фаз, содержащих Cr(VI), и уменьшается концентрация Cr(III) в трехкомпонентной фазе на основе крупнодисперсной формы Аl2O3. Наибольшее повышение количества Cr(VI) и снижение количества Cr(III) наблюдается до концентрации лития 2–3%. Массовая доля Cr(VI) в образцe № 12 составляет около 4%, что вдвое больше, чем в образцах, не содержащих лития [5, 8, 16, 17]. Как известно, ионы Сr(VI) в виде хроматов и оксидов в реакционной среде восстанавливаются до высокодисперсных активных ионов Cr(III) [5, 8]. Следовательно, введение от 1.8 до 4.5% лития должно благоприятно влиять на активность и селективность алюмохромового катализатора. Кроме того, по данным ДР в этих образцах литий вместе с хромом внедряется в носитель Al2O3, образуя твердые трехкомпонентные растворы переменного состава Al1Crx1 –x2Liy1 –y2 с увеличенным параметром кубической решетки γ-Al2O3 (по данным РФА a = = 7.945 Å). Это приводит к уменьшению растворения катионов хрома в γ-Al2O3 и повышению содержания активных мелкодисперсных частиц оксида хрома(III) на поверхности носителя. Механизм образования фазы твердого раствора Ф6 можно представить следующим образом: по данным [18, 19] в кристаллической решетке оксида алюминия происходит замещение атомов алюминия атомами хрома и одновременно внедрение атомов лития в межатомные промежутки шпинельной структуры оксида алюминия.
Рис. 6.
Распределение введенного хрома между фазами, присутствующими в системе LiCl + CrO3 + γ-Аl2O3, в зависимости от содержания лития: 1 – доля хрома в фазе твердого раствора Cr(III)0.17Al1, модифицированного ионами Cr(VI); 2 – доля хрома в фазе Li2CrO4; 3 – доля хрома в фазе твердого раствора (Al1Cr(III)x1–x2 Liy1–y2).
ЗАКЛЮЧЕНИЕ
Итак, совместное использование методов РФА и ДР позволило изучить генезис фазового состава алюмохромового катализатора с высоким (до 12.3%) содержанием хрома при введении модифицирующих добавок калия и лития и разных температурах прокалки. Исследования показали, что и температура прокалки и природа добавки влияют на состав образующихся фаз. Результаты методов ДР и РФА совпадают только в случае обнаружения окристаллизованных фаз. ДР-анализ существенно дополняет данные РФА, позволяя дополнительно обнаружить рентгеноаморфные формы и подтвердить результаты метода РФА по окристаллизованным фазам.
Методами РФА и ДР показано, что:
– при прокалке носителя γ-Al2O3 при 650°С остатки гидроксидов и низкотемпературных оксидов превращаются в высокодисперсную ренгеноаморфную (высокодисперсную) форму Al2O3;
– сушка образцов KNO3 + γ-Al2O3 при 150°С приводит к частичному образованию фазы γ-KNO3. Данные метода ДР свидетельствуют, что в результате повышения температуры прокалки образцов KNO3 + γ-Al2O3 до 650°С в этих образцах образуется рентгеноаморфная форма алюмината калия. При повышении температуры прокалки до 700°С образуется окристаллизованная форма алюмината калия, которую обнаруживают оба метода;
– повышение температуры прокалки образцов LiCl + γ-Al2O3 до 650°С ведет к формированию фазы твердого раствора соединений лития в оксиде алюминия;
– в образцах CrO3 + γ-Al2O3 и LiCl + CrO3 + + γ-Al2O3, прокаленных при 650°С, имеется крупнодисперсная фаза оксида хрома(III).
Дополнительно только методом ДР показано, что:
– в образцах CrO3 + γ-Al2O3, прокаленных при 650°С, образуется два типа твердых растворов: оксид хрома(III), растворенный в высокодисперсной форме Al2O3, и оксид хрома(III), растворенный в хорошо окристаллизованной форме γ-Al2O3;
– в образцах LiCl + CrO3 + γ-Al2O3, прокаленных при 650°С, присутствуют фазы хлорида лития и хромата лития, фаза твердого раствора хрома(III) в высокодисперсной форме Al2O3, модифицированная хромом(VI), и фаза твердого раствора переменного состава соединений лития и хрома(III) в γ-Al2O3.
Таким образом, изучено влияние добавок хлорида лития на фазовый состав алюмохромовых катализаторов. Исследования с помощью методов РФА и ДР показали, что при добавке 1–4.5% LiCl в катализатор хром(VI) сохраняется в нем в количестве до 4% от исходной концентрации в виде хромата лития и химически связан с мелкодисперсной формой Аl2O3, а также снижается доля хрома(III) в твердом растворе Al1Crx1–x2 путем замены части Cr(III) на литий с образованием трехкомпонентного твердого раствора (Al1Crx1–x2Liy1–y2).
Список литературы
Sanfilippo D., Miracca I. // Catal. Today. 2006. V. 111. № 1–2. P. 133.
Weckhuysen B., Schoonheydt R. // Catal. Today. 1999. № 51. P. 223.
Пахомов Н.А. // Промышленный катализ в лекциях. М.: Калвис, 2006. № 6. С. 53.
Пахомов Н.А., Парахин О.А., Немыкина Е.И., Данилевич В.В., Чернов М.П., Печериченко В.А. // Катализ в промышленности. 2012. № 3. С. 65.
Немыкина Е.И., Пахомов Н.А., Данилевич В.В., Рогов В.А., Зайковский В.И., Ларина Т.В., Молчанов В.В. // Кинетика и катализ. 2010. Т. 51. № 6. С. 929.
Пахомов Н.А. // Промышленный катализ в лекциях. М.: Калвис, 2005. № 6. С. 87
Оксиды титана, церия, циркония, иттрия, алюминия. Свойства, применение и методы получения. Под ред. Пармона В.Н. Новосибирск: Издательство Сибирского отделения РАН, 2010. С. 170.
Немыкина Е.И. Дис. … канд. хим. наук. Новосибирск: ИК РАН, 2012.
Полуэктов Н.С., Мешкова С.Б., Полуэктова Е.Н. // Аналитическая химия лития. М.: Наука, 1975. С. 11.
Юрьева Т.М., Боресков Г.К., Поповский В.В., Чигрина В.А., Егорова Л.С. // Кинетика и катализ.1971. Т. 12. Вып. 1. С. 140.
Танашев Ю.Ю., Мороз Э.М., Исупова Л.А., Иванова А.С., Литвак Г.С., Амосов Ю.И., Рудина Н.А., Шмакова А.Н., Степанов А.Г., Харина И.В., Кулько Е.В., Данилевич В.В., Балашов В.А., Кругляков В.Ю., Золотарский И.А., Пармон В.Н. // Кинетика и катализ. 2007. Т. 48. № 1. С. 161.
Poole Ch., MacIver D. // Adv. Catal. 1967. № 17. P. 224.
Малахов В.В., Васильева И.Г. // Успехи химии. 2008. 77. № 4. С. 370.
Малахов В.В., Болдырева Н.Н., Власов А.А., Довлитова Л.С. // Журн. аналит. химии. 2011. Т. 66. № 5. С. 473.
Малахов В.В., Власов А.А. //. Журн. аналит. химии. 2011. Т. 66. № 3. С. 268.
Болдырева Н.Н., Купцов А.В. // Заводская лаборатория. Диагностика материалов. 2014. Т. 80. № 10. С. 12.
Болдырева Н.Н., Купцов А.В. // Заводская лаборатория. Диагностика материалов. 2017. Т. 83. № 7. С. 7.
Плясова Л.М. // Введение в рентгенографию катализаторов. Новосибирск: Институт катализа им. Г.К. Борескова, 2010. С. 30.
Исупов В.П., Габуда С.П., Козлова С.Г., Чупахина Л.Э. // Журн. структ. химии. 1998. Т. 39. № 3. С. 448.
База данных Inorganic Crystal Structure Database (ICSD), Copyright 2003–2011. Fachinformationszentrum (FIZ) Karlsruhe.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


