Кинетика и катализ, 2019, T. 60, № 1, стр. 11-24
Влияние добавок н-бутанола на образование С3Н3 при горении н-бутана
M. Li 1, *, G. Xu 1, Y. Zhao 1, G. Li 1, Zh. Wang 2
1 School of Automotive Engineering, Changshu Institute of Technology
215500 Jiangsu, P. R. China
2 School of Automotive and Traffic Engineering, Jiangsu University
212013 Jiangsu, P. R. China
* E-mail: lmd-fj@163.com
Поступила в редакцию 10.04.2018
После доработки 20.08.2018
Принята к публикации 02.07.2018
Аннотация
Изучено влияние варьирования мольной доли н-бутанола (Rb) в смесях н-бутанол/н-бутан на образование пропаргильных радикалов C3H3 (важного прекурсора бензола) при горении смесей. Развита детальная кинетическая модель горения смесей н-бутанол/н-бутан и рассчитаны пламена в предварительно приготовленных смесях н-бутанол/н-бутан при эквивалентном отношении компонентов 1.5, начальном давлении 1.0 атм и температурном интервале 800–2000 K в реакторе идеального смешения (PSR) при варьировании Rb от 0 до 1.0. Показано, что в условиях экспериментов пиковое значение мольной доли C3H3 нелинейно уменьшается при возрастании Rb. Вследствие взаимодействия продуктов горения н-бутана и н-бутанола в процессе горения реальная пиковая мольная доля С3Н3 выше, чем теоретическое значение. Анализ скоростей образования продуктов (ROP) показывает, что число β-углеродных атомов в молекуле н-бутана и н-бутанола влияет на эффективность отщепления атомов Н при образовании 2-бутил (sC4H9) и C4H8OH-3 (CH3–*CH–CH2–CH2–OH) – двух основных источников C3H3. Для н-бутана и н-бутанола основной путь образования C3H3 из пропилена (C3H6) один и тот же, а именно C3H6 → C3H5-a (симметричный аллильный радикал) → C3H4-a (аллен) → C3H4-p (пропин) → C3H3. В области значений Rb = 0.4–0.6 степень отклонения пиковой мольной доли, участвующей в образовании частиц С3, достигает максимума. Это указывает на важность взаимодействия двух горючих. Нелинейное уменьшение мольной доли C3H3 можно объяснить следующими причинами: (а) увеличение Rb способствует конверсии н-бутана в sC4H9 и н-бутанола в C4H8OH-3; (б) вклад реакций, участвующих в маршруте C3H5-a → C3H4-a → C3H4-p → C3H3, уменьшается при увеличении Rb; (в) маршрут C3H5-t (третичный аллильный радикал) → C3H4-p → C3H3 является вторичным маршрутом образования С3Н3. С ростом Rb зависимость C3H4-p от C3H5-t возрастает, и степень конверсии C3H5-t в C3H4-p увеличивается. В данной работе обнаружено нелинейное уменьшение мольной доли C3H3 за счет взаимодействия н-бутанола с н-бутаном в процессе горения. Это позволило глубже понять влияние н-бутанола на образование бензола.
Биотопливо представляет большой интерес как топливо для транспорта, поскольку оно является возобновляемым ресурсом и в меньшей степени загрязняет окружающую среду, что может позволить снизить общий парниковый эффект эмиссии газов. Биоэтанол является одним из наиболее широко распространенных биотоплив и может использоваться как альтернатива бензина. Однако он имеет ряд недостатков (низкая энергетическая плотность, высокое давление пара, большая растворимость в воде). По сравнению с биоэтанолом биобутанол, как потенциальное биотопливо, используемое в бензиновых и дизельных двигателях, имеет ряд заметных преимуществ, включая более высокую энергетическую плотность, лучшую смешиваемость с бензином и дизельным топливом, более низкое давление пара и сродство к воде, а также пониженную коррозионную активность [1–3]. В последние годы проведены многочисленные исследования, касающиеся применения н-бутанола в качестве моторного топлива [4–7]. Результаты моторных тестов показывают, что эмиссия сажи существенно уменьшается при добавлении бутанола к обычному топливу, в особенности к дизельному топливу [8–10].
Существуют четыре изомерных молекулярных структуры бутанола общей формулы C4H9OH. Изомер с прямой углеродной цепью и ОН-группой на концевом атоме углерода является н-бутанолом. Структуры углеродной цепи н-бутана и н-бутанола одинаковы.
Наиболее существенное различие состоит в том, что в молекулярной структуре бутанола имеется функциональная ОН-группа. В молекуле н-бутана есть два α-углеродных атома и два β-углеродных атома, в то время как в молекуле н-бутанола присутствуют α-, β-, γ- и δ-углеродные атомы. Разница в структуре молекул топлива может влиять на процесс его горения, а также на образование интермедиатов.
Механизм образования сажи включает в себя стадии газофазных реакций, коагуляции, поверхностного роста, агломерации и окисления. Полициклические ароматические углеводороды (PAHs), обычно рассматриваемые как прекурсоры сажи, играют важную роль в газофазных реакциях и нуклеации, образуя димеры, тримеры, тетрамеры и т.д. PAHs [11]. Помимо теоретических исследований, существуют также косвенные экспериментальные доказательства в пользу того, что PAHs являются прекурсорами сажи [12, 13]. Многочисленные исследования образования PAHs при горении углеводородных топлив показывают, что первое ароматическое кольцо, а именно бензол (C6H6) является основным прекурсором, а малые частицы С2–С4-интермедиатов, в особенности пропаргильные радикалы (C3H3) играют важную роль в образовании бензола.
В литературе имеются работы, посвященные изучению влияния кислородсодержащих топлив на образование PAHs, бензола и интермедиатов [14, 15]. Однако в литературе детально не обсуждается вопрос о том, каким образом кислородсодержащее топливо влияет на образование этих прекурсоров. В частности, в этих работах не изучено влияние н-бутанола на маршруты образования пропаргильных радикалов, которые считаются наиважнейшими интермедиатами в процессе образования бензола. В связи с этим возникает необходимость исследовать образование С3Н3 в процессе горения н-бутанола.
Целью настоящей работы был анализ влияния н-бутанола на характеристики богатых пламен н-бутанол/н-бутан и исследование кинетики превращения н-бутанола с образованием С3Н3.
РАЗВИТИЕ МОДЕЛИ И ЕЕ ПОДТВЕРЖДЕНИЕ
Подход к модели
Моделирование проводили для реактора идеального смешения (PSR). Разработка модели была нацелена на детальный кинетический механизм для н-бутанола, поскольку он включает в себя субмеханизм для н-бутана. Кроме того, для рассмотрения влияния С3Н3 на образование бензола и PAHs был добавлен еще и механизм образования PAHs. Также были рассмотрены несколько химических кинетических механизмов образования бензола и PAHs, известных из литературы. Предложен также химический кинетический механизм для моделирования образования C3H3 при горении смесей н-бутанол/н-бутан при варьировании мольной доли н-бутанола (Rb) в интервале 0–1.0, который в дальнейшем будет называться “механизм н-бутанол/н-бутан”.
Данные, полученные при моделировании с использованием предложенного нами химического кинетического механизма н-бутанол/н-бутан, были сопоставлены с результатами моделирования по механизму для н-бутанола [16] и экспериментальными данными [3, 17]. Времена задержки воспламенения для четырех изомеров бутанола рассчитаны для гомогенного реактора периодического действия с постоянным объемом, а профили мольных долей частиц в предварительно смешанных пламенах бутанола моделировали PSR-кодом.
Разработка механизма
Химический кинетический механизм для н-бутанола был разработан в прошлом десятилетии. Даго и соавт. [18] получили экспериментальные данные для окисления н-бутанола в реакторах струйного перемешивания (JSR) при 10 атм для серии эквивалентных отношений и температур и предложили химическую кинетическую модель для н-бутанола. Улучшенный детальный механизм (118 частиц и 878 реакций), вытекающий из более раннего механизма Даго для окисления н-бутанола, был разработан Сарати с соавт. [3]. Кроме того, Кай с соавт. [19] экспериментально изучили пиролиз н-бутанола в проточном реакторе и предложили детальный химический кинетический механизм.
Помимо упомянутых выше механизмов для н-бутанола, Мосс и др. [20] предложили детальный механизм (158 частиц и 1250 реакций) для описания окисления всех четырех изомеров бутанола и подтвердили его путем сравнения с данными для ударных труб. Сарати и др. [16] предложили подробную химическую кинетическую модель для всех четырех изомеров бутанола (426 частиц и 2355 реакций) для высоко- и низкотемпературных реакционных маршрутов. По сравнению с механизмом Мосса предложенный механизм лучше согласуется с экспериментальными данными по составу частиц в реакторах струйного перемешивания (JSR) [18, 21], составу частиц в пламенах предварительно не смешанных компонентов [22, 23], задержке воспламенения в ударных трубах [17, 24], ламинарной скорости пламен в предварительно смешанных смесях [22, 25] и быстрым компрессионные машинам [26]. Поэтому механизм Сарати был использован в настоящей работе как базовый механизм. Полное описание этого механизма можно найти в [16].
В литературе можно найти несколько химических механизмов, предсказывающих образование PAHs, например, механизм WF [27], механизм ABF [28], механизм KAUST (также известный как KM1 и KM2) [29, 30], механизм DRL [31, 32] и другие [33, 34]. По сравнению с другими механизмами, KM1 (202 частицы, 1351 реакций) является механизмом, разработанным для суррогатных бензиновых топлив cупором на образование и рост PAHs вплоть до коронена (A7, C24H12) [29]. Механизм KM1 подходит и для моделирования образования сажи, поскольку PAHs, бόльшие, чем пирен, предположительно могут поглощать частицы сажи [35]. Однако предсказания концентраций малых углеводородных частиц по механизму КМ1 неудовлетворительны. Поэтому для легких углеводородных топлив (С1–С4) был разработан механизм КМ2 (226 частиц, 2121 реакция), в который включены детальные реакционные маршруты образования и роста PAHs вплоть до коронена для расчета профилей больших PAHs [30]. Механизм КМ2 хорошо подтверждается экспериментальными данными. Таким образом, в настоящей работе механизм КМ2 был использован для описания образования PAHs.
Химический кинетический механизм для моделирования образования С3Н3 в пламенах н-бутанол/н-бутан, который мы будем называть “механизм н-бутанол/н-бутан”, был получен слиянием механизма для н-бутанола, разработанного Сарати и др. [16], и субмеханизма для PAHs, предложенного Вангом и др. [30]. Реакции и их скорости, а также термодинамические данные оставлены без изменения.
Подтверждение механизма
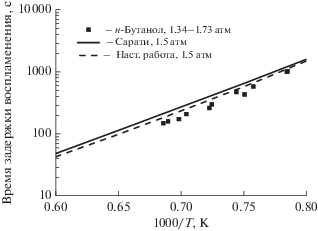
Время задержки воспламенения изомеров бутанола за отраженной ударной волной в различных экспериментальных условиях измерены Страником и др. [17]. Предлагаемый нами механизм н-бутанол/н-бутан подтвержден экспериментальными данными, полученными при низких давлениях ~1.5 атм. Подтверждение данных проводили с помощью CHEMKINPRO для гомогенного реактора периодического действия постоянного объема при эквивалентном отношении 1.0, начальном давлении 1.5 атм для смесей, содержащих 4% О2, разбавленных аргоном. Рассчитанное время задержки воспламенения определяли как точку максимальной скорости роста температуры (максимум dT/dt), которая точно соответствует точке максимальной скорости роста давления (максимум dP/dt) [16]. Как следует из рис. 1, предлагаемый механизм хорошо согласуется с экспериментальными данными и базовым механизмом при низком давлении.
Рис. 1.
Времена задержки воспламенения при низком давлении. Символы – экспериментальные данные [17], сплошные линии – рассчитанные профили концентраций на основе механизма Сарати [16], пунктирные линии – рассчитанные профили концентраций на основе предложенного в настоящей работе механизма горения смеси н-бутанол/н-бутан.
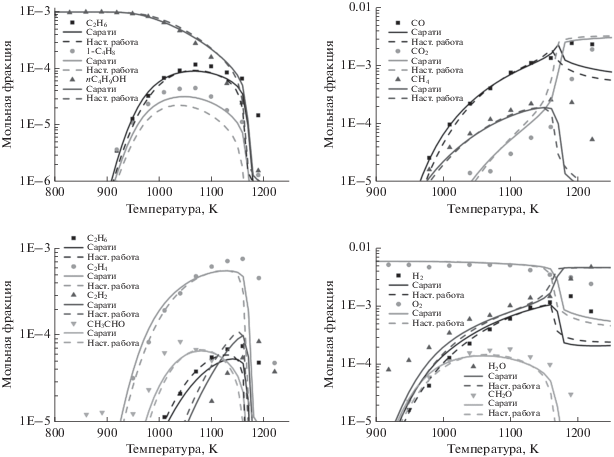
Окисление н-бутанола в JSR было выполнено Сарати и др. [3] в стационарном режиме: время пребывания 0.07 с, постоянное давление 1.0 атм, температура от 800 до 1150 К. Экспериментальные данные использовали для валидации предложенного механизма н-бутанол/н-бутан при эквивалентном отношении компонентов 1.0, мольной доле н-бутанола 0.001 и реактантах, разбавленных азотом. На рис. 2 видно, что форма рассчитанных профилей концентраций соответствует экспериментальным данным (символы). Мольные доли соединений С1 (СО, СО2, СН4 и формальдегид), C2 (ацетилен C2H2, этилен C2H4, этан C2H6 и ацетальдегид), C3 и C4 (пропилен C3H6, н-C4H9OH), а также O2, H2 и H2O хорошо предсказываются предложенным механизмом. Концентрация бутена-1 (1-C4H8) оказалась немного ниже предсказанной. В общем, предсказания в рамках предложенного механизма можно считать приемлемыми.
Рис. 2.
Окисление н-бутанола в реакторе JSR при φ = 1, P = 1 атм, τ = 0.07 с. Символы – экспериментальные данные [3], сплошные линии – рассчитанные профили концентраций на основе механизма Сарати [16], пунктирные линии – рассчитанные профили концентраций на основе предложенного в настоящей работе механизма горения смеси н-бутанол/н-бутан.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Профили мольных долей PAHs и пропаргильных радикалов
Процесс горения смесей н-бутанол/н-бутан в JSR исследован при эквивалентном отношении компонентов (φ), равном 1.5, начальном давлении 1.0 атм и температуре 800–2000 К. Начальная общая мольная доля топлива (Xf) поддерживалась постоянной (Xf = 0.001), а доля н-бутанола в смеси (Rb) определялась выражением
(1)
${{R}_{{\text{b}}}} = {{{{X}_{n}}_{{ - {{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{9}}}}{\text{OH}}}}} \mathord{\left/ {\vphantom {{{{X}_{n}}_{{ - {{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{9}}}}{\text{OH}}}}} {{{X}_{{\text{f}}}},}}} \right. \kern-0em} {{{X}_{{\text{f}}}},}}\quad$Реактанты разбавляли азотом. Мольные доли кислорода (${{X}_{{{{{\text{O}}}_{2}}}}}$) и азота (${{X}_{{{{{\text{N}}}_{2}}}}}$) могут быть рассчитаны по уравнениям (2) и (3) соответственно
(2)
${{X}_{{{{{\text{O}}}_{2}}}}} = (6{{R}_{{\text{b}}}}{{X}_{{\text{f}}}} + 6.5(1--{{R}_{{\text{b}}}}){{{{X}_{{\text{f}}}}} \mathord{\left/ {\vphantom {{{{X}_{{\text{f}}}}} \varphi }} \right. \kern-0em} \varphi },$На рис. 3 показано изменение мольных долей семи полициклических ароматических углеводородов (PAHs) – бензола (A1), нафталина (A2), фенантрена (A3), пирена (A4), бензпирена (A5), бензоперилена (A6), и коронена (A7) в богатых пламенах н-бутанол/н-бутан при варьировании Rb от 0 до 1. Видно, что выход всех семи PAHs в присутствии н-бутанола ниже, чем в чистом н-бутане. Пиковая величина мольных долей А1 уменьшается на 12, 14, 17 и 20% для доли н-бутанола в смеси, равной, соответственно, 20, 40, 60 и 80%. Для одинаковых долей н-бутанола в смеси уменьшение мольных долей А5–А7 больше, чем снижение А1–А4.
Рис. 3.
Профили мольных долей PAHs (бензола (A1), нафталина (A2), фенантрена (A3), пирена (A4), бензпирена (A5), бензоперилена (A6), и коронена (A7)) при эквивалентном отношении 1.5, при варьировании Rb от 0 до 1.0, общая мольная доля топлива 0.001, реактанты разбавлены азотом.
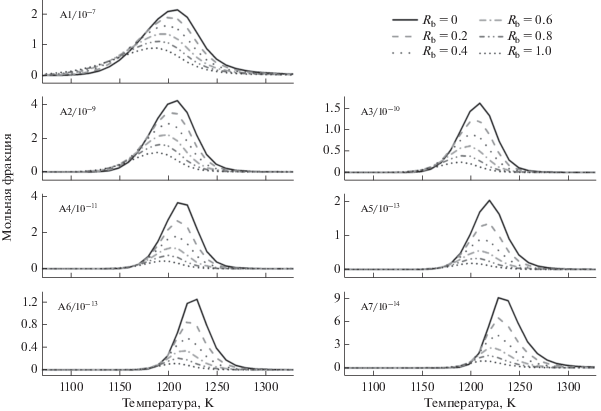
Среди PAHs первое ароматическое кольцо, т.е. бензол (A1, C6H6), является наиболее важным прекурсором PAHs, а реакцию рекомбинации пропаргильных радикалов можно считать основным путем образования А1. Поэтому мы обсудим образование С3Н3.
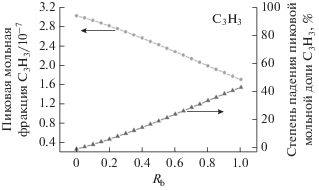
На рис. 4 представлены профили мольных долей пропаргильного радикала (С3Н3) в богатых пламенах н-бутанол/н-бутан при варьировании Rb от 0 до 1. Как видно на рис. 4, образование С3Н3 начинается приблизительно при 1000 К, а когда температура горения повышается до ~1200 K, мольная доля С3Н3 достигает максимума. При горении чистого н-бутана и чистого н-бутанола максимальные мольные доли С3Н3 равны 3.01 × × 10–7 и 1.71 × 10–7, а соответствующие им температуры равны 1206 и 1188 К.
Рис. 4.
Профили мольных долей С3Н3 при эквивалентном отношении 1.5, при варьировании Rb от 0 до 1.0, общая мольная доля топлива 0.001, реактанты разбавлены азотом.
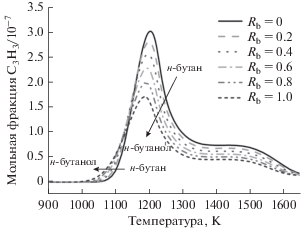
По сравнению с чистым н-бутаном, н-бутанол, содержащий функциональную ОН-группу, дает меньший выход С3Н3. В случае н-бутанола температура начала образования C3H3, а также температура максимальной мольной доли С3Н3 ниже, чем соответствующие значения для н-бутана. Для каждого 10%-ного увеличения отношения н-бутанола температура пиковой мольной доли С3Н3 понижается примерно на 2 К.
Пиковое значение мольной фракции С3Н3, образующегося из чистого н-бутанола, составляет только 57% от такового, образующегося из чистого н-бутана. Пиковое значение мольной фракции С3Н3 уменьшается на 6.9, 15.2, 24.5 и 34% по сравнению с чистым н-бутаном при процентной доле н-бутанола в смеси 20, 40, 60 и 80% соответственно. Как показано на рис. 4, с ростом доли н-бутанола (Rb) пиковое значение мольной доли С3Н3 падает.
Основываясь на предположении о том, что оба топлива (н-бутанол и н-бутан) не оказывают влияния друг на друга в процессе горения, теоретически пиковое значение мольной доли промежуточных частиц (i) для смесей н-бутанол/н-бутан ($X_{{{\text{theor}}}}^{{i,{{R}_{{\text{b}}}}}}$) может быть рассчитано по уравнению (4):
(4)
$X_{{{\text{thе о r}}}}^{{i,{{{\text{R}}}_{{\text{b}}}}}} = \left( {1{\text{ }}--{{R}_{{\text{b}}}}} \right)X_{{n{\text{ - }}{{{\text{C}}}_{4}}{{{\text{H}}}_{{10}}}}}^{i} + {{R}_{{\text{b}}}}X_{{n{\text{ - }}{{{\text{C}}}_{4}}{{{\text{H}}}_{9}}{\text{OH}}}}^{i},$Вследствие взаимодействия продуктов горения н-бутана и н-бутанола реальное пиковое значение мольной доли частиц интермедиатов отклоняется от теоретической пиковой мольной доли. Поэтому для оценки степени отклонения, отклонение реальной пиковой доли ($D_{{{{R}_{{\text{b}}}}}}^{i}$) в зависимости от Rbн-бутанола можно представить в виде:
(5)
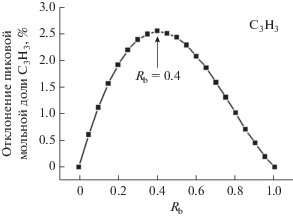
$D_{{{{R}_{{\text{b}}}}}}^{i} = \frac{{X_{{{\text{actual}}}}^{{i,{{R}_{{\text{b}}}}}}}}{{X_{{{\text{actual}}}}^{{i,{{R}_{{\text{b}}}}}} - X_{{{\text{theor}}}}^{{i,{{R}_{{\text{b}}}}}}}} \times 100,$,Пиковая мольная доля С3Н3 уменьшается с ростом Rb (рис. 5). Влияние доли н-бутанола в смеси (Rb) на отклонение реального пика мольной доли С3Н3 показано на рис. 6. Наблюдается нелинейное уменьшение пиковой мольной фракции С3Н3. Отклонение реальной пиковой мольной фракции С3Н3 больше нулевого, что указывает на то, что реальная пиковая мольная фракция С3Н3 выше теоретического значения. Как видно на рис. 6, отклонение максимально при Rb = 0.4, что указывает на существенное взаимодействие н-бутанола с н-бутаном в таких смесях.
Анализ реакционных маршрутов С3Н3
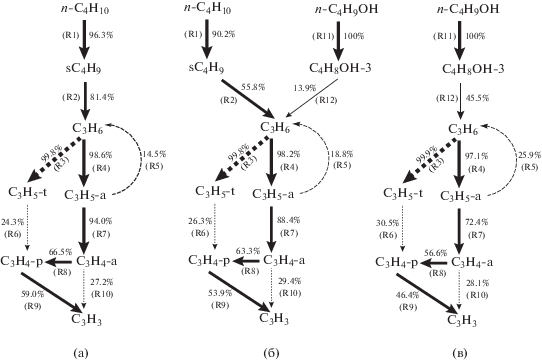
Для дальнейшего исследования причин нелинейного уменьшения пиковой мольной доли С3Н3 проводили анализ скоростей образования продуктов (ROP) для анализа маршрутов образования С3Н3. Результаты показаны на схемах 1 и 2. Для определения доминирующих путей образования С3Н3 анализ ROP проводили для температуры 1200 К, когда большая часть топлива израсходована. Существуют 12 реакций (R1–R12), участвующих в образовании С3Н3, где X представляет радикалы CH3, H, OH, O и HO2, а X' представляет, соответственно, радикалы CH4, H2, H2O, OH и H2O2.
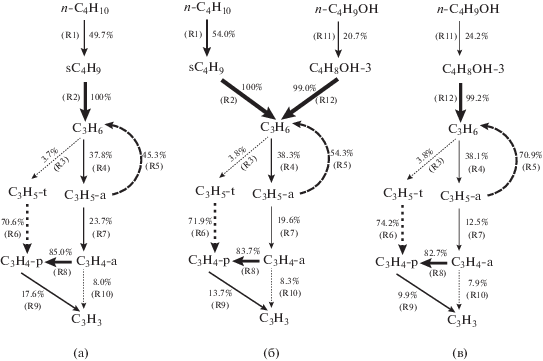
(Проценты соответствуют зависимости частиц под стрелками от частиц над стрелками.)
Схема 1. Анализ реакционных маршрутов образования C3H3 для Rb = 0 (a), Rb = 0.4 (b), Rb = 1.0 (c) при 1200 K в реакторе JSR при эквивалентном отношении 1.5.
На схеме 1 сплошная черная стрелка обозначает первичный маршрут для C3H3, а пунктирная стрелка обозначает вторичный маршрут образования C3H3. Толщина стрелки и проценты на схеме 1 отражают зависимость определенных частиц (таких как С3Н3) от родственных частиц (аллен C3H4-a и пропин C3H4-p). Например, для н-бутана (а) 59% образующихся С3Н3 зависят от C3H4-p и 27.2% зависят от C3H4-a; для н-бутанола (с) 46% образующихся С3Н3 зависят от C3H4-p и 28.1% зависят от C3H4-a, а для смесей н-бутанол/н-бутан при Rb = 0.4 (b) 53.9% образующихся С3Н3 зависят от C3H4-p и 29.4% зависят от C3H4-a.
Как видно на схеме 1(а) и (с), н-бутан и н-бутанол образуются по разным маршрутам. В случае н-бутана образуется 2-бутил (sC4H9) путем отщепления Н от β-углеродного атома молекулы н-бутана (R1), а sC4H9 дальше разлагается с образованием C3H6 (R2). В случае н-бутанола образуется C4H8OH-3 (CH3–*CH–CH2–CH2–OH) путем реакций отщепления Н от γ-углеродного атома молекулы н-C4H9OH (R11), а C4H8OH-3 затем разлагается с образованием пропена (C3H6) (R12). Вклады sC4H9 и C4H8OH-3 в образование C3H6 различны. В случае н-бутана 81.4% С3Н6 образуются из sC4H9, тогда как в случае н-бутанола только 45.5% С3Н6 образуются из C4H8OH-3, т.е. н-бутан дает больший вклад в образование С3Н6. Это является одной из причин более интенсивной генерации С3Н3 в случае н-бутана по сравнению с н‑бутанолом. После образования С3Н6 основной путь образования С3Н3 один и тот же для н-бутана и н-бутанола, а именно: C3H6 → C3H5-a (симметричный аллильный радикал, → CH2=CH–CH2*) → C3H4-a (аллен) → C3H4-p (пропин) → C3H3 (R4, R7, R8, R9). Существуют также два вторичных маршрута, относящихся к образованию С3Н3: отщепление Н от C3H4-a (R10) и C3H6 → C3H5-t (третичный аллильный радикал, CH2=*C–CH3) → C3H4-p (R3, R6).
Хотя первичный и вторичный маршруты образования C3H3 из C3H6 одинаковы, они различаются по процентным долям. Для н-бутана процентная доля реакций, участвующих в первичном маршруте образования C3H3 (R4, R7, R8, R9), больше, чем эта величина для н-бутанола. Соответственно, для н-бутанола процентная доля реакций, участвующих во вторичном маршруте образования C3H3 (R3, R6, R10), больше, чем таковая для н-бутана. Для смеси н-бутанол/н-бутан (Rb = 0.4) процентная доля всех реакций генерирования C3H3 из C3H6, за исключением реакции R10, промежуточная между значением для н-бутана и н-бутанола (схема 1(b)). Полученные результаты показывают, что для н-бутанола роль вторичного маршрута образования C3H3 усиливается, тогда как влияние первичного маршрута образования ослабляется. Этим можно объяснить тот факт, что н-бутанол дает меньше С3Н3, чем н-бутан.
(R1)
$n{\text{ - }}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{10}}} + {\text{X}} = s{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{9}} + {\text{X'}},$(R2)
${\text{s}}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{9}}}} = {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{C}}{{{\text{H}}}_{3}},$(R3)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{X = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ - t + X',}}$(R4)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{X = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ - a}} + {\text{X',}}$(R5)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ - a}} + {\text{H }}\left( {{\text{ + M}}} \right) = {{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}}\left( {{\text{ + M}}} \right){\text{,}}$(R6)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ - t = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - p + H,}}$(R7)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{\text{ - a = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - a + H,}}$(R8)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - a = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - p,}}$(R9)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - p + X = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{3}}}} + {\text{X',}}$(R10)
${{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{4}}}}{\text{ - a + X = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{3}}}} + {\text{X',}}$(R11)
$n{\text{ - }}{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{9}}}}{\text{OH + X}} = {{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{OH - 3 + X',}}$(R12)
${{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{8}}}}{\text{OH - 3 = }}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{6}}}} + {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}{\text{.}}$(Проценты соответствуют вкладам частиц над стрелками в частицы под стрелками в реакциях окисления и разложения.)
Схема 2. Анализ реакционных маршрутов получения C3H3 для Rb = 0 (a), Rb = 0.4 (b), Rb = 1.0 (c) при 1200 K в реакторе JSR при эквивалентном отношении 1.5.
На схеме 2 показаны конверсии для всех реакций, участвующих в образовании С3Н3. Сплошная черная стрелка соответствует первичному маршруту образования С3Н3, а пунктирная серая стрелка соответствует вторичному маршруту образования С3Н3. Толщина стрелки и проценты отражают величину конверсии некоторых частиц (например, н-C4H10) в родственные частицы (sC4H9), например, 49.7% н-C4H10 дают sC4H9.
Разница молекулярных структур н-бутана и н-бутанола является основной причиной их различной конверсии в реакциях отщепления Н. н-Бутан имеет два β-углеродных атома, которые могут участвовать в реакциях отщепления Н с образованием sC4H9, что приводит к высокой конверсии н-бутана в sC4H9 (49.7%). Напротив, в молекуле н-бутанола есть только один β-углеродный атом и поэтому конверсия н-бутанола в C4H8OH-3 низкая (24.2%). Этим можно объяснить, почему н-бутанол дает меньше C3H3, чем н-бутан.
При горении н-бутана конверсия по реакциям R7, R8 и R9 в первичном маршруте образования C3H3 выше, чем конверсия н-бутанола. Для смесей н-бутанол/н-бутан (Rb = 0.4) процентная доля всех реакций, генерирующих C3H3 из C3H6, за исключением реакций R4 и R10, промежуточная между долями для н-бутана и н-бутанола (схема 2(b)).
Профили мольных долей частиц С3 и С4
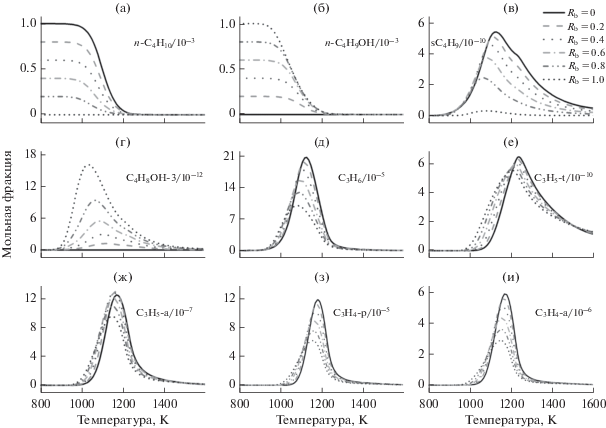
По результатам анализа реакционных маршрутов C3H3 построен рис. 7, который показывает профили мольных долей частиц C3 и C4, участвующих в маршрутах образования C3H3. Начальная температура горения н-бутанола ниже таковой для н-бутана, что объясняет сдвиг кривой мольных фракций интермедиатов С3 и С4 к более низким температурам после добавления н-бутанола. С ростом Rb мольная доля C3H5-a подрастает и затем уменьшается. Мольные доли пропена (C3H6), третичных аллильных радикалов (C3H5-t), пропина (C3H4-p) и аллена (C3H4-a) монотонно уменьшаются, причем мольная доля C3H6 уменьшается в наибольшей степени, а мольная доля C3H5-t уменьшается в наименьшей степени.
Рис. 7.
Профили мольных долей частиц С4 (a–г) и С3 (д–и) при эквивалентном отношении 1.5 при варьировании Rb от 0 до 1.0, суммарной мольной доли топлива 0.001 и реактантах, разбавленных азотом.
Температурная область, соответствующая пиковой мольной доле частиц С3 для смесей н-бутанола/н-бутан, показана на рис. 8. В общем, соответствующие температуры для всех частиц С3 в случае н-бутанола ниже таковых для н-бутана.
Рис. 8.
Температурные области, соответствующие пиковой мольной доле частиц С3 при эквивалентном отношении 1.5.
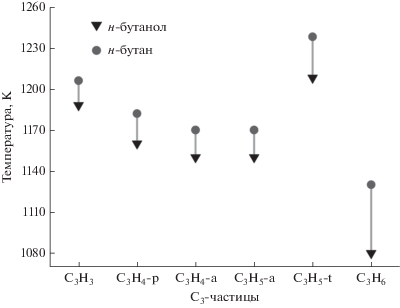
Температурная область, соответствующая пиковой мольной доле C3H6, самая низкая среди шести частиц С3. Она расположена между 1080 К для н-бутанола и 1130 К для н-бутана. Это указывает на то, что доля н-бутанола в смеси оказывает большое влияние на температурный диапазон получения. Температурная область, соответствующая пиковой мольной доле C3H5-t, самая высокая среди шести частиц С3. Она расположена между 1208 К для н-бутанола и 1238 К для н-бутана. Мольная доля резко падает в температурном интервале, где мольная доля C3H5-t достигает максимума (рис. 7e и 7f), и только ~3.8% С3Н6 дают C3H5-t (R3) (рис. 7). Поэтому мольная доля C3H5-t самая маленькая среди шести частиц С3.
Температурная область, соответствующая пиковой мольной доле C3H5-a, расположена между 1150 К для н-бутанола и 1170 К для н-бутана, что очень близко для температурной области C3H6. Около 38% C3H6 дают C3H5-a по реакции R4, которая падает до 38.09% (Rb = 1.0) после подъема от 37.79% (Rb = 0) до 38.32% (Rb = 0.6). Это может быть одной из причин, обуславливающих небольшой рост мольной доли C3H5-a и последующее падение при увеличении Rb от 0 до 1.0. C3H4-a и C3H4-p являются изомерами; температурная область, соответствующая пиковой мольной доле C3H4-p, лежит в интервале 1160–1182 K. Для C3H4-a она находится между 1150 и 1170 K, т.е. точно там же, что и для C3H4-p, полученного из C3H4-a (R8). Мольная доля C3H4-p больше, чем таковая C3H4-a, поскольку C3H4-p более стабилен, чем C3H4-a и поэтому легче образуется и труднее окисляется. Температурная область, соответствующая пиковой мольной доле C3H3, изменяется от 1188 К для н-бутанола до 1206 К для н-бутана, что очень близко к температурной области для C3H4-p.
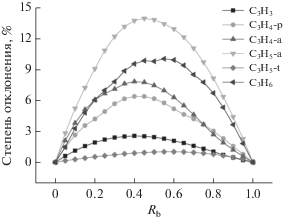
Влияние доли н-бутанола в смеси (Rb) на отклонение пиковой мольной доли частиц С3 показано на рис. 9. Найден следующий порядок отклонения пиковых мольных долей: C3H5-a > C3H6 > > C3H4-a > C3H4-p > C3H3 > C3H5-t. Больше всего отклоняется пиковая мольная доля C3H5-a, поскольку пиковая мольная доля C3H5-a немного растет, а затем падает, тогда как пиковая мольная доля других частиц С3 монотонно уменьшается с ростом Rb от 0 до 1.0 (рис. 9).
Порядок отклонения пиковой мольной доли родственных частиц C3 (C3H6 > C3H4-a > C3H4-p > > C3H3) согласуется с первичным маршрутом образования С3Н3 (C3H6 > C3H4-a > C3H4-p > C3H3). C3H5-t, как вторичная частица в маршруте образования C3H3, плохо коррелирует с C3H3 в отношении температурной области, соответствующей пиковой мольной доле, и отклонения пиковой мольной доли. Отклонение пиковой мольной доли C3H4-a, C3H4-p и C3H3 максимально при доле н-бутанола в смеси, равной 40% (Rb = 0.4). Отклонение пиковой мольной доли C3H5-a, C3H6 и C3H5-t максимально при Rb = 0.45, 0.55 и 0.6 соответственно. Взаимодействие н-бутана с н-бутанолом в процессе горения является основной причиной отклонения реальной мольной доли С3-интермедиатов горения от теоретических значений. А взаимодействие двух топлив наиболее сильно при процентной доле н-бутанола в смеси 40–60%.
Влияние доли н-бутанола в смеси
Для лучшего понимания взаимодействия топлив проанализировано влияние доли н-бутанола в смеси (Rb) на вклад и конверсию каждой реакции в маршруты образования C3H3 (рис. 10 и 11).
Рис. 10.
Влияние Rb на вклад реакций (R1)–(R12) в маршруте образования C3H3 при эквивалентном отношении 1.5.
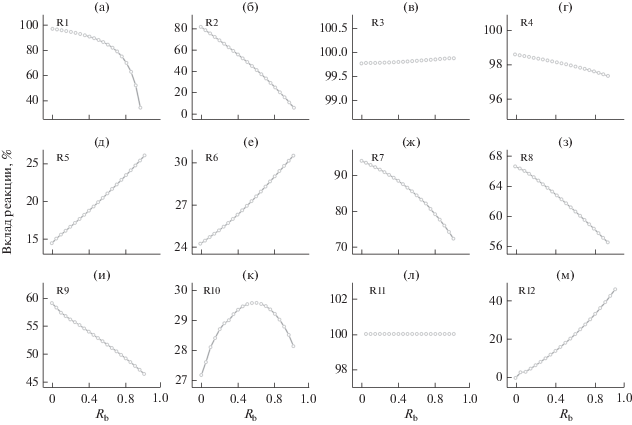
Рис. 11.
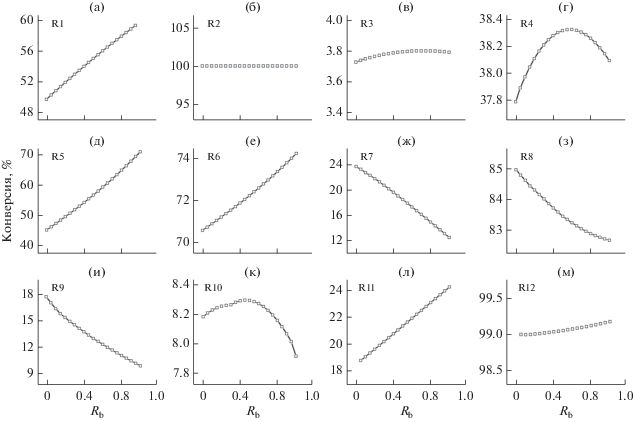
Влияние Rb на конверсию реакций (R1)–(R12) в маршруте образования C3H3 при эквивалентном отношении 1.5.
На рис. 10 видно, что с ростом Rb вклад R1 в образование sC4H9 уменьшается, что указывает на то, что sC4H9 слабее зависит от н-бутана, поскольку только малая доля sC4H9 может быть получена из н-бутанола. Вклад R11 в образование C4H8OH-3 остается 100%, т.е. н-бутанол является единственным источником C4H8OH-3. С ростом Rb роль R2 ослабляется, а роль R12 усиливается. Это указывает на существование компромисса вкладов R2 и R12 в образование C3H6. В то же время вклад R5 в C3H6 сильно зависит от Rb и с ростом Rb вклад R5 монотонно увеличивается (от 14.5 до 25.9%).
После образования C3H6 варьирование Rb мало влияет на вклады R3 (~100%) и R4 (между 97 и 99%) в образование C3H5-t и C3H5-a соответственно. Вклад R6 монотонно увеличивается, а вклады R7, R8 и R9 монотонно уменьшаются с ростом Rb. Следует отметить, что с ростом Rb вклад R10 сначала увеличивается, а затем уменьшается. Видно, что добавление н-бутанола усиливает зависимость С3Н6 от C3H5-a, которая вносит вклад в уменьшение C3H3. В то же время с ростом Rb конверсия C3H5-a в C3H6 также возрастает, что еще больше усиливает эффект уменьшения С3Н3.
На рис. 11 видно, что увеличение Rb способствует росту конверсии н-бутана в sC4H9 (R1) и н-бутанола в C4H8OH-3 (R11). Это является важнейшей причиной того, что реальная пиковая мольная доля C3H3 выше, чем теоретическая величина (рис. 5, $D_{{{{R}_{{\text{b}}}}}}^{{{{{\text{C}}}_{3}}{{{\text{H}}}_{3}}}} > 0$). В силу некоторых причин конверсия сохраняется почти постоянной (рис. 11б, 11в, 11м). Конверсия и реакция разложения sC4H9 с образованием C3H6 (R2) сохраняется на уровне 100%. Эти показатели для C4H8OH-3 (R12) с образованием C3H6 близки к 99%, a для реакции отщепления Н от C3H6 с образованием C3H5-t (R3) находятся в пределах 3.7–3.8%. Эти результаты показывают, что реакции R2, R3 и R12 относительно независимы от взаимодействия топлив.
Конверсия по R4 достигает максимума при Rb = 0.6, что очень близко к значению Rb, соответствующему максимуму отклонения мольной доли C3H5-a (Rb = 0.45) и C3H6 (Rb = 0.55) (рис. 9). С ростом Rb конверсия C3H5-a в C3H6 (R5) монотонно возрастает, уменьшая C3H3. На рис. 10ж–10и и 11ж–11и видно, что как вклад, так и конверсия реакций R7, R8 и R9 уменьшаются с ростом Rb, что является существенной причиной превышения реальной пиковой мольной доли C3H3 выше теоретического значения. Конверсия R10 достигает пика при Rb = 0.45. Это значение очень близко к Rb, соответствующим максимумам отклонения мольной доли C3H3 (Rb = 0.4) и C3H4-a (Rb = 0.4) (рис. 9).
ЗАКЛЮЧЕНИЕ
В настоящей работе проведен анализ влияния добавления н-бутанола на процессы образования C3H3 – важного прекурсора бензола. Полученные данные можно просуммировать следующим образом.
1. Результаты анализа скорости образования продуктов (ROP) C3H3 показывают, что sC4H9 и C4H8OH-3, образующиеся путем реакций отщепления Н от β-углеродных атомов н-бутана и н-бутанола, являются исходными источниками C3H3. Поскольку н-бутанол содержит меньше β-углеродных атомов, чем н-бутан, конверсия н-бутанола в C4H8OH-3 значительно ниже, чем конверсия н-бутана в sC4H9. В результате мольная доля C4H8OH-3 была значительно ниже, чем мольная доля sC4H9. Кроме того, с ростом Rb зависимость C3H6 от sC4H9 уменьшается, а зависимость C3H6 от C4H8OH-3 и C3H5-a значительно увеличивается. В этом заключаются две важных причины существенно более низкой мольной доли С3Н3, образующегося из н-бутанола, по сравнению с таковой, образующейся из н-бутана.
2. Основной маршрут образования С3Н3 из С3Н6 для н-бутана и н-бутанола практически один и тот же, а именно: C3H6 → C3H5-a → C3H4-a → → C3H4-p → C3H3. Степень отклонения пиковой мольной доли C3H4-a, C3H4-p и C3H3 достигает максимума при Rb = 0.4, а отклонение соответствующих значений для C3H5-a, C3H6 и C3H5-t максимально при Rb, соответственно, равном 0.45, 0.55 и 0.6. Это указывает на то, что при изменении Rb от 0.4 до 0.6 взаимодействие двух топлив наиболее существенно.
3. Существуют три причины нелинейного уменьшения мольной доли С3Н3. (а) При процентном содержании н-бутанола в смеси менее 60% увеличение Rb способствует конверсии н-бутана в sC4H9, что является основной причиной, поскольку менее сильная зависимость sC4H9 от н-бутана становится несущественной. При процентном содержании н-бутанола в смеси выше 60% увеличение Rb промотирует возрастание конверсии н-бутанола в C4H8OH-3. (б) Вклад реакций, участвующих в маршруте C3H5-a → C3H4-a → → C3H4-p → C3H3, уменьшается с ростом Rb, компенсируя эффект снижения конверсии в этих реакциях при уменьшении С3Н3. (в) Маршрут C3H5-t → C3H4-p → C3H3 является вторичным маршрутом образования C3H3. С ростом Rb зависимость C3H4-p от C3H5-t увеличивается, и конверсия C3H5-t в C3H4-p возрастает. В этом случае промотируется образование C3H4-p, которое косвенно усиливает образование С3Н3. Полученные данные о влиянии добавления н-бутанола на нелинейное уменьшение мольной доли C3H3 могут способствовать лучшему пониманию влияния н-бутанола на образование бензола.
БЛАГОДАРНОСТИ
Данное исследование было поддержано Национальным фондом естественных наук Китая (гранты №№ 51506011 и 51776089), Фондом естественных наук китайской провинции Цзянсу (BK 20160406), Проектом провинции Цзянсу “Шесть талантов саммита” (JXQC-001) и Правительственной стипендией Цзянсу для зарубежных исследований (JS-2016-169).
Список литературы
Jin H., Cai J., Wang G., Wang Y., Yang J., Cheng Zh., Yuan W., Qi F. // Combust. Flame. 2016. V. 169. P. 154.
Wu F., Law C.K. // Combust. Flame. 2013. V. 160. № 12. P. 2744.
Sarathy S.M., Thomson M.J., Togbe C., Dagaut R., Halter F., Mounaim-Rousselle C. // Combust. Flame. 2009. V. 156. № 4. P. 852.
Trindade W.R.d.S., Santos R.G.d. // Renew. Sustain. Energy Rev. 2017. V. 69. P. 642.
Elfasakhany A. // Renew. Sustain. Energy Rev. 2017. V. 71. P. 404.
Wei H., Feng D., Pan M., Pan J.P., Rao X.K., Gao D. // Appl. Energy. 2016. V. 175. P. 346.
Mack J.H., Schler D., Butt R.H., Dibble R.W. // Appl. Energy. 2016. V. 165. P. 612.
Yang P.-M., Lin Y.-C., Lin K.C., Jhang S.-R., Chen S.C., Wang C.-C., Lin Y.-C. // Energy. 2015. V. 90. P. 266.
Rakopoulos D.C., Rakopoulos C.D., Giakoumis E.G., Dimaratos A.M., Kuritsis D.C. // Energy Convers. Manage. 2010. V. 51. № 10. P. 1989.
Vojtisek-Lom M., Beranek V., Mikuska P., Krumal K., Coufalik P., Sikorova J., Topinka J. // Fuel. 2017. V. 197. P. 407.
Veshkini A., Eaves N.A., Dworkin S.B., Thomson M.J. // Combust. Flame. 2016. V. 167. P. 335.
Teini P.D., Karwat D.M.A., Atreya A. // Combust. Flame. 2011. V. 158. № 10. P. 2045.
Dobbins R.A., Fletcher R.A., Chang H.C. // Combust. Flame. 1998. V. 115. № 3. P. 285.
Dias V., Katshiatshia H.M., Jeanmart H. // Combust. Flame. 2014. V. 161. № 9. P. 2297.
McEnally C.S., Pfefferle L.D. // Proceedings of the Combustion Institute. 2007. V. 31. № 1. P. 603.
Sarathy S.M., Vranckx S., Yasunaga K., Mehl M., Obwald P., Metcalfe W.K., Westbrook Ch.K., Pitz W.J., Kohse-Hoinghaus K., Fernandes R.X., Curran H.J. // Combust. Flame. 2012. V. 159. № 6. P. 2028.
Stranic I., Chase D.P., Harmon J.T., Yang Sh., Davidson D.F., Hanson R.K. // Combust. Flame. 2012. V. 159. № 2. P. 516.
Dagaut P., Sarathy S.M., Thomson M.J. // Proceedings of the Combustion Institute. 2009. V. 32. № 1. P. 229.
Cai J., Zhang L., Zhang F., Wang Z., Cheng Zh., Yuan V., Qi F. // Energy & Fuels. 2012. V. 26. № 9. P. 5550.
Moss J.T., Berkowitz A.M., Oehlschlaeger M.A., Biet J., Warth V., Glaude P., Battin-Leclers F. // J. Phys. Chem. A. 2008. V. 112. № 43. P. 10843.
Togbe C., Mze-Ahmed A., Dagaut P. // Energy & Fuels. 2010. V. 24. P. 5244.
Liu W., Kelley A.P., Law C.K. // Proceedings of the Combustion Institute. 2011. V. 33. № 1. P. 995.
Grana R., Frassoldati A., Faravelli T., Niemann U., Ranzi E., Seiser R., Cattolica R., Seshadri K. // Combust. Flame. 2010. V. 157. № 11. P. 2137.
Heufer K.A., Fernandes R.X., Olivier H., Beeckmann J., Rohl O., Peters N. // Proceedings of the Combustion Institute. 2011. V. 33. № 1. P. 359.
Veloo P.S., Wang Y.L., Egolfopoulos F.N., Westbrook Ch.K. // Combust. Flame. 2010. V. 157. № 10. P. 1989.
Weber B.W., Kumar K., Zhang Y., Sung C.-J. // Combust. Flame. 2011. V. 158. № 5. P. 809.
Wang H., Frenklach M. // Combust. Flame. 1997. V. 110. № 1. P. 173.
Appel J., Bockhorn H., Frenklach M. // Combust. Flame. 2000. V. 121. № 1. P. 122.
Raj A., Prada I.D.C., Amer A.A., Chung S.H. // Combust. Flame. 2012. V. 159. № 2. P. 500.
Wang Y., Raj A., Chung S.H. // Combust. Flame. 2013. V. 160. № 9. P. 1667.
Slavinskaya N.A., Riedel U., Dworkin S.B., Thomson M.J. // Combust. Flame. 2012. V. 159. № 3. P. 979.
Slavinskaya N.A., Frank P. // Combust. Flame. 2009. V. 156. № 9. P. 1705.
Marchal C., Delfau J.-L., Vovelle C., Moreac G., Mounai-Rousselle C., Mauss F. // Proceedings of the Combustion Institute. 2009. V. 32. № 1. P. 753.
Jin H., Frassoldati A., Wang Y., Zhang X., Zeng M., Li Y., Qi F., Cuoci A., Faravelli T. // Combust. Flame. 2015. V. 162. № 5. P. 1692.
Raj A., Sander M., Janardhanan V., Kraft M. // Combust. Flame. 2010. V. 157. № 3. P. 523.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ