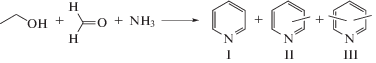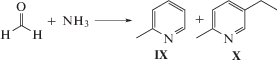Кинетика и катализ, 2019, T. 60, № 1, стр. 81-92
Мезопористые алюмосиликаты в синтезе N-гетероциклических соединений
Н. Г. Григорьева 1, 2, *, М. Р. Аглиуллин 1, 2, С. А. Костылева 1, С. В. Бубеннов 1, В. Р. Бикбаева 2, А. Р. Гатаулин 1, Н. А. Филиппова 1, Б. И. Кутепов 1, 2, Нама Нарендер 3
1 ФГБУН Институт нефтехимии и катализа Уфимского федерального исследовательского центра РАН
450075 Уфа, просп. Октября, 141, Россия
2 ФГБОУ ВО Уфимский государственный нефтяной технический университет
450062 Уфа, ул. Космонавтов, 1, Россия
3 CSIR-Indian Institute of Chemical Technology Uppal Road
500 007 Telangana State, Tarnaka, Hyderabad, India
* E-mail: ngg-ink@mail.ru
Поступила в редакцию 09.08.2018
После доработки 15.10.2018
Принята к публикации 19.10.2018
Аннотация
Исследованы каталитические свойства образцов аморфного мезопористого алюмосиликата ASM с различным мольным соотношением Si/Al (40, 80, 160) в синтезе практически важных пиридинов (взаимодействием спиртов С2–С5 с формальдегидом и аммиаком, циклоконденсацией ацетальдегида и пропаналя с аммиаком), диалкилхинолинов и алкилтетрагидрохинолинов (реакцией анилина с альдегидами С3, С4) и алкилдигидрохинолинов (взаимодействием анилина с кетонами – ацетоном, ацетофеноном). Установлено, что наибольшую активность и селективность в указанных реакциях проявляет мезопористый алюмосиликат ASM с мольным соотношением Si/Al = 40, обладающий максимальной кислотностью среди изученных образцов.
ВВЕДЕНИЕ
Азотсодержащие гетероциклические соединения представляют собой обширный класс органических веществ, многие из которых имеют практическое значение. Среди наиболее востребованных – пиридины и хинолины. Главными потребителями пиридинов являются полимерная, химическая, фармацевтическая и другие отрасли промышленности. За 150 лет после открытия пиридина были найдены и получены сотни эффективных лекарственных препаратов [1] и поиск новых лекарственных форм пиридинового ряда продолжается до сих пор [2–4]. Алкилпиридины, в частности, α-пиколин (2-метилпиридин), γ-пиколин (4-метилпиридин) и 5-этил-2-метилпиридин, используются в качестве сырья для производства 2-винилпиридина, 4-винилпиридина, 2-метил-5-винилпиридина, на основе которых изготавливаются латексы для пропитки шинного корда, ионообменные смолы, кинофотоматериалы [5–7]. Кроме того, алкилпиридины – это сырье для производства химических средств защиты растений от сорняков, вредителей и различного рода болезней [8, 9]. На основе замещенных пиридинов синтезированы экстрагенты, ингибиторы коррозии металлов, растворители, поверхностно-активные вещества, ускорители вулканизации каучука и т.д. [9–12].
Производные хинолина служат важными интермедиатами в синтезе биологически активных соединений и гербицидов [13]. Известен целый ряд противомалярийных [14, 15], антибактериальных, антисептических, противотуберкулезных средств [16], противораковых препаратов [17], приготовленных на основе хинолинов. Хинолиновый фрагмент содержится в некоторых широко используемых антибиотиках [18].
Для синтеза как пиридинов, так и хинолинов разработано много способов. Промышленно значимые методы получения N-гетероциклических соединений заключаются, в основном, в конденсации различных карбонильных соединений с аммиаком или аминами под действием кислот или оснований [19]. Для указанных процессов характерно формирование значительного количества побочных продуктов, в результате чего целевые продукты образуются не селективно, поэтому создание высокоселективных гетерогенно-каталитических способов производства N-гетероциклических соединений представляет собой важную и актуальную задачу.
Последние годы для синтеза N-гетероциклических соединений активно используют цеолитные катализаторы [20], которые дают много преимуществ при превращении вредных экологически опасных процессов циклоконденсации карбонильных соединений с аммиаком в “зеленые” химические производства. Следует, однако, отметить, что существенными недостатками цеолитов является их быстрая дезактивация из-за блокировки микропор кристаллической решетки продуктами реакции и коксом. Кроме того, микропористая структура цеолита ограничивает или затрудняет возможность синтеза объемных молекул с диаметром около и более 1 нм.
Новый подход к гетерогенно-каталитическому синтезу N-гетероциклических соединений – использование в качестве катализаторов мезопористых материалов, которые, как мы предполагали, позволят уменьшить транспортные затруднения для передвижения объемных молекул реагентов и продуктов реакции. Кроме того, в мезопорах концентрация реагирующих молекул может быть выше, что приведет к росту числа актов химического взаимодействия реагентов и увеличению степени их превращения. А для таких объемных молекул, как алкил(арил)хинолины, только в мезопорах и создаются условия для их синтеза.
Для синтеза базовых N-гетероциклических соединений – пиридинов и хинолинов – мы использовали аморфные мезопористые алюмосиликаты (ASM), получение которых золь–гель-методом было описано нами ранее [21, 22]. Указанные мезопористые материалы характеризуются узким распределением мезопор размером 2–5 нм и обладают кислотностью.
Целью настоящей работы было изучение каталитических свойств образцов аморфного мезопористого алюмосиликата ASM с различным мольным соотношением Si/Al (40, 80, 160) в синтезе пиридина и его алкилпроизводных различными способами: взаимодействием спиртов С2–С5 с формальдегидом и аммиаком, циклоконденсацией карбонильных соединений (уксусного альдегида, пропионового альдегида) с аммиаком, а также исследование активности и селективностьи мезопористого алюмосиликата ASM в синтезе алкилхинолинов, алкилтетрагидрохинолинов и алкилдигидрохинолинов реакцией анилина с альдегидами и кетонами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты
Для синтеза пиридинов использовали спирты (этанол 96%, н-пропанол 99%, н-бутанол 99%, н-пентанол 99%, “Acros”), водные растворы формальдегида (37%, “Acros”) и аммиака (28%, ч. д. а., “Сигма Тек”), уксусный альдегид (99.5%, “Acros”), пропионовый альдегид (99%, “Acros”). Алкилхинолины, алкилтетрагидрохинолины и алкилдигидрохинолины получали из анилина (99.8%, “Acros”) и карбонильных соединений (“Acros”): пропионового альдегида (99%), масляного альдегида (99%), ацетофенона (98%). Реагенты применяли без дополнительной очистки.
Катализаторы
Мезопористые алюмосиликаты синтезировали с помощью разработанного нами способа, основанного на золь–гель-методе [21, 22]. Источником кремния был тетраэтилортосиликат (ТЭОС) (98%, “Acros Organics”), источником алюминия – Al(NO3)3 ⋅ 9H2O (99%, “Merck”), растворителем служил этиловый спирт (98%). Были получены образцы мезопористых алюмосиликатов ASM с мольным соотношением Si/Al = 40, 80, 160, обозначенные как ASM-40, ASM-80, ASM-160 соответственно. Приготовленные алюмосиликаты ASM измельчали до порошков фракционного состава <100 мкм.
Физико-химические исследования катализаторов
Химический состав полученных алюмосиликатов исследовали методом рентгенфлуоресцентной спектрометрии на приборе EDX-720/900hs (“Shimadzu”, Япония).
Фазовый состав образцов анализировали на дифрактометре D8 Advance (“Bruker”, Германия) в монохроматизированном CuKα-излучении в области углов от 5° до 40° по 2θ с шагом 0.5 град/мин и временем накопления в каждой точке 20 с.
Состояние алюминия в прокаленных образцах оценивали по спектрам ЯМР 27Al. Спектры регистрировали на ЯМР-спектрометре Avance-400 (“Bruker”, Германия) c многоядерным датчиком SD4 в условиях простого одноимпульсного эксперимента при вращении образцов под магическим углом (~104 Гц) в роторах из диоксида циркония. Внешний стандарт – водный раствор AlCl3 с концентрацией 1 моль/л.
Характеристики пористой структуры определяли с помощью низкотемпературной адсорбции–десорбции азота (77 К) на сорбтометре ASAP-2020 (“Micromeritics”, США). Перед анализом образцы вакуумировали 6 ч при 350°С.
Кислотные свойства алюмосиликатов изучали методом инфракрасной (ИК) спектроскопии с использованием низкотемпературной адсорбции молекулы-зонда СО. Инфракрасные спектры регистрировали на ИК-Фурье-спектрометре FTIR-8400 (“Shimadzu”, Япония) в области 700–6000 см–1.
Синтез пиридинов и хинолинов
Синтез пиридинов осуществляли взаимодействием спиртов (этанола, н-пропанола, н-бутанола, н-пентанола) с формальдегидом и аммиаком в проточном реакторе с неподвижным слоем катализатора (1 г) при 300–400°C, атмосферном давлении, объемной скорости подачи сырья (w) 7 ч–1, мольном соотношении ROH : CH2O : NH3, равном 1.0 : 0.8 : 1.5. После окончания реакции реактор продували азотом. Продукты реакции, собранные в охлаждаемый льдом приемник, экстрагировали диэтиловым эфиром и анализировали с помощью газожидкостной хроматографии (ГЖХ).
5-Этил-2-метилпиридин синтезировали реакцией уксусного альдегида с аммиаком в автоклаве при 150°C и мольном соотношении CH3СOH : NH3 = = 1 : 3. Содержание катализатора – 10 мас. %, время реакции – 5 ч. Продукты реакции экстрагировали хлористым метиленом и анализировали с помощью ГЖХ. Реакционную массу отфильтровывали от катализатора и хроматографировали на колонке (30 г SiO2, 200 мм), элюент – смесь гексан–этилацетат (20 : 80).
2-Этил-3,5-диметилпиридин получали взаимодействием пропионового альдегида с аммиаком в проточном реакторе при 300°C, атмосферном давлении, w = 5.2 ч–1 и мольном соотношении пропаналь : NH3 = 1 : 3. Продукты реакции экстрагировали диэтиловым эфиром и анализировали методом ГЖХ.
ГЖХ-анализ пиридинов проводили на хроматографе Vega Series 2 GC-6000 (“Carlo Erba Strumentazione”, Италия) с пламенно-ионизационным детектором (насадочная колонка 3 м, фаза 15% ПЭГ-6000 на Хроматоне), температура анализа 50–200°С с программированным нагревом со скоростью 8°С/мин, температура детектора –200°С, температура испарителя – 200°С, газ-носитель – гелий (30 мл/мин).
Диалкилхинолины и диалкилтетрагидрохинолины синтезировали реакцией анилина с альдегидами (С3, С4) в автоклаве при 160°С и атмосферном давлении 6 ч, содержание катализатора – 20 мас. %, мольное соотношение анилин : альдегид = 1 : 2. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали. Реакционную массу отфильтровывали от катализатора и хроматографировали на колонке (SiO2, элюент – гексан → смесь гексан–этилацетат).
Алкилдигидрохинолин получали взаимодействием анилина с ацетофеноном в автоклаве при 130°С и атмосферном давлении 5 ч, содержание катализатора – 30 мас. %, мольное соотношение анилин : ацетофенон = 1 : 2. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали. Реакционную массу отфильтровывали от катализатора и хроматографировали на колонке (SiO2, элюент – гексан → → смесь гексан–этилацетат).
Продукты реакции (диалкилхинолины, диалкилтетрагидрохинолины, алкилдигидрохинолины) анализировали с помощью ГЖХ на хроматографе GС-9А (“Shimadzu”, Япония), пламенно-ионизационный детектор, насадочная колонка 3 м, фаза SE-30, программированный нагрев 50–250°С, газ-носитель – гелий.
Масс-спектры получены на хромато-масс-спектрометре GCMS-QP2010Plus (“Shimadzu”, Япония), фаза SPB-5, капиллярная колонка 30 м × 0.25 мм, газ-носитель – гелий, температура программирования 40–300°C, температура ионного источника – 200°C, энергия ионизации – 70 эВ).
Спектры ЯМР 1Н и 13С, гомо- и гетероядерные методики COSY, HSQC, HMBC регистрировали на приборах Avance-400 (“Bruker” , Германия, рабочая частота для 1Н – 400.13 МГц; для 13С – 100.62 МГц) и Avance III 500 HD Ascend (“Bruker” , Германия, рабочая частота для 1Н – 500.17 МГц; для 13С – 125.78 МГц), растворитель – CDCl3.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства катализаторов
Физико-химические свойства мезопористого алюмосиликата были детально изучены нами в [21, 22]. Информация о характеристиках пористой структуры и кислотных свойствах представлена в табл. 1.
Таблица 1.
Физико-химические характеристики образцов мезопористых алюмосиликатов
| Образец | Si/Al | Объем пор, см3/г | Удельная поверхность SБЭТ, м2/г |
Средний размер пор D, нм |
Концентрация кислотных центров, мкмоль/г | ||
|---|---|---|---|---|---|---|---|
| Vмикро | Vмезо | ЛКЦ | БКЦ | ||||
| ASM-40 | 40 | 0.05 | 0.50 | 670 | 4 | 162 | 50 |
| ASM-80 | 80 | 0.05 | 0.71 | 640 | 4 | 119 | 27 |
| ASM-160 | 120 | 0.05 | 0.80 | 520 | 4 | 74 | 15 |
Образцы АSM характеризуются узким распределением мезопор по размеру от 2 до 5 нм, объем мезопор находится в интервале 0.50–0.80 см3/г, удельная поверхность, рассчитанная по БЭТ, составляет 520–670 м2/г.
На поверхности исследованных образцов ASМ обнаружены Бренстедовские (БКЦ) и Льюисовские (ЛКЦ) группы. На рис. 1 приведены ИК-спектры образца ASМ-80 в области валентных колебаний ОН-групп до и после адсорбции СО. В ИК-спектре (рис. 1а, 1б) наблюдаются полосы поглощения (п. п) нескольких типов гидроксильных групп: сильные БКЦ I-типа (величина сдвига ΔνOH = 300 см–1), относящиеся к мостиковым Si–O(H)–Al-группам, и сильные БКЦ II-типа (величина сдвига ΔνOH = 270–320 см–1), принадлежащие к группам Si–O(H)…Al3+ или Al–O(H)–Al. Кроме того, на поверхности образцов присутствуют также слабокислые силанольные группы (п.п при 3742 и 3747 см–1 в ИК-спектре до адсорбции СО, величина сдвига ΔνOH = 90–150 см–1).
Рис. 1.
ИК-спектр образца ASM-80 в области колебаний поверхностных гидроксильных групп (а); разностные ИК-спектры в области валентных колебаний поверхностных гидроксильных групп для образца ASM-80 при давлении СО, равном 0.2 (1), 0.3 (2) и 5 (3) Торр (б); ИК-спектры СО, адсорбированного на образце ASM-80, в области валентных колебаний карбонильных групп при увеличении давления СО в интервале от 0.1 до 10 Торр (в).
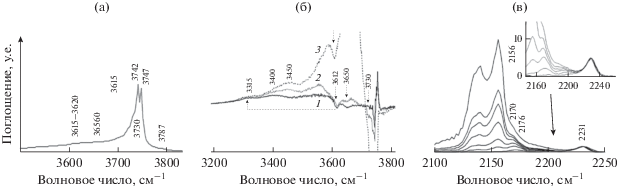
По данным ИК-спектроскопии адсорбированного СО на поверхности образцов наблюдаются 3 типа Льюисовских кислотных центров. В ИК-спектре (рис. 1в) присутствуют п.п 2223 и 2231 см–1, характерные для комплексов с СО с ионами Al3+ в пентаэдрической координации, являющихся типичными структурными дефектами алюмосиликатов и цеолитов, п.п 2210–2212 см–1, относящиеся к ЛКЦ средней силы, и п.п 2202–2200 и 2190 см–1, принадлежащие комплексу СО с ионами Al3+, по-видимому, кластеров оксида алюминия. Типы кислотных центров близки к тем, что наблюдаются для аморфных алюмосиликатов [23]. Максимальной концентрацией как БКЦ, так и ЛКЦ обладает образец ASМ-40. На образцах ASМ-80 и ASМ-160 концентрация кислотных центров ниже (табл. 1).
Каталитические свойства мезопористого алюмосиликата ASM в синтезе N-гетероциклических соединений
Синтез пиридинов реакцией спиртов С2–С5 с формальдегидом и аммиаком. Синтез пиридина и его метилпроизводных проводили реакцией этанола с формальдегидом и аммиаком, впервые осуществленной под действием цеолитов ZSM-5 [24]. Как на цеолитных катализаторах, так и на аморфных мезопористых алюмосиликатах АSM основными продуктами этой реакции являются пиридин (I), пиколины (2-, 3- и 4-метилпиридины) (II) и лутидины (диметилпиридины) (III) (схема 1 ). В составе пиколинов до 80% приходится на долю 3-метилпиридина, в составе лутидинов преобладает 3,5-изомер. Кроме этого, образуются более “тяжелые”, чем диметилпиридины, соединения.
Схема 1 .
Результаты изучения каталитических свойств мезопористых алюмосиликатов АSM (с мольным соотношением Si/Al = 40, 80 и 160), отличающихся кислотными характеристиками, в реакции этанола, формальдегида и аммиака, приведены в табл. 2.
Таблица 2.
Синтез пиридинов на мезопористых алюмосиликатах ASМ реакцией этанола, формальдегида и аммиака*
| Катализатор | Т, °С | Конверсия спирта, % | Селективность, % | Ссылка | |||
|---|---|---|---|---|---|---|---|
| пиридин (I) |
пиколины (II) |
лутидины (III) |
тяжелые | ||||
| ASМ-40 | 300 | 50 | 19 | 57 | 18 | 6 | Настоящая работа |
| ASМ-80 | 300 | 30 | 20 | 56 | 22 | 2 | » |
| ASМ-160 | 300 | 10 | 24 | 49 | 25 | 2 | » |
| ASМ-40 | 400 | 80 | 18 | 47 | 24 | 11 | » |
| H-ZSM-5** (Si/Al = 150) |
420 | 72.5 | 53 | 32 | 15 | Не определяли | 24 |
| Pb-ZSM-5** | 400 | 44.9 | 53 | 32 | 15 | Не определяли | 24 |
Установлено, что наиболее активен в реакции мезопористый алюмосиликат ASМ-40. Конверсия этанола на образцах мезопористых алюмосиликатов падает в ряду ASМ-40 > ASМ-80 > ASМ-160, что связано с уменьшением концентрации кислотных центров за счет понижения доли атомов Al в каркасе алюмосиликата. Полученные данные показывают, что каталитические системы ASМ проявляют активность в исследуемой реакции только при наличии в них определенного количества сильных кислотных центров. Уменьшение концентрации БКЦ ниже определенного уровня приводит к потере активности катализатора, которую не может восполнить доступность центров.
В продуктах реакции, образующихся под действием изученных катализаторов, преобладают пиколины (преимущественно 3-метилпиридин) – 49–57%. Наиболее селективно пиколины образуются на образцах мезопористых алюмосиликатов с мольным соотношением Si/Al, равным 40 и 80. Повышение соотношения каркасных атомов образцов алюмосиликатов Si/Al от 40 до 160 приводит к росту селективности по пиридину и лутидинам, а селективность образования пиколинов и “тяжелых” соединениям снижается.
Активность и селективность мезопористых алюмосиликатов ASМ мы сравнили со свойствами микропористых катализаторов – цеолитов Н-ZSM-5 и Pb-ZSM-5 [24]. Из приведенных в табл. 2 данных видно, что конверсия этанола при близких температурах (400 и 420°С) на мезопористом алюмосиликате ASМ-40 несколько выше, чем на наиболее активном цеолите Н-ZSM-5. Учитывая, что опыты на образце ASМ-40 проводили при большей объемной скорости подачи сырья (7 ч–1), чем на цеолитах Н-ZSM-5 и Pb-ZSM-5 (0.5 ч–1), и что с уменьшением w конверсия спирта возрастает, можно достаточно уверенно говорить о высокой активности мезопористых алюмосиликатов ASМ в синтезе пиридинов реакцией этанола, формальдегида и аммиака.
При сравнении состава продуктов, образующихся на цеолитных катализаторах и аморфных алюмосиликатах, видно, что реакционная масса, полученная на мезопористом алюмосиликате, обогащена метилпиридинами – пиколинами и лутидинами. Соотношение пиридин : пиколины : : лутидины в продуктах, синтезированных в присутствии цеолитов Н-ZSM-5 и Pb-ZSM-5, равно 1 : 0.6 : 0.3, в то время как для мезопористого алюмосиликата ASМ-40 это соотношение составляет 1 : 3 : 1.
Представленные данные убедительно показывают возможность применения аморфных мезопористых алюмосиликатов, обладающих кислотными свойствами, в синтезе пиридинов реакцией этанола, формальдегида и аммиака. По активности образец мезопористого алюмосиликата ASМ-40 не уступает цеолитным катализаторам Н-ZSM-5 и Pb-ZSM-5, а суммарная селективность образования пиколинов и лутидинов на нем достигает 75–78%.
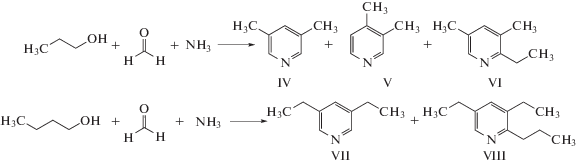
Реакция других спиртов – н-пропанола и н-бутанола – с формальдегидом и аммиаком проходит в присутствии мезопористых алюмосиликатов ASМ с образованием преимущественно 3,5-диалкилпиридинов (схема 2 ).
Схема 2 .
В случае н-пропанола основным продуктом реакции является 3,5-лутидин (IV), в случае н-бутанола – 3,5-диэтилпиридин (VII). Помимо диалкилпиридинов (IV) и (VII) в продуктах реакции присутствуют “легкие” соединения, среди которых идентифицированы как продукты линейной конденсации спирта, формальдегида и аммиака (имины, пропил- и бутиламины, ацеталь), так и 3-метилпиридин. В реакции с н-пропанолом наряду с 3,5-лутидином (IV) образуется 3,4-лутидин (V) и смесь триалкилпиридинов с преобладающим содержанием 2-этил-3,5-диметилпиридина (VI). В реакции с н-бутанолом основной побочный продукт – 2-пропил-3,5-диэтилпиридин (VIII). Приведенные в табл. 3 данные показывают, что образец мезопористого алюмосиликата ASM-40 проявляет высокую селективность в синтезе 3,5-диалкилпиридинов. В реакции н-пропанола с формальдегидом и аммиаком при 300°С селективность образования 3,5-лутидина составляет 97% при конверсии спирта 25%. С повышением температуры до 400°С конверсия спирта увеличивается до 70%, но в реакционной массе возрастает количество побочных соединений, в результате чего селективность образования диалкилпиридинов снижается. Аналогичные зависимости наблюдали при взаимодействии н-бутанола с формальдегидом и аммиаком: с повышением температуры от 300 до 400°С конверсия спирта возрастает с 22 до 62%, а селективность образования 3,5-диэтилпиридина падает с 86 до 63%.
Таблица 3.
Синтез 3,5-диалкилпиридинов на мезопористом алюмосиликате ASМ-40 и цеолитных катализаторах*
| Катализатор | Спирт | Т, °С | Конверсия спирта, % | Селективность, % | Ссылка | |||
|---|---|---|---|---|---|---|---|---|
| легкие | 3,5-ди-алкилпи-ридины | другие ди- и триалкил-пиридины | тяжелые | |||||
| ASM-40 | н-Пропанол | 300 | 25 | 3 | 97 | – | – | Настоящая работа |
| ASM-40 | н-Пропанол | 350 | 45 | 5 | 84 | 11 | – | » |
| ASM-40 | н-Пропанол | 400 | 70 | 6 | 79 | 15 | – | » |
| ASM-40 | н-Бутанол | 300 | 22 | 3 | 86 | 11 | – | » |
| ASM-40 | н-Бутанол | 400 | 62 | 11 | 63 | 26 | – | » |
| ASM-40 | н-Пентанол | 400 | 20 | 25 | 40 | 25 | 10 | » |
| H-Y | н-Пропанол | 400 | 16 | 11 | 63 | 23 | 3 | » |
| H-Y | н-Бутанол | 400 | 14 | 30 | 41 | 28 | 1 | » |
| La-ZSM-5** | н-Пропанол | 400 | 88.6 | 25.1 | 72.2 | 2.7 | Не опред. | 25 |
| Н-ZSM-5*** | н-Бутанол | 400 | 91.2 | 12 | 69 | 19 | Не опред. | 26 |
Дальнейшее удлинение углеводородной цепи спирта (н-пентанол) приводит к ухудшению показателей реакции: даже при 400°С конверсия спирта не превышает 20%, образуется сложная смесь продуктов, в которой содержание 3,5-дипропилпиридина составляет 40%.
Сравнение каталитических свойств мезопористого алюмосиликата ASM-40 и микропористого цеолита H-Y с мольным соотношением SiO2/Al2O3 = 5.0 (собственные данные) при взаимодействии н-пропанола/н-бутанола с формальдегидом и аммиаком показало, что на алюмосиликате ASM-40 селективность образования диалкилпиридинов и конверсия спирта выше (табл. 3). Появление большого количества побочных соединений на цеолите H-Y может быть связано со значительной концентрацией в нем неоднородных активных центров, в том числе сильных Бренстедовских кислотных центров.
При сопоставлении полученных в настоящей работе результатов с литературными данными видно (табл. 3), что мезопористый алюмосиликат ASM близок к цеолитам La-ZSM-5 (реакция н-пропанола с формальдегидом, метанолом и аммиаком, [25]) и Н-ZSM-5 (взаимодействие н-бутанола с формальдегидом и аммиаком, [26]) по селективности образования диалкилпириинов (IV) и (VII), но активность его ниже.
Реакции альдегидов с аммиаком приводят к образованию ди- и триалкилпиридинов. Одна из промышленно значимых реакций – взаимодействие уксусного альдегида с аммиаком с образованием 2-метил-5-этилпиридина (X), являющегося основным сырьем в производстве никотиновой кислоты и 2-метил-5-винилпиридина (схема 3 ).
Схема 3 .
Известно, что в промышленности метилэтилпиридин (X) получают реакцией паральдегида (тримера ацетальдегида) с аммиаком в жидкой фазе при 200–250°С и 5–10 МПа в присутствии солей аммония (например, ацетата аммония) или уксусной кислоты. Выход метилэтилпиридина по этой реакции достигает 60% [19].
Реакция уксусного альдегида с аммиаком на мезопористом алюмосиликате ASM-40 проходит с формированием преимущественно метилэтилпиридина (X), селективность образования которого в указанных условиях составляет 88% при конверсии ацетальдегида 60%. В небольшом количестве обнаружен 2-метилпиридин (IX). На микропористом цеолите H-Y, с которым мы сравнивали алюмосиликат ASM-40, конверсия уксусного альдегида выше – 69%, что обусловлено большей кислотностью катализатора H-Y (табл. 4). По-видимому, этими же причинами объясняется меньшая селективность цеолита H-Y (в 1.8 раза ниже, чем на образце ASM-40) и появление значительного количества “тяжелых” соединений, представляющих собой различные ди- и триалкилпиридины. Сравнение полученных нами результатов с литературными данными показывает, что выход метилэтилпиридина (X) (53%) близок к промышленным показателям.
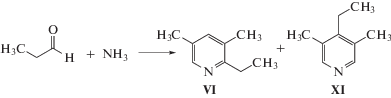
Реакция пропионового альдегида с аммиаком приводит к образованию смеси моно-, ди- и триалкилпиридинов, среди которых основным является 2-этил-3,5-диметилпиридин (VI) (схема 4 ).
Схема 4 .
В продуктах реакции помимо 2-этил-3,5-диметилпиридина (VI) идентифицированы имины (обозначены “легкие”), пиридин (I), 3- и 4-метилпиридины, диметилпиридины, 3,5-диметил-4-этилпиридин и более “тяжелые”, чем 4-этил-3,5-диметилпиридин (XI), соединения. Конверсия пропионового альдегида и состав продуктов, формирующихся на различных образцах цеолитных катализаторов, приведены в табл. 5.
Таблица 5.
Синтез 2-этил-3,5-диметилпиридина (VI) в присутствии цеолитных катализаторов
| Катализатор | Т, °С | Конверсия пропионового альдегида, % | Селективность образования, % | |||||
|---|---|---|---|---|---|---|---|---|
| легкие | пиридин (I), пиколины | 2,6-лутидин | 2-этил-3,5-диметил-пиридин (VI) | 4-этил-3,5-диметилпи-ридин (XI) | тяжелые | |||
| H-Y | 300 | 85 | 26 | 8 | – | 43 | 8 | 15 |
| ASM-40 | 150 | 70 | 23 | 15 | 10 | 40 | 9 | 3 |
| ASM-40 | 300 | 91 | 24 | 4 | 5 | 41 | 16 | 10 |
В изученных условиях (150–300°С, 7 ч–1) конверсия пропионового альдегида на алюмосиликате ASM-40 достигает 70–91%, селективность по 2-этил-3,5-диметилпиридину (VI) составляет 40–41%, количество “тяжелых” соединений не превышает 10%. Наиболее селективно 2- и 4-этил-3,5-диметилпиридины (VI) и (XI) образуются при 300°C (суммарная селективность 57%).
На микропористом цеолите H-Y при 300°C конверсия альдегида ниже (85%) и реакция проходит с формированием большего количества “тяжелых” соединений, что связано, по-видимому, с повышенной кислотностью цеолита H-Y.
Представляло интерес сравнить полученные результаты с уже известными. Оказалось, что упомянутая в работе [27] реакция пропионового альдегида с аммиаком под действием цеолита Pb-ZSM-5 проходит при 400°С и 0.5 ч–1 с конверсией альдегида, равной 69.5%. При этом состав продуктов авторы описывают как смесь 2,6-лутидина (10%) 3,5-лутидина (15%), пиридина и коллидинов (75%). Информация о селективном образовании 2-этил-3,5-диметилпиридина (VI) в работе отсутствует.
Синтез хинолинов и дигидрохинолинов. Наиболее часто для синтеза хинолинов применяются методы Скраупа, Дебнера–Миллера, Фридлендера, Комба, катализаторами которых служат кислоты или основания. Большинство из предложенных методов характеризуется многостадийностью, жесткими условиями реакции, невысокими выходами целевых продуктов.
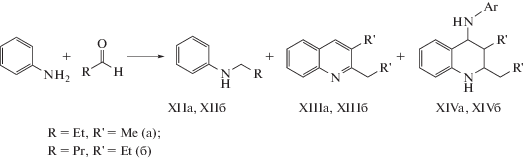
Синтез диалкилхинолинов мы попытались провести в присутствии мезопористого алюмосиликата ASM-40 реакцией анилина с альдегидами (пропионовым и масляным). Установлено, что продуктами указанной реакции являются N-алкиланилины (XIIа, XIIб), 2,3-диалкилхинолины (XIIIа, XIIIб) и 2,3-диалкил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амины (XIVа, XIVб) (схема 5 ). Кроме соединений (XII)–(XIV), в реакционной массе присутствуют продукты конденсации альдегидов, диалкил-дигидрохинолины и “тяжелые” соединения. Они обозначены на рис. 2, как “другие”.
Рис. 2.
Взаимодействие анилина с альдегидами С3, С4 в присутствии мезопористого алюмосиликата ASM-40. Мольное соотношение анилин : альдегид = 1 : 2; 160°С, 20% катализатора, растворитель – хлорбензол.
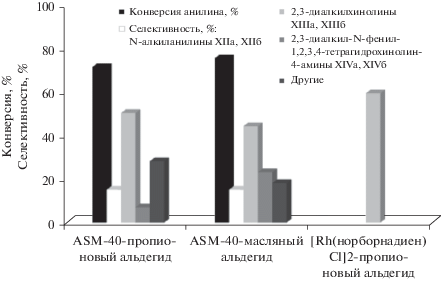
Схема 5 .
В изученных условиях конверсия анилина при взаимодействии с пропионовым и масляным альдегидами достаточно высокая и составляет 71 и 75% соответственно (рис. 2). В составе продуктов реакции с пропионовым альдегидом основным соединением является диалкилхинолин (XIIIа), селективность образования которого достигает 50%. В реакции анилина с масляным альдегидом обнаружены два основных продукта – диалкилхинолин (XIIIб) и тетрагидрохинолин (XIVб) в соотношении примерно 2 : 1. Селективность образования N-алкиланилинов (XIIа, XIIб) в обеих реакциях составила 15%.
Сравнение значений выхода диалкилхинолина (XIIIa), полученного в присутствии алюмосиликата ASM-40 (39%) и [Rh(норборнадиен)Cl]2 (59%) [28] показало, что Rh-каталитические системы более эффективны в реакции анилина с пропионовым альдегидом.
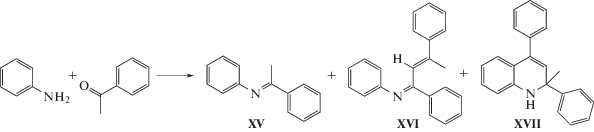
Один из наиболее простых и удобных методов получения дигидрохинолинов – взаимодействие анилина с кетонами, катализируемое кислотами [29, 30]. Ранее [31] нами было продемонстрировано, что мезопористый алюмосиликат ASM-40 позволяет осуществить синтез 2,2,4-триметил-1,2-дигидрохинолина из анилина и ацетона.
Реакция анилина с ацетофеноном на аморфных алюмосиликатах идет с образованием трех основных продуктов: (Е)-N-(1-фенилэтилиден)анилина (XV), (1Е,2Е)-N-(1,3-дифенилбут-2-ен-1-илиден)анилина (XVI) и 2-метил-2,4-дифенил-1,2-дигидрохинолина (XVII) (схема 6 ).
Схема 6 .
Кроме того, возможно протекание альдольной конденсации ацетофенона с формированием 2(Z,E)-1,3-дифенилбут-2-ен-1-она и тримеризации ацетофенона в присутствии анилина с появлением 1,3,5-триарилбензола, обозначенных в табл. 6 как “другие”.
Таблица 6.
Взаимодействие анилина с ацетофеноном в присутствии мезопористого алюмосиликата ASM-40
| Катализатор | Кетон | Конверсия анилина, % | Селективность образования, % | |||
|---|---|---|---|---|---|---|
| (Е)-N-(1-фенилэтили-ден)анилин (XV) | (1Е,2Е)-N-(1,3-дифенилбут- 2-ен-1-илиден)анилин (XVI) | 2-метил-2,4-дифенил-1,2-дигидрохинолин (XVII) | другие | |||
| ASM-40 | Ацетофенон | 57 | 18 | 23 | 45 | 14 |
| H-Y | Ацетофенон | 79 | 100 | – | – | – |
В реакции анилина с ацетофеноном алюмосиликат ASM-40 менее активен, чем в реакции с ацетоном, о чем свидетельствует меньшее значение конверсии анилина (57 и 85% соответственно). Селективность по дигидрохинолину (XVII) составляет 45%. Образовавшиеся имины (XV) и (XVI) представляют собой продукты взаимодействия анилина как с исходным ацетофеноном, так и с димером ацетофенона, параллельно формирующимся в реакционной массе в изученных условиях.
Следует отметить, что на микропористых алюмосиликатах (цеолит H-Y) образования имина (XVI), как и дигидрохинолина (XVII) не происходит. Единственный продукт в этом случае – основание Шиффа (XV), появляющееся в результате конденсации анилина с ацетофеноном.
Полученные результаты указывают на существенную зависимость активности и селективности исследованных катализаторов от их текстурных характеристик. Поскольку в цеолитах, как известно, бóльшая часть активных центров (сильнокислотные структурные ОН-группы) находится внутри каналов или полостей, то именно их доступность для реагирующих молекул является основным фактором, определяющим каталитические свойства. Низкая активность цеолита H-Y и образование на нем преимущественно продукта линейной конденсации (XV), а не объемной молекулы дигидрохинолина (XVII), обусловлены проявлением молекулярно-ситового эффекта микропористой кристаллической решетки цеолита. Кроме того, причиной малой активности цеолита H-Y могут быть не только пространственные ограничения для диффузии и взаимодействия реагентов, но и блокировка крупных полостей формирующимися молекулами дигидрохинолина (XVII), возникающая вследствие того, что диаметр входных окон в большую полость меньше диаметра самой полости (0.75 и 1.2 нм соответственно) [32].
В мезопорах алюмосиликата ASM-40 стерические препятствия для образования более объемных молекул, чем имин (XV), отсутствуют, поэтому идет не только линейная конденсация анилина с ацетофеноном, но и другие реакции: конденсация анилина с димером ацетофенона и последующая гетероциклизация соединения (XVI), приводящая к образованию дигидрохинолина (XVII).
ЗАКЛЮЧЕНИЕ
В результате изучения каталитических свойств аморфных мезопористых алюмосиликатов ASM с различным мольным соотношением Si/Al (40, 80, 160) в синтезе базовых N-гетероциклических соединений – пиридинов и хинолинов – установлено, что наиболее эффективен в исследованных реакциях циклоконденсации спиртов/карбонильных соединений с аммиаком/аминами образец ASM-40 (Si/Al = 40), имеющий максимальную концентрацию кислотных центров.
Взаимодействие этанола с формальдегидом и аммиаком в присутствии алюмосиликата ASM-40 проходит с конверсией спирта 50–80% при 300–400°C. Реакционная масса, полученная на образцах мезопористых алюмосиликатов, характеризуется высоким содержанием метилпиридинов (до 57% пиколинов и 24% лутидинов) и низким – “тяжелых” соединений.
Основной продукт реакции н-пропанола с формальдегидом и аммиаком на алюмосиликате ASM-40 – 3,5-лутидин, образующийся с селективностью до 97% при конверсии 25% (300°С). Взаимодействием н-бутанола с формальдегидом и аммиаком на цеолите H-Y удалось синтезировать 3,5-диэтилпиридин с селективностью 86% при конверсии спирта 22% (300°С).
Алюмосиликат ASM-40 обеспечивает получение 5-этил-2-метилпиридина в реакции ацетальдегида с аммиаком с селективностью 88% при конверсии альдегида 60%. Взаимодействие пропионового альдегида с аммиаком на алюмосиликате ASM-40 идет с образованием 2- и 4-этил-3,5-диметилпиридинов, суммарная селективность образования которых составляет 57% при конверсии альдегида 91%.
Анилин с альдегидами (С3, С4) реагирует с формированием 2,3-диалкилхинолинов и 2,3-диалкилтетрагидрохинолинов с суммарной селективностью 57–67%.
Показано, что анилин с ацетофеноном в присутствии мезопористого алюмосиликата ASM-40 в изученных условиях дает смесь (Е)-N-(1-фенилэтилиден)анилина, (1Е,2Е)-N-(1,3-дифенилбут-2-ен-1-илиден)анилина и 2-метил-2,4-дифенил-1,2-дигидрохинолина, в которой преобладает 2-метил-2,4-дифенил-1,2-дигидрохинолин (45%).
Высокая активность и селективность мезопористого алюмосиликата ASM в синтезе объемных молекул алкилпиридинов и алкилхинолинов по сравнению с микропористыми цеолитами достигается благодаря присутствию в его структуре мезопор, способствующих увеличению доступности кислотных центров. Такая мезопористая структура позволяет снизить диффузионные ограничения для перемещения молекул реагентов и продуктов реакции, уменьшить возможность блокирования пор. Кроме того, в мезопорах концентрация реагирующих молекул может быть больше, что приводит к росту числа актов химического взаимодействия реагентов и повышению степени их превращения. Другим фактором, благоприятствующим селективному образованию целевых продуктов, может быть наличие в алюмосиликате ASM небольшого количества кислотных центров меньшей силы, чем в цеолитных катализаторах, что препятствует протеканию побочных реакций, сопровождающихся формированием значительного количества “тяжелых” соединений и кокса, которые являются причиной дезактивации катализатора.
Список литературы
Пожарский А.Ф. // Сорос. Образ. Журн. 1996. № 6. С. 25.
Солдатенков А.Т., Колядина Н.М., Шендрик И.В. Основы органической химии лекарственных веществ. М.: Химия, 2001. 192 с.
Altaf A.A., Shahzad A., Gul Z., Rasool N., Badshah A., Lal B., Khan E. // J. Drug Design & Med. Chem. 2015. V. 1. № 1. P. 1.
El-Sayed H.A., Moustafa A.H., El-Torky A.E., Abd El-Salam E.A. // Russ. J. General Chem. 2017. V. 87. № 10. P. 2401.
Платэ Н.А., Сливинский Е.В. Основы химии и технологии мономеров. М.: МАИК Наука/Интерпериодика, 2002. 696 с.
Брацыхин Е.Л. Технология пластических масс. 2-е изд. М.-Л.: Химия, 1974. 350 с.
Лосев И.П., Тростянская Е.Б. Химия синтетических полимеров. 3-е изд. М.: Химия, 1971. 615 с.
Мельников Н.Н. Пестициды. M.: Химия, 1987. С. 712.
Henry G.D. // Tetrahedron. 2004. V. 60. P. 6043.
Химическая энциклопедия / Под ред. Кнунянца И.Л. М.: Советская энциклопедия, 1988. Т. 1. 623 с.
Камзина Ю.Н. Водорастворимый ингибитор коррозии для защиты нефтепромыслового оборудования на основе пиридина и его производных. Дис. … канд. техн. наук. Казань: КГТУ, 2005.
Reddy K.S.K., Scrinivasa Kannan C., Raghavan K.V. // Catal. Surv. Asia. 2012. V. 16. P. 28.
Marella A., Tanwar O.P., Saha R., Ali M.R., Srivastava S., Akhter M., Shaquiquzzaman M., Alam M.M. // Saudi Pharmaccutical J. 2013. V. 21. P. 1.
Golden E.B., Cho H-Y., Hofman F.M., Louie S.G. // Neurosurgical Focus. 2015. V. 38. № 3. P. 12.
Bawa S., Kumar S., Drabu S., Kumar R. // J. Pharm. Bioapllied Sci. 2010. V. 2. № 2. P. 64.
Eswaran S., Adhikari A.V., Chowdhury I.H., Pal N.K., Thomas K.D. // European J. Med. Chem. 2010. V. 45. № 8. P. 3374.
Jain S., Chandra V., Kumar Jain P., Pathak K., Pathak D., Vaidya A. // Arabian J. Chem. 2016. P. 1.
Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. М.: Медицина, 1985. 437 с.
Schimizu S., Watanabe N., Kataoka T., Shoji T., Abe N., Morishita S., Ichimura H. / Ullmann’s Encyclopedia of Industrial Chemistry, V. 30. Wiley-VCH Verlag GmbH & Co. KGaA: Weinheim, 2012. P. 34.
Krishna Mohan Kandepi V.V., Narender N. // Catal. Sci. Technol. 2012. № 2. C. 471.
Agliullin M.R., Danilova I.G., Faizullin A.V., Amarantov S.V., Bubennov S.V., Prosochkina T.R., Grigor’eva N.G., Paukshtis E.A., Kutepov B.I. // Micropor. Mesopor. Mater. 2016. V. 230. P. 118.
Аглиуллин М.Р., Григорьева Н.Г., Данилова И.Г., Магаев О.В., Водянкина О.В. // Кинетика и катализ. 2015. Т. 56. № 4. С. 507.
Паукштис Е.А. ИК-спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука. Сибир. отд., 1992. 255 с.
Kulkarni S.J., Ramachandra Rao R., Subrahmanyanm M., Rama Rao A.V. // Appl. Catal. 1994. V. 113. P. 1.
Rao R.R., Srinivas N., Kulkarni S.J., Subrahmanyam M., Raghavan K.V. // Appl. Catal.: A: General. 1997. № 161. P. 37.
Chandrakala M., Rao R.R., Kulkarni S.J., Subrahmanyam M., Raghavan K.V. // Indian J. Chem. 1998. № 37. P. 323.
Rao R., Srinivas N., Kulkarni S.J., Subrahmanyam M., Raghavan K.V. // Appl. Cat.: A: General. 1997. № 161. P. 37.
Watanabe Y., Yamamoto M., Shim S.C., Mitsudo T., Takegami Y. // Chem. Lett. 1979. P. 1025.
Walter H. // Helv. Chim. Acta. 1994. V. 77. № 3. P. 608.
Kamakshi R., Reddy B.S.R. // Catal. Commun. 2007. V. P. 825.
Григорьева Н.Г., Филиппова Н.А., Гатаулин А.Р., Бубеннов С.В., Аглиуллин М.Р., Кутепов Б.И., Нарендер Нама // Изв. АН. Сер. Хим. 2017. № 11. С. 2115.
Baerlocher Ch., McCusker L.B., Olson D.H. Atlas o Zeolite Framework Types. Amsterdam: Elsevier, 2007. 404 p.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ