Кинетика и катализ, 2019, T. 60, № 2, стр. 245-255
Влияние метода приготовления на физико-химические и функциональные свойства Ni/CeO2-катализаторов
Е. В. Матус 1, 2, *, А. С. Шляхтина 1, 2, О. Б. Сухова 1, И. З. Исмагилов 1, В. А. Ушаков 1, С. А. Яшник 1, А. П. Никитин 3, P. Bharali 4, М. А. Керженцев 1, З. Р. Исмагилов 1, 3
1 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
2 ФГБОУ ВО Новосибирский государственный технический университет
630073 Новосибирск, просп. К. Маркса, 20, Россия
3 Институт углехимии и химического материаловедения ФИЦ УУХ СО РАН
650000 Кемерово, просп. Советский,18, Россия
4 Tezpur University
784 028 Assam, India
* E-mail: matus@catalysis.ru
Поступила в редакцию 29.11.2018
После доработки 29.11.2018
Принята к публикации 29.11.2018
Аннотация
C целью разработки высокоактивных и устойчивых к зауглероживанию катализаторов риформинга углеводородного сырья изучено влияние способа приготовления (метод сложноэфирных полимерных предшественников, пропитка по влагоемкости) на физико-химические и функциональные свойства Ni/CeO2-катализаторов с различным содержанием никеля (0–15 мас. %). На основании результатов исследования образцов методами низкотемпературной адсорбции азота, рентгенофазового анализа, спектроскопии комбинационного рассеяния, просвечивающей электронной микроскопии и термопрограммируемого восстановления водородом установлено, что текстурные, структурные и окислительно-восстановительные свойства материалов зависят от способа их синтеза. Ni/CeO2-катализаторы, полученные методом сложноэфирных полимерных предшественников, по сравнению с образцами, приготовленными пропиткой, отличаются формами стабилизации активного компонента (фаза твердого раствора Сe1 – xNixOy и частицы NiO размером <5 нм vs. фаза NiO с размером частиц 5–50 нм), меньшим средним размером кристаллитов СеO2 (5.5 vs. 11 нм), высокой удельной поверхностью (105 vs. 75 м2/г) и дефектностью структуры, а также пониженной восстанавливаемостью. Показано, что в реакции автотермического риформинга этанола образцы обеих серий обеспечивают сравнимый выход водорода (до 50% при 600°С), но Ni/CeO2-катализаторы, синтезированные методом сложноэфирных полимерных предшественников, более устойчивы к образованию углеродистых отложений.
ВВЕДЕНИЕ
Диоксид церия широко используется в катализе в качестве активного компонента, носителя и модифицирующей добавки [1–5]. Устойчивость кубической структуры типа флюорита при нестехиометричности диоксида церия и наличие окислительно-восстановительной пары Се4+/Се3+ обеспечивают преимущества применения систем на его основе. Уникальность свойств этого материала обусловлена высокой кислородной емкостью и подвижностью кислорода кристаллической решетки, способностью образовывать твердые растворы различного состава Се1 – xMxOy (M = Zr, La, Pr, Gd, Y, Mg и др.), а также возможностью реализации сильного взаимодействия с нанесенными переходными металлами [6–11]. При использовании CeO2 в качестве носителя оксидных и металлических наночастиц активного компонента ключевыми факторами, определяющими функциональные свойства катализатора, являются морфология, текстурные и структурные свойства диоксида церия, а также состав, метод и условия синтеза катализатора [11–15].
Установлено [12–16], что эффективность нанесенных наночастиц металлов в каталитических реакциях зависит от морфологии частиц CeO2 носителя. В частности [12], активность RhPd/CeO2 в реакции парового риформинга этанола (ПР С2H5OH) повышается в следующем ряду: CeO2 поликристаллической структуры < кристаллиты CeO2 стержневидной формы (СeO2-стержни) < кристаллиты CeO2 кубической формы (СeO2-кубы). Улучшение каталитических свойств образцов Co/CeO2-кубы по сравнению с образцами Co/CeO2-стержни в ПР С2H5OH, по мнению авторов [15], может быть обусловлено как увеличением дисперсности и восстанавливаемости активного компонента, так и более высокой подвижностью кислорода кристаллической решетки СеО2. Для Ni-катализаторов в реакции разложения N2O наблюдается аналогичная зависимость, что объясняется большей концентрацией активных в реакции центров состава Сe–O–Ni [16]. Выявлено [17], что различие в реакционном механизме реакции ПР С2H5OH, а именно образование формиатных или ацетатных интермедиатов в присутствии Со-катализаторов на основе микро- и наночастиц диоксида церия, коррелирует с различной концентрацией кислородных вакансий в исследуемых образцах.
Показано, что увеличение степени взаимодействия металл–носитель оказывает положительное влияние на каталитические свойства материалов на основе СеО2 [3, 9, 18–21]. Так, например, активность катализаторов X–CeO2 (X = Ru, Pd, Pt) в реакциях окисления СО и СH4 повышается в ряду металлов Ru < Pd < Pt, что связывают с наблюдаемым в этом порядке усилением взаимодействия металл–диоксид церия. Отмечено [18, 19], что в случае сильного взаимодействия между нанесенными наночастицами (кластерами) металла и диоксидом церия улучшается транспорт активных форм кислорода, что увеличивает устойчивость катализаторов к зауглероживанию. Для регулирования степени взаимодействия металл–СеО2 применяют допирование диоксида церия [10, 20], варьирование метода введения активного компонента [22–24] или условий термообработки катализатора [8, 25–27]. Показано, что модифицирование диоксида церия лантаном улучшает дисперсность Ni активного компонента и стабильность работы катализатора в реакции автотермического риформинга этанола (АТР С2H5OH) [10]. Использование для приготовления Сo/CeO2 метода обратной эмульсии, в отличие от пропитки и сольватотермического разложения, обеспечивает более высокие показатели процесса ПР С2H5OH за счет повышения дисперсности активного компонента и формирования развитой поверхности раздела металл–носитель. Предельным вариантом реализации сильного взаимодействия между нанесенным активным компонентом и носителем является образование совместных поверхностных или объемных фаз, например, твердых растворов со структурой флюорита или перовскита, смешанных оксидов шпинельной структуры. При применении таких материалов в качестве предшественников катализаторов в ряде случаев требуется их активация в восстановительной или реакционной среде, что приводит к разрушению исходной совместной фазы и формированию нанесенных высокодисперсных частиц активного компонента на поверхности оксидного носителя [28–31].
Таким образом, катализаторы на основе диоксида церия – перспективные материалы, улучшение характеристик которых возможно путем направленного регулирования степени взаимодействия металл–носитель. В настоящей работе с целью разработки высокоактивных и устойчивых к зауглероживанию катализаторов риформинга углеводородного сырья синтезированы и комплексно исследованы (низкотемпературная адсорбция азота, рентгенофазовый анализ, спектроскопия комбинационного рассеяния, просвечивающая электронная микроскопия, термопрограммируемое восстановление водородом, тестирование в реакции автотермического риформинга этанола) Ni/CeO2-катализаторы с различным содержанием никеля (0–15 мас. %). Для оптимизации формы стабилизации, дисперсности и окислительно-восстановительных свойств активного компонента проведено варьирование метода приготовления (метод сложноэфирных полимерных предшественников, пропитка по влагоемкости) катализаторов, обеспечивающее различную степень взаимодействия между Ni-содержащим активным компонентом и диоксидом церия. Настоящая работа продолжает цикл исследований, направленных на разработку подходов к управлению функциональными свойствами катализаторов через направленное регулирование его физико-химических характеристик [10, 20, 32–35].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика синтеза катализаторов
Ni/CeO2-катализаторы получали методами сложноэфирных полимерных предшественников (P-серия) и пропитки по влагоемкости (I-серия). Для синтеза образцов методом сложноэфирных полимерных предшественников лимонную кислоту (ЛК) растворяли в этиленгликоле (ЭГ) при температуре 70°С. К приготовленному раствору последовательно добавляли водный раствор с заданной концентрацией нитрата церия и нитрата никеля (Сe + Ni), этилендиамин (ЭД). Мольное соотношение (Сe + Ni) : ЛK : ЭГ : ЭД было фиксированным и составляло 1 : 4 : 12 : 4. Образовавшийся гель перемешивали и затем сушили под ИК-лампой в течение 72 ч для удаления избытка растворителя. Полученное смолообразное вещество прокаливали в муфельной печи при температуре 500°С в течение 4 ч.
Для получения образцов катализаторов пропиткой по влагоемкости СеО2-носитель, синтезированный по методике [36], пропитывали водным раствором нитрата никеля с заданной концентрацией, образцы сушили под ИК-лампой и прокаливали в муфельной печи при 500°С в течение 4 ч.
В обозначении образцов цифры перед Ni показывают его массовое содержание в катализаторе, равное 2, 5, 10 или 15 мас. %. Перед проведением реакции катализаторы активировали в потоке 30 об. % H2/Не при 600°С в течение часа.
Физико-химические методы исследования катализаторов
Содержание металлов в исследуемых катализаторах определяли рентгеноспектральным флуоресцентным методом на анализаторе ARL ADVANT’X (“ThermoTechno Scientific”, Швейцария) с Rh-анодом рентгеновской трубки.
Текстурные характеристики катализаторов (удельная поверхность (SБЭТ), объем пор (Vпор) и средний диаметр пор (Dпор)) исследовали на автоматизированной волюмометрической установке ASAP 2400 (“Micromeritics”, США) путем измерения и обработки изотерм низкотемпературной адсорбции азота при 77 K.
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре HZG-4С (“Freiberger Prazisionmechanik”, Германия) в монохроматизированном CоKα-излучении (λ = 1.79021 Å). Фазовый состав определяли по дифракционным картинам, полученным путем сканирования области углов 2θ = 10°–80° с шагом 0.1 град и временем накопления 6–15 с. Размеры области когерентного рассеяния (ОКР) Сe1 – xNixOy (x = 0–0.4) рассчитывали из уширения дифракционного пика 1.1.1. фиксируемых фаз, имеющих кубическую структуру типа флюорита; OKР NiO – пика 2.0.0. фазы NiO; ОКР Ni – пика 2.0.0. фазы Ni°.
Спектры комбинационного рассеяния (КР) регистрировали в спектральном диапазоне частотного смещения 120–900 см–1 на КР-спектрометре Renishaw Invia (“Renishaw plc.”, Англия) с использованием в качестве источника возбуждения аргонового лазера с длиной волны 514.5 нм, дифракционной решетки 1800 ш/мм и объектива L50x. Мощность лазерного излучения, попадающая на образец, не превышала 2 мВт, а время накопления полезного сигнала составляло 30 с.
Снимки просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) получали на электронном микроскопе JEM–2010 (“JEOL”, Япония) с разрешением по решетке 0.14 нм при ускоряющем напряжении 200 кВ. Локальный элементный анализ образцов проводили методом спектрометрии характеристического рентгеновского излучения с дисперсией по энергиям (EDX) на спектрометре EDAX (“EDAX Inc.”, США), оснащенном Si(Li)-детектором с энергетическим разрешением не менее 130 эВ. Образцы для ПЭМВР наносили на перфорированные углеродные подложки, закрепленные на медных сетках.
Термопрограммируемое восстановление водородом (ТПВ-H2) выполняли в проточном реакторе (внутренний диаметр 5 мм) по методике, описанной в [37].
Термический анализ (дифференциальный термический анализ (ДТА), термогравиметрический анализ (ТГА) и дифференциальный термогравиметрический анализ (ДТГ)) образцов проводили на термоанализаторе NETZSCH STA 449 C (”NETZSCH-Geratebau GmbH”, Германия) в интервале температур 25–900°С со скоростью подъема температуры 10°С/мин в атмосфере воздуха.
Методика исследования активности катализаторов
Активность катализаторов в реакции АТР С2Н5OH исследовали в проточном кварцевом реакторе (внутренний диаметр 11 мм) по методике, описанной в [10], при атмосферном давлении, температуре 200–600°C, скорости газового потока 320 млN/мин и мольном соотношении реагентов C2H5OH : H2O : O2 : He = 1 : 3 : 0.4 : 0.7.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства
В табл. 1 представлены текстурные и структурные свойства синтезированных Ni/СеO2-катализаторов, а также результаты их изучения методом ТПВ-H2. Согласно данным рентгеноспектрального флуоресцентного метода во всех полученных образцах содержание металлов соответствует расчетным значениям. Из результатов исследования образцов методом низкотемпературной адсорбции азота следует, что способ синтеза оказывает существенное влияние на текстурные характеристики катализаторов (табл. 1). Удельная поверхность образцов P-серии выше, чем образцов I-серии. Этот эффект усиливается с увеличением доли никеля в составе катализатора (табл. 1). Так, при содержании Ni 2 мас. % SБЭТ = 105 и 85 м2/г, а при повышении его концентрации до 15 мас. % SБЭТ = 115 и 65 м2/г для образцов Ni/СеO2 (P) и Ni/СеO2 (I) соответственно. Следует отметить, что для катализаторов P-серии с увеличением содержания никеля SБЭТ изменяется слабо, составляя 110 ± 5 м2/г, что выше, чем для аналогичных систем, полученных гидротермальным методом [38]. Напротив, для катализаторов I-серии c возрастанием доли Ni наблюдается снижение удельной поверхности от 85 до 65 м2/г, что может быть связано с частичной блокировкой пор носителя кристаллитами активного компонента [37]. Независимо от способа синтеза, Ni/CeO2-катализаторы являются мезопористыми материалами, на что указывают полученные для них изотермы адсорбции IV типа с петлей гистерезиса типа H3.
Таблица 1.
Физико-химические свойства носителя и катализаторов
| Образец | Текстурные характеристики | Данные РФА | Данные КР-спектро-скопии | Результаты ТПВ-H2 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| после прокаливания* | после активации** | |||||||||||
| SБЭТ, м2/г |
Vпор, см3/г |
Dпор, нм |
фазовый состав |
размер ОКР CeO2, нм |
размер ОКР NiO, нм |
фазовый состав |
размер ОКР CeO2, нм |
размер ОКР Ni*, нм |
I570/I465 | ммоль H2/гкат | H2/Ni | |
| Немодифицированный диоксид церия | ||||||||||||
| CeO2 | 85 | 0.20 | 9.6 | CeO2 | 11.0 | – | CeO2 | 25 | – | 0 | 1.13 | 0 |
| Катализаторы, полученные методом сложноэфирных полимерных предшественников | ||||||||||||
| 2Ni/CeO2 (P) | 105 | 0.20 | 7.3 | CeO2 | 8.0 | – | CeO2 | 19.0 | – | 0.42 | 1.23 | 0.29 |
| 5Ni/CeO2 (P) | 110 | 0.24 | 8.5 | CeO2 | 6.5 | – | CeO2, Ni | 19.0 | 6.0 | 0.61 | 1.29 | 0.19 |
| 10Ni/CeO2 (P) | 105 | 0.23 | 8.8 | CeO2 | 5.5 | – | CeO2, Ni | 18.0 | 7.8 | 1.03 | 2.37 | 0.73 |
| 15Ni/CeO2 (P) | 115 | 0.27 | 9.1 | CeO2 | 5.5 | – | CeO2, Ni | 14.0 | 8.2 | 1.39 | 2.98 | 0.73 |
| Катализаторы, полученные методом пропитки по влагоемкости | ||||||||||||
| 2Ni/CeO2 (I) | 85 | 0.22 | 9.9 | CeO2 | 11.0 | – | CeO2 | 25.0 | – | 0.06 | 1.26 | 0.38 |
| 5Ni/CeO2 (I) | 80 | 0.19 | 9.6 | CeO2, NiO | 11.0 | 20.0 | CeO2, Ni | 25.0 | 20.0 | 0.24 | 1.62 | 0.58 |
| 10Ni/CeO2 (I) | 75 | 0.19 | 10.1 | CeO2, NiO | 11.0 | 25.0 | CeO2, Ni | 25.0 | 25.0 | 0.14 | 2.92 | 1.06 |
| 15Ni/CeO2 (I) | 65 | 0.16 | 9.7 | CeO2, NiO | 11.0 | 50.0 | CeO2, Ni | 25.0 | 50.0 | 0.12 | 3.61 | 0.98 |
* Образцы после прокаливания при 500°С на воздухе. ** Образцы после восстановления при 600°С в смеси 30% H2/Не. Примечание. Прочерки означают, что для этих образцов указанная характеристика (размер ОКР NiO/Ni) отсутствует из-з отсутствия соответствующих фаз NiO/Ni, что видно из фазового состава образцов.
Анализ дифракционных картин Ni/СеO2 показал, что фазовый состав образцов определяется их методом приготовления (рис. 1). Образцы P-серии по данным РФА однофазные и представляют собой фазу диоксида церия. Отсутствие пиков, относящихся к Ni-содержащим фазам, может свидетельствовать о стабилизации катионов никеля либо в составе твердого раствора на основе диоксида церия, либо в составе высокодисперсных частиц оксида никеля (ОКР < 4 нм). На образование твердого раствора Се1 – xNixOy могло бы указывать изменение параметра ячейки СеO2. Как правило, замещение катионов церия (${{r}_{{{\text{C}}{{{\text{e}}}^{{4 + }}}}}}$ = = 0.097 нм) катионами меньшего радиуса (в частности, ${{r}_{{{\text{N}}{{{\text{i}}}^{{2 + }}}}}}$ = 0.081 нм) сопровождается сокращением параметра ячейки и сдвигом дифракционных пиков в область бóльших углов [36, 38]. Однако независимо от метода синтеза катализаторов и содержания никеля в них параметр ячейки диоксида церия не изменяется при введении активного компонента в матрицу носителя и равен 5.413 ± ± 0.002 Å. Образцы I-серии двухфазные: кроме фазы носителя присутствует фаза NiO активного компонента.
Рис. 1.
Влияние метода приготовление на фазовый состав катализаторов Ni/CeO2: 1 – CeO2, 2 – 2Ni/CeO2 (P), 3 – 2Ni/CeO2 (I), 4 – 5Ni/CeO2 (P), 5 – 5Ni/CeO2 (I), 6 – 10Ni/CeO2 (P), 7 – 10Ni/CeO2 (I), 8 – 15Ni/CeO2 (P), 9 – 15Ni/CeO2 (I).
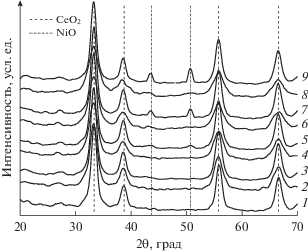
Оценка среднего размера кристаллических доменов (размер области когерентного рассеяния) по уравнению Шеррера показала, что с увеличением содержания никеля от 0 до 15 мас. % в образцах P-серии размер ОКР (СеО2) уменьшается от 11.0 до 5.5 нм, а в случае I-серии остается неизменным и составляет 11.0 нм. Наблюдаемое снижение ОКР (СеО2) в образцах Ni/СеO2 (P), полученных методом сложноэфирных полимерных предшественников, аналогично эффекту, наблюдаемому при допировании диоксида церия катионами La, Gd или Мg [36]. В частности, было показано [40], что повышение мольной доли допирующего катиона от 0.1 до 0.9 приводит к сокращению среднего размера CеО2-кристаллитов от 12 до 3 нм. Уменьшение размера ОКР при допировании – широко известное для СеО2-системы явление, обусловленное ингибированием роста кристаллитов в присутствии допирующего катиона [41]. Следует отметить, что при снижении размера частиц немодифицированного СеО2 от 70 до 2.8 нм параметр ячейки а увеличивается от 5.41 до 5.54 Å [42]. В этой связи отсутствие влияния введенного катиона никеля на параметр ячейки СеО2 для образцов P-серии может быть обусловлено уменьшением размеров кристаллитов СеО2. Соответственно, можно предположить, что при синтезе Ni/СеO2 (P) часть никеля входит в состав твердого раствора на основе диоксида церия, что ведет к наблюдаемому снижению размеров кристаллитов и росту удельной поверхности образцов по сравнению с немодифицированным диоксидом церия. Это свидетельствует о повышении устойчивости к спеканию структуры образцов P-серии по сравнению со структурой исходного СеО2-носителя и образцов I-серии.
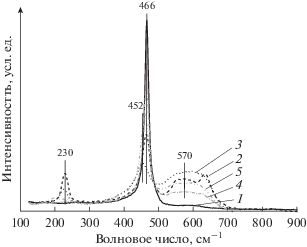
Известно, что неизовалентное замещение катионов церия катионами Ni2+ приводит к нарушению стехиометрии по кислороду и, соответственно, увеличению дефектности структуры материала [43–45]. Действительно, из анализа данных спектроскопии КР (рис. 2, табл. 1) следует, что дефектность материалов, связанная с наличием кислородных вакансий, возрастает в ряду: СеО2 < Ni/CeO2 (I) < Ni/CeO2 (P). Это подтверждается: 1) наличием полос комбинационного рассеяния в области 550–650 см–1, возникающих при допировании диоксида церия катионами металла другого радиуса и валентности; 2) значениями соотношения интенсивности полос I570/I466, используемого для оценки дефектности структуры СеО2; 3) увеличением интенсивности полосы комбинационного рассеяния в области 220–230 см–1, обусловленной поперечными акустическими колебаниями [43–45]. В частности, видно (табл. 1), что параметр I570/I466 существенно выше для образцов P-серии (0.4–1.4) по сравнению с образцами I-серии (0.1–0.2). Кроме того, для Ni/CeO2 (P), в отличие от Ni/CeO2 (I), с ростом содержания Ni в катализаторе от 2 до 15 мас. % значение I570/I466 увеличивается от 0.4 до 1.4, а положение максимума F2g-моды CeO2 (466 см–1) смещается в сторону меньших частот на 14 см–1. Наблюдаемые эффекты могут быть обусловлены частичным замещением катионов церия катионами никеля и образованием твердого раствора Сe1–xNixOy [43–45].
Рис. 2.
Спектры КР носителя (1) и катализаторов Ni/CeO2: 2Ni/CeO2 (P) (2), 15Ni/CeO2 (P) (3), 2Ni/CeO2 (I) (4), 15Ni/CeO2 (I) (5).
Результаты исследования образцов методом ПЭМ (рис. 3) хорошо согласуются с данными РФА и спектроскопии комбинационного рассеяния. Установлено, что частицы диоксида церия представлены кристаллитами размером ~10 нм, которые образуют поликристаллические агломераты преимущественно в форме пластин. Для образцов I-серии на поверхности носителя наблюдаются частицы оксида никеля, диапазон размеров которых определяется содержанием никеля: от 3 до 10 нм для 2Ni/CeO2 (I) и от 3 до 30 для 10 Ni/CeO2 (I) (рис. 3б). Образцы Ni/CeO2 (P) сформированы кристаллитами с характерными размерами до 8 нм, их структура отличается высокой дефектностью частиц оксида никеля практически не видно, за исключением единичных частиц с размером менее 5 нм в образцах с большим содержанием никеля (10–15 мас. %) (рис. 3а).
Поскольку для формирования активного компонента, а именно Ni0, катализаторы перед реакцией АТР С2Н5OH активируют путем восстановления, был исследован фазовый состав образцов после активации при 600°С в 30% H2/Не, а также выявлены особенности процесса их восстановления в условиях ТПВ-H2 (табл. 1). Из данных табл. 1 видно, что, несмотря на высокотемпературную обработку в восстановительной среде, катализаторы P-серии, в отличие от образцов I-серии, сохраняют высокую дисперсность как носителя (14–19 нм против 25 нм), так и активного компонента (6–8 нм против 20–50 нм).
На рис. 4 представлены кривые ТПВ-H2 для образцов Ni/СеO2 (P) и Ni/СеO2 (I) с различным содержанием никеля. На кривых ТПВ-H2 немодифицированного диоксида церия можно выделить две области поглощения водорода – в интервалах температур 100–600°C (максимум пика при T = 510°C) и 600–1000°C (максимум пика при T = = 880°C), которые обусловлены восстановлением катионов Ce4+, локализованных на поверхности и в объеме частиц соответственно [46]. Введение никеля в матрицу носителя изменяет профиль кривых ТПВ-H2, преимущественно, в низкотемпературной области (T < 600°C). В случае катализаторов P-серии, кроме пика с максимумом при 880°C, наблюдаются два пика с максимумами при температуре ~160 и 230 ± 5°С, а также широкий пик в области 250–450°С без выраженного максимума (рис. 4а). В случае образцов I-серии наличие Ni в их составе приводит к появлению двух пиков с максимумами при 235 ± 10 и 340 ± 20°С (рис. 4б). Независимо от метода приготовления при увеличении содержания никеля от 2 до 15 мас. % положение и интенсивность пиков при T < 250°C не изменяются, в то время как интенсивность поглощения при 250–450°С возрастает (рис. 4). Согласно анализу литературных данных [47–49] для материалов состава Ni–Ce–O можно выделить три области поглощения водорода: низкотемпературную (T < 250°С), среднюю (250°С < < T < 550°С) и высокотемпературную (T > 550°С). Первая область поглощения H2 обусловлена наличием структур [Ni–O–Ce], локализованных на поверхности твердого раствора или в местах контакта высокодисперсных частиц оксида никеля с кристаллитами диоксида церия. В работе [47] была предложена следующая схема восстановления, в которой металлический никель, первоначально образующийся из катионов Ni2+, промотирует восстановление поверхностных катионов Ce4+ до Ce3+, но сам при этом реокисляется до Ni2+:
Рис. 4.
Влияние метода приготовления на ТПВ-H2 катализаторов Ni/СеО2: а – P-серия, б – I-серия. Содержание Ni, мас. %: 1 – 0, 2 – 2, 3 – 5, 4 – 10, 5 – 15.
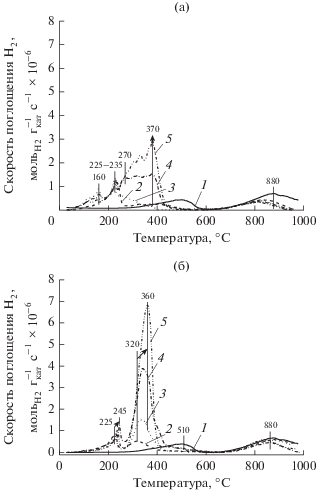
Поглощение Н2 при 250 < T < 550°С относят к восстановлению катионов никеля как в составе частиц и кластеров оксида никеля, так и в составе твердого раствора. Повышение температуры восстановления Ni2+ может быть обусловлено: 1) увеличением степени взаимодействия металл–носитель; 2) формированием крупных частиц оксида никеля [47–49]. В работе [47] было отмечено, что при образовании твердого раствора Сe1 – xMxOy (M = Cu, Ni) восстанавливаемость катионов Ce4+ возрастает, а Mn+ – уменьшается по сравнению с соответствующими однокомпонентными оксидами. Третья область поглощения водорода связана с восстановлением катионов Ce4+, локализованных в объеме частиц. В соответствии с вышеизложенным и на основании экспериментальных данных ТПВ водородом для образцов P- и I-серий (рис. 4) можно заключить, что при использовании метода сложноэфирных полимерных предшественников площадь контакта между активным компонентом и носителем более развита, а набор форм стабилизации катионов никеля шире. Кроме того, более низкие значения как общего поглощения водорода, так и H2/Ni для образцов P-серии по сравнению с образцами I-серии свидетельствует о меньшей восстанавливаемости систем, полученных методом сложноэфирных полимерных предшественников, что может быть связано с формированием твердого раствора Сe1 – xNixOy.
Для установления взаимосвязи “метод синтеза–структура–свойства” полученные катализаторы протестированы в реакции автотермического риформинга этанола.
Активность катализаторов в реакции АТР С2H5OH
В табл. 2 представлены результаты исследования активности носителя и катализаторов Ni/CeO2 в реакции АТР С2Н5OH. Помимо водорода образуется широкий спектр С-содержащих продуктов: оксиды углерода, метан, этилен, ацетальдегид и ацетон. Независимо от состава и метода приготовления катализатора с повышением температуры реакции наблюдается увеличение конверсии этанола и выхода водорода, селективность образования монооксида углерода возрастает, а селективность образования побочных продуктов С2−С3 снижается, что хорошо согласуется с ранее полученными результатами и отражает особенности механизма этой реакции [50].
Таблица 2.
Активность* носителя и катализаторов в реакции автотермического риформинга этанола и их степень зауглероживания
| Образец | T, °C | ${{X}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}},$ % | ${{Y}_{{{{{\text{H}}}_{2}}}}},$ % | S, % | С**, % | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| CO | CO2 | CH4 | C2H4 | C2H4O | C3H6O | |||||
| CeO2 | 300 | 42 | 5 | 4 | 36 | 1 | 19 | 18 | 22 | 1.7 |
| 400 | 72 | 9 | 6 | 31 | 3 | 21 | 8 | 31 | ||
| 500 | 88 | 15 | 6 | 30 | 6 | 14 | 6 | 38 | ||
| 600 | 99 | 22 | 16 | 41 | 20 | 11 | 4 | 8 | ||
| 2Ni/CeO2 (P) | 300 | 26 | 5 | 3 | 52 | 1 | 4 | 19 | 21 | 3.6 |
| 400 | 54 | 12 | 6 | 45 | 1 | 4 | 33 | 11 | ||
| 500 | 58 | 20 | 17 | 41 | 6 | 1 | 26 | 9 | ||
| 600 | 97 | 35 | 30 | 46 | 11 | 1 | 9 | 2 | ||
| 2Ni/CeO2 (I) | 300 | 56 | 15 | 10 | 46 | 4 | 6 | 5 | 29 | 2.9 |
| 400 | 78 | 24 | 11 | 40 | 4 | 5 | 8 | 32 | ||
| 500 | 88 | 30 | 18 | 41 | 5 | 5 | 5 | 26 | ||
| 600 | 99 | 42 | 23 | 63 | 11 | 0 | 2 | 1 | ||
| 15Ni/CeO2 (P) | 300 | 99 | 20 | 1 | 56 | 42 | 1 | 0 | 0 | 3.1 |
| 400 | 100 | 25 | 3 | 63 | 34 | 0 | 0 | 0 | ||
| 500 | 100 | 40 | 10 | 63 | 27 | 0 | 0 | 0 | ||
| 600 | 100 | 54 | 27 | 61 | 12 | 0 | 0 | 0 | ||
| 15Ni/CeO2 (I) | 300 | 83 | 17 | 18 | 38 | 25 | 2 | 13 | 4 | 33.8 |
| 400 | 99 | 21 | 5 | 63 | 31 | 0 | 1 | 0 | ||
| 500 | 99 | 32 | 9 | 63 | 26 | 0 | 1 | 1 | ||
| 600 | 100 | 40 | 23 | 59 | 18 | 0 | 0 | 0 | ||
* Конверсия этанола (${{X}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}}$), выход водорода (${{Y}_{{{{{\text{H}}}_{2}}}}}$), селективность образования продукта (S). **Количество углеродистых отложений в катализаторах после 6 ч реакции АТР С2H5OH при 600°C по результатам термического анализа.
Как следует из данных табл. 2, в присутствии CeO2 выход водорода составляет не более 20%. Введение никеля приводит к улучшению показателей процесса: конверсия этанола и выход водорода увеличиваются, а выход побочных продуктов С2−С3 падает (табл. 2). Для катализаторов P-серии с ростом содержания никеля от 2 до 15 мас. % выход водорода повышается от 35 до 55%, в то время как для I-серии − практически не изменяется, составляя 40−45%. Для всех исследуемых образцов Ni/CeO2 на протяжении 6 ч реакции показатели процесса остаются практически неизменными, однако в присутствии CeO2 конверсия этанола снижается от 100 до 70%.
Для оценки степени зауглероживания катализаторов в ходе процесса автотермического риформинга этанола проведено исследование катализаторов после 6 ч реакции АТР С2H5OH (температура реакции 600°C) методом термического анализа в воздушной атмосфере. Установлено (табл. 2), что количество углеродистых отложений зависит от состава и метода приготовления Ni/CeO2. В случае образцов P-серии доля углеродистых отложений составляет 3−4 мас. % и слабо изменяется при варьировании состава образца. Для образцов I-серии при увеличении содержания никеля от 2 до 15 мас. % количество углеродистых отложений значительно растет – от ~3 до 30%. Следовательно, катализаторы, полученные методом сложноэфирных полимерных предшественников, в отличие от образцов, полученных пропиткой, характеризуются высокой устойчивостью к образованию углеродистых отложений.
Закономерно, что различия в функциональных свойствах образцов обусловлены их разными физико-химическими характеристиками. Как было показано выше, метод приготовления определяет текстурные и структурные свойства этих материалов, а также их способность к восстановлению. Ni/CeO2 катализаторы P-серии, в сравнении с образцами I-серии, характеризуются различными формами стабилизации активного компонента (фаза твердого раствора Сe1 – xNixOy и частицы NiO размером <5 нм против фазы NiO с размером частиц 5–50 нм), меньшим средним размером кристаллитов СеO2 (5–8 против 11 нм), более высокой удельной поверхностью (105–115 против 65–85 м2/г) и дефектностью структуры, но меньшей восстанавливаемостью. Наблюдаемые различия, по-видимому, являются результатом частичного вхождения катионов никеля в кристаллическую решетку диоксида церия и образования твердого раствора Сe1 – xNixOy. Важно отметить, что в результате восстановительной активации в образцах Ni/CeO2 (P), в отличие от катализаторов I-серии, происходит формирование частиц активной фазы Ni0, отличающихся высокой дисперсностью активного компонента (6–8 нм против 20–50 нм). Известно, что скорость образования углеродистых отложений снижается с уменьшением размера частиц Ni0 [51], а стабильный рост волокнистого углерода происходит на частицах размером 20–60 нм [52]. Высокая дисперсность активного компонента также обуславливает развитую поверхность контакта металл–носитель, что способствует эффективному транспорту активных форм кислорода от носителя к С-содержащим интермедиатам, формирующимся на Ni-центрах. Большее содержание кислородных вакансий в образцах P-серии будет оказывать влияние на кислородную емкость материала и подвижность кислорода и, соответственно, на эффективность удаления углеродистых отложений [45, 53]. Таким образом, можно заключить, что метод сложноэфирных полимерных предшественников обеспечивает реализацию сильного взаимодействия металл–носитель, что приводит к устойчивости активного компонента к спеканию и его стабилизации в высокодисперсном состоянии. Как следствие, катализаторы P-серии проявляют высокую устойчивость к зауглероживанию в ходе каталитического процесса.
ЗАКЛЮЧЕНИЕ
Проведено систематическое исследование физико-химических и каталитических свойств Ni/CeO2 (2, 5, 10 и 15 мас. %) в зависимости от способа их синтеза (метод сложноэфирных полимерных предшественников, пропитка по влагоемкости). Установлено, что оптимальным способом приготовления Ni/CeO2 является метод сложноэфирных полимерных предшественников. При его использовании, в отличие от пропитки, происходит стабилизация Ni активного компонента в высокодисперсном состоянии, что обеспечивает его устойчивость к образованию углеродистых отложений в ходе автотермического риформинга этанола.
Список литературы
Исмагилов З.Р., Кузнецов В.В., Охлопкова Л.Б., Цикоза Л.Т., Яшник С.А. Оксиды титана, церия, циркония, иттрия, алюминия. Свойства, применение и методы получения. Новосибирск: Издательство СО РАН, 2010. С. 246.
Paier J., Penschke C., Sauer J. // Chem. Rev. 2013. V. 113. P. 3949.
Rodriguez J.A., Grinter D.C., Liu Z., Palomino R.M., Senanayake S.D. // Chem. Soc. Rev. 2017. V. 46. P. 1824.
Кузнецова Т.Г., Садыков В.А. // Кинетика и катализ. 2008. Т. 49. № 6. С. 886.
Ivanov V.K., Polezhaeva O.S., Tret’yakov Yu.D. // Russ. J. Gen. Chem. 2010. V. 80. P. 604.
Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Mota N., Navarro R.M., Kerzhentsev M.A., Ismagilov Z.R., Fierro J.L.G. // Catal. Today. 2013. V. 210. P. 10.
Wang F., Wei M., Evans D.G., Duan X. // J. Mater. Chem. A. 2016. V. 4. P. 5773.
Gonzalez-DelaCruz V.M., Holgado J.P., Pereñíguez R., Caballero A. // J. Catal. 2008. V. 257. P. 307.
Малютин А.В., Михайличенко А.И., Зубавичус Я.В., Мурзин В.Ю., Кошкин А.Г., Соколов И.В. // Кинетика и катализ. 2015. Т. 56. № 1. С. 97.
Ismagilov Z.R., Matus E.V., Ismagilov I.Z., Sukhova O.B., Yashnik S.A., Ushakov V.A., Kerzhentsev M.A. // Catal. Today. 2019. V. 323. P. 166.
Capdevila-Cortada M., Vilé G., Teschner D., Pérez-Ramírez J., López N. // Appl. Catal. B. 2016. V. 197. P. 299.
Divins N.J., Casanovas A., Xu W., Senanayake S.D., Wiater D., Trovarelli A., Llorca J. // Catal. Today. 2015. V. 253. P. 99.
Hong W., Lijuan Z., Miao L., Yuan L., Xue B. // J. Rare Earths. 2013. V. 31. № 6. P. 565.
Cai W., Wang F., Daniel C., van Veen A.C., Schuurman Y., Descorme C., H. Provendier, Shen W., Mirodatos C. // J. Catal. 2012. V. 286. P. 137.
Soykal I.I., Bayram B., Sohn H., Gawade P., Miller J.T., Ozkan U.S. // Appl. Catal. A: Gen. 2012. V. 449. P. 47.
Zhao P., Qin F., Huang Z., Sun C., Shen W., Xu H. // Catal. Sci. Technol. 2018. V. 8. P. 276.
Sohn H., Celik G., Gunduz S., Dogu D., Zhang S., Shan J., Tao F.F., Ozkan U.S. // Catal. Lett. 2017. V. 147. P. 2863.
Liu Z., Duchoň T., Wang H., Peterson E.W., Zhou Y., Luo S., Zhou J., Matolín V., Stacchiola D.J., Rodriguez J.A., Senanayake S.D. // J. Phys. Chem. C. 2015. V. 119. P. 18248.
Liu Z., Duchon T., Wang H., Grinter D.C., Waluyo I., Zhou J., Liu Q., Jeong B., Crumlin E.J., Matolın V., Stacchiola D.J., Rodrigueza J.A., Senanayake S.D. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 16621.
Матус Е.В., Нефедова Д.В., Кузнецов В.В., Ушаков В.А., Стонкус О.А., Исмагилов И.З., Керженцев М.А., Исмагилов З.Р. // Кинетика и катализ. 2017. Т. 58. № 5. С. 623.
Cai W., Wanga F., Zhan E., Van Veen A.C., Mirodatos C., Shen W. // J. Catal. 2008. V. 257. P. 96.
Song H., Tan B., Ozkan U.S. // Catal. Lett. 2009. V. 132. P. 422.
Liu Z., Senanayake S.D., Rodriguez J.A. // Appl. Catal. B. 2016. V. 197. P. 184.
Carvalho F.L.S., Asencios Y.J.O., Bellido J.D.A., Assaf E.M. // Fuel Process. Technol. 2016. V. 142. P. 182.
Soykal I.I., Sohn H., Miller J.T., Ozkan U.S. // Top. Catal. 2014. V. 57. P. 785.
Bayram B., Soykal I.I., von Deak D., Miller J.T., Ozkan U.S. // J. Catal. 2011. V. 284. P. 77.
Matus E.V., Okhlopkova L.B., Sukhova O.B., Ismagilov I.Z., Kerzhentsev M.A., Ismagilov Z.R. // J. Nanoparticle Research. 2019. V. 21. P. 11.
Wang M., Zhao T., Li M., Wang H. // RSC Adv. 2017. V. 7. P. 41847.
Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Yashnik S.A., Prosvirin I.P., Kerzhentsev M.A., Ismagilov Z.R., Mota N., Navarro R.M., Fierro J.L.G. // Appl. Catal. A. 2014. V. 481. P. 104.
Mota N., Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Kerzhentsev M.A., Ismagilov Z.R., Navarro R.M., Fierro J.L.G. // Int. J. Hydrogen Energy. 2016. V. 41. P. 19373.
Zhang L., Wang X., Chen C., Zou X., Shang X., Ding W., Lu X. // RSC Adv. 2017. V. 7. P. 33143.
Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Kerzhentsev M.A., Yashnik S.A., Prosvirin I.P., Mota N., Navarro R.M., Fierro J.L.G., Ismagilov Z.R. // Int. J. Hydrogen Energy. 2014. V. 39. P. 20992.
Исмагилов И.З., Матус Е.В., Попкова В.С., Кузнецов В.В., Ушаков В.А., Яшник С.А., Просвирин И.П., Керженцев М.А., Исмагилов З.Р. // Кинетика и катализ. 2017. Т. 58. № 5. С. 634.
Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Kerzhentsev M.A., Yashnik S.A., Larina T.V., Prosvirin I.P., Navarro R.M., Fierro G.J., Gerritsen G., Abbenhuis H.C., Ismagilov Z.R. // Eurasian Chem. Technol. J. 2016. V. 18. № 2. P. 93.
Ismagilov I.Z., Matus E.V., Kuznetsov V.V., Yashnik S.A., Kerzhentsev M.A., Gerritsen G., Abbenhuis H.C.L., Ismagilov Z.R. // Eurasian Chem. Technol. J. 2017. V. 19. № 1. P. 3.
Керженцев М.А., Матус Е.В., Исмагилов И.З., Ушаков В.А., Стонкус О.А., Ларина Т.В., Козлова Г.С., Bharali P., Исмагилов З.Р. // Журн. структ. химии. 2017. Т. 58. № 1. С. 133.
Исмагилов И.З., Матус Е.В., Нефедова Д.В., Кузнецов В.В., Яшник С.А., Керженцев М.А., Исмагилов З.Р. // Кинетика и катализ. 2015. Т. 56. № 3. С. 397.
Hu Z., Qiu S., You Y., Guo Y., Guo Y., Wang L., Zhan W., Lu G. // Appl. Catal. B: Env. 2018. V. 225. P. 110.
Katta L., Sudarsanam P., Thrimurthulu G., Reddy B.M. // Appl. Catal. A. 2010. V. 101. P. 101.
Kerzhentsev M.A., Matus E.V., Ismagilov I.Z., Sukhova O.B., Bharali P., Ismagilov Z.R. // Eurasian Chem. Technol. J. 2018. V. 20. P. 283.
Ponchel A., D’Huysser A., Lamonier C., Jalowiecki-Duhamel L. // Phys. Chem. Chem. Phys. 2000. V. 2. P. 303.
Wu L., Wiesmann H.J., Moodenbaugh A.R., Klie R.F., Zhu Y., Welch D.O., Suenaga M. // Phys. Rev. B. 2014. V. 69. P. 125415.
Romero-Nunez A., Dıaz G. // RSC Adv. 2015. V. 5. P. 54571.
Liyanage A.D., Perera S.D., Tan K., Chabal Y., Balkus K.J. // ACS Catal. 2014. V. 4. P. 577.
Deng J., Chu W., Wang B., Yanga W., Zhao X.S. // Catal. Sci. Technol. 2016. V. 46. P. 851.
Yu Q., Wu X., Tang C., Qi L., Liu B., Gao F., Sun K., Dong L., Chen Y. // J. Colloid and Interface Sci. 2011. V. 354. P. 341.
Lamonier C., Ponchel A., D’Huysser A., Jalowiecki-Duhamel L. // Catal. Today. 1999. V. 50. P. 247.
Vita A., Italiano C., Fabiano C., Lagana M., Pino L. // Mater. Chem. Phys. 2015. V. 163. P. 337.
Shan W., Luo M., Ying P., Shen W., Li C. // Appl. Catal. A: Gen. 2003. V. 246. P. 1.
Zanchet B., Santos J.B.O., Damyanova S., Gallo J.M.R., Bueno J.M.C. //ACS Catal. 2015. V. 5. P. 3841.
Aramouni N.A.K., Zeaiter J., Kwapinski W., Ahmad M.N. // Energy Convers. Manage. 2017. V. 150. P. 614.
Christensen K.O., Chen D., Lødeng R., Holmen A. // Appl. Catal. 2006. V. 314. P. 9.
Vinodkumar T., Rao B.G., Reddy B.M. // Catal. Today. 2015. V. 253. P. 57.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



