Кинетика и катализ, 2019, T. 60, № 2, стр. 264-272
Исследование совместной конверсии метана с пентаном в неокислительных условиях на алюмоплатиновых катализаторах, модифицированных оксидом циркония
Н. В. Виниченко 1, *, Д. В. Голинский 1, Е. В. Затолокина 1, Е. А. Паукштис 2, И. В. Муромцев 1, Т. И. Гуляева 1, А. С. Белый 1
1 ФГБУН Институт проблем переработки углеводородов СО РАН
644040 Омск, ул. Нефтезаводская, 54, Россия
2 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: ostanina_n@mail.ru
Поступила в редакцию 28.05.2018
После доработки 31.08.2018
Принята к публикации 12.10.2018
Аннотация
Изучены физико-химические свойства алюмоплатиновых катализаторов с носителями, полученными смешением гидроксидов алюминия и циркония. Исследованы особенности хемосорбции и неокислительного превращения метана в присутствии вышеуказанных систем. Установлено влияние содержания циркония на активность и селективность превращения хемосорбированного СН4 и н-С5Н12 в ароматические углеводороды.
ВВЕДЕНИЕ
Несмотря на широкое распространение метана (CH4) на Земле, его доля использования в нефтехимической отрасли незначительна. Данный парадокс связан с крайне высокой стабильностью молекулы.
В настоящий момент на основе обширных фундаментальных исследований окислительной конверсии метана были созданы технологии, получившие название GTL (Gas to Liquid – газ в жидкость) и направленные на получение синтетического жидкого топлива или кислородсодержащих углеводородов [1–5].
Первые работы, посвященные изучению конверсии метана в неокислительных условиях, появились на рубеже 90-х гг. XX века. Их можно разделить на две большие группы: двухстадийная и одностадийная конверсия СН4. Превращение метана в две стадии заключается в его первоначальной активации взаимодействием с нанесенными катализаторами с образованием водорододефицитных СНх-частиц и последующим гидрированием этих фрагментов водородом с получением этана, пропана и бутана. Значительное количество работ в этом направлении опубликовано двумя научными коллективами под руководством Amariglio [6, 7] и Koerts [8–10]. Одностадийная конверсия – реакция дегидроциклизации метана с получением ароматических углеводородов – осуществляется в проточном реакторе при Т ≥ 973 K и атмосферном давлении в присутствии катализаторов на основе высококремнеземных цеолитов. В этом направлении неокислительного превращения СН4 проведены обширные исследования и опубликовано множество работ [11–18].
Однако, несмотря на достигнутые успехи, из-за ряда нерешенных проблем (низкие стабильность и/или активность катализаторов) и по сей день остается потребность в создании новых способов активации и методов превращения метана в более ценные углеводороды.
Ранее нами было опубликованы исследования, посвященные превращению СН4 в неокислительных условиях в арены на алюмоплатиновых системах при температуре ≤823 K [19]. Процесс осуществляли в два этапа: активировали метан хемосорбцией на поверхности Pt/Al2O3 при 293–823 K в реакторе идеального смешения с получением водорододефицитных СНх-частиц, а затем в реакционную среду подавали н-пентан. На данный момент нами изучено влияние парциального давления водорода и метана в системе, количества нанесенного металла на особенности протекания реакции [20–22]. По своей природе алюмоплатиновые катализаторы бифункциональны, поэтому наряду с описанными выше способами смещения направления превращения метана и н-пентана можно выделить и такой, как модифицирование кислотных свойств носителя. В работах [23, 24] было показано, что введение циркония в оксид алюминия приводит к изменению его физико-химических характеристик и каталитических свойств. Рассмотрены два основных метода приготовления Al2O3–ZrO2-систем: соосаждение солей металлов и пропитка оксида предшественником циркония.
Таким образом, целью настоящей работы является изучение влияния содержания ZrO2 в алюмоплатиновых катализаторах, в которых носитель получен смешением гидроксидов алюминия и циркония, на физико-химические свойства образцов и их каталитическую активность в реакции совместной дегидроциклизации активированного на поверхности метана с н-пентаном.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Носитель заданного состава получали смешением AlO(OH) и ZrO(OH)2. Гидроксид циркония готовили путем осаждения при добавлении раствора ZrO(NO3)2 · 5H2O к водному раствору аммиака и интенсивном перемешивании. Значение рН поддерживали постоянным и равным 9.5 ± 0.5. Полученный осадок выдерживали в маточном растворе в течение 1 ч, после чего отфильтровывали и промывали дистиллированной водой, а затем подсушивали при 373 K в течение 5 ч. Вторым предшественником был порошок гидроксида алюминия псевдобемитной структуры марки Pural SB1 (“Sasol Germany GmbH”). Использование водного раствора щавелевой кислоты (10 мас. %) позволило придать пластичные свойства массе смешанных гидроксидов, которую формовали в экструдаты. Далее модифицированный носитель сушили при комнатной температуре в течение суток, а затем в сушильном шкафу при 393 K в течение часа. Высушенные системы прокаливали при 873 K в токе осушенного воздуха. Платину наносили в количестве 0.5 мас. % из раствора H2PtCl6 в смеси с кислотами-конкурентами: 1 Н соляной (1 мас. %) и 1 Н уксусной (1.5 мас. %). Высушенный при 393 K катализатор прокаливали в токе осушенного воздуха при 773 K, а затем восстанавливали в атмосфере водорода. Состав приготовленных образцов представлен в табл. 1.
Таблица 1.
Номенклатура и состав катализаторов
| № | Обозначение образца | Состав носителя | Содержание нанесенной Pt, % | |
|---|---|---|---|---|
| cодержание оксида, мас. % | ||||
| ZrO2 | Al2O3 | |||
| 1 | Pt/Al2O3 | 0.00 | 100 | 0.57 |
| 2 | Pt/0.5Zr–Al | 0.51 | 99.49 | 0.47 |
| 3 | Pt/1.0Zr–Al | 0.95 | 99.05 | 0.49 |
| 4 | Pt/5.0Zr–Al | 4.80 | 95.20 | 0.47 |
| 5 | Pt/7.0Zr–Al | 7.00 | 93.00 | 0.43 |
Рентгенофазовый состав систем исследовали на порошковом рентгеновском дифрактометре D8 Advance (“Bruker”, Германия) в монохроматизированном CuKα-излучении (длина волны 0.15418 нм). Режим измерения: шаг сканирования — 0.05°, время накопления сигнала – 3 с на точку, напряжение и ток накала – 40 кВ и 40 мА соответственно, диапазон сканирования 2θ = = 10°–80°. Размеры кристаллитов оксида алюминия оценивали по параметрам рефлекса (440) рентгеновского спектра. Полученные дифрактограммы расшифровывали с использованием базы данных по порошковой дифракции ICDD PDF-2, 2006 г.
Текстурные параметры образцов определяли на приборе Sorptomatic-1900 (“Carlo Erba”, Италия) по изотермам адсорбции–десорбции азота. Удельную поверхность (Sуд) рассчитывали по изотермам адсорбции в области относительных давлений паров азота P/P0 = 0.05–0.3. Относительная ошибка нахождения удельной поверхности составляла ±3%. Суммарный объем пор вычисляли по изотермам адсорбции при относительном давлении паров азота 0.996. При расчетах плотность адсорбата принимали равной плотности нормальной жидкости, что составляет 0.02887 моль/см3.
Размер частиц нанесенной платины определяли методом просвечивающей электронной микроскопии (ПЭМ) с помощью электронного микроскопа JEM-2100 (“JEOL”, Япония), ускоряющее напряжение 200 кВ. Для исследования образцы растирали в агатовой ступке, затем диспергировали в этиловом спирте (частота 44 кГц). Полученную суспензию напыляли на медные сетки диаметром 3 мм с нанесенной на них перфорированной аморфной углеродной пленкой. Для нанесения образцов применяли ультразвуковой диспергатор УЗДН-2Т (“Укрросприбор”, Украина).
Кислотные свойства приготовленных образцов изучали методом инфракрасной (ИК) спектроскопии адсорбированного СО. Концентрацию центров N (мкмоль/г) рассчитывали по формуле: N = АСО/А0, где АСО – интегральная интенсивность полосы поглощения СО после нормировки на толщину таблетки, а А0 – коэффициент интегрального поглощения. Для регистрации спектров образцы прессовали в таблетки “толщиной” (определяли как отношение массы катализатора к его площади) 10–20 мг/см2 и прокаливали непосредственно в вакуумной ИК-кювете при температуре 773 K в течении 1 ч. Спектры адсорбированного СО записывали на Фурье-спектрометре Shimadzu 8300 (“Shimadzu”, Япония) при 77 К в интервале давлений 0.1–10 Торр (13.3–1333.3 Па) в диапазоне 4000–6000 см–1 с разрешением 4 см–1. Число накопления каждого спектра было 200 [30].
Дисперсность определяли на прецизионном хемосорбционном анализаторе AutoChem II 2920 (“Micromeritics”, США) c детектором по теплопроводности. Для нахождения дисперсности металлов использовали метод импульсной хемосорбции Н2 и СО. Хемосорбцию проводили после дополнительного восстановления при 773 K и охлаждения образца в потоке инертного газа до комнатной температуры. В расчет дисперсности платины заложены следующие стехиометрические коэффициенты: Н2 : Pt = 1 : 1; СО : Pt = 1 : 1 [25, 26].
Хемосорбцию метана исследовали в диапазоне температур 293–823 K при соотношении (моль/моль) СН4 : Ме = 10 : 1 в замкнутом реакторе (автоклаве). Катализатор предварительно восстанавливали в токе осушенного водорода при Т = 773 K в течение 1 ч, после чего, не снижая температуры, в целях удаления с поверхности катализатора слабосвязанного водорода реактор продували аргоном в течение 2 ч с последующим охлаждением до комнатной температуры. Далее в реактор подавали смесь (об. %) метана и аргона в соотношении 50 : 50. При расчете аргон использовали в качестве внутреннего стандарта.
Для определения каталитической активности образцов в реакции совместного превращения метана с н-пентаном после изучения хемосорбционных свойств в реакционную среду подавали н‑пентан (чистота 98 мас. %, “AppliChem”, Германия) при соотношении (моль/моль) C5H12 : Pt = 1 : 1. Время контакта составляло 1 мин. Выбор н-пентана в качестве модельного углеводорода связан с тем, что возможность прямой ароматизации отсутствует, а образующиеся в реакционной среде арены могут быть получены при совместном превращении н-С5Н12 и активированного на поверхности катализатора СН4. Компонентный состав продуктов реакции анализировали на хроматографах КристалЛюкс 4000М (“Мета-хром”, Россия), оборудованном детекторами по теплопроводности и насадочной колонкой длиной 1 м, наполненной цеолитом марки NaA, и Цвет-800 (“Дзержинское ОКБА”, Россия) с капиллярной колонкой PONA/PIONA (“J&W Scientific”, США) и пламенно-ионизационный детектором.
Содержание углеродных отложений на поверхности катализатора определяли на экспресс-анализаторе АН-7529 (“Гомельский завод измерительных приборов”, Белоруссия) методом автоматического кулонометрического титрования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
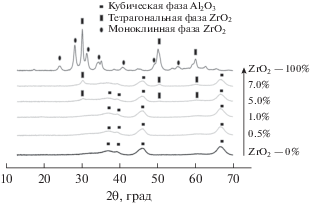
Методом рентгенофазового анализа (РФА) для катализаторов, промотированных различным количеством модификатора, были определены фазовый состав и параметры ячейки оксида алюминия. На рис. 1 представлены дифрактограммы Pt/Zr–Al-систем и индивидуальных оксидов, в табл. 2 показаны структурные параметры Al2O3 с различным содержанием циркония. На рентгенограмме ZrO2 присутствуют рефлексы, соответствующие тетрагональной и моноклинной фазам. На РФА-спектрах образцов с содержанием модификатора 0.5 и 1.0 мас. % зафиксированы пики, характерные только для оксида алюминия, кристаллическая структура которого соответствует γ-Al2O3. Отсутствие рефлексов, относящихся к диоксиду циркония, связано с недостаточным количеством этой фазы для ее определения методом РФА. При увеличении содержания промотора в образце (5.0–7.0 мас. %) на дифрактограмме появляются пики, характерные для тетрагональной фазы ZrO2 (2θ = 30° и 51°) и кубической фазы Al2O3 (2θ = 46° и 67°). Рассчитанные по реперному рефлексу (440) и приведенные в табл. 1 структурные параметры оксида алюминия показывают отсутствие смещения положения пика при 2θ = = 66.8° и изменения параметров решетки а ≈ 7.9 Å с введением оксида циркония от 0.5 до 7 мас. %. Это свидетельствует о том, что встраивания ионов Zr в структуру Al2O3 и образования твердых растворов не происходит.
Таблица 2.
Структурные параметры оксида алюминия в образцах
| Образец | 2θ440, ° | d440, Å | a, Å | D440, Å |
|---|---|---|---|---|
| Pt/Al2O3 | 66.8 | 1.4 | 7.914 | 38.72 |
| Pt/0.5Zr–Al | 66.8 | 1.4 | 7.908 | 39.05 |
| Pt/1.0Zr–Al | 66.8 | 1.4 | 7.914 | 39.05 |
| Pt/5.0Zr–Al | 66.8 | 1.4 | 7.908 | 38.28 |
| Pt/7.0Zr–Al | 66.8 | 1.4 | 7.925 | 42.56 |
В табл. 3 представлены текстурные параметры Al2O3, ZrO2 и Pt/Zr–Al-систем. Оксид алюминия и Pt/Al2O3 обладают хорошо развитой пористой структурой с площадью поверхности Sуд = 250–252 м2/г и удельным объемом пор (Vуд), равным 0.51 и 0.47 см3/г соответственно. Для Pt/0.5Zr–Al и Pt/7.0Zr–Al-систем Sуд составляет 247 и 249 м2/г, а Vуд = 0.61 и 0.53 см3/г соответственно. Средний диаметр пор (Dср) в образцах на основе оксида алюминия находится в диапазоне 75–100 Å, что характерно для мезопор. Удельная площадь поверхности и объем пор ZrO2 невелики и составляют 56 м2/г и 0.08 см3/г соответственно. Таким образом, введение диоксида циркония в количестве 0.5–7 мас. % в носитель на стадии смешения гидроксидов не оказывает влияния на текстурные характеристики катализатора, а разница в результатах измерений лежит в пределах погрешности метода. Отметим, что в работах [27, 28], где системы Al2O3–ZrO2 были приготовлены либо соосаждением солей металлов, либо пропиткой предшественником Zr, было зафиксировано снижение удельной площади поверхности с ростом концентрации диоксида циркония. Полученные наблюдения авторы объясняют частичной блокировкой пор кристаллитами ZrO2.
Таблица 3.
Текстурные параметры исследуемых образцов
| Образец | Sуд, м2/г | Vуд, см3/г | Dср, Å |
|---|---|---|---|
| Al2O3 | 250 | 0.51 | 81 |
| Pt/Al2O3 | 252 | 0.47 | 75 |
| Pt/0.5Zr–Al | 247 | 0.61 | 100 |
| Pt/7.0Zr–Al | 249 | 0.53 | 85 |
| ZrO2 | 56 | 0.08 | 58 |
Кислотные свойства приготовленных катализаторов изучали методом ИК-спектроскопии адсорбированного СО (рис. 2). На поверхности всех образцов идентифицируются четыре типа кислотных центров Льюиса (ЛКЦ), которые соответствуют максимумам полос поглощения (п. п.) при 2178–2183, 2190–2195, 2196–2197 и 2233–2235 см–1. Первые три, вероятно, относятся к структурному типу октаэдрического алюминия (AlO), а различия обусловлены составом второй координационной сферы алюминия: например, предполагают наличие соседнего тетраэдрического алюминия или присутствие в координационной сфере ОН-групп. Полоса 2233–2235 см–1, по-видимому, соответствует СО, адсорбированному на атоме алюминия, связанном с четырьмя атомами кислорода. Такая структура предположительно может быть реализована на ребре кристаллитов оксида [29]. Полосы с максимумами при 2150–2165 см–1 характеризуют СО, адсорбированный на слабокислых ОН-группах оксида алюминия. П. п. с волновым числом ниже 2150 см–1 соответствуют физической адсорбции оксида углерода на поверхности катализатора. Полосы поглощения в диапазоне 2097–2105 см–1 принадлежат линейному комплексу СО с металлической платиной [30]. Согласно [31, 32] в спектре ИК СО диоксида циркония, прокаленного при 873 K, присутствуют две полосы поглощения с максимумами при 2185–2188 и 2196–2197 см–1, относящиеся к кислотным центрам Льюиса.
Рис. 2.
ИК-спектры адсорбированного СО при температуре 77 K и давлении СО 10 Торр (1333.3 Па) для образцов: Pt/Al2O3 (а); Pt/0.5Zr–Al (б); Pt/5.0Zr–Al (в); Pt/7.0Zr–Al (г).
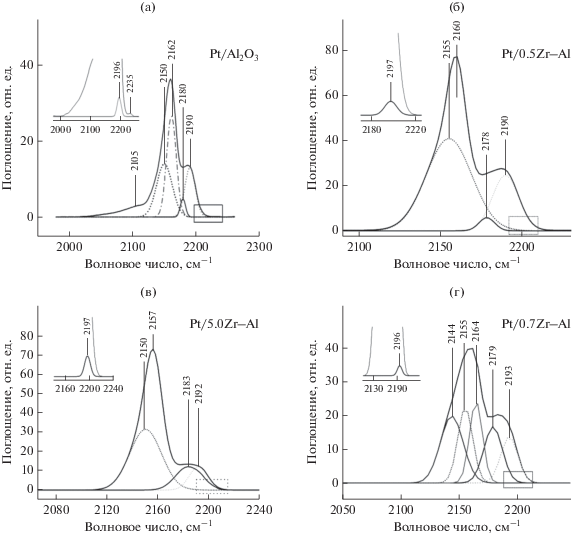
В табл. 4 представлены данные о концентрация центров (мкмоль/г), полученные методом ИК-спектроскопии адсорбированного СО. Так, введение в оксид алюминия ZrO2 в количестве 0.5 мас. % приводит к увеличению ∑ЛКЦ 2 и 3 типов носителя от 498 до 563.5 мкмоль/г и отношения ЛКЦ-2/ЛКЦ-3 от 32 до 53. Дальнейший рост содержания оксида циркония ведет к падению как ∑ЛКЦ 2 и 3 типов до 262.6 мкмоль/г, так и отношения ЛКЦ-2/ЛКЦ-3 до 20 (Pt/7.0Zr–Al). Модифицирование катализатора ZrO2 приводит к исчезновению полосы 2235 см–1, соответствующей наиболее сильным ЛКЦ. Для всех систем Pt/Zr–Al характерно повышение числа ЛКЦ 1 типа со 100 до 470 мкмоль/г. Таким образом, приготовление носителя, содержащего диоксид циркония в количестве 1–7 мас. %, путем смешения гидроксидов металлов приводит не только к росту общего числа ЛКЦ от 590 до 732.6 мкмоль/г, но и к существенному снижению силы кислотных центров. Исключение составляет образец с 0.5 мас. % ZrO2, в котором возрастание концентрации центров происходит за счет увеличения числа ЛКЦ средней силы 2-го типа. Авторы работы [33], опираясь на данные рентгеновской фотоэлектронной спектроскопии, объяснили наблюдаемое незначительное повышение числа кислотных центров в образцах с диоксидом циркония возможным замещением атомов алюминия цирконием и образованием Zr–O–Al-связей. Вероятно, подобное явление характерно и для исследованного нами образца Pt/0.5Zr–Al, так как рост ЛКЦ 2-го типа с п. п. 2190–2195 см–1 вряд ли возможен за счет введения промотора по причине отсутствия вышеуказанных кислотных центров на поверхности ZrO2.
Таблица 4.
Положения полос поглощения и концентрация ЛКЦ (мкмоль/г) по данным ИК-спектроскопии адсорбированного СО
| Образец | ЛКЦ-1 | ЛКЦ-2 | ЛКЦ-3 | ЛКЦ-4 | Отношение ЛКЦ-2/ЛКЦ-3 |
Сумма всех ЛКЦ, мкмоль/г |
|---|---|---|---|---|---|---|
| мкмоль/г | ||||||
| 2178–2183 | 2190–2195 | 2196–2197 | 2235 | |||
| см–1 | ||||||
| Pt/Al2O3 | 92 | 482 | 15.0 | 1 | 32 | 590.0 |
| Pt/0.5Zr–Al | 100 | 553 | 10.5 | – | 53 | 663.5 |
| Pt/5.0Zr–Al | 430 | 280 | 11.5 | – | 24 | 721.5 |
| Pt/7.0Zr–Al | 470 | 250 | 12.6 | – | 20 | 732.6 |
Для установления влияния эффектов модифицирования на размер и дисперсность нанесенных частиц платины в катализаторе мы использовали методы хемосорбции (зонды Н2 и СО) и ПЭМ. Дисперсность Pt для всех промотированных систем по H2 и CO изменяется в диапазоне 92–100 и 84–88% соответственно (табл. 5). Эти данные указывают на отсутствие влияния введения диоксида циркония на особенности закрепления платины. На снимке ПЭМ образца с максимальным содержанием оксида циркония наблюдаются темные по контрасту частицы металла округлой формы (рис. 3). Рассчитанный средний арифметический диаметр Pt в образце составляет 0.9 нм, т.е. платина на поверхности носителя локализована в виде кластеров.
Таблица 5.
Дисперсность Pt в исследуемых образцах, рассчитанная по величине хемосорбции Н2 и СО.
| Образец | Дисперсность, % | |
|---|---|---|
| Н2 | СО | |
| Pt/Al2O3 | ≈100 | 88 |
| Pt/1.0Zr–Al | ≈100 | 86 |
| Pt/5.0Zr–Al | 92 | 84 |
| Pt/7.0Zr–Al | 97 | 85 |
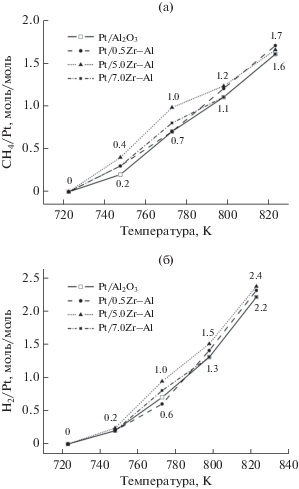
В присутствии приготовленных катализаторах исследовано превращение метана в неокислительных условиях в диапазоне температур 293–823 K. Так, на всех образцах хемосорбция CH4 начинается при температуре 748 K и составляет 0.2–0.4 моль/моль Pt. С ростом температуры количество превращенного метана на поверхности катализаторов увеличивается и при Т = 823 K составляет 1.6–1.7 моль CH4/моль Pt. Необходимо отметить, что содержание ZrO2 в носителе не влияет на величину хемосорбции метана во всем диапазоне температур (рис. 4а). Протекание поверхностной реакции сопровождается выделением водорода, данные о количестве которого представлены на рис. 4б.
Рис. 4.
Результаты хемосорбции метана в присутствии Pt/Zr–Al-систем в температурном диапазоне 293–823 K: а – величина хемосорбции метана (моль СН4/моль Pt); б – содержание водорода, выделяющегося в систему (моль Н2/моль Pt).
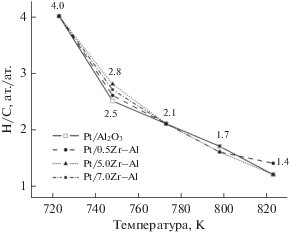
Состав углеводородных фрагментов (H/C), образующихся на поверхности катализаторов, рассчитывали из величины хемосорбции метана и количества выделившегося водорода (рис. 5). Так, при 748 K отношение Н/С составляет 2.5–2.8 ат./ат. для всех образцов. Повышение температуры реакции приводит к увеличению степени дегидрирования СНх-фрагментов и обеднению их водородом. При 823 K отношение Н/С достигает 1.2–1.4 ат./ат. Таким образом, модифицирование диоксидом циркония в количестве 0.5–7.0 мас. % алюмоплатиновых катализаторов не оказывает влияние на закономерности превращения метана, вероятно, по причине отсутствия изменений размеров нанесенной платины и ее дисперсности. Атомы платины, по-видимому, являются единственными активными центрами хемосорбции СН4.
Рис. 5.
Состав СНх-частиц, образующихся при хемосорбции метана (отношение атом Н/атом С) в диапазоне температур 293–823 K.
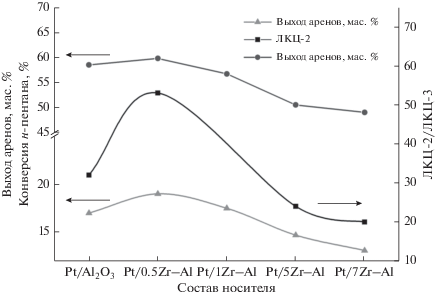
Для исследования реакционной способности активированных частиц метана при температуре 823 K в реактор подавали н-пентан при соотношении (моль/моль) C5H12 : Pt = 1 : 1. Установлено, что с ростом содержания оксида циркония с 0.5 до 7.0 мас. % в образце конверсия н-пентана снижается с 59.7 до 48.9%. Количество углеводородных газов (метан, этан, пропан, бутаны) для всей линейки катализаторов существенно не изменяется и составляет 19.3–22.2 мас. %. Для образца с содержанием ZrO2 0.5 мас. % выход аренов увеличивается по сравнению с немодифицированным катализатором с 17.1 до 19.0 мас. %. Дальнейший рост количества циркония в образцах приводит к уменьшению выхода целевых продуктов реакции до 13.1 мас. %. С повышением содержания модификатора в носителе наблюдается тенденция к снижению коксовых отложений с 17.6 до 11.7 мас. %. Наблюдаемые эффекты связаны с различным составом кислотных центров носителя. Так, выход ароматических углеводородов и конверсия н-пентана соответствуют изменениям соотношения типов ЛКЦ-2/ЛКЦ-3, которое зависит от концентрации диоксида циркония (рис. 6).
ЗАКЛЮЧЕНИЕ
Проведенные в работе исследования позволили установить, как изменяются физико-химические и каталитические свойства образцов с разным количеством ZrO2, введенного смешением его предшественника (ZrO(OH)2) с AlO(OH). Так, образование фаз взаимодействия в прокаленном носителе между оксидами циркония и алюминия не обнаружено. Отсутствует существенное влияние ZrO2 и на текстурные характеристики катализаторов. Однако модифицирование носителя цирконием ведет к изменению его кислотных свойств, а именно, к перераспределению концентраций между центрами разной силы. Только в присутствии 0.5 мас. % ZrO2 наблюдается рост центров средней силы 2 типа, что, вероятно, объясняется образованием связи Zr–O–Al. Дальнейшее увеличение содержания промотора в системе приводит к снижению ЛКЦ-2 и повышению концентрации слабых центров 1 типа.
Модифицирование оксида алюминия ZrO2 в количестве 0.5–7.0 мас. % не оказывает влияния на количество превращенного метана и степень его дегидрирования на поверхности катализаторов.
Результаты каталитических испытаний в реакции совместной конверсии активированного метана с н-пентаном показали, что максимальную активность проявляет образец Pt/0.5Zr–Al, вероятно, по причине более оптимального состава кислотных центров носителя, т.к. другие свойства бифункционального катализатора, такие как дисперсность, размер атомов платины и ее содержание практически не изменяются. Дальнейшее увеличение содержания модификатора ZrO2 в алюмоплатиновом катализаторе не рационально для изученной реакции как по причине снижения выхода целевого продукта (ароматических углеводородов), так и из-за снижения общей каталитической активности систем.
БЛАГОДАРНОСТИ
Физико-химические исследования образцов выполнены на базе Омского регионального центра коллективного пользования СО РАН (ОмЦКП СО РАН).
ФИНАНСИРОВАНИЕ
Работа выполнена при финансовой поддержке ФАНО России в соответствии с Программой фундаментальных научных исследований государственных академий наук на 2013–2020 годы по направлению V.46, проект № V.46.2.4, этап 1 (Номер госрегистрации в системе ЕГИСУ НИОКТР AAAA-A17-117021450095-1).
Список литературы
Warren K.J., Scheffe J.R. // Mater. Today Energy. 2018. V. 9. P. 39.
Yagi F., Wakamatsu S., Kajiyama R., Suehiro Y., Shimura M. // Stud. Surf. Sci. Catal. 2004. V. 147. P. 127.
Vogel A.P., van Dyk B., Saib A.M. // Catal. Today. 2016. V. 259. P. 323.
Bakkerud P.K., Gol J.N., Aasberg-Petersen K., Dybkjaer I. // Stud. Surf. Sci. Catal. 2004. V. 147. P. 13.
Itkulova S.S., Nurmakanov Y.Y., Kussanova S.K., Boleubayev Y.A. // Catal. Today. 2018. V. 299. P. 272.
Amariglio H., Saint-Justb J., Amariglio A. // Fuel Proces. Technol. 1995. V. 42. P. 291.
Amariglio H., Pareja P., Amariglio A. // Catal. Today. 1995. V. 25. P. 113.
Koerts T., Van Santen R. // J. Mol. Catal. 1991. V. 70. P. 119.
Koerts T., Van Santen R. // J. Mol. Catal. 1992. V. 74. P. 185.
Koerts T., Deelen M., van Santen R. // J. Catal. 1992. V. 138. P. 101.
Wang L., Tao L., Xie M., Xu G. // Catal. Lett. 1996. V. 21. P. 35.
Tan P. // J. Catal. 2016. V. 338. P. 21.
Xie M., Yang X., Chen W., Tao L., Wang X., Xu G., Wang L., Xu Y., Liu S., Guo X. // Progress in Zeolite and Micropor. Mater. Stud. in Surf. Sci. Catal. 1997. V. 105. P. 869.
Sobal’ık Z., Tvaružková Z., Wichterlová B., F’ıla V., Špatenka Š. // Appl. Catal. A: General. 2003. V. 253. P. 271.
Huang L.-Q., Yuan Y.-Z., Zhang H.-B., Xiong Z.-T., Zeng J.-L., Lin G.-D. // Stud. Surf. Sci. Catal. 2004. V. 147. P. 565.
Yao B., Chen J., Liu D., Fang D. // J. Natur. Gas Chem. 2008. V. 17. P. 64.
Tempelman C.H.L., Zhu X., Hensen E.J.M. // Chin. J. Catal. 2015. V. 36. P. 829.
Tan P. // Catal. Commun. 2018. V. 103. P. 101.
Vinichenko N.V., Golinsky D.V., Pashkov V.V., Zatolokina E.V., Dvoyan A.V., Gulyaeva T.I., Trenikhin M.V., Krol O.V., Belyi A.S. // Proced. Eng. 2016. V. 152. P. 101.
Виниченко Н.В., Голинский Д.В., Затолокина Е.В., Паукштис Е.А., Гуляева Т.И., Павлюченко П.Е., Кроль О.В., Белый А.С. // Кинетика и катализ. 2018. Т. 59. № 3. С. 386.
Виниченко Н.В., Голинский Д.В., Затолокина Е.В., Паукштис Е.А., Удрас И.Е., Белый А.С. // НефтеГазоХимия. 2017. № 4. С. 41.
Голинский Д.В., Виниченко Н.В., Затолокина Е.В., Пашков В.В., Паукштис Е.А., Гуляева Т.И., Павлюченко П.Е., Кроль О.В., Белый А.С. // Рос. хим. журн. 2018. Т. LXII. № 1–2. С. 55.
Li G., Li W., Zhang M., Tao K. // Catal. Today. 2004. V. 93–95. P. 595.
Angel J.D., Aguilera A.F., Galindo I.R., Martínez M., Viveros T. // Mater. Sci. Applications. 2012. V. 3. P. 650.
Wilson G.R., Hall W.K. // J. Catal. 1970. V. 17. P. 190.
Freel J. // J. Catal. 1972. V. 25. P. 149.
Wang H., Yao Z., Zhan X., Wu Y., Li M. // Fuel. 2015. V. 158. P. 918.
Faro A.C. Jr., Souza K.R., Camorim V.L.D.L., Cardoso M.B. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 1932.
Глазнева Т.С., Коцаренко Н.С., Паукштис Е.А. // Кинетика и катализ. 2008. Т. 49. № 6. P. 906.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука. Сиб. отд., 1992. С. 255.
Романова Р.Г., Петрова Е.В. // Кинетика и катализ. 2006. Т. 47. № 1. P. 141.
Харланов А.Н., Лунина Е.В., Лунин В.В. // Журн. физ. химии. 1997. Т. 71. № 9. С. 1672.
Damyanova S., Grange P., Delmon B. // J. Catal. 1997. V. 168. P. 421.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ