Кинетика и катализ, 2019, T. 60, № 2, стр. 235-244
Влияние состава синтез-газа на совмещенный процесс синтеза и гидрооблагораживания углеводородов из СО и Н2
Р. Е. Яковенко 1, *, Г. Б. Нарочный 1, И. Н. Зубков 1, Е. В. Непомнящих 1, А. П. Савостьянов 1
1 ФГБОУ ВО Южно-Российский государственный политехнический университет (НПИ) имени М.И. Платова
346428 Новочеркасск, ул. Просвещения, 132, Россия
* E-mail: jakovenko@lenta.ru
Поступила в редакцию 06.09.2018
После доработки 12.11.2018
Принята к публикации 27.11.2018
Аннотация
Представлены результаты исследований влияния состава синтез-газа (СО + Н2) на процесс совмещенного синтеза и гидрооблагораживания углеводородов, протекающего на композитном катализаторе Со–SiO2/ZSM-5/Al2O3 при давлении 2.0 МПа и температуре 240°С. Сырьем служил концентрированный и разбавленный азотом синтез-газ с соотношением Н2/СО в исходном газе от 1 до 3. Показано, что с ростом отношения Н2/СО в перерабатываемом газе от 1 до 3 степень превращения СО увеличивалась от 28.0 до 87.0%, селективность по углеводородам С5+ снижалась с 74.0 до 48.0%, а доля непредельных углеводородов уменьшалась в 12 раз. Разбавление синтез-газа азотом также способствовало росту степени превращения СО от 75.8 до 84.0% и небольшому (~3%) повышению селективности по углеводородам С5+ при условии одинакового соотношения Н2/СО = 2 в разбавленном и концентрированном синтез-газе. Количество разветвленных алкенов в бензиновой фракции увеличивалось с 14.0 до 32.5%, тогда как в дизельной фракции оно оставалось практически неизменным. Максимальная производительность катализатора (108 кг м–3 ч–1) достигнута при использовании синтез-газа с соотношением Н2/СО = 2.
ВВЕДЕНИЕ
В настоящее время остается актуальной задача создания рентабельных технологий получения моторных топлив из природных и попутных нефтяных газов, которым дали название “Gas to Liquids” (GTL) [1]. Важным этапом в преобразовании природного газа в жидкое топливо является стадия производства синтез-газа. В промышленных условиях реализованы следующие технологии его получения: паровой риформинг (SMR) [2], автотермичный риформинг (ATR) [3], углекислотный риформинг (DMR) [4], парциальное окисление (POX) кислородом [5] или воздухом [6]. Эти технологии позволяют производить синтез-газ с соотношением Н2/СО от 1 до 3. При использовании парциального окисления метана воздухом получают синтез-газ, забалластированный азотом на 40–60%.
Синтез-газ может быть конвертирован в моторные топлива по технологии Methanol to “Gasoline Technology” (MTG), которая предусматривает синтез метанола, превращение его в диметиловый эфир и синтез углеводородов из диметилового эфира. При этом технологически она может быть оформлена в три (Mobil Process) [7], две (TIGAS Process) [8] или одну [9] стадии. По MTG-технологии получают, в основном, углеводороды бензиновой фракции, состоящие преимущественно из ароматических, разветвленных парафиновых и циклопарафиновых углеводородов [10].
По технологии GTL можно производить более широкий спектр продуктов: бензиновое и дизельное топливо, парафины, церезины, компоненты моторных масел [11]. Крупные заводы (“Shell”, “Sasol”), где реализована технология GTL в промышленных масштабах [12], работают по трехстадийной схеме получения углеводородов: автотермичный риформинг (ATR), синтез длинноцепочечных углеводородов по методу Фишера–Тропша (ФТ), гидрокрекинг продуктов синтеза ФТ.
В настоящее время множество исследований [13, 14] направлено на разработку каталитических систем, которые позволят объединить последние две стадии в одном реакторе, снизив при этом капитальные и эксплуатационные затраты. Такие системы включают в себя катализаторы синтеза ФТ и гидрооблагораживания углеводородов (цеолиты ZSM-5, MOR, HY, Betta и др.) и называются в литературе бифункциональными, гибридными или композитными [15–20]. Использование вышеуказанных каталитических систем в модульных установках GTL даст возможность перерабатывать природные и попутные нефтяные газы на удаленных месторождениях.
Ранее было установлено, что для синтеза ФТ на классических кобальтовых катализаторах (Co/SiO2, Co/Al2O3, Co/TiO2) оптимальное соотношение Н2/СО в синтез-газе должно быть близко к двум [21–23]. Однако при применении гибридных каталитических систем, на которых помимо синтеза углеводородов могут протекать процессы гидрокрекинга, изомеризации, алкилирования, оптимальное соотношение может быть другим. Влияние состава синтез-газа, соотношения Н2/СО на таких каталитических системах мало изучено. Поэтому цель настоящей работы заключалась в установлении закономерностей протекания процессов совмещенного синтеза и гидропреобразования углеводородов в зависимости от состава синтез-газа на композитном катализаторе Со–SiO2/HZSM-5.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализатора
Композитный катализатор готовили смешением порошков (фракция <0.1 мм) кобальталюмосиликагелевого катализатора синтеза ФТ, цеолита НZSM-5 и связующего – гидроксида алюминия. Были использованы следующие компоненты: 1) катализатор ФТ для селективного синтеза длинноцепочечных углеводородов Co–Al2O3/SiO2, содержащий (мас. %) 20 Co и 1 Al2O3. Методика и технология его синтеза отработаны в промышленных условиях на ЗАО “Самарский завод катализаторов” [24, 25]; 2) цеолит НZSM-5 (Si/Al = 40) (ООО “Ишимбайский специализированный химический завод катализаторов”); 3) бемит AlOOH ⋅ H2O (TH 80), (“Sasol”).
Для пластификации в смесь порошков добавляли водно-спиртовой раствор триэтиленгликоля с азотной кислотой (0.1 моль/моль Al2O3). Цилиндрические гранулы композитного катализатора диаметром 2 и длиной 3 мм формовали методом экструзии, сушили 24 ч на воздухе при температурах 20–25°С и подвергали термообработке в режиме: 80°С – 4 ч; 100, 120, 140°С – 1 ч и 400°С – 4 ч. Полученный композитный катализатор содержал (мас. %) 35 Со/SiO2, 30 НZSM-5 и 35 Al2O3.
Методики каталитических и физико-химических исследований свойств катализатора
Синтез углеводородов осуществляли по методу ФТ в проточном изотермическом реакторе (Dвн = 17 мм) со стационарным слоем катализатора (10 см3), разбавленного кварцевой крошкой (30 см3). Перед началом каталитических испытаний образец восстанавливали в токе водорода в течение 1 ч при температуре 400°С и объемной скорости газа (ОСГ) 3000 ч–1, при этом степень восстановления кобальта, определенная волюмометрически по методике [26] составила ~50%. Затем устанавливали требуемые технологические параметры (Р = 2.0 МПа, ОСГ = 1000 ч–1, Н2/СО = 1–3) и ступенчато (2.5°С/ч) поднимали температуру от 180 до 240°С. По ее достижении из сборников извлекали продукты синтеза, после чего проводили сравнительные балансовые опыты в течение 100 ч при заданном составе синтез-газа. Исследования по влиянию состава разбавленного азотом синтез-газа проводили, используя газовую смесь состава (об. %): СО – 20, Н2 – 40, N2 – 40.
Газообразные продукты синтеза анализировали на хроматографе Кристалл 5000 (“Хроматэк”, Россия), оснащенном детектором по теплопроводности и двумя колонками Haysep R и NaX (молекулярные сита). Первая колонка служила для определения состава углеводородов С1–С5 и СО2 (газ-носитель – гелий, расход – 15 мл/мин), вторая – для анализа СО, Н2 и N2 (газ-носитель – аргон, расход – 15 мл/мин). Режим анализа – температурно-программируемый со скоростью нагрева 8°C/мин.
Полученные жидкие углеводороды С5+ фракционировали, выделяя фракции углеводородов в зависимости от температуры кипения (н.к.–180, 180–330, >330°C). Индивидуальный и групповой состав фракций устанавливали методом капиллярной газожидкостной хромато-масс-спектрометрии на газовом хроматографе GC 7890 (“Agilent”, США) с масс-селективным детектором MSD 5975С и капиллярной колонкой HP-5MS.
Содержание кобальта в катализаторе находили методом рентгенофлуоресцентого анализа (РФлА) на спектрометре ARLQUANT’X (“Thermo Scientific”, Швейцария) при следующих условиях: среда – воздух, тефлоновая подложка, эффективная площадь облучения 48.99 мм2.
Рентгенофазовый анализ (РФА) катализаторов производили на дифрактометре ARLX’TRA Powder Diffrac-tometer (“Thermo Scientific”, Швейцария) с монохроматизированным CuKα-излучением методом сканирования по точкам (шаг 0.01°, время накопления в точке 2 с) в интервале 2θ от 5° до 90°. Определение качественного фазового состава было выполнено с помощью PDF-2 в программном комплексе Crystallographica [27]. Морфологию поверхности катализатора изучали методом сканирующей электронной микроскопии (СЭМ) на приборе JSM-6490LV (“JEOL”, Япония) с ускоряющим напряжением 30 кВ, оснащенном системой энергодисперсионного анализа INCA Penta Fet3 (“OXFORD Instrument”, Великобритания) для нахождения элементного состава поверхности образцов.
Исследование катализатора методом просвечивающей электронной микроскопии (ПЭМ) осуществляли на микроскопе Tecnai G2 Spirit BioTWIN (“FEI”, США) с ускоряющим напряжением 120 кВ. Образцы предварительно восстанавливали азото-водородной смесью (5 об. % Н2) при линейном нагреве от комнатной температуры до 500°С в течение часа.
Определение удельной поверхности (Sуд) катализатора по методу БЭT и температурно-программированную десорбцию водорода (ТПД-Н2) проводили на приборе ChemiSorb 2750 (“Micromeritics”, США). Предварительно образцы дегазировали в токе гелия при 200°С для удаления влаги и других адсорбированных газов в течении 1 ч. ТПД-Н2 осуществляли в интервале температур 25–500°С в токе гелия после насыщения восстановленного образца водородом и удаления физически адсорбированного газа. Степень восстановления кобальта находили по результатам импульсного окисления кислородом восстановленного образца.
Квантово-химические расчеты были сделаны при использовании программного комплекса Gaussian’09 [28] в приближении теории DFT B3LYP/6-311++G(2d,2p) [29]. Характер стационарной точки поверхности потенциальной энергии (локальный минимум) был подтвержден вычислением матрицы Гессиана на том же уровне теории в гармоническом приближении. Все оптимизированные структуры имели только реальные частоты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика катализатора
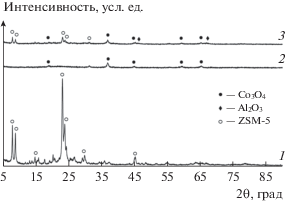
Образцы катализаторов были охарактеризованы методами РФА, СЭМ, ПЭМ, ТПД-H2. Рентгенографические исследования (рис. 1) показали, что для исходного цеолита наблюдаются рефлексы в области углов 2θ ≈ 7°–30°. Интенсивные максимумы на рентгенограмме, характерные для структурного типа цеолита ZSM-5 [30], зафиксированы при углах 2θ: 7.92°; 7.94°; 13.95°; 14.77°; 23.08°; 23.25°; 23.40°; 29.83°; 45.2°. Исследуемый образец цеолита обладает высокой фазовой чистотой и степенью окристаллизованности. В образцах катализатора Со–Al2O3/SiO2 и композитного катализатора на его основе присутствует фаза оксида кобальта Co3O4, о чем свидетельствуют рефлексы в диапазоне углов 2θ ≈ 18°–65°. Кристаллическая фазы Co3O4 имеет кубическую структуру шпинели типа MgAl2O4 (пространственная группа Fd3m) с кристаллохимической формулой Co2+${\text{Co}}_{2}^{{3 + }}$O4, где Со2+ находится в тетраэдрической позиции 8a, а Со3+ – в октаэдрической позиции 16d [31, 32]. Отсутствие следов аморфного фона и уширения линий говорит о том, что условия термообработки не повлияли на кристаллическую структуру цеолитного каркаса. В структуре композитного катализатора установлена фаза оксида алюминия, которая образуется за счет термического разложения бемита на стадии его термообработки. Согласно базе данных ICSD (Inorganic crystal structure database) идентифицированный оксид алюминия представляет собой нестехиометрический оксид с формулой Al2.666O3.999, имеющий кубическую структуру шпинели дефектного типа (пространственная группа Fm3m).
С помощью уравнения Шеррера [33] для характеристической линии со значением 2θ, равным 16.8°, был рассчитан средний размер кристаллитов Co3O4 (табл. 1). Размер кристаллитов кобальта Co0 определен по данным РФА по формуле d(Co0) = 0.75 × d(Co3O4) [34], а также по результатам ТПД-Н2 и ПЭМ. Полученные значения соответствуют оптимальным размерам частиц 6–8 нм для наиболее активных кобальтовых катализаторов [35, 36].
Из данных о средних размерах частиц кобальта d(Co0)*** (табл. 1), была рассчитана общая дисперсность активного компонента композитного катализатора (Dобщ), которая оказалась равной 11.7%.
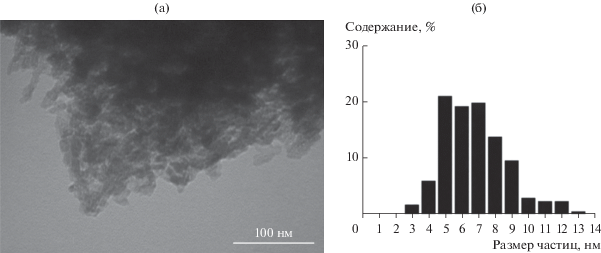
Анализ диаграммы распределения кристаллитов кобальта по размерам, полученной с помощью ПЭМ (рис. 2), дает средневзвешенный размер частиц кобальта ~8.2 нм, что практически совпадает с найденным ранее в [24] значением (8 нм) для катализатора Co–Al2O3/SiO2 с содержанием кобальта 20%. Таким образом, присутствие цеолита и бемита в составе композитного катализатора не оказывает влияния на размер кристаллитов кобальта.
Рис. 2.
Микрофотографии ПЭМ восстановленного композитного катализатора (а) и гистограмма распределения частиц кобальта по размеру (б).
СЭМ-изображения композитного катализатора, приведенные на рис. 3, дают сведения о локализации элементов на его поверхности. Распределение кобальта по поверхности носит фрагментарный характер. Его содержание в композитном катализаторе по данным энергодисперсионной рентгеновской спектроскопии примерно соответствует количеству катализатора Co–Al2O3/SiO2 синтеза ФТ, введенного в состав композитного катализатора. Элементы кремний, алюминий и кислород распределены по поверхности катализатора более равномерно.
Результаты каталитических испытаний
Результаты исследований влияния соотношения Н2/СО на синтез углеводородов представлены в табл. 2.
Таблица 2.
Каталитические свойства бифункционального катализатора в зависимости от состава синтез-газа и соотношения Н2/СО*
| H2/CO | Конверсия СО, % | Селективность, % | Производительность по С5+, кг/(м3 ч) | |||
|---|---|---|---|---|---|---|
| СН4 | С2–С4 | С5+ | СО2 | |||
| 1 | 28.4 | 12.4 | 12.0 | 74.2 | 1.4 | 68 |
| 2 | 75.8 | 18.5 | 11.8 | 67.3 | 2.4 | 108 |
| 2** | 84.0 | 17.3 | 9.4 | 69.1 | 4.1 | 81 |
| 3 | 87.0 | 31.7 | 20.1 | 47.7 | 0.5 | 67 |
С увеличением отношения Н2/СО от 1 до 3 наблюдается рост степени превращения СО с 28 до 87%, при этом селективность по углеводородам С5+ снижается с 74 до 48%. Селективность образования метана увеличивается в 2.6 раза, тогда как селективность по углеводородам С2–С4 – в 1.7 раза. Производительность катализатора максимальна при соотношении Н2/СО = 2 и составляет 108 кг м–3 ч–1. При соотношениях Н2/СО, равных 1 и 3, производительность практически одинаковая и находится в диапазоне значений 67–68 кг м–3 ч–1. Разбавление синтез-газа азотом способствует увеличению степени превращения СО до 87% и приводит к некоторому росту селективности по углеводородам С5+.
Состав синтез-газа и соотношение Н2/СО существенно влияют на фракционный и групповой состав продуктов синтеза (табл. 3, рис. 4).
Таблица 3.
Фракционный и групповой состав продуктов синтеза
| Н2/СО | Группа углеводородов | Фракционный состав углеводородов, мас. % | ∑ | н/изо** | о/п*** | |||
|---|---|---|---|---|---|---|---|---|
| C5–C10 | C11–С18 | С19+ | ||||||
| 1 | н-Алканы | 9.4 | 19.2 | 11.2 | 39.8 | 46.5 | 1.56 | 1.15 |
| изо-Алканы | 1.3 | 4.2 | 1.2 | 6.7 | ||||
| Неразв. алкены | 18.3 | 2.9 | 0 | 21.2 | 53.5 | |||
| Разв. алкены | 20.7 | 11.6 | 0 | 32.3 | ||||
| Итого | 49.7 | 37.9 | 12.4 | 100 | ||||
| 2 | н-Алканы | 12.5 | 18.4 | 5.2 | 36.1 | 58.1 | 1.31 | 0.72 |
| изо-Алканы | 9.5 | 10.8 | 1.7 | 22.0 | ||||
| Неразв. алкены | 18.3 | 2.3 | 0 | 20.6 | 41.9 | |||
| Разв. алкены | 14.0 | 7.3 | 0 | 21.3 | ||||
| Итого | 54.3 | 38.8 | 6.9 | 100 | ||||
| 2* | н-Алканы | 7.2 | 14.7 | 11.0 | 32.9 | 50.7 | 0.8 | 0.97 |
| изо-Алканы | 6.0 | 10.5 | 1.3 | 17.8 | ||||
| Неразв. алкены | 10.1 | 1.3 | 0 | 11.4 | 49.3 | |||
| Разв. алкены | 32.5 | 5.3 | 0.1 | 37.9 | ||||
| Итого | 55.8 | 31.8 | 12.4 | 100 | ||||
| 3 | н-Алканы | 27.4 | 16.9 | 5.7 | 50.0 | 95.5 | 1.08 | 0.05 |
| изо-Алканы | 27.3 | 15.8 | 2.4 | 45.5 | ||||
| Неразв. алкены | 1.9 | 0.1 | 0 | 2.0 | 4.5 | |||
| Разв. алкены | 2.4 | 0.1 | 0 | 2.5 | ||||
| Итого | 59.0 | 32.9 | 8.1 | 100 | ||||
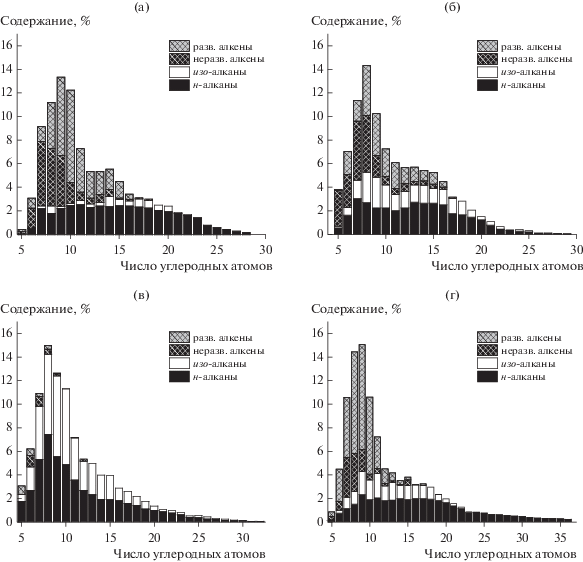
Рис. 4.
Молекулярно-массовое распределение продуктов синтеза на композитном катализаторе: а – Н2/СО = 1; б – Н2/СО = 2; в – Н2/СО = 3; г – разбавленный азотом синтез-газ (состав, об. %: СО – 20; Н2 – 40; N2 – 40).
С повышением соотношения Н2/СО от 1 до 3 доля бензиновой фракции возрастает с 49.7 до 59%. Содержание дизельной фракции максимально для соотношения Н2/СО = 2 (38.8%) и с увеличением Н2/СО до значения 3 сокращается до 32.9%. Минимальное содержание высокомолекулярных углеводородов С19+ наблюдается при Н2/СО =2 и равно 6.9%. С понижением концентрации водорода в синтез-газе доля углеводородов С19+ в продуктах синтеза растет до 12.4%.
Разбавление синтез-газа азотом уменьшает долю дизельной фракции углеводородов в продуктах синтеза до 31.8%. При этом увеличивается (до 12.4%) количество высокомолекулярных углеводородов С19+, тогда как содержание бензиновой фракции практически не изменяется и составляет 55.8%. Такая закономерность характерна и для монофункционального катализатора Со/SiO2, для которого также наблюдается рост селективности образования длинноцепочечных углеводородов С19+ при использовании забалластированного синтез-газа [37].
Более существенно изменение состава и соотношения Н2/СО в синтез-газе сказывается на групповом составе углеводородов. При повышении соотношения Н2/СО от 1 до 3 доля непредельных углеводородов в продукте снижается в 12 раз. Т.е. непредельные углеводороды, которые образуются как в результате синтеза ФТ, так и в результате вторичных превращений углеводородов на кислотных центрах цеолита, практически полностью гидрируются при избыточном содержании Н2 в реакционной смеси. Суммарная концентрация всех разветвленных углеводородов в синтетической нефти с ростом содержания водорода в синтез-газе увеличивается, о чем свидетельствует уменьшение показателя н/изо с 1.56 до 1.08.
Разбавление синтез-газа азотом повышает долю разветвленных алкенов в бензиновой фракции с 14 до 32.5%, тогда как в дизельной фракции их содержание практически не изменяется. Так, для синтетической нефти, полученной из забалластированного азотом газа, показатель н/изо сокращается в 1.6 раза, а показатель о/п (олефины/парафины) возрастает в 1.4 раза в сравнении с концентрированным синтез-газом.
При всех составах синтез-газа производимая синтетическая нефть имеет близкое к мономодальному молекулярно-массовое распределение (рис. 4), при этом максимум кривой распределения приходится на углеводороды С7–С10. В продуктах синтеза присутствуют углеводороды вплоть до С28–С32, а при использовании забалластированного газа – до С35.
Проведенные исследования показали, что влияние соотношения Н2/СО и состава синтеза-газа на каталитические свойства композитного катализатора Со–SiO2/HZSM-5 в совмещенном процессе синтеза и гидропреобразования углеводородов в целом такое же, как и для монофункциональных катализаторов процесса ФТ, например Со/Al2O3, Со/SiO2 [21, 23]. Наибольшая производительность по углеводородам С5+ также достигается при соотношении Н2/СО, равном 2. Увеличение парциального давления водорода в синтез-газе приводит к значительному росту степени конверсии СО за счет повышения скорости гидрирования СО до метана и легких углеводородов С2–С4. При низком парциальном давлении водорода скорость образования метана и легких углеводородов замедляется, и, как следствие, возрастает селективность по углеводородам С5+.
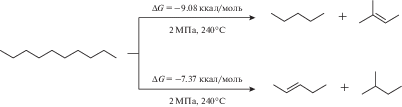
Влияние соотношения Н2/СО и состава синтез-газа на молекулярно-массовое распределение получаемых углеводородов С5+ на бифункциональном катализаторе Со–SiO2/HZSM-5 существенно отличается от закономерностей, установленных на монофункциональных катализаторах. В частности, понижение отношения Н2/СО до 1 способствует росту доли непредельных углеводородов разветвленного строения, которые, по-видимому, образуются в результате вторичных превращений продуктов синтеза ФТ на цеолите. Ранее [38] нами было показано, что в близких условиях синтеза (2.0 МПа, ОСГ = 1000 ч–1, Н2/СО = 1) на Со–Al2O3/SiO2 образуются преимущественно терминальные (α) алкены линейного строения, а изомерные алкены найдены в следовых количествах. В настоящей работе нами обнаружено, что в присутствии цеолитсодержащего композитного катализатора при отношении Н2/СО = 1 в бензиновой фракции углеводородов доля терминальных алкенов от общего содержания алкенов составляет всего 20%, тогда как 80% приходятся на интернальные алкены (β и др.). Кроме того, проведенные термодинамические расчеты (на примере углеводорода С10) свидетельствуют, что в условиях синтеза ФТ (240°С, 2.0 МПа) возможно получение разветвленных и линейных алкенов (рис. 5).
Рис. 5.
Свободная энергия Гиббса реакции расщепления н-декана по данным квантово-химического расчета (B3LYP/6-311++G(2d,2p)) при 240°С и 2 МПа в газовой фазе.
Увеличение доли углеводородов С19+ при низком содержании водорода в синтез-газе говорит о том, что скорость процесса гидрокрекинга во вторичных превращениях углеводородов на кислотных центрах катализатора падает. Более значительный вклад в образование непредельных углеводородов разветвленного строения при Н2/СО = 1 вносят процессы изомеризации.
При повышении парциального давления водорода в перерабатываемом газе (Н2/СО = 3) возрастает скорость гидрирования непредельных углеводородов как нормального, так и изостроения. В дизельной фракции непредельные углеводороды обнаружены в следовых количествах, а в бензиновой их содержание не превышают 5%. За счет гидрирования алкенов изомерного строения растет доля изо-алканов. Содержание углеводородов С19+ при изменении Н2/СО от 2 до 3 немного увеличивается (с 6.9 до 8.1%), то есть значительного повышения скорости процесса гидрокрекинга этих углеводородов также не наблюдается.
Использование забалластированного до 40% азотом синтез-газа снижает производительность процесса по углеводородам С5+ на 25% в сравнении с концентрированным газом. Селективность образования углеводородов С5+ и длинноцепочечных С19+ несколько возрастает. Это можно объяснить как повышением изотермичности работы каталитического слоя, так и ослаблением диффузионных ограничений при высоких значениях конверсии СО в случае забалластированного синтез-газа [39]. Увеличение содержания разветвленных алкенов в 2.3 раза в бензиновой фракции указывает на ускорение вторичных процессов преобразования углеводородов при использовании газа, обогащенного азотом. Это связано с падением производительности по первичным углеводородам С5+ и более глубокой их конверсией в изомерные ненасыщенные углеводородные структуры за счет снижения нагрузки на цеолитную составляющую композитного катализатора. Разбавление синтез-газа азотом уменьшает парциальное давление водорода и, как следствие, скорость гидрирования непредельных углеводородов.
Таким образом, изменяя соотношение Н2/СО в синтез-газе, можно управлять групповым и фракционным составом производимых синтетических углеводородов в широком диапазоне. При Н2/СО = 1 образуется значительное количество олефинов (до 80% в бензиновой фракции), являющихся ценным сырьем для нефтехимии. Для этого целесообразно использовать синтез-газ, получаемый при углекислотной конверсии природного газа, что позволит утилизировать СО2 и снизить парниковый эффект. Увеличивая Н2/СО до 3 (паровой риформинг) можно настраивать селективность процесса на синтез моторных топлив (бензиновую и дизельную фракции) с высокими эксплуатационными и экологическими характеристиками. Результативная работа композитного катализатора Со–SiO2/HZSM-5 в случае разбавленного азотом синтез-газа дает возможность использовать процесс парциального окисления метана воздухом для производства синтез-газа в технологии GTL, что будет способствовать развитию GTL-технологии в модульном исполнении при утилизации попутного нефтяного газа и получении синтетической нефти на удаленных месторождениях.
ЗАКЛЮЧЕНИЕ
Установлено, что в процессе совмещенного синтеза и гидропреобразования углеводородов на композитном катализаторе Со–SiO2/HZSM-5 с увеличением отношения Н2/СО в синтез-газе от 1 до 3, а также при разбавлении синтез-газа азотом растет степень превращения СО. Определено, что повышение концентрации водорода приводит к снижению селективности образования углеводородов С5+, уменьшению доли (~12 раз) непредельных углеводородов, в том числе разветвленных, в продуктах и возрастанию количества изомерных углеводородов парафинового ряда. Показано, что при одинаковом соотношении Н2/СО = 2 в разбавленном и концентрированном синтез-газе содержание разветвленных алкенов выше в забалластированном азотом газе, преимущественно в бензиновой фракции C5–C10. Найдено, что максимальная производительность композитного катализатора достигается при использовании концентрированного синтез-газа с отношением Н2/СО = 2.
Список литературы
Fazeli H., Panahi M., Rafiee A. // J. Natural Gas Sci. Eng. 2018. V. 52. P. 549.
Aasberg-Petersen K., Dybkjær I., Ovesen C.V., Schjødt N.C., Sehested J., Thomsen S.G. // J. Natural Gas Sci. Eng. 2011. V. 3. P. 423.
Holladay J.D., Hu J., King D.L., Wang Y. // Catal. Today. 2009. V. 139. P. 244.
Pakhare D., Spivey J. // Chem. Soc. Rev. 2014. V. 43. P. 7813.
Ashcroft A.T., Cheetham A.K., Green M.L.H., Vernon P.D.F. // Nature. 1991. V. 352. P. 225.
De Groote A.M., Froment G.F. // Appl. Catal. A: General. 1996. V. 1386. P. 245.
Keil F.J. // Micropor. Mesopor. Mater. V. 29. P. 49.
Tow-Jorgensen J. // Stud. Surf. Sci. Catal. 1988. V. 36. P. 293.
Mysov V.M., Reshetnikov S.I., Stepanov V.G., Ione K.G. // Chem. Eng. J. 2005. V. 107. P. 63.
Fu T., Chang J., Shao J., Li Z. // J. Energy Chem. 2017. V. 26. P. 139.
Khodakov A.Y., Chu W., Fongarland P. // Chem. Rev. 2007. V. 107. P. 1692.
Kok P.J., Overtoom R.M. // Proceedings of the 3rd Gas Processing Symposium. 2012. V. 3. P. 157.
Sineva L.V., Asalieva E.Yu., Mordkovich V.Z. // Russ. Chem. Rev. 2015. V. 84. P. 1176.
Flores C., Batalha N., Ordomsky V.V., Zholobenko V.L., Baaziz W., Marcilio N.R., Khodakov A.Y. // ChemCatChem. 2018. V. 10. P. 2291.
Yao M., Yao N., Liu B., Li S., Xu L., Li X. // Catal. Sci. Technol. 2015. V. 5. P. 2821.
Valero-Romeroa M.J., Sartipib S., Xiaohuib S., Rodríguez-Mirasola J., Corderoa T., Kapteijnb F., Gascon J. // Catal. Sci. Technol. 2016. V. 6. P. 2633.
Kang J., Wang X. // Ind. Eng. Chem. Res. 2016. V. 55. P. 13008.
Cheng K., Kang J., Huang S., You Z., Zhang Q., Ding J., Hua W., Lou Y., Deng W., Wang Y. // ACS Catal. 2012. V. 2. P. 441.
Lia Z., Wu L., Han D., Wu J. // Fuel. 2018. V. 220. P. 257.
Kruse N., Machoke A.G., Schwieger W., Gottel R. // ChemCatChem. 2015. V. 7. P. 1018.
Tristantini D., Lцgdberg S., Gevert B., Borg Ø., Holmen A. // Fuel Proc. Technol. 2007. V. 88. P. 643.
Lu Y., Lee T. // J. Natural Gas Chem. 2007. V. 16. P. 329.
Савостьянов А.П., Нарочный Г.Б., Яковенко Р.Е., Митченко С.А., Зубков И.Н. // Нефтехимия. 2018. Т. 58. № 1. С. 80.
Savost'yano, A.P., Yakovenko R.E., Sulima S.I., Bakun V.G., Narochnyi G.B., Chernyshev V.M., Mitchenko S.A. // Catal. Today. 2017. V. 279. P. 107.
Савостьянов А.П., Яковенко Р.Е., Нарочный Г.Б., Бакун В.Г., Сулима С.И., Якуба Э.С., Митченко С.А. Кинетика и катализ. 2017. Т. 58. № 1. С. 86.
Яковенко Р.Е. Дис. … канд. техн. наук. Новочеркасск: ЮРГПУ(НПИ) имени М.И. Платова, 2017.
PDF-2.The powder diffraction file TM. International Center for Diffraction Data (ICDD), PDF-2 Release 2012, web site: www.icdd.com. 2014.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A.Jr., Peralta J.E., Ogliaro F., Bearpark M.J., Heyd J.J., Brothers E.N., Kudin K.N., Staroverov V.N., Kobayashi R., Normand J., Raghavachari K., Rendell A.P., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D., Farkas Ö., Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J. // Gaussian 09. Gaussian Inc., Wallingford CT. 2009.
Becke A.D // J. Chem. Phys. 1993. V. 98. P. 5648.
Treacy M.M.J., Higgins J.B. // Elsevier. 2001. 586 p.
Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М.: Мир, 1979. 677 с.
Булавченко О.А., Черепанова С.В., Малахов В.В., Довлитова Л.C., Ищенко А.В., Цыбцля С.В. // Кинетика и катализ. 2009. Т. 50. С. 205.
Young R.A. The Rietveld Method. International Union of Crystallography. Oxford University Press, 1993. P. 298.
Xu D., Li W., Duan H., Ge Q., Xu H. // Catal. Lett. 2005. V. 102. P. 229.
Breejen J.P., Radstake P.B., Bezemer G.L., Bitter J.H., Frøseth V., Holmen A., Jong K.P. // J. Am. Chem. Soc. 2009. V. 131. P. 7197.
Diehl F., Khodakov A.Y. // Oil & Gas Sci.Technol. Rev. 2009. V. 64. P. 11.
Савостьянов А.П., Яковенко Р.Е., Нарочный Г.Б., Лапидус А.Л. // Химия твердого топлива. 2015. Т. 49. № 6. С. 19.
Савостьянов А.П., Нарочный Г.Б., Яковенко Р.Е., Митченко С.А., Зубков И.Н. // Нефтехимия. 2018. Т. 58. № 1. С. 80.
Muleja A.A., Yao Y., Glasser D., Hildebrandt D. // Chem. Eng. J. 2016. V. 293. P. 151.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ