Кинетика и катализ, 2019, T. 60, № 3, стр. 308-314
Влияние состава медьсодержащих солевых трегерных катализаторов на их активность в реакции Дикона. Зависимость скорости реакции Дикона от соотношения хлоридов меди и калия в солевом трегерном катализаторе СuCl2–KCl
А. Г. Аглулин *
Государственный научный центр РФ АО “НИФХИ им. Л.Я. Карпова”,
105064 Москва, пер. Обуха, 3-1/12, стр. 6, Россия
* E-mail: avetisov@nifhi.ru
Поступила в редакцию 04.04.2018
После доработки 13.12.2018
Принята к публикации 21.12.2018
Аннотация
Безградиентным методом в интервале температур 350–425°С изучено влияние мольного соотношения КСl/CuCl2 от 0 до 2.5 в катализаторе СuCl2–KCl (носитель) на активность реакции Дикона. Установлена существенная роль процессов гидратации компонентов солевых катализаторов в гомогенизации реакционного слоя. Эксперименты не противоречат ранее предложенной кинетике и механизму реакции. На основе поляризационных представлений, использованных ранее в механизме реакции, дано возможное объяснение результатов экспериментов.
Реакция окисления хлористого водорода в молекулярный хлор (реакции Дикона)
(I)
${\text{4HCl}} + {{{\text{O}}}_{{\text{2}}}} = {\text{2C}}{{{\text{l}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}$(II)
${\text{С }}{{{\text{Н }}}_{{\text{4}}}} + n{\text{HCl}} + {n \mathord{\left/ {\vphantom {n {2{{{\text{O}}}_{2}}}}} \right. \kern-0em} {2{{{\text{O}}}_{2}}}}{\text{ = C}}{{{\text{H}}}_{{{\text{4 --}}n}}}{\text{C}}{{{\text{l}}}_{n}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Появление альтернативных катализаторов (например, [10, 11], рассмотренных в [9]) не снизило интереса к традиционным медьсодержащим солевым катализаторам из-за отсутствия реальных достижений в этих двух реакциях.
В ранее проведенных исследованиях влияние состава медьсодержащих катализаторов на их активность в реакции Дикона было изучено мало. Имеющаяся информация ограничена и противоречива даже для трегерного бинарного катализатора CuCl2–KCl. Так, согласно пионерскому исследованию [4], константа скорости реакции (I) является экстремальной функцией мольного отношения хлоридов калия и меди с максимумом, близким к 0.1. По нашим же предварительным оценкам [12], максимум активности реакции соответствует составу с отношением этих компонентов, близким к 0.5. Однако в работе [13] максимум активности, по мнению авторов, принадлежит эквимольным количествам хлоридов калия и меди в катализаторе (КСl/CuCl2 = 1). Такой же результат был получен в работе [7], но в условиях проведения реакции (II).
Настоящее расширенное исследование должно было внести определенность в этом спорном вопросе. Также представляло интерес сопоставить его результаты с новыми представлениями о механизме реакции Дикона [9].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование влияния мольного соотношения хлоридов КCl/CuCl2 в диапазоне от 0 до 2.5 в катализаторе на скорость окисления НCl проводили безградиентным проточно-циркуляционным методом [14, 15] при атмосферном давлении в интервале температур 350–425°С. Приготовление трегерных катализаторов и их анализ на содержание меди аналогичны описанным ранее [9]. В качестве носителей использовали, как и в работе [9], диатомит ДН-2 (Sуд ≈ 1–1.5 м2/г) и силикагель КСК (Sуд ≈ 340 м2/г) оба с размером зерен 0.25–0.5 мм. Как было показано [4], использование такого размера частиц в условиях реакции Дикона исключает влияние внутренней диффузии в грануле катализатора при температурах 350–425°С.
В готовом катализаторе с содержанием каталитических солей ~25 мас. % (6.7 мас. % Cu) поверхность диатомита практически полностью покрыта солевым расплавом. В силикагелевом катализаторе того же состава площади поверхности солевого расплава и поверхности, свободной от расплава, составляют 180 и 170 м2/г соответственно [16–18]. Как было показано в работе [19] и установлено нами, силикагель инертен в реакции окисления НСl.
В настоящее время не вызывает сомнения тот факт, что окисление НСl может протекать в объеме медьсодержащего солевого расплава, диспергированного на носителе. Однако экспериментальная оценка удельных скоростей реакции (I) при разных соотношениях компонентов в катализаторе представляется невыполнимой из-за возможности неполного, частичного плавления хлорида меди [20]. Судя по фазовым диаграммам [21, 22], неизбежна фазовая неоднородность медьсодержащей солевой системы, а также изменение состава ее активной части в расплаве. При определенных соотношениях солевых компонентов обнаружено их выпадение из расплава в виде твердых фаз. Например, при К/Сu = 0.1 таким компонентом должен быть хлорид меди. В случае К/Сu = 0, т.е. на твердом хлориде меди (Тпл = = 596°С) без модификаторов, реакционная зона, скорее всего, должна быть ограничена его поверхностью. Поэтому с учетом данных фазового термического анализа принято считать медьсодержащие солевые катализаторы реакции Дикона в ряде случаев только частичными расплавами [20].
Опыты при различных соотношениях солевых компонентов в катализаторах проводили с учетом возможных их особенностей. Для получения истинных удельных скоростей реакции требовалось определить условия, гарантирующие участие в реакции всего объема солевого катализатора и всех его активных центров. Для этого была использована апробированная ранее [9] методика сопоставления скоростей реакции на катализаторах с разной толщиной солевой пленки на носителе. Последнее достигалось либо изменением общего количества солей одного и того же состава на носителе, либо существенным изменением величины удельной поверхности носителя в катализаторе. Замена диатомита ДН-2 на силикагель КСК-2 более чем на порядок уменьшает среднюю толщину солевой пленки в катализаторе при таком же содержании солей [16, 17]. В соответствии с этой методикой оказалось возможным наблюдать [9] постоянство константы скорости реакции при существенно разной толщине солевой пленки с эквимольным соотношением хлоридов меди и калия. Такой экспериментальный факт явился основанием для вывода об участии в реакции всего объема солевого расплава и доступности его активных центров в этом катализаторе для реактантов.
Опыты, как и в работе [9], проводили вдали от равновесия в условиях нулевого порядка по хлористому водороду. Последнее обстоятельство облегчало выявление кинетических закономерностей реакции на разных катализаторах и в этих условиях практически исключало возможные изменения их фазового и химического составов под воздействием реакционной среды. В исходную смесь продукты реакции – хлор и водяной пар – не добавляли. Поэтому, в согласии со стехиометрией уравнения реакции (I), их концентрации во всех опытах были одинаковыми.
Чтобы избежать искажения соотношения хлоридов в катализаторах и наблюдаемых скоростей реакции из-за летучести хлоридов меди при температурах 400 и 425°С, опыты, как и в работе [9], проводили в течение ограниченного времени.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
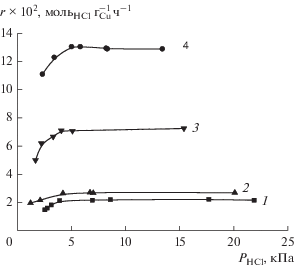
Изучение влияния величины парциального давления хлористого водорода в реакционной смеси (РHCl) на скорость его окисления (rHCl) при достаточно постоянных уровнях ${{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ и ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ показало, что характер зависимости rHCl от величины PHCl (включая аналогичные опыты при эквимольном соотношении хлоридов меди и калия [9]) не зависит от соотношения компонентов в катализаторе. Во всех случаях значение $Р _{{{\text{HCl}}}}^{{{\text{min}}}},$ ниже которого скорость окисления HCl начинает снижаться, остается примерно на одном уровне ~4 кПа (рис. 1). Можно не без основания полагать, что в условиях нулевого порядка реакции по хлористому водороду (независимо от соотношения К/Cu) термическое разложение хлорида меди в катализаторах сопровождается быстрой его регенерацией за счет стадий взаимодействия хлористой меди и оксихлорида меди с кислородом и с HСl. Поэтому следует ожидать только минимальные концентрации промежуточных форм соединений меди в составе катализаторов в этих условиях. При РHCl < $Р _{{{\text{HCl}}}}^{{{\text{min}}}},$ как было показано [9], из-за дисбаланса в скоростях основных стадий изменяются стационарный состав катализатора с образованием кислородсодержащих соединений меди и сама кинетика реакции.
Рис. 1.
Зависимости скоростей окисления НСl (r) от PHCl на медькалиевых трегерных катализаторах при температуре 375°С в реакциях Дикона (1–3) и оксихлорирования метана (4) при различных мольных отношениях солевых компонентов: 1 – К/Сu = 1.5 (${{Р }_{{{{{\text{О }}}_{{\text{2}}}}}}}$ = 12 кПа, ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ = 1.3 кПа), 2 – К/Сu = 0.1 (${{Р }_{{{{{\text{О }}}_{{\text{2}}}}}}}$ = = 10 кПа, ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ = 3 кПа), 3 – К/Сu = 0.5 (${{Р }_{{{{{\text{О }}}_{{\text{2}}}}}}}$ = 12 кПа, ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ = 4 кПа), 4 – К/Сu = 1.0 (${{Р }_{{{{{\text{О }}}_{{\text{2}}}}}}}$ = 11 кПа, ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ = = 0.7 кПа, ${{Р }_{{{\text{С }}{{{\text{Н }}}_{{\text{4}}}}}}}$ = 48 кПа). Во всех случаях величина ${{Р }_{{{\text{С }}{{{\text{l}}}_{{\text{2}}}}}}}$ характеризует область нулевого порядка реакции по хлористому водороду.
Учитывая наблюдающееся химическое сходство рассматриваемых катализаторов, предположим, что (как и при эквимольном соотношении хлоридов калия и меди [9]) кинетический порядок реакции по хлору в условиях нулевого порядка по хлористому водороду равен –0.65. Правдоподобность принятого показателя торможения реакции хлором подтверждается величиной кинетического порядка по кислороду, близкому (как и в [9]) к ~0.75 (рис. 2) независимо от состава катализатора. Соответствующее уравнение
(1)
$r = {{{{k}_{{\text{1}}}}P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{0.{\text{75}}}}} \mathord{\left/ {\vphantom {{{{k}_{{\text{1}}}}P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{0.{\text{75}}}}} {P_{{{\text{C}}{{{\text{l}}}_{{\text{2}}}}}}^{{0.{\text{65}}}}}}} \right. \kern-0em} {P_{{{\text{C}}{{{\text{l}}}_{{\text{2}}}}}}^{{0.{\text{65}}}}}}$Рис. 2.
Кинетические порядки по кислороду в реакции Дикона на медькалиевом солевом катализаторе при различных мольных отношениях компонентов: КCl/CuCl2 = 0.1 (1 – 375°С, 4 – 400°С), КCl/CuCl2 = = 0.25 (5 – 400°С), КCl/CuCl2 = 0.5 (3 – 375°С), КCl/CuCl2 = 1.5 (2 – 400°С).
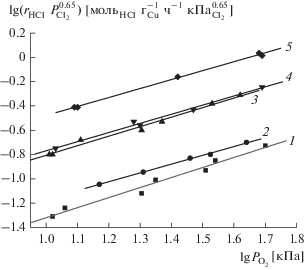
Таблица 1.
Скорости (r) и константы уравнения (1) для скорости окисления НСl (k1) на медькалиевом нанесенном катализаторе при различных температурах и мольных отношениях КСl/CuCl2
| № опыта | Носитель | Сu, мас. % | T, °С | Рi, кПа | rHCl× 104, мольHCl${\text{г }}_{{{\text{С u}}}}^{{ - {\text{1}}}}$ ч–1 | k1 × 104, мольHCl${\text{г }}_{{{\text{С u}}}}^{{ - {\text{1}}}}$ ч–1 кПа–0.1 | ||
|---|---|---|---|---|---|---|---|---|
| О2 | HCl | Cl2 | ||||||
| Мольное отношение КСl/CuCl2 = 0.1 | ||||||||
| 1 | КСК-2 | 11.2 | 350 | 20.3 | 17.8 | 1.42 | 214 | 28.1 |
| 2 | ДН-2 | 1.35 | 375 | 11.0 | 11.5 | 1.85 | 392 | 96.8 |
| 3 | 3.57 | 11.5 | 10.2 | 1.45 | 455 | 92.5 | ||
| 4 | 6.7 | 9.8 | 9.7 | 1.53 | 437 | 104 | ||
| 5 | 8.9 | 10.0 | 12.6 | 1.40 | 408 | 90.3 | ||
| 6 | КСК-2 | 9.6 | 375 | 10.3 | 10.3 | 1.46 | 416 | 92.5 |
| 7 | 10.9 | 32.4 | 17.6 | 3.53 | 522 | 87.3 | ||
| 8 | ДН-2 | 9.3 | 400 | 48.9 | 11.55 | 5.65 | 1790 | 298 |
| Мольное отношение КСl/CuCl2 = 0.25 | ||||||||
| 9 | ДН-2 | 8.9 | 350 | 12.7 | 8.7 | 1.44 | 282 | 54.5 |
| 10 | 8.9 | 375 | 12.1 | 11.6 | 3.13 | 613 | 198 | |
| 11 | 8.7 | 400 | 12.3 | 11.4 | 6.16 | 1193 | 592 | |
| 12 | 8.8 | 425 | 12.2 | 10.2 | 9.77 | 2340 | 1577 | |
| Мольное отношение КСl/CuCl2 = 0.5 | ||||||||
| 13 | КСК-2 | 8.8 | 350 | 20.2 | 17.1 | 2.22 | 450 | 79 |
| 14 | 8.8 | 375 | 12.5 | 15.4 | 4.18 | 705 | 269 | |
| 15 | 9.1 | 400 | 12.1 | 9.4 | 7.34 | 1420 | 800 | |
| 16 | ДН-2 | 8.9 | 400 | 4.6 | 14.6 | 4.43 | 902 | 756 |
| 17 | КСК-2 | 9.3 | 400 | 19.8 | 11.3 | 9.50 | 1770 | 813 |
| 18 | 9.3 | 425 | 8.4 | 13.2 | 11.01 | 2390 | 2320 | |
| Мольное отношение КСl/CuCl2 = 1.0 | ||||||||
| 19 | ДН-2 | 6.7 | 350 | 9.3 | 9.5 | 0.93 | 312 | 55.9 |
| 20 | 375 | 44.9 | 9.0 | 3.78 | 1240 | 171 | ||
| 21 | 400 | 32.1 | 12.7 | 5.06 | 1730 | 368 | ||
| 22 | 415 | 10.0 | 6.0 | 4.25 | 1440 | 656 | ||
| Мольное отношение КСl/CuCl2 = 1.5 | ||||||||
| 23 | КСК-2 | 6.6 | 350 | 21.3 | 18.9 | 0.83 | 217 | 19.4 |
| 24 | 6.4 | 375 | 19.4 | 19.1 | 1.28 | 350 | 44.5 | |
| 25 | 6.2 | 400 | 28.9 | 18.1 | 3.40 | 675 | 120 | |
| 26 | 6.1 | 425 | 15.4 | 20.1 | 4.40 | 875 | 295 | |
| 27 | 6.0 | 450 | 13.6 | 26.45 | 6.09 | 1064 | 486 | |
| 28 | ДН-2 | 5.85 | 400 | 43.4 | 12.4 | 3.14 | 955 | 119 |
| Мольное отношение КСl/CuCl2 = 2.5 | ||||||||
| 29 | ДН-2 | 4.4 | 375 | 22.2 | 11.7 | 0.52 | 159 | 10.2 |
| 30 | 4.3 | 400 | 34.3 | 17.6 | 1.03 | 345 | 24.8 | |
В опытах на катализаторе CuCl2/носитель при полном отсутствии хлорида калия (табл. 2), опираясь на механизм реакции (I) [9], можно исключить маршрут окисления НCl с участием координационно-ненасыщенных активных центров в комплексе ${\text{CuCl}}_{{\text{4}}}^{{{\text{2}} - }}.$ Поэтому реакция (I) на этом катализаторе должна протекать только по одному маршруту, и для ее анализа можно использовать уравнение
(2)
$r = {{{{k}_{{\text{2}}}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{\text{2}}}}{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}}} {{{P}_{{{\text{C}}{{{\text{l}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{P}_{{{\text{C}}{{{\text{l}}}_{{\text{2}}}}}}}}}.$Таблица 2.
Скорости (r) и константы уравнения (2) для скорости окисления НСl (k2) на катализаторе CuCl2/носитель
| № пп | Носитель | Сu, мас. % | Т, °С | Pi, кПа | rHCl × 104, мольHCl${\text{г }}_{{{\text{Cu}}}}^{{ - {\text{1}}}}$ ч–1 | k2 × 104, мольНСl ${\text{г }}_{{{\text{Cu}}}}^{{ - {\text{1}}}}$ ч–1 | ||
|---|---|---|---|---|---|---|---|---|
| О2 | HCl | Cl2 | ||||||
| 1 | ДН-2 | 9.9 | 350 | 45.4 | 11.0 | 0.73 | 112 | 1.80 |
| 2 | 22.3 | 10.9 | 0.46 | 87 | 1.79 | |||
| 3 | КСК-2 | 11.5 | 20.3 | 20.8 | 0.51 | 75 | 1.88 | |
| 4 | 11.4 | 36.6 | 15.6 | 0.67 | 95 | 1.74 | ||
| 5 | ДН-2 | 9.0 | 40.5 | 23.1 | 0.54 | 133 | 1.83 | |
| 6 | 9.2 | 15.9 | 23.7 | 0.38 | 75 | 1.80 | ||
| 7 | 9.8 | 375 | 27.5 | 34.6 | 1.40 | 297 | 15.1 | |
| 8 | 8.6 | 400 | 23.2 | 33.5 | 3.36 | 581 | 84.3 | |
| 9 | 8.4 | 425 | 18.3 | 25.8 | 6.20 | 1210 | 410 | |
Полученное повышенное значение энергии активации реакции (~59 ккал/моль) иллюстрирует, таким образом, роль активатора в составе солевого катализатора, каковым в данном случае является хлорид калия. Присутствие ионов калия во внешней сфере комплекса ${\text{CuCl}}_{{\text{4}}}^{{{\text{2}} - }}$ – активного центра реакции (I) – приводит к появлению координационно-ненасыщенных аналогов ${\text{CuCl}}_{{\text{4}}}^{{{\text{2}} - }}$ и ослаблению связей в нем.
Опыты с варьированием толщины солевой пленки в катализаторах двумя описанными в методической части способами при значениях К/Сu от 0.1 до 1.5 (табл. 1) показали постоянство констант уравнения (1) в пределах каждого состава. Это дает основание констатировать факт участия в реакции всех имеющихся в объеме каждого катализатора активных центров, независимо от соотношения солевых компонентов. Особо отметим, что такой вывод распространяется и на составы с явной фазовой неоднородностью (например, при К/Сu = 0.1 (табл. 1, оп. 2–7)) и даже на катализатор на основе твердого хлорида меди (К/Сu = 0). Резкое увеличение поверхности нанесенного хлорида меди посредством замены диатомита на силикагель (табл. 2, оп. 1–6), как можно видеть, не изменяет величину константы скорости реакции, отнесенной к грамму меди в катализаторе.
Таким образом, можно утверждать, что в условиях реакции нулевого порядка по хлористому водороду медьсодержащие солевые трегерные катализаторы разного состава проявляют свойства гомогенных расплавов, диспергированных на носителях. В силу этого их исходная в ряде случаев фазовая неоднородность не препятствует участию в реакции всех доступных потенциальных активных центров в реакционном слое катализаторов. На этом основании давно сложившееся представление [20] о том, что медьсодержащие солевые катализаторы представляют собой частичные расплавы в условиях реакции, по нашему мнению, ошибочно при условии отсутствия диффузионных осложнений для реактантов в объеме солевого расплава.
Полученные неожиданные факты можно объяснить, если принять их в качестве прямого доказательства существенной роли процессов гидратации компонентов солевых катализаторов в условиях реакции Дикона. В пользу этого свидетельствует способность к гидратации щелочных катионов [22–25] и хлоранионов [25] и их устойчивость в таком виде в широком диапазоне температур. Тенденция к гидратации наблюдается также на атомах и ионах переходных металлов и лантаноидов. Примером может служить предложенная в работе [26], по данным рентгеноструктурного анализа, модель ближнего порядка в концентрированном водном растворе хлорида лантана, рассматриваемого авторами скорее как расплав гидратированной соли, поскольку в нем нет свободной воды.
Судя по всему, гидратация солевых катализаторов в ходе реакции является главным фактором их гомогенизации. Полученные в отсутствие диффузионных ограничений в реакционных слоях катализаторов оценки удельных скоростей реакции (табл. 1) позволяют на этом основании достоверно судить о влиянии соотношения солей на их активность в реакции. Применимость уравнения (1) к этим экспериментам, кроме случая с К/Сu = 0, дает основание считать, что предложенный в [9] двухмаршрутный механизм окисления НСl сохраняется независимо от соотношения компонентов в катализаторе. В соответствии с ним поляризующее действие внешнесферных ионов калия должно приводить к ускорению реакции за счет ослабления связей во внутренней координационной сфере комплекса ${\text{CuCl}}_{{\text{4}}}^{{{\text{2}} - }}$ и образования координационно-насыщенных его аналогов – активных центров второго маршрута. Исходя из этого, следует ожидать повышения удельной активности катализатора с ростом в нем отношения КСl/CuCl2. Однако на практике эти ожидания оправдываются только частично при изменении величины этого отношения от 0.1 до 0.5 независимо от температуры (рис. 3). При дальнейшем повышении отношения К/Сu в составе катализатора, вопреки ожиданиям, происходит явное падение константы уравнения (1) при несколько пониженном, но стабильном уровне энергии активации (32–33 ккал/моль).
Рис. 3.
Влияние мольного отношения КСl/CuCl2 в медькалиевом катализаторе в условиях нулевого порядка реакции по хлористому водороду на величину наблюдаемой константы скорости реакции Дикона при различных температурах, °С: 350 (1), 375 (2) и 400 (3).
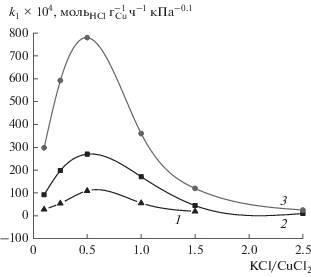
Неизменность кинетики и, судя по всему, механизма реакции и полное участие в каждом случае всех имеющихся активных центров дают основание предположить уменьшение их числа в катализаторах с ростом в них отношения КСl/CuCl2. Естественной причиной такой тенденции, по нашему мнению, может быть взаимодействие хлорида калия с хлоридом меди, поставщиком ионов Сu2+, существующих в расплаве в комплексной форме ${\text{С uCl}}_{{\text{4}}}^{{{\text{2}} - }}$ [27]. Реакция этих солей, согласно [19], протекает легко с образованием неустойчивого соединения К2CuCl4, разлагающегося на инертные КCl и KCuCl3.
Таким образом, образование двойной соли КCuCl3 хотя и способствует в ряде случаев переводу медьсодержащих солей в расплав при более низких температурах и повышению их стабильности, должно, по нашему мнению, одновременно понижать активность катализатора в реакции с ростом отношения К/Cu. На этом основании можно утверждать, что зависимости на рис. 3 получены без учета возможного существенного изменения стационарной концентрации активной формы меди в условиях реакции с изменением соотношения солей в катализаторе. Для получения правдоподобной информации о влиянии соотношения хлоридов на активность катализатора необходимо сохранение постоянства концентрации активной формы меди в подобных экспериментах. Совершенно очевидно, что соответствующие корректировки актуальны, поскольку они могут принципиально изменить характер зависимостей на рис. 3. Решение этой задачи возможно только при контроле концентрации активной формы меди в катализаторах (например, на основе знания кинетики образования КСuCl3 в условиях реакции или другими методами). Но приблизительные оценки все же возможны при сопоставлении результатов экспериментов, проведенных на катализаторах с существенно разными соотношениями компонентов, учитывая легкость реакции взаимодействия хлоридов меди и калия [29 ] .
Суть такого приблизительного подхода можно понять, если сравнить, например, оп. 10 и 24 (табл. 1) при температуре 375°С на катализаторах с соотношениями хлоридов 0.25 и 1.5, заведомо отличающихся, по нашему мнению, уровнем потерь в них активной меди. В оп. 10 можно не без основания условно принять уровень потерь минимальным, а величину константы уравнения (1) (k1 = 198 × 10–4 мольHCl${\text{г }}_{{{\text{Cu}}}}^{{ - {\text{1}}}}$ ч–1 кПа–0.1) практически неискаженной, что нельзя признать для оп. 24 с наблюдаемой величиной k1 = 44.5 × × 10–4 мольHCl${\text{г }}_{{{\text{Cu}}}}^{{ - {\text{1}}}}$ ч–1 кПа–0.1. Если предположить, что ~90% активной меди в условиях этого опыта не смогло появиться из-за возросшей скорости превращения СuCl2 в KCuCl3 (что вполне реально из-за легкости его образования [15] и повышенной концентрации хлористого калия), то соответствующая поправка приводит к новой оценке величины константы уравнения (1) k1 ≈ ≈ 400 × 10–4 мольHCl ${\text{г }}_{{{\text{Cu}}}}^{{ - {\text{1}}}}$ ч–1 кПа–0.1. Подобные полуколичественные поправки с учетом температуры и влияния концентрации хлоридов в катализаторах с похожим результатом приводят в итоге вместо наблюдения падения к постоянному росту активности катализатора с повышением отношения КСl/CuCl2. Это дает основание не отказываться от существенной роли поляризационных взаимодействий в механизме реакции Дикона [9] во всем диапазоне соотношений компонентов медькалиевого солевого катализатора. Но подтверждение этого вывода, тем не менее, нуждается в дополнительной информации.
Список литературы
Rideal E.K., Tayler H.S. Catalysis in Theory and Practice. London: Macmillan &Co, 1926.
Engel W.F., Waale M.J., Muller S. // Chem. Ind. (London). 1962. P. 76.
Ruthven D.M., Kenney C.N. // Chem. Eng. Sci. 1967. V. 22. P. 1561.
Шаховцева Г.А., Васильева И.Б., Аветисов А.К., Гельбштейн А.И. // Кинетика и катализ. 1970. Т. 11. № 6. С. 1469.
Amrute A.P., Mondelli C., Hevia M.A.G., Pérez-Ramírez J. // J. Phys. Chem. 2011. V. 115. P. 1056.
Sun Y., Li C., Guo Y., Zhan W., Guo Y., Wang L., Wang Y., Lu G. // Catal. Today. 2018. V. 307. P. 2.
Garcia C.L., Resasco D.E. // Appl. Catal. 1987. V. 29. P. 55.
Трегер Ю.А., Розанов В.Н., Флид М.Р., Карташов Л.М. // Успехи химии. 1988. Т. 57. С. 577.
Аглулин А.Г. // Кинетика и катализ. 2014. Т. 55. № 5. С. 599.
Li C., Sun Y., Hess F., Djerdj I., Sann J., Voepel P., Cop P., Guo Y., Smarsly B.M., Over H. // Appl. Catal. B. Environ. 2018. V. 239. P. 628.
Li C., Hess F., Djerdj I., Chai G., Sun Y., Guo Y., Smarsly B.M., Over H. // J. Catal. 2018. V. 357. P. 257.
Бакши Ю.М., Аглулин А.Г. // Современное состояние и перспективы развития теоретических основ производства хлорорганических продуктов. Тез. докл. II Всесоюз. науч. конф. Баку: Азинефтехим, 1978. Т. 1. С. 19.
Гельбштейн А.И., Бакши Ю.М. // Журн. физ. химии. 1988. Т. 62. № 10. С. 2649.
Темкин М.И., Киперман С.Л., Лукьянова Л.И. // Докл. АН СССР. 1950. Т. 74. № 4. С. 763.
Темкин М.И. // Кинетика и катализ. 1962. Т. 3. № 4. С. 509.
Курляндская И.И., Кудрявцева Т.Ф. // Современное состояние и перспективы теоретических основ производства хлорорганических продуктов. Тез. докл. III Всесоюз. конф. Баку: Азинефтехим, 1981. С. 28.
Кудрявцева Т.Ф. Дисс. канд. хим. наук. М.: ГосНИИхлорпроект, 1981.
Курляндская И.И., Бакши Ю.М., Кудрявцева Т.Ф., Дмитриева М.П., Гельбштейн А.И. // Кинетика и катализ. 1984. Т. 25. № 3. С. 598, 603.
Zurowski K. // J. Therm. Anal. 1992. V. 38. P. 2369.
Fontana C.M., Gorin E., Kidder G.A., Meredith C.S. // Ind. Eng. Chem. 1952. V. 44. P. 363.
Воробей М.П., Скиба О.В. // Журн. неорган. химии. 1970. Т. 15. № 5. С. 1414.
Dzidic J., Kabarle P. // J. Phys. Chem. 1970. P. 1466.
Kikuchi O., Yamaguchi K., Morihashi K., Yokoyama Y., Nakayama M. // Bull. Chem. Soc. Jpn. 1993. V. 66. № 8. P. 2412.
Zidi Zouhaier S.J. // J. Chem. Phys. 2012. V. 137. № 12. P. 124107.
Arshadi M., Yamdagni R., Kebarle P. // J. Phys. Chem. 1970. P. 1475.
Grigoriew H., Siekierski S. // J. Phys. Chem. 1993. V. 97. № 20. P. 5400.
Волков С.В., Грищенко В.Ф., Делимарский Ю.К. Координационная химия солевых расплавов. Киев: Наук. думка, 1977.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


