Кинетика и катализ, 2019, T. 60, № 3, стр. 275-279
Проявление изотопного эффекта в реакции каталитического гидроаллилирования норборнадиена аллилформиатом
С. А. Дураков 1, Р. С. Шамсиев 1, В. Р. Флид 1, *, А. Е. Гехман 2
1 ФГБОУ ВО МИРЭА – Российский технологический университет, Институт тонких химических технологий
им. М.В. Ломоносова
119571 Москва, просп. Вернадского, 86, Россия
2 ФГБУН Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский просп., 31, Россия
* E-mail: vitaly-flid@yandex.ru
Поступила в редакцию 12.01.2019
После доработки 04.02.2019
Принята к публикации 04.02.2019
Аннотация
Аллилирование норборнадиена аллилформиатом в присутствии палладиевых каталитических систем имеет ряд особенностей, связанных с различными направлениями β-гидридного переноса в ключевых интермедиатах, который может осуществляться с участием аллильного, норборненильного или формильного фрагментов. С помощью дейтерированных реагентов установлены значение кинетического изотопного эффекта и природа лимитирующей стадии в реакции гидроаллилирования норборнадиена.
ВВЕДЕНИЕ
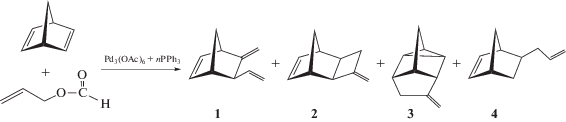
Давно ставшие классическими работы И.И. Моисеева и сотр. в значительной степени стимулировали формирование нового направления – металлокомплексного катализа. Информация о механизме каталитических реакций позволяет направленно воздействовать на важнейшие характеристики процесса – активность катализатора, состав продуктов, селективность, и тем самым расширять ассортимент базовых мономеров и полупродуктов, улучшать технико-экономические показатели процесса. Принципы, методы и подходы металлокомплексного катализа оказались чрезвычайно привлекательными для решения проблем селективности различного уровня. В полной мере это относится к выдающимся достижениям в области химии и строения η3-аллильных комплексов переходных металлов [1–3]. η3-Аллильные комплексы палладия являются прекурсорами, катализаторами или ключевыми интермедиатами во многих реакциях с участием диеновых углеводородов, в том числе бицикло[2.2.1]гепта-2,5-диена (норборнадиена, (НБД)) [4–6]. В каталитической химии НБД особое место занимают реакции с аллилкарбоксилатами, в частности, аллилформиатом (АФ), катализируемые комплексными соединениями никеля и палладия с фосфорорганическими лигандами [7–14]. Так, взаимодействие НБД и АФ в присутствии системы “ацетат палладия–трифенилфосфин в ацетонитриле” приводит к продуктам 1–4 (схема 1 ).
Принципиальные отличия при образовании соединений 1–3 и 4 связаны с направлениями гидридного переноса. В первом случае (для 1–3) аллильная группа, присоединяясь к НБД в виде фрагмента С3Н4, теряет атом водорода (окислительное аллилирование). При реализации другого направления, ведущего к появлению 5-аллилнорборнена-2 (4), осуществляется гидроаллилирование НБД (восстановительное аллилирование, молекула НБД формально присоединяет фрагмент С3Н6). Особенность поведения Pd-фосфиновой системы проявляется в том, что она катализирует оба процесса. Это обстоятельство является важным при изучении вариативности гидридного переноса – ключевой стадии, определяющей проблему селективности.
Схема 1 . Каталитическое аллилирование НБД аллилформиатом.
Ранее нами были исследованы закономерности гидридного переноса с использованием дейтерированных реагентов – аллилацетата (C3D5OAc) и АФ с различным типом замещения водорода атомами дейтерия – С3Н5ОС(О)D, C3D5OC(O)H и C3D5OC(O)D [15, 16]. Установлено не только положение всех дейтериевых меток в продуктах 1–4, но и направления гидридного переноса при их образовании. Показано, что реакции имеют общую природу и связаны с разрывом связи С–Н, находящейся в β-положении относительно атома металла. β-Гидридный перенос может протекать с участием аллильного, норборненильного или формильного фрагментов. Тем не менее, ответ на вопрос о природе лимитирующей стадии и значениях кинетического изотопного эффекта (КИЭ) остается дискуссионным. В ряде работ высказывались предположения, что именно стадии гидридного переноса лимитируют протекание всего каталитического цикла, однако экспериментальные подтверждения получены не были [16, 17]. В связи с этим целью настоящей работы явилось изучение природы лимитирующей стадии в реакции гидроаллилирования НБД методом меченых атомов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали АФ, НБД и аллиловый спирт с чистотой не менее 99.5%, а также муравьиную кислоту – D2 с содержанием дейтерия не менее 99%.
Дейтерозамещенный АФ синтезировали этерификацией муравьиной кислоты DCOOD и аллилового спирта С3Н5ОН. После перегонки собирали фракцию с Ткип = 82.5–83°С. Выход продукта составлял 75%. Состав дейтерозамещенного АФ и его чистоту контролировали методами ЯМР и хромато-масс-спектрометрии. После дополнительной очистки содержание целевого продукта составляло не менее 98%.
Источник палладия Pd3(OAc)6 получали по известной методике [19]. Трифенилфосфин фирмы “Aldrich” перекристаллизовывали в атмосфере азота из смеси метанол–хлороформ (объемное соотношение равно 4 : 1; 15 мл смеси на 1 г PPh3). Ацетонитрил перед опытом перегоняли над Р2О5.
Реакции проводили в атмосфере аргона при температурах 25 и 60°С в термостатированном вакуумируемом реакторе, снабженном магнитной мешалкой и устройством для отбора проб.
Ход процесса контролировали методом ГХ с помощью хроматографа Кристалл ПМ-2000, (“Хроматэк”, Россия) с пламенно-ионизационным детектором и капиллярной колонкой Agilent J&W HP-50+ (“Аgilent Technologies”, США). Идентификацию продуктов осуществляли методами хромато-масс-спектрометрии на хромато-масс-спектрометре Automass-120 (“Delsi-Nermag”, Франция) с капиллярной колонкой CPS CP-Sil 5 CB в режиме электронного удара, диапазон сканирования m/z равен 15–300, скорость сканирования – 1 скан за 300 мс, энергия ионизации – 70 эВ. При анализе и интерпретации масс-спектров использовали стандартные базы данных и данные работ [16, 20, 21]. Спектры ЯМР 1Н и 13С регистрировали на спектрометре DPX 300 (“Bruker”, Германия), рабочая частота 300.13 МГц для ядер 1H и 75.033 МГц для ядер 13C.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
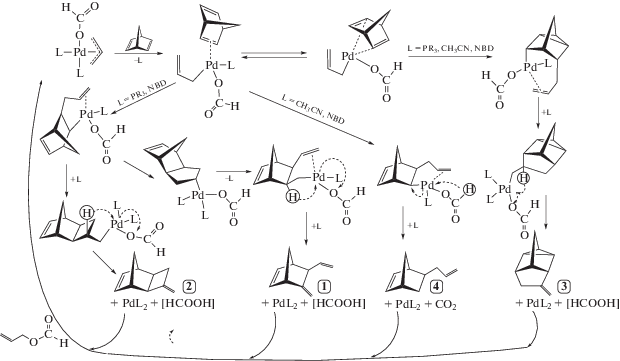
Предполагаемый механизм реакций аллилирования и гидроаллилирования НБД, учитывающий образование основных продуктов, был предложен в работе [16] (схема 2 ).
Схема 2 . Механизм каталитического аллилирования НБД.
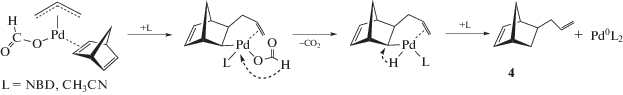
Маршруты, приводящие к каждому из соединений 1–4, включают в себя обязательную стадию β-гидридного переноса. Природа атомов водорода, участвующих в этих стадиях, существенно различна, а сами параллельные маршруты связаны общим материальным балансом и могут быть сопряженными. В таких случаях бывает целесообразно упростить реакционную систему, исключив из нее ряд направлений. Проведение гидроаллилирования НБД с применением безлигандной палладиевой системы (прекурсор – Pd3(OAc)6 в ацетонитриле) позволяет получать 4 с селективностью выше 95%. Стереохимия его формирования определяется исключительно направлением экзо-атаки β-гидридного переноса по отношению к норборненовому кольцу (схема 3 ).
Схема 3 . Механизм образования 5-аллилнорборнена-2.
В этой стадии участвует формильный атом водорода. Поэтому для оценки КИЭ использовали обычный и дейтерированный по формильной группе АФ (С3Н5ОС(О)Н и С3Н5ОС(О)D). Первая серия экспериментов заключалась в их совместном участии в реакции для создания конкурентных условий. Оценку КИЭ осуществляли путем сопоставления концентраций продуктов 4 и его дейтерированного аналога 4-D1, образующихся параллельно в присутствии каталитической системы Pd3(OAc)6 и с применением равных количеств АФ и АФ-D1 (${1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}C_{{{\text{Н Б Д }}}}^{0}$ = $C_{{{\text{А Ф }}}}^{0}$ = $C_{{{\text{А Ф - D1}}}}^{0}$ = = 0.25 моль л–1).
Полагая, что механизм реакции не изменяется при использовании различных изотопов, образование продуктов 4 и 4-D1 должно описываться одинаковыми кинетическими уравнениями. Тогда отношение концентраций продуктов будет постоянным во времени и равным отношению наблюдаемых констант скорости (уравнение (1)).
(1)
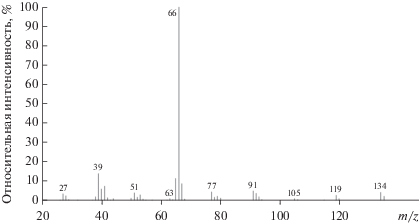
${\text{К И Э }} = \frac{{{{C}_{{{{4}_{{\text{H}}}}}}}}}{{{{C}_{{{{4}_{{\text{D}}}}}}}}} = \frac{{{{k}_{{\text{H}}}}}}{{{{k}_{{\text{D}}}}}},$Соединения 4 и 4-D1 хроматографически практически не различимы ввиду близости состава (отличие в молекулярных массах равно единице). Для анализа их концентраций в реакционных растворах использовали метод деконволюции спектров ГХ-МС в программе AMIDIS. Метод позволяет обработать масс-спектр смеси (рис. 1) с помощью алгоритма, предназначенного для извлечения желаемого сигнала или сигналов из экспериментальных данных (рис. 2).
Рис. 2.
Деконволюция сигналов, соответствующих характеристическим ионам, в смеси продуктов 4 и 4-D1.
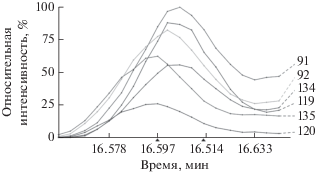
Рассчитанные значения отношений m/z в характеристических ионах продуктов 4 и 4-D1 (134/135, 119/120, 91/92) совпадают между собой с погрешностью, не превышающей 10%, что дает возможность оценить соотношения концентраций продуктов 4 и 4-D1. Полученное значение КИЭ составляет 2.2 ± 0.2.
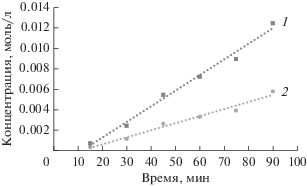
Во второй серии экспериментов исследования с участием С3Н5ОС(О)Н и С3Н5ОС(О)D проводили раздельно в полностью идентичных условиях, минимизирующих образование побочных продуктов: двойного аллилирования НБД, его гидрирования и гидроформилирования. Для этого АФ брали в некотором недостатке (10%) по отношению к НБД. С этой же целью концентрации продуктов определяли при низких конверсиях реагентов (не выше 5%). Время начинали отсчитывать сразу после завершения индукционного периода. Из данных, полученных при обработке зависимостей, следует, что значение КИЭ = 2.3 ± ± 0.2 (рис. 3).
Рис. 3.
Зависимость соотношения продуктов гидроаллилирования НБД 4 (1) и 4-D1 (2) от времени на катализаторе Pd3(OAc)6. Мольное отношение $C_{{{\text{Н Б Д }}}}^{0}$ : : $C_{{{\text{Pd}}}}^{0}$ = 100 : 1, $C_{{{\text{Н Б Д }}}}^{0}$ = 0.275 моль л–1, $C_{{{\text{А Ф }}}}^{0}$ = $C_{{{\text{А Ф - D1}}}}^{0}$ = = 0.250 моль л–1; растворитель – ацетонитрил, Т = 25°С.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты, полученные в двух сериях экспериментов, полностью совпадают. Достаточно высокое значение КИЭ (больше 1.4) подтверждает гипотезу о предпочтительности разрыва формильной С–Н-связи на лимитирующей стадии процесса [18]. Это означает, что β-гидридный перенос является лимитирующей стадией в каталитическом цикле механизма гидроаллилирования НБД в присутствии соединений палладия. Такой вывод не следует, однако, распространять на закономерности образования продуктов окислительного аллилирования НБД 1–3, для которых природа лимитирующей стадии может оказаться иной. Совместное применение изотопных и кинетических методов позволит в будущем ответить на этот вопрос.
Список литературы
Моисеев И.И., Федоровская Е.А., Сыркин Я.К. // Журн. неорг. химии. 1959. Т. 4. С. 2641.
Cornils B., Herrmann W.A., Muhler M., Wong C. / Catalysis from A to Z: A Concise Encyclopedia, 4 Volume set Completely Revised and Enlarged Edition. Wiley-VCH Verlag GmbH & Co. KGaA. 2013. P. 79.
Cornils B., Herrmann W.A., Beller M., Paciello R. / Applied Homogeneous Catalysis with Organometallic Compounds: A Comprehensive Handbook in Four Volumes, Third Edition. Wiley-VCH Verlag GmbH & Co. KGaA. 2017. P. 1366
Флид В.Р., Манулик О.С., Белов А.П., Григорьев А.А. // Металлоорганическая химия. 1991. Т. 4. С. 864.
Флид В.Р., Грингольц М.Л., Шамсиев Р.С., Финкельштейн Е.Ш. // Успехи химии. 2018. Т 87. С. 1169.
Джемилев У.М., Хуснутдинов Р.И., Толстиков Г.А. // Успехи химии. 1987. Т. 56. С. 65.
Эфрос И.Е., Евстигнеева Е.М., Колесникова А.А., Флид В.Р. // Рос. хим. журн. 2007. Т. 51. С. 103.
Tsukada N., Sato T., Inoue Y. // Tetrahedron Lett. 2000. №. 41. P. 4181.
Евстигнеева Е.М., Манулик О.С., Флид В.Р. // Кинетика и катализ. 2004. Т. 45. С. 188.
Евстигнеева Е.М., Флид В.Р. // Изв. АН. Сер. хим. 2008. Т. 57. С. 823.
Шамсиев Р.С., Флид В.Р. // Изв. АН. Сер. хим. 2013. Т. 62. С. 2301.
Евстигнеева Е.М., Манулик О.С., Флид В.Р., Столяров И.П., Козицына Н.Ю., Варгафтик М.Н., Моисеев И.И. // Изв. АН. Сер. хим. 2004. Т. 53. С. 1292.
Столяров И.П., Гехман А.Е., Моисеев И.И., Колесников А.Ю., Евстигнеева Е.М., Флид В.Р. // Изв. АН. Сер. хим. 2007. Т. 56. С. 309.
Шамсиев Р.С., Тхиен Ха Нгок, Флид В. Р. // Изв. АН. Сер. хим. 2013. Т. 62. С. 1553.
Флид В.Р., Дураков С.А., Морозова Т.А. // Изв. АН. Сер.хим. 2016. Т. 65. С. 2639.
Дураков С.А., Шамсиев Р.С., Флид В.Р., Гехман А.Е. // Изв. АН. Сер. хим. 2018. Т. 67. С. 2234.
Флид В.Р., Дураков С.А. // Изв. АН. Сер. хим. 2018. Т. 67. С. 469.
Chen Y., Romarie J.P., Newhouse T.R. //J. Am. Chem. Soc. 2015. V. 137. P. 5875.
Столяров И.П., Демина Л.И., Черкашина Н.В. // Журн. неорг. химии. 2011. Т. 56. С. 1611.
Аль Хазраджи А.Х., Крылов А.В., Куликова М.В., Флид В.Р., Ткаченко О.Ю. // Тонкие хим. технол. 2016. Т. 11. № 6. С. 70.
Флид ВР., Дураков С.А., Морозова Т.А., Чешков Д.А., Кацман Е.А. // Изв. АН. Сер. хим. 2018. Т. 67. С. 1335.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ