Кинетика и катализ, 2019, T. 60, № 3, стр. 377-387
Влияние добавок селена на физико-химические и каталитические свойства VMoTeNbO-катализаторов в окислительном дегидрировании этана
Т. Ю. Кардаш 1, *, Е. В. Лазарева 1, Д. А. Свинцицкий 1, 2, Е. П. Ковалёв 1, 2, В. М. Бондарева 1
1 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
2 ФГАОУ ВО Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: kardash@catalysis.ru
Поступила в редакцию 20.09.2018
После доработки 28.11.2018
Принята к публикации 04.12.2018
Аннотация
Исследовано влияние добавок селена на структуру, физико-химические и каталитические свойства VMoTeNbO-катализаторов в реакции окислительного дегидрирования этана. Показано, что введение селена на первой стадии синтеза катализаторов (смешение исходных растворов) позволяет при последующей термообработке получать высоко окристаллизованные образцы, в состав которых входит преимущественно фаза М1. Несмотря на то, что в процессе термообработки селен полностью удаляется из образцов, приготовленные катализаторы заметно отличаются по свойствам от немодифицированных и демонстрируют более высокие значения селективности по этилену при конверсии этана 93%. Наблюдаемые эффекты связаны с тем, что присутствие селена способствует процессу формирования фазы М1 и повышает степень ее кристалличности.
ВВЕДЕНИЕ
Этилен – один из важнейших олефинов в химической промышленности. Он используется для синтеза широкого спектра полимеров различного назначения. Кроме того, этилен необходим для производства стирена, этиленоксида, винилхлорида и большого круга функциональных производных углеводородов (например, дихлорэтана, этилбензола, ацетальдегида, этанола) и множества других продуктов.
Промышленное получение этилена основано на пиролизе углеводородного сырья (прямогонный бензин или легкие алканы С2–С4) в присутствии перегретого водяного пара. Однако эти процессы имеют несколько существенных ограничений. К ним относятся термодинамическое ограничение на конверсию, эндотермичность реакции, высокие температуры проведения реакции (800°С) и образование кокса [1, 2].
Окислительное дегидрирование этана может быть альтернативой существующим процессам синтеза этилена. При введении кислорода в реакционную смесь решаются проблемы коксования и термодинамических ограничений. Реакция окислительного дегидрирования является экзотермической, что позволяет проводить ее при более низкой температуре. Основной проблемой остается контроль селективности. В присутствии кислорода молекулы этана и этилена могут подвергаться окислительной деструкции с образованием оксидов углерода [3–8].
Оксидные VMoTeNbO-катализаторы – одни из наиболее эффективных в окислительном дегидрировании этана. Их использование позволяет достигать выхода этилена до 75% при температуре реакции 400°С [4, 9–12]. Однако, несмотря на достигнутые успехи в разработке и исследовании этих систем, в настоящее время продолжается поиск методов их модифицирования с целью увеличения селективности по этилену при высоких конверсиях, что сделало бы этот процесс более привлекательным с экономической точки зрения [5, 8].
В состав VMoTeNbO-катализаторов в основном входят две кристаллические фазы: орторомбическая (M1) и псевдо-гексагональная (M2). Такие названия они получили после работы Ушикубо (Ushikubo) и др. [13], где их впервые охарактеризовали методом просвечивающей электронной микроскопии. Для процесса окислительного дегидрирования этана было надежно показано, что каталитически активной является фаза М1 [4, 11]. Эта фаза имеет орторомбическую решетку и относится к пространственной группе Pba2, параметры a = 21.133 Å, b = 26.644 Å, c = 4.014 Å. Структура построена из протяженных сеток, которые трансляционно накладываются друг на друга в направлении [001]. Такие сетки в плоскости (001) состоят из сочлененных по вершинам октаэдров MoO6 и VO6, а также пентагональныхбипирамид NbO7, соединенных по ребрам с пятью октаэдрами. За счет сочленения структурных фрагментов формируются шести- и семичленные петли, которые при наложении сеток друг на друга образуют протяженные каналы вдоль направления [001]. Теллур в состоянии Te4+, находяcь в кислородном окружении, связывается с октаэдрами MeO6 (Me = Mo, V) [14, 15]. Локальное окружение теллура представляет собой ассиметричную треугольную бипирамиду, которая располагается внутри шестичленных каналов.
Разрыв C–H-связи является лимитирующей стадией реакции окисления этана. Считается, что эта стадия протекает на поверхности фазы M1 на центрах, в состав которых входят катионы ванадия в специфическом локальном окружении и зарядовом состоянии [16–19]. Селективное окисление этана до этилена обеспечивается тем, что активные центры пространственно разделены, в результате чего этилен может десорбироваться без дальнейшей деструкции с образованием оксидов углерода. Однако точное строение активного центра до сих пор не установлено и остается предметом дальнейших исследований и дискуссий. Так, некоторые авторы на основании in situ исследований показали, что катионы теллура могут принимать участие в генерации активных форм кислорода [20, 21].
Влияние катионов теллура на активность катализаторов подтверждает тот факт, что при введении модифицирующих добавок, которые могут встраиваться в позиции теллура, удается варьировать активность и селективность фазы М1 [22, 23]. Ранее нами было показано, что модифицирование VMoTeNbO-катализаторов катионами Bi3+, являющихся электронными аналогами Te4+, позволяет увеличить селективность фазы М1 по этилену при высоких конверсиях этана [22].
Целью настоящей работы было изучение влияния добавок селена на структурные и физико-химические характеристики VMoTeNbO-катализаторов. Полученные образцы тестировали в реакции окислительного дегидрирования этана. При выборе модифицирующей добавки предполагалось, что селен, как структурный аналог теллура, способен замещать его позиции и модифицировать свойства фазы М1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Катализаторы расчетного катионного состава Mo1V0.3Te0.23Nb0.12Sex (x = 0.0075, 0.025 и 0.05) получали способом, описанным в работах [24, 25]. Синтезированные катализаторы далее по тексту обозначены как Se-0 (x = 0), Se-1 (x = = 0.0075), Se-2 (x = 0.025) и Se-3 (x = 0.05). Для изучения процесса формирования активной фазы при модифицировании селеном был отдельно приготовлен образец с повышенным содержанием селена, где Se/Mo = 0.15 (образец Se-4). Образец без селена катионного состава Mo1V0.3Te0.23Nb0.12 использовали в качестве стандарта. Катионные составы полученных образцов приведены в табл. 1. В качестве исходных реактивов применяли аммоний молибденовокислый (NH4)6Mo7O24 ⋅ 4H2O (“НеваРеактив”, Россия), аммоний метаванадат NH4VO3 (“Реахим”, Россия), теллуровую кислоту H6TeO6 (“Aldrich”, США), селенистую кислоту H2SeO3 (“Реахим”, Россия), оксалат ниобия. Оксалат ниобия готовили согласно методике, приведенной в работах [24, 25]. Содержание основных компонентов в реактивах составляло >99%. Способ приготовления катализаторов включал следующие стадии: 1 – получение влажного прекурсора, содержащего Mo, V, Te, Nb и Se, путем смешения водных растворов исходных реагентов; 2 – удаление растворителя с использованием лабораторной распылительной сушилки; 3 – сушка полученного порошка на воздухе при 160°С в течение 1 ч; 4 – прокалка сухого прекурсора (кратковременно при 310°С в токе воздуха, затем 2 ч при 560°С в токе гелия).
Таблица 1.
Химический и фазовый состав образцов с различным количеством вводимого при синтезе селена после термообработки в токе гелия при 560°С
| Образец | Se/Mo** | Катионный состав | Фазовый состав, мас. % | Степень крист., % | ||
|---|---|---|---|---|---|---|
| химический анализ | РФЭС | М1 | М2 | |||
| Se-0-560* | 0 | Mo1V0.32Te0.18Nb0.11 | Mo1.0V0.28Te0.37Nb0.11 | 93 | 7 | 74 |
| Se-1-560 | 0.0075 | Mo1V0.32Te0.17Nb0.11 | Mo1.0V0.27Te0.44Nb0.11 | 96 | 4 | 92 |
| Se-2-560 | 0.025 | Mo1V0.32Te0.16Nb0.11 | Mo1.0V0.24Te0.39Nb0.12 | 91 | 9 | 87 |
| Se-3-560 | 0.05 | Mo1V0.32Te0.16Nb0.11 | Mo1.0V0.24Te0.41Nb0.11 | 93 | 7 | 93 |
| Se-4-560 | 0.15 | Mo1V0.32Te0.18Nb0.11 | Mo1.0V0.22Te0.40Nb0.11 | 88 | 12 | 83 |
Образец Se-4 прокаливали, изменяя условия термообработки: кратковременно при 310°С только в токе воздуха и при 310°С на воздухе с последующей термообработкой в токе гелия отдельно при 350, 400, 450, 500 и 560°С. Также была получена аналогичная серия образцов для стандартного катализатора (Se-0) с вариацией условий термообработки: при 310°С на воздухе и при 350, 400, 450, 500 и 560°С в токе гелия. Температура обработки в гелии указана в обозначении катализаторов.
Исследования катализаторов
Удельную поверхность образцов определяли методом БЭТ по изотермам низкотемпературной адсорбции азота, полученным на анализаторе ASAP-2400 (“Micrometritics”, США).
Химический состав катализаторов определяли на атомно-абсорбционном спектрофотометре ISP OPTIMA 4300DV (“PerkinElmer”, США).
Рентгенофазовый анализ (РФА) выполняли на дифрактометре BrukerD8 (“Bruker”, Германия), используя CuKα-излучение и детектор LynxEye; сканирование в диапазоне углов 2θ = 5°–70°, шаг – 0.05°, накопление в точке – 3 с. Фазовый анализ, оценку количественного содержания фаз и степени кристалличности образцов проводили методом Ритвельда. Для расчетов применяли программный пакет TOPAS v.4.2, структурные параметры взяты из работы [14] и базы структурных данных ICSD. Для вычисления областей когерентного рассеяния (ОКР) использовали Lvol-IB в изотропном приближении для формы частиц. Инструментальный вклад учитывали методом фундаментальных параметров.
Фотоэлектронные спектры регистрировали на спектрометре ES-300 (“KRATOS Analytical”, Великобритания). В качестве первичного излучения применяли линию MgКα с энергией фотонов hv = = 1253.6 эВ. Мощность рентгеновской трубки составляла 170 Вт. Прибор калибровали по положению максимумов линий Au4f7/2 и Cu2p3/2 при 84.0 и 932.7 эВ для массивных металлических золота и меди соответственно. Образцы предварительно размалывали и спрессовывали в таблетки. Таблетки фиксировали на держателе при помощи двухстороннего углеродного скотча. При таком подходе внутренняя калибровка спектров не требовалась.
Анализ спектральных данных (вычитание фона, сглаживание, разложение на компоненты, расчет площадей пиков) выполняли с использованием программного пакета “XPS-Calc”, который ранее был апробирован при исследовании различных систем [26–28]. Разложение на компоненты производили с аппроксимацией пиков суммой функций Лоренца и Гаусса с вычитанием фона по Ширли. Концентрации и соотношения компонентов на поверхности определяли из соответствующих площадей линий элементов с помощью эмпирических факторов атомной чувствительности [29].
Каталитические свойства синтезированных катализаторов изучали при атмосферном давлении в проточной установке с on-line хроматографическим анализом компонентов реакционной смеси. Эксперименты проводили в стеклянном трубчатом реакторе с коаксиально расположенным термопарным карманом в неподвижном слое катализатора фракции 0.25–0.50 мм. Состав реакционной смеси (об. %) – C2H6 : O2 : N2 = = 10 : 10 : 80, температура реакции – 400°C. Отсутствие гомогенного окисления в указанных условиях было установлено в экспериментах с пустым реактором.
По данным хроматографического анализа (Цвет-500, Россия) рассчитывали конверсию этана и селективности по продуктам реакции (этилену и оксидам углерода) по формулам, приведенным в работе [4]. При вариации времени контакта в интервале 1–16 с получали зависимости селективностей образования продуктов реакции от конверсии этана.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства катализаторов
В табл. 1 представлены физико-химические характеристики катализаторов, в состав которых вводили различное количество селена. Удельная поверхность образцов после термообработки при 560°С в токе гелия составляла 4–5 м2/г. Согласно данным химического анализа в результате термообработки катализаторов в гелии при 560°С селен из них удаляется полностью. Исследование поверхностного состава образцов методом рентгеновской фотоэлектронной спектроскопии (РФЭС) также подтвердило удаление селена при термообработке.
Сравнение результатов химического анализа и РФЭС указывает на обогащение поверхности всех катализаторов теллуром и на несколько меньшее содержание ванадия на поверхности по сравнению с объемом. Отметим, что в стандартном образце Se-0 (без добавления селена на стадии синтеза) поверхностная концентрация теллура ниже, чем для модифицированных селеном катализаторов, а соотношение Nb/Mo на поверхности образца такое же, как и в объеме.
По данным рентгеновской дифракции в составе всех полученных катализаторов присутствуют только фазы М1 и М2. Рентгенограммы представлены на рис. 1. Методом Ритвельда был проведен количественный фазовый анализ и оценка степени кристалличности (табл. 1). Во всех изученных образцах формируется хорошо окристаллизованная фаза М1, содержание которой варьируется в пределах 91–96%. Наибольшее количество этой фазы наблюдается в образце Se-1-560. Уточненные параметры решетки и значения ОКР для фазы М1 приведены в табл. 2. Видно, что добавление селена на стадии синтеза не приводит к структурным изменениям после термообработки при 560°С.
Рис. 1.
Рентгенограммы образцов с различным содержанием селена, вводимого при синтезе, после термообработки в гелии при 560°С. Показаны экспериментальная рентгенограмма и результат моделирования ее полного профиля методом Ритвельда. Рефлексы, относящиеся к фазе М2, отмечены знаком (◆).
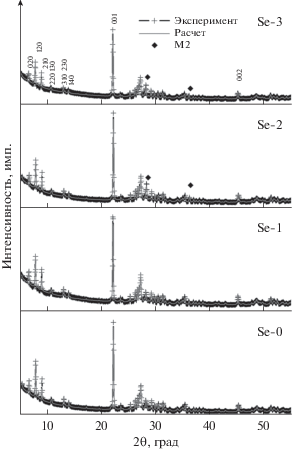
Таблица 2.
Параметры решетки для фазы М1 и размер ОКР для образцов с различным количеством селена, вводимого при синтезе, после термообработки в токе гелия при 560°С
| Образец | Se/Mo* | a, Å | b, Å | c, Å | Vячейки, Å3 | ОКР, нм |
|---|---|---|---|---|---|---|
| Se-0 | 0 | 21.14(1) | 26.63(2) | 4.019(3) | 2263(1) | 64(1) |
| Se-1 | 0.0075 | 21.15(1) | 26.60(2) | 4.021(3) | 2262(3) | 70(3) |
| Se-2 | 0.025 | 21.15(1) | 26.63(2) | 4.020(3) | 2263(3) | 67(3) |
| Se-3 | 0.05 | 21.14(1) | 26.62(2) | 4.018(3) | 2261(3) | 65(3) |
Отметим, что степень кристалличности модифицированных катализаторов Se-1, Se-2 и Se-3 заметно выше по сравнению со стандартным образцом Se-0. Определенные значения степени кристалличности для Se-0 близки к величинам, полученным другими авторами для подобных VMoTeNbO-катализаторов [30].
Каталитические свойства
Зависимости селективностей образования продуктов реакции от конверсии этана-для модифицированных селеном катализаторов, аналогичны таковым, характерным для VMoTeNbO-катализаторов [3, 4, 9, 19, 31–34]. С ростом степени превращения этана селективность по этилену уменьшается, а по оксидам углерода, соответственно, увеличивается. В области низких конверсий (до 35–40%) изменения селективностей невелики, в то время как в области конверсий >80% наблюдается существенное снижение селективности образования этилена при повышении конверсии. Подобного вида зависимости позволяют описать процесс окислительной конверсии этана последовательно-параллельной схемой: из этана по параллельным маршрутам образуются этилен и оксиды углерода, последние появляются также в результате окислении этилена по последовательному маршруту. Таким образом, на основании характера зависимостей селективностей образования продуктов реакции в областях высоких и низких конверсий этана можно судить о влиянии модифицирования селеном на протекание реакции по последовательному и параллельному маршрутам соответственно.
При исследовании кинетики реакции окислительного дегидрирования этана на VMoTeNbО-катализаторе в [35] было установлено, что при исходной концентрации этана до 10 об. % реакция удовлетворительно описывается уравнением первого порядка по этану. Также было показано, что при соотношениях О2/С2Н6 ≥ 1 наблюдается нулевой порядок реакции по кислороду. Учитывая, что значения удельной поверхности всех изученных катализаторов близки, их активность может быть охарактеризована величиной константы скорости общего превращения этана, рассчитываемой по уравнению 1-го порядка для проточного реактора [36].
На рис. 2а приведена зависимость селективности образования этилена от содержания добавляемого в процессе приготовления катализаторов селена при конверсиях этана 35 и 93%. Представленные диаграммы на рис. 2а отражают действие промотора на превращения этана и этилена в ходе реакции окислительного дегидрирования по отдельным маршрутам. Видно, что при низкой конверсии этана для всех катализаторов селективность по этилену практически не меняется, что свидетельствует об отсутствии влияния добавок селена на долю продуктов реакции, образующихся непосредственно из этана. Иная картина наблюдается при высокой конверсии этана, то есть когда преобладает последовательный маршрут образования продуктов. Модифицирование селеном сопровождается заметным увеличением селективности по этилену и соответствующим уменьшением селективности по оксидам углерода, что может быть обусловлено подавлением реакции окисления этилена до СОх.
Рис. 2.
а – Зависимость селективности образования этилена от содержания добавленного селена при конверсии Х, равной 35 и 93%; б – зависимость константы скорости общего превращения этана 1-го порядка от содержания введенного селена.
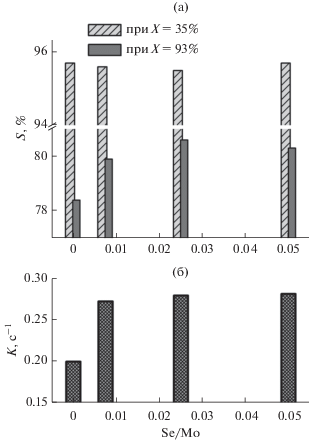
На рис. 2б представлена зависимость константы скорости общего превращения этана от содержания селена. Добавление селена при синтезе катализаторов приводит к заметному росту их активности – константа скорости реакции 1-го порядка возрастает с 0.2 до 0.27–0.28 с–1. Отметим, что, как и в предыдущем случае, величина константы практически не зависит от содержания селена.
Таким образом, селен оказывает положительное влияние на каталитические свойства VMoTeNbO-катализатора, одновременно увеличивая его активность и снижая доокисление этилена. Для достижения наилучших показателей достаточно вводить минимальное количество селена (Se/Mo = 0.0075).
Влияние селена на формирование структуры и состава катализаторов
Поскольку в катализаторах после термообработки при 560°С обнаружить селен не удалось, было дополнительно изучено влияние селена на формирование структуры и состав поверхности образца катализатора на разных стадиях термообработки. Для этого был отдельно приготовлен образец катионного состава Mo1V0.3Nb0.12Te0.23Se0.15 с большим содержанием селена (Se-4). Анализ этого образца методом Ритвельда после термообработки в гелии при 560°С показал, что в его состав входят только фазы М1 и М2. Однако содержание в нем примесной фазы М2 немного выше (12%), чем в образцах Se-1, Se-2 и Se-3 (табл. 1).
Для образца Se-4 методами рентгеновской дифракции и РФЭС было исследовано, как влияет добавка селена на структуру, состав и состояния элементов на различных этапах термообработки. Для сравнения в аналогичных условиях был изучен стандартный катализатор Se-0 (табл. 1).
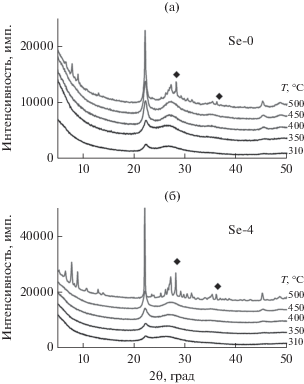
На рис. 3 представлены рентгенограммы образцов Se-0 и Se-4 после прокалки на воздухе при 310°С, а также после термообработки в гелии при температурах 350–500°С. Полученные данные свидетельствуют, что в ходе ступенчатого нагрева в токе гелия структурные трансформации образцов схожи. Появления отдельных фаз, содержащих селен, по ходу нагрева не наблюдалось.
Рис. 3.
Рентгенограммы образцов Se-0 (а) и Se-4 (б) на разных стадиях термообработки: при 310°С на воздухе, при 350, 400, 450 и 500°С в токе гелия. Неотмеченные рефлексы относятся к фазе М1, обозначенные (◆) – к фазе М2.
Структурные превращения в VMoTeNbO-катализаторах при термообработке ранее были исследованы в работах [17, 37, 38]. Попова и соавт. показали [37], что при термообработке VMoNbTeO-катализаторов при температурах ниже 500°C формировались только наноразмерные кристаллиты фазы М1 в аморфной матрице. На рентгенограмме наноразмерной фазы М1 присутствовал рефлекс (001) при 2θ = 22.4° (d = 4.0 Å), а на месте рефлексов (hk0) наблюдалось диффузное рассеяние. Локальная структура наноразмерного домена была близка структуре фазы М1 [38].
Рентгенограммы для образцов Se-0 и Se-4, полученные в настоящей работе (рис. 3а и 3б), характеризуются аналогичной дифракционной картиной – наблюдаются пики на месте рефлексов (001) и (002) фазы М1, а также диффузное рассеяние вместо рефлексов (hk0). Таким образом, учитывая ранее полученные данные [37, 38], можно предположить, что общий характер структурных трансформаций модифицированных селеном образцов аналогичен таковому для стандартного катализатора и включает формирование наноструктурированных кристаллитов.
Существенным отличием образцов Se-0 и Se-4 является то, что степень кристалличности фазы М1 при 500°С в образце Se-4 (70%) выше чем, в образце Se-0 (не более 50%) и при дальнейшем нагревании до 560°С увеличивается до 81%. Кроме того, при 500°С размеры ОКР фазы М1 в образцах существенно отличаются и составляют 14 ± 1 нм для Se-0 и 50 ± 1 нм для Se-4.
Таким образом, присутствие селена в катализаторе способствует процессу кристаллизации фазы М1. В конечном итоге это приводит к повышенной кристалличности образцов после прокалки при 560°С и, следовательно, большей упорядоченности структуры активной фазы.
Состав поверхности для всех изученных образцов в ходе термообработке в гелии, нормированный на общее количество молибдена, приведен в табл. 3. Количество селена в составе прекурсора образца Se-4 после сушки оказалось близким к объемной концентрации (Se/Mo = 0.15), указывая на его равномерное распределение по объему. Спектры Se3d для изученной серии образцов представлены на рис. 4. При термообработке наблюдается уменьшение поверхностной концентрации селена вплоть до значения Se/Mo = 0.006 (в ~25 раз). Выше 450°C присутствие селена на поверхности с помощью метода РФЭС надежно зафиксировать не удалось.
Таблица 3.
Атомные соотношения элементов на поверхности образцов Se-0 и Se-4 на разных стадиях термообработки по данным метода РФЭС
| Образец | Nb/Mo | V/Mo | Te/Mo | Se/Mo | |
|---|---|---|---|---|---|
| Se-0 | Прекурсор | 0.09 | 0.46 | 0.34 | – |
| 310°C (воздух) | 0.09 | 0.24 | 0.30 | – | |
| 350°C (гелий) | 0.09 | 0.30 | 0.29 | – | |
| 400°C (гелий) | 0.09 | 0.28 | 0.30 | – | |
| 450°C (гелий) | 0.10 | 0.29 | 0.31 | – | |
| 500°C (гелий) | 0.10 | 0.28 | 0.31 | – | |
| 560°C (гелий) | 0.11 | 0.27 | 0.37 | – | |
| Se-4 | Прекурсор | 0.09 | 0.33 | 0.36 | 0.158 |
| 310°C (воздух) | 0.09 | 0.30 | 0.30 | 0.129 | |
| 350°C (гелий) | 0.09 | 0.28 | 0.29 | 0.052 | |
| 400°C (гелий) | 0.09 | 0.29 | 0.30 | 0.031 | |
| 450°C (гелий) | 0.09 | 0.29 | 0.31 | 0.006 | |
| 500°C (гелий) | 0.11 | 0.25 | 0.40 | – | |
| 560°C (гелий) | 0.11 | 0.24 | 0.40 | – | |
Рис. 4.
Фотоэлектронные спектры Se3d для образца Se-4 на разных стадиях его приготовления: 1 – исходный прекурсор, 2 – после прокаливания на воздухе при 310°C, 3–7 – после прокаливания в гелии при 350, 400, 450, 500 и 560°C соответственно. Слева представлено разложение некоторых спектров Se3d на индивидуальные компоненты.
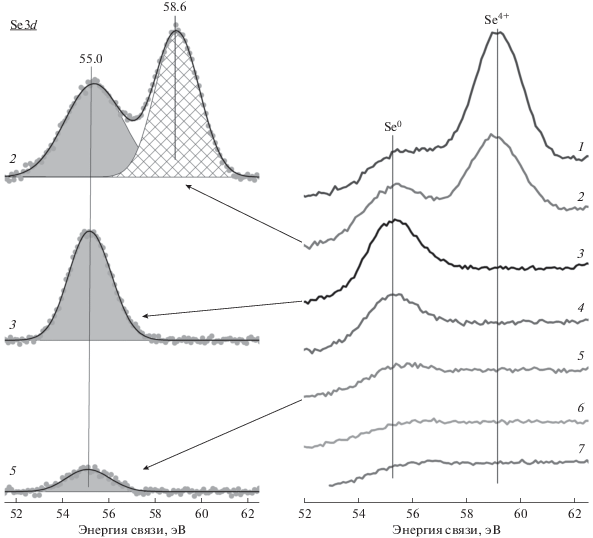
Отметим, что характер изменения соотношений Nb/Mo и Te/Mo в зависимости от температуры прогрева на воздухе и в гелии близок для серий образцов Se-0 и Se-4 (табл. 3). В то же время соотношение Te/Mo меняется немонотонно. Скачкообразный рост наблюдается при 500°С для образца Se-4 и при 550°С для образца Se-0. По данным рентгеновской дифракции (рис. 3) эти температуры соответствовали скачкообразному изменению количества кристаллической фазы М1 в образцах и степени ее кристалличности. В конечном итоге, содержание теллура на поверхности образца Se-4 оказалось несколько выше, чем для Se-0.
Анализ спектров Se3d выявил присутствие на поверхности модифицированных VMoTeNbO-образцов двух форм селена с энергиями связи пика Se3d5/2 близкими к ~55.0 и ~58.6 эВ. На основании литературных данных [29, 39, 40] такие формы могут быть отнесены элементарному (Se0) и окисленному (Se4+) селену соответственно. Соотношения форм селена в зависимости от температуры термообработки представлены в табл. 4. Прокаливание в гелии при 350°C приводит к полному восстановлению Se до элементарного состояния с последующим его удалением с поверхности при температуре выше 450°C.
Таблица 4.
Относительное количество* форм теллура, ванадия, молибдена и селена по данным метода РФЭС на поверхности катализаторов Se-0 и Se-4 на разных стадиях их приготовления
| Образец | Te4+/ Te0, % | V4+/ V5+, % | Mo5+/ Mo6+, % | Se0/ Se4+, % | |
|---|---|---|---|---|---|
| Se-0 | Прекурсор | 100/0 | **13/**87 | 0/100 | – |
| 310°C (воздух) | 100/0 | **44/**56 | 33/67 | – | |
| 350°C (гелий) | 92/8 | 56/44 | 53/47 | – | |
| 400°C (гелий) | 91/9 | 58/42 | 52/48 | – | |
| 450°C (гелий) | 94/6 | 55/45 | 53/47 | – | |
| 500°C (гелий) | 100/0 | 57/43 | 55/45 | – | |
| 560°C (гелий) | 100/0 | 58/42 | 57/43 | – | |
| Se-4 | Прекурсор | 100/0 | **22/**78 | 0/100 | 71/29 |
| 310°C (воздух) | 100/0 | **41/**59 | 42/58 | 59/41 | |
| 350°C (гелий) | 93/7 | 56/44 | 45/55 | 100/0 | |
| 400°C (гелий) | 96/4 | 58/42 | 43/57 | 100/0 | |
| 450°C (гелий) | 100/0 | 53/47 | 44/56 | 100/0 | |
| 500°C (гелий) | 100/0 | 58/42 | 57/43 | – | |
| 560°C (гелий) | 100/0 | 59/41 | 57/43 | – | |
На рис. 5 приведены разложенные на компоненты спектры Te3d5/2 для образцов серий Se-0 и Se-4. В исходном прекурсоре и итоговом VMoTeNbO-катализаторе (после прокаливания при 560°C) наблюдается присутствие теллура только в одном состоянии – с энергией связи (Есв) пика Te3d5/2 вблизи 576.5 эВ, что соответствует окисленной форме Te4+ [22, 41, 42]. Однако в результате термообработки при промежуточных температурах (350–450°C) появляется дополнительная компонента c энергией связи пика Te3d5/2 около 573.5–573.7 эВ (рис. 5). Количество такой компоненты, отнесенной элементарному теллуру – Te0 [29, 39, 43], не превышает 10% от общего содержания теллура на поверхности (табл. 4). Отметим, что модифицирование селеном приводит к уменьшению вклада Te0 при сохранении общего количества теллура в составе образцов (табл. 1).
Рис. 5.
Разложенные на компоненты спектры Te3d5/2 для катализатора Se-4 на разных стадиях его приготовления: 1 – исходный прекурсор, 2 и 3 – после прокаливания в гелии при 350 и 500°C соответственно.
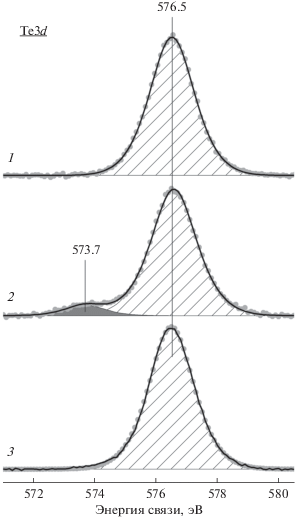
Таким образом, теллур и селен начинают восстанавливаться при промежуточных температурах в ходе термообработки. Надежно установлено, что восстановителем в процессе формирования фазы М1 выступает оксалат-анион, который вводится на стадии синтеза вместе с ниобием [44–46]. Селен восстанавливается легче теллура в соответствии с более высоким стандартным потенциалом восстановления Se4+ по сравнению с Te4+ [47]. При высоких температурах восстановление сопровождается возгонкой элементарных теллура и селена и последующим их удалением с поверхности катализатора. Подробно этот процесс для теллура обсуждался в работе [46]. При этом Se0 удаляется раньше Te0, что коррелирует с температурами их возгонки: 350–400°C для селена и 550–650°C для теллура [47].
На рис. 6 приведены разложенные на компоненты регионы Nb3d, Mo3d и V2p для образца Se-4 после прокаливания в гелии при 500°C. Отметим, что представленное разложение и интерпретация спектров являются типичными для обеих серий стандартных и модифицированных образцов. Так, для всех изученных образцов спектры Nb3d характеризовались присутствием одного состояния ниобия с энергией связи пика Nb3d5/2 в районе 206.9–207.2 эВ. Это состояние соответствует окисленной форме Nb5+ [22, 29, 48].
Рис. 6.
Разложенные на компоненты спектры Nb3d, Mo3d и V2p для катализатора Se-4 после термообработки в гелии при 500°C.
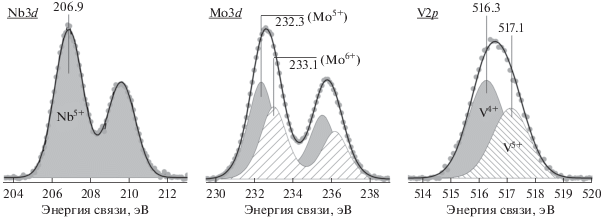
Спектры Mo3d для большинства исследованных катализаторов были разложены на две компоненты со значениями Есв(Mo3d5/2), равными 232.2 ± 0.1 и 233.0 ± 0.2 эВ, которые относятся к формам Mo5+ и Mo6+ соответственно [22, 49]. При анализе региона V2p3/2 проводили разложение спектров на два пика с энергиями связи равными 516.2 ± 0.1 и 517.2 ± 0.1 эВ. Эти пики на основании литературных данных отнесены к формам V4+ и V5+, соответственно [48, 50, 51].
Количественные данные о содержании форм Mo5+, Mo6+, V4+ и V5+ на поверхности изученных VMoNbTeO-катализаторов представлены в табл. 4. В случае стандартного и модифицированного прекурсоров до и после прокаливания на воздухе при 310°C наблюдается интегральный сдвиг V2р-линии в сторону меньших энергий связи по ходу измерения фотоэлектронных спектров. Это указывает на частичное восстановление V5+ под влиянием рентгеновского излучения. Поэтому количество V4+, приведенное для таких образцов в табл. 4 (помечено как **), завышено. Присутствие селена на поверхности способствует сохранению более окисленного состояния молибдена (~55–60% Mo6+) по сравнению со стандартными VMoTeNbO-образцами. При удалении селена при температуре выше 450°C относительное содержание формы Mo6+ уменьшается до ~45%. В то же время методом РФЭС не удалось обнаружить заметного влияния селена на распределение форм V4+ и V5+.
Ранее [22] при исследовании дезактивации VMoTeNbO-катализаторов было обнаружено, что удаление теллура вызывает разрушение активной структуры поверхности и формирование аморфной фазы в образцах. Вероятно, частичное удаление теллура в ходе термообработки затрудняет процесс полной кристаллизации фазы М1. Присутствие селена препятствуют возгонке теллура (табл. 4), что способствует кристаллизации фазы М1. По данным химического анализа объемная концентрация теллура в составе модифицированных селеном VMoTeNbO-катализаторов начинает заметно уменьшаться при прокаливании выше 400°C, когда большая часть селена восстановлена и удалена (табл. 3). Это связано с тем, что стандартный потенциал восстановления Se4+ до Se0 заметно выше, чем для восстановления Те4+ до Те0 [47]. Было показано, что кристаллизация фазы М1 для селенсодержащих образцов происходит при более низкой температуре, чем в случае стандартного VMoTeNbO-катализатора. Это вызвано упорядочением структуры М1 в плоскости ab, что приводит к формированию протяженных 6- и 7-членных каналов [14]. Теллур занимает преимущественно позиции внутри таких каналов, формируя бесконечные цепи Те–О–Те [45, 52]. Количество и длина таких каналов напрямую коррелируют со степенью кристалличности фазы М1. Роль селена заключается в том, что в его присутствии кристаллизация М1 происходит при пониженной, а восстановление и удаление теллура – при повышенной температуре. В таком случае протяженные шести- и семичленные каналы с теллуром внутри успевают сформироваться при более низкой температуре, что впоследствии диффузионно ограничивает удаление теллура из структуры. Это приводит к увеличению концентрации теллура в поверхностной/приповерхностной зоне для модифицированных катализаторов по сравнению со стандартными VMoTeNbO-образцами даже после прокалки при 560°С (табл. 1). Такой вывод подтверждается данными рентгеновской дифракции, на основе которых был найден средний размер кристаллитов М1 – 14 и 50 нм для прокаленных при 500°С образцов Se-0 и Se-4 соответственно. Эти размеры можно напрямую коррелировать с длиной каналов, поскольку их кристаллографическое направление совпадает с направлением роста частиц М1 [38]. При сопоставлении модифицированных селеном и стандартных VMoTeNbO-катализаторов, прокаленных при одинаковой температуре, длина каналов в структуре М1 в среднем выше в случае селенсодержащих образцов. Для каналов большей длины появляются кинетические ограничения для удаления теллура из структуры.
Строение фазы М1 таково, что катионы ванадия и молибдена занимают несколько одинаковых октаэдрических позиций в структуре [15]. Эти позиции разделены между собой пентагональными бипирамидами ниобия NbO7. На поверхности с разной вероятностью, которая связана с заполнением позиций в октаэдрах, могут формироваться как одиночные центры V5+ в окружении молибдена и теллура, так и несколько катионов V5+ в соседних октаэдрах. Статистический анализ, проведенный в работе [47], показал, что разрыв C–H-связи в пропане и образование пропилена должно происходить на центрах, где V5+ изолирован от других ванадиевых центров катионами молибдена. Продукты полного окисления появляются, если два высокозарядных ванадиевых центра находятся рядом. Подобные закономерности должны соблюдаться и для окислительного дегидрирования этана.
В случае разупорядоченной структуры фазы М1, которая остается в образце из-за удаления теллура при термообработке, формирование полимерных ванадиевых центров на поверхности более вероятно, чем на поверхности кристаллической фазы. Действительно, при значительном содержании аморфной фазы в составе образцов наблюдается уменьшение селективности по этилену, как было показано ранее [22]. Таким образом, получение высоко окристаллизованных образцов при модифицировании селеном может способствовать увеличению их селективности при высоких конверсиях этана. Подобный эффект повышения селективности по этилену для фазы М1 при росте ее степени кристалличности наблюдали и Мийе (Millet) с соавт. [11], а также обсуждали Грассели (Grasselli) и др. в работе [53].
Увеличение активности при модифицировании селеном также должно быть связано с образованием большего числа активных центров. Однако метод РФЭС не выявил существенных отличий в распределении форм V5+/V4+. Для модифицированных катализаторов наблюдалось даже пониженное содержание ванадия на поверхности. Это указывает на то, что не все ванадиевые центры, детектируемые методом РФЭС, входят в состав реальных активных структур. Более того, в работе [21] был рассмотрен механизм активации структуры фазы М1 без возрастания содержания ванадия на поверхности. Было показано, что при формировании вакансий в цепочках Te–O–Te происходит перераспределение заряда и формирование реакционноспособных кислородных форм. Вероятно, подобный механизм может возникать и при удалении селена. Подтверждение этой гипотезы требует детальных квантово-химических расчетов и дополнительных исследований. В заключении отметим, что пониженная концентрация ванадия на поверхности образцов с повышенной активностью может свидетельствовать о более равномерном распределении изолированных ванадиевых активных центров на поверхности VMoTeNbO-катализаторов.
ЗАКЛЮЧЕНИЕ
Показано, что добавление селена на стадии смешения исходных растворов при синтезе оксидов VMoTeNbO позволяет получать высокоэффективные катализаторы для реакции окислительного дегидрирования этана. Все катализаторы, в состав которых во время синтеза вводили селен, отличаются большей активностью и селективностью образования этилена при высоких конверсиях этана. Несмотря на то, что селен полностью удаляется из образцов в результате высокотемпературной термообработки, его присутствие оказывает влияние на процесс формирования активной фазы М1.
В представленной работе проведен детальный и систематичный анализ методами РФЭС и рентгеновской дифракции стандартного и модифицированного селеном VMoTeNbО-оксидов на различных стадиях их приготовления: от исходного прекурсора до прокаленного в гелии при 560°C катализатора. Удалось установить эволюцию селена на поверхности модифицированного образца в зависимости от условий и температуры термообработки (табл. 1).
Повышение температуры прокаливания в токе гелия приводит к уменьшению содержания селена в образце вплоть до его полного удаления при 500°С. Это обусловлено восстановлением изначально окисленной формы селена до элементарного состояния, преобладающего на поверхности VMoTeNb-образцов, прокаленных при 350–450°C (рис. 4). При этом распределение форм V4+ и V5+ остается неизменным. Кроме того, присутствие селена на поверхности VMoTeNb-оксидов поддерживает повышенную концентрацию формы Mo6+ и понижает количество элементарного теллура (табл. 4).
Данные рентгеновской дифракции свидетельствуют, что образцы, в состав которых при синтезе вводили селен, отличаются более высокой степенью кристалличности. Исследование образца, промотированного максимальным количеством селена (Se-4), показало, что присутствие селена снижает температуру формирования кристаллической фазы М1 в его составе.
Список литературы
Corma A., Melo F.V., Sauvanaud L., Ortega F. // Catal. Today. 2005. V. 107–108. P. 699.
McFarland E. // Sci. 2012. V. 338. P. 341.
Bondareva V.M., Lazareva E.V., Sobolev V.I. // Russ. J. Appl. Chem. 2018. V. 91. C. 977.
Bondareva V.M., Kardash T.Y., Ishchenko E.V., Sobolev V.I. // Catal. Chem. Petrochem. Ind. 2015. V. 7. C. 104.
Baroi C., Ga A.M., FushimiR. // Catal. Today. 2017. V. 298. P. 138.
Gärtner C.A., VanVeen A.C., LercherJ.A. // ChemCatChem. 2013. V. 5. P. 3196.
Cavani F., Ballarini N., Cericola A. // Catal. Today. 2007. V. 127. P. 113.
Gaffney A.M., Mason O.M. // Catal. Today. 2018. V. 285. P. 159.
Nieto J.M.L., Botella P., Vázquez M.I., Dejoz A. // Chem. Commun. 2002. V. 4. P. 1906.
Ivars F., Botella P., A. Dejoz, Nieto J.M.L., Concepción P., Vázquez M.I. // Top. Catal. 2006. V. 38. P. 59.
Nguyen T.T., Aouine M., Millet J.M.M. // Catal. Commun. 2012. V. 21. P. 22.
Pat. 9937486 B2 USA, 2014.
Ushikubo T., Oshima K., Kayou A., Hatano M. // Stud. Surf. Sci. Catal. 1997. P. 473.
DeSanto P., Buttrey D., Grasselli R.K., Lugmair C.G., Volpe Jr A.F., Toby B.H., Vogt T. // Z. Krist. 2004. V. 219. P. 152
Li X., Buttrey D.J., Blom D.A., Vogt T. // Top. Catal. 2011. V. 54. P. 614.
Biswas P., Woo J., GuliantsV.V. // Catal. Commun. 2010. V. 12. P. 58.
Beato P., Blume A., Girgsdies F., Jentoft R.E., Schlögl R., Timpe O., Trunschke A., Weinberg G., Basher Q., Hamid F.A., Hamid S.B.A., Omar E., Mohd Salim L. // Appl. Catal. A: Gen. 2006. V. 307. P. 137.
Yu J., Xu Y., Guliants V.V. // Top. Catal. 2014. V. 57. P. 1145.
Konya T., Katou T., Murayama T., Ishikawa S., Sadakane M., Buttrey D., Ueda W. // Catal. Sci. Technol. 2013. V. 3. P. 380.
Aouine M., Epicier T., Millet J.-M.M. // ACS Catal. 2016. V. 6. P. 4775.
Zhu Y., Sushko P.V., Melzer D., Jensen E., Kovarik L., Ophus C., Sanchez-sanchez M., Lercher J.A. // J. Am. Chem. Soc. 2017. P. 24.
Ishchenko E.V., Gulyaev R.V., Kardash T.Y., Ishchenko A.V., Gerasimov E.Y., Sobolev V.I., Bondareva V.M. // Appl. Catal. A: Gen. 2017. V. 534. P. 58.
Ishchenko E.V., Kardash T.Y., Gulyaev R.V., Ishchenko A.V., Sobolev V.I., Bondareva V.M. // Appl. Catal. A: Gen. 2016. V. 514. P. 1.
Ishchenko E.V., Andrushkevich T.V., Popova G.Y., Chesalov Y.A., Plyasova L.M., Ishchenko A.V., Kardash T.Y., Dovlitova L.S. // Catal. Ind. 2011. V. 2. P. 291.
Popova G.Y., Andrushkevich T.V., Dovlitova L.S., Aleshina G.A., Chesalov Y.A., Ishenko A.V., Ishenko E.V., Plyasova L.M., Malakhov V.V., Khramov M.I. // Appl. Catal. A: Gen. 2009. V. 353. P. 249.
Svintsitskiy D.A., Kibis L.S., Smirnov D.A., Suboch A.N., Stonkus O.A., Podyacheva O.Y., Boronin A.I., Ismagilov Z.R. //Appl. Surf. Sci. 2018. V. 435. P. 1273.
Свинцицкий Д.А., Кибис Л.С., Стадниченко А.И., Зайковский В.И., Кощеев С.В., Боронин А.И. // Кинетика и катализ. 2013. Т. 54. № 4. С. 524.
Svintsitskiy D.A., Slavinskaya E.M., Kardash T.Y., Avdeev V.I., Senkovskiy B.V., Koscheev S.V., Boronin A.I. // Appl. Catal. A: Gen. 2016. V. 510. P. 64.
Moulder K.D.B. J.F., Stickle W.F., Sobol P.E. Handbook of X-ray photoelectron spectroscopy. Perkin-Elmer Corp, Eden Prairie, Minnesota, USA, 1992.
Kolenko Y.V., Zhang W., Girgsdies F., Hansen T.W., Wolfram T., Schlögl R., Trunschke A. // ChemCatChem. 2011. V. 3. P. 1597.
Botella P., Dejoz A., Abello M.C., Vázquez M.I., Arrúa L., Nieto J.M.L. // Catal. Today. 2009. V. 142. P. 272.
Deniau B., Bergeret G., Jouguet B., Dubois J.L., Millet J.M.M. // Top. Catal. 2008. V. 50. P. 33.
Nguyen T.T., Deniau B., Delichere P., Millet J.-M.M. // Top. Catal. 2014. V. 57. P. 1152
Botella P., García-González E., Dejoz A., Nieto J.M.L., Vazquez M., Gonzalez-Calbet J. // J. Catal. 2004. V. 225. P. 428.
Bondareva V., Shadrina L., Ovchinnikova E., SobolevV. Ethane oxidative dehydrogenation. Reaction kinetics., in: XXI Int. Conf. Chem. React. CHEMREACTOR-21, Delft, the Netherlands, 2014. P. 14.
Безденежных А.А. Инженерные методы составления уравнений скоростей реакций и расчета кинетических констант. Л.: Химия. 1973. 256 с.
Popova G.Y., Andrushkevich T.V., Chesalov Y.A., Plyasova L.M., Dovlitova L.S., Ischenko E.V., Aleshina G.I., Khramov M.I. // Catal. Today. 2009. V. 144. P. 312.
Kardash T.Y., Lazareva E.V., Svintsitskiy D.A., Ishchenko A.V., Bondareva V.M., Neder R.B. // RSC Adv. 2018. V. 8. P. 35903.
Wagner C.J.R. C.D., Naumkin A.V., Kraut-Vass A., Allison J.W., Powell. C.J. NIST X-ray Photoelectron Spectroscopy Database. 2003.
Iwakuro H., Tatsuyama C., Shoji K. // Jpn. J. Appl. Phys. 1982. V. 21. P. 94.
Concepción P., Hernández S., Nieto J.M.L. // Appl. Catal. A: Gen. 2011. V. 391. P. 92.
Mekki A., Khattak G.D., Wenger L.E. // J. Non. Cryst. Solids. 2006. V. 352. P. 3326.
Berchenko N., Vitchev R., Trzyna M., Wojnarowska-Nowak R., Szczerbakow A., Badyla A., Cebulski J., Story T. // Appl. Surf. Sci. 2018. V. 452. P. 134.
Botella P., Concepción P., Nieto J.M.L., Moreno Y. // Catal. Today. 2005. V. 99. P. 51.
Valente J., Armendáriz-Herrera H., Quintana-Solórzano R., del Ángel P., Nava N., Masso A., Nieto J.M.L. // ACS Catal. 2014. V. 4. P. 1292.
Ivars F., Botella P., Dejoz A., Nieto J.M.L., Concepción P., Vázquez M.I. // Top. Catal. 2006. V. 38. P. 59.
Лебедь А.Б., Набойченко С.С., Шунин В.А. Производство селена и теллура на ОАО “Уралэлектромедь”, Издательство Уральского университета, Екатеринбург, 2015. 112 с.
Asakura K., Nakatani K., Kubota T., Iwasawa Y. // J. Catal. 2000. V. 194. P. 309.
Sanfiz A.C., Hansen T.W., Teschner D., Schnörch P., Girgsdies F., Trunschke A., Schlögl R., Looi M.H., Sharifah B.A.H. // J. Phys. Chem. C. 2010. V. 114. P. 1912.
Hävecker M., Wrabetz S., Kröhnert J., Csepei L.I., NaumannD’Alnoncourt R., Kolen’ko Y.V., Girgsdies F., Schlögl R., Trunschke A. // J. Catal. 2012. V. 285. P. 48.
Trunschke A., Noack J., Trojanov S., Girgsdies F., Lunkenbein T., Pfeifer V., Hävecker M., Kube P., Sprung C., Rosowski F., SchlöglR. // ACS Catal. 2017. V. 7. P. 3061.
Millet J.M.M., Roussel H., Pigamo A., Dubois J.L., Jumas J.C. // Appl. Catal. A: Gen. 2002. V. 232. P. 77.
Grasselli R.K., Volpe A.F. // Top. Catal. 2014. V. 57. P. 1124.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


