Кинетика и катализ, 2019, T. 60, № 3, стр. 334-338
О взаимной растворимости компонентов каталитической системы Pt–Au в частицах субмикронного размера
А. В. Шишулин 1, *, В. Б. Федосеев 1
1 ФГБУН Институт металлорганической химии им. Г.А. Разуваева РАН
603137 Нижний Новгород, ул. Тропинина, 49, Россия
* E-mail: chichouline_alex@live.ru
Поступила в редакцию 13.11.2018
После доработки 29.01.2019
Принята к публикации 04.02.2019
Аннотация
Равновесный фазовый состав частиц расслаивающихся твердых растворов является одним из параметров, определяющих их каталитическую активность. В работе методами равновесной химической термодинамики рассмотрено влияние геометрических факторов на фазовые равновесия в частицах субмикронного размера с конфигурацией core–shell расслаивающейся системы Pt–Au. Форма и объем частицы были заданы величинами эффективного радиуса и фрактальной размерности и использованы в качестве параметров расчета. Получены зависимости взаимных растворимостей компонентов как функции объема и формы частиц субмикронного размера и показано существенное изменение области составов устойчивых твердых растворов в частицах различной формы.
Частицы системы Pt–Au являются эффективными гетерогенными катализаторами и электрокатализаторами для широкого спектра органических реакций [1–5]. Значительная практическая и фундаментальная важность исследования их каталитических свойств связана с их применением в “зеленой химии” [2], при создании экологически чистых топливных элементов [3, 4], а также каталитической очистке вод [5]. Компоненты данной системы ограниченно взаимно растворимы в твердом состоянии и образуют непрерывный ряд твердых растворов лишь при температурах выше ~1500 К [6]. Как было показано [2], распад твердого раствора Pt–Au в частицах малого объема в большинстве случаев сопровождается образованием структуры core–shell.
Использование частиц катализатора субмикронного и нанометрового размеров позволяет достичь более высокой каталитической активности (КА) преимущественно за счет значительной удельной поверхности катализатора, а также ряда других факторов [7]. Однако при прогнозировании и анализе каталитических свойств наночастиц расслаивающихся твердых растворов необходимо принимать во внимание ряд следующих особенностей.
С одной стороны, КА может являться нелинейной функцией состава частицы с одним или несколькими выраженными максимумами. Например, как показано в [1], КА наночастиц пересыщенного (термодинамически неустойчивого) при комнатной температуре твердого раствора состава AuxPt1 –x (0 < x < 0.2) в реакциях гидрирования эвгенола и нитробензола имеет ярко выраженный максимум при x ≈ 0.1, где КА вдвое превышает активность чистой Pt, и падает при дальнейшем росте x. В случае образования в частице структуры core–shell следует ожидать подобного же вида зависимостей КА от состава shell-фазы.
С другой стороны, при фазовых превращениях в системах субмикронного и нанометрового размеров проявляются размерные эффекты [8–11] и эффекты формы [12–14]. Сущность данных эффектов состоит во влиянии размера частицы и геометрической конфигурации всех ее межфазных границ на взаимную растворимость компонентов, число и отношение объемов сосуществующих стабильных и метастабильных фаз, а также на температуры фазовых переходов. Графически эти эффекты проявляются на фазовых диаграммах как значительные сдвиги характеристических точек и сдвиг и деформация характеристических линий по сравнению с “табличными” диаграммами для систем макроскопического размера.
Размерные эффекты и эффекты формы в расслаивающихся системах приводят к изменению и расширению области термодинамически устойчивых составов растворов. При этом следует ожидать, что растворы, подобные описанным в работе [1], термодинамически неравновесные в системах макроскопического размера и обладающие повышенной КА, могут становиться устойчивыми в частицах определенного размера и формы.
В настоящем сообщении методами равновесной химической термодинамики рассмотрено влияние размера и формы core–shell-частиц субмикронного размера каталитической системы Pt–Au на взаимную растворимость и определяющий каталитические свойства равновесный состав сосуществующих фаз.
ОБЪЕКТ И МЕТОДИКА МОДЕЛИРОВАНИЯ
В качестве объекта моделирования рассмотрим несферические наночастицы системы Pt–Au эквиатомного состава при температуре 298.15 K. Предположим, что расслаивание приводит к образованию в наночастице единичного включения твердого раствора сферической формы (core-фаза), окруженного слоем другого состава (shell-фазой). Для описания формы наночастицы (аналогично [14]) введем коэффициент формы k, равный отношению площади поверхности рассматриваемой фигуры A к площади сферы равного объема A0, k = A/A0. Радиус сферы, чей объем равен объему рассматриваемой частицы, далее будем называть эффективным радиусом частицы rэф. Геометрические характеристики структуры core–shell описываются уравнениями:
(1)
$\begin{gathered} {{V}_{j}} = \sum {{{n}_{{ij}}}{{V}_{i}}} ,\,\,\,\,{{A}_{{\text{c}}}} = 4{\pi }{{\left( {\frac{3}{{4{\pi }}}{{V}_{{\text{c}}}}} \right)}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}, \\ {{A}_{{\text{s}}}} = 4{\pi }kr_{{{\text{э ф }}}}^{2}, \\ \end{gathered} $Условия сохранения вещества при фазовом превращении в закрытой двухкомпонентной системе связывают эффективный радиус частицы rэф, суммарное количество вещества в системе n, число молей каждого из компонентов ni и концентрации xij компонентов i в фазах j. Они имеют вид
(2)
$\begin{gathered} \frac{4}{3}{\pi }r_{{{\text{э ф }}}}^{3} = {{n}_{1}}{{V}_{1}} + {{n}_{2}}{{V}_{2}},\,\,\,\,{{n}_{1}} = {{n}_{2}} = 0.5n{\text{,}} \\ {{n}_{i}} = {{n}_{{i{\text{c}}}}} + {{n}_{{i{\text{s}}}}},\,\,\,\,{{x}_{{ij}}} = \frac{{{{n}_{{ij}}}}}{{{{n}_{{1j}}} + {{n}_{{2j}}}}}. \\ \end{gathered} $Критерием равновесного состояния системы является минимум функции Гиббса с учетом энергетического вклада всех границ раздела
(3)
$\begin{gathered} g = \left( {{{n}_{{1{\text{c}}}}} + {{n}_{{2{\text{c}}}}}} \right)G\left( {{{x}_{{1{\text{c}}}}},T} \right) + \\ + \,\,\left( {{{n}_{{1{\text{s}}}}} + {{n}_{{2{\text{s}}}}}} \right)G\left( {{{x}_{{1{\text{s}}}}},T} \right) + {{\sigma }_{{\text{s}}}}{{A}_{{\text{s}}}} + {{\sigma }_{{{\text{cs}}}}}{{A}_{{\text{c}}}}, \\ \end{gathered} $Функция Гиббса системы Pt–Au в области твердых растворов получена в рамках полиномиальной модели Риддлиха–Кистера [6]:
(4)
$\begin{gathered} G(x,T) = RT(x\ln x + (1 - x)ln(1 - x)) + \\ + \,\,x(1 - x){{\sum\limits_i {{{L}_{i}}(2x - 1)} }^{i}},\,\,\,\,{{L}_{i}} = {{A}_{i}} + {{B}_{i}}T, \\ \end{gathered} $В отсутствие надежных теоретических и экспериментальных данных о поверхностных энергиях твердых растворов величину σcs вычисляли как
Подобное приближение было использовано в работах [10, 14]. Для вычисления σ(x) использовали линейную аппроксимацию ${\sigma }(x) = {{{\sigma }}_{2}}(1 - x) + {{{\sigma }}_{1}}x,$ где ${{{\sigma }}_{1}}$ и ${{{\sigma }}_{2}}$ – поверхностные энергии чистых компонентов. Температурные зависимости поверхностных энергий чистых Au и Pt приведены в обзоре [15], и при T = 298.15 K их величины составляют ${{{\sigma }}_{1}}$ = 1.298 Дж/м2 и ${{{\sigma }}_{2}}$ = 2.189 Дж/м2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Высокими значениями коэффициента формы k обладают простые геометрические структуры несферической конфигурации, например, для тетраэдра k = 1.49, для конуса k = 1.52, для прямоугольной пластины с отношением сторон 1 : 1 : 0.06 k = 3.00, для звездчатого икосаэдра (икосаэдра, на каждой грани которого расположен тетраэдр) k = = 3.20. (Следует отметить, однако, что подход, основанный на механическом переборе простых геометрических конфигураций, к которому прибегают авторы работ [12, 13, 16], едва ли следует считать удачным.) Помимо этого, высокие k характерны для вискеро- и дендритоподобных частиц [3, 17], а также частиц нерегулярной формы, для описания морфологии которых воспользуемся методами фрактальной геометрии [18, 19].
Форма частиц характеризуется величиной фрактальной размерности D, задающей связь площади поверхности и объема As = CV 2/D, где C – коэффициент, согласующий размерности, полагаемый численно равным $4{\pi }$ в дальнейших расчетах. Для простых геометрических структур D = 3.00, для структур с более сложной морфологией, примеры которых приведены на рис. 1а, фрактальная размерность D < 3.00 и может не являться целым числом. Следует отметить, что фрактальная геометрия, используя в качестве параметра соотношение площади поверхности и объема (ключевой параметр в термодинамике наноструктур [8–14, 19]), является одним из наиболее общих и удобных методов для описания формы максимально широкого класса геометрических объектов от достаточно простых архимедовых многогранников и пластин [20], многогранников нерегулярной формы [21] до нанотрубок, вискеров, дендритоподобных объектов [17] и структур, подобных изображенным на рис. 1б. В рамках данного подхода коэффициент формы является функцией объема и фрактальной размерности частицы:
(5)
$k\left( {V,D} \right) = \frac{C}{{4{\pi }}}\frac{{{{V}^{{{2 \mathord{\left/ {\vphantom {2 D}} \right. \kern-0em} D}}}}}}{{{{{\left( {{{3V} \mathord{\left/ {\vphantom {{3V} {4{\pi }}}} \right. \kern-0em} {4{\pi }}}} \right)}}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}}}.$Рис. 1.
Зависимость коэффициента формы частицы от ее фрактальной размерности (а) и примеры фрактальных структур с D = 2.95 (б, верхний ряд) и D = 2.90 (б, нижний ряд) при различных значениях rэф, нм: ▲ – 300, ◼ – 250, ⚫ – 200 и ◆ – 150.
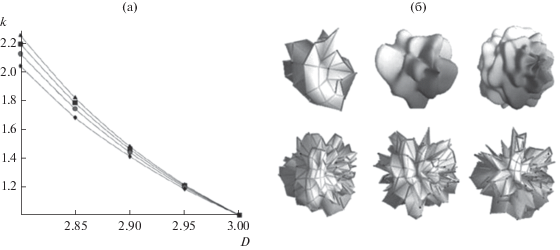
Данная зависимость проиллюстрирована на рис. 1а, где приведены коэффициенты формы частицы как функции фрактальной размерности для четырех различных эффективных радиусов. На рис. 1б приведены примеры частиц с D = 2.95 и D = 2.90. Детальное изложение алгоритма построения геометрических структур различной фрактальной размерности и большее число примеров таковых могут быть найдены в [18].
Функция Гиббса для core–shell-структуры (3) обладает двумя минимумами, соответствующими гетерогенным состояниям с различным взаимным расположением сосуществующих твердых растворов. В системе субмикронного размера равновесные составы и объемы сосуществующих фаз в этих двух состояниях отличаются от справочных значений для макросистем, различаются между собой и зависят от объема и формы наночастицы [10, 14, 19]. Равновесный состав сосуществующих фаз находится минимизацией функции Гиббса системы, описываемой уравнением (3), эффективный радиус и фрактальная размерность наночастицы являются параметрами расчета. Полученные на основе этих расчетов зависимости взаимных растворимостей компонентов от размера и формы наночастицы при T = 298.15 K представлены на рис. 2. Основные закономерности таковы.
Рис. 2.
Зависимости растворимости х от эффективного радиуса частицы и ее фрактальной размерности: а – Pt в Au для состояния, где shell-фаза образована раствором на основе Au; б – Au в Pt для состояния, где shell-фаза образована раствором на основе Pt (при различных значениях rэф, нм: ▲ – 300, ■ – 250, ⚫ – 200 и ♦ – 150).
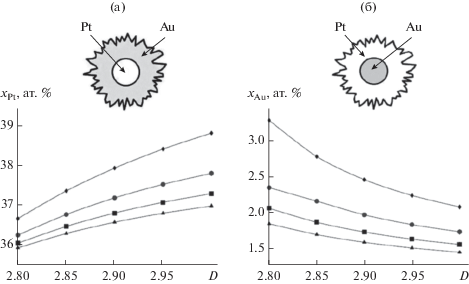
1) Для состояния, где shell-фаза представлена твердым раствором на основе золота, усложнение формы (уменьшение D) сопровождается снижением растворимости платины в золоте (см. рис. 2a). Для частиц, чей эффективный радиус составляет, к примеру, 150 нм, растворимость падает с ~38.8 ат. % при D = 3.00 до ~36.7 ат. % при D = = 2.80. Растворимость же золота в платине при уменьшении фрактальной размерности для данного состояния незначительно возрастает (~1 ат. %), а доля объема, занимаемого core-фазой, растет с ~17.5% при D = 3.00 до ~20.1% при D = 2.80.
2) Для состояния с shell-фазой на основе платины при уменьшении фрактальной размерности происходит рост растворимости золота в платине (см. рис. 2б). При этом для частицы с эффективным радиусом 150 нм растворимость растет с ~2 ат. % (при D = 3.00) до ~3.3 ат. % (при D = 2.80), т.е. в 1.65 раза. В свою очередь, растворимость платины в золоте незначительно снижается (~1 ат. %), как и доля объема, занимаемого core-фазой (также на ~1%).
Двухфазная система со структурой core–shell способна понизить вклад поверхностной энергии путем межфазного перераспределения компонентов, сопровождающегося повышением концентрации компонента с бόльшим мольным объемом в shell-фазе (уменьшением суммарной протяженности границ раздела) и/или повышением концентрации компонента с меньшей поверхностной энергией в shell-фазе (уменьшением поверхностной энергии внешней границы) [22]. В рассматриваемой системе золото имеет одновременно больший, чем у платины мольный объем и меньшую поверхностную энергию, что приводит к повышению равновесной концентрации золота в shell-фазе в обоих состояниях. При этом достигнутое понижение поверхностной энергии в состоянии c shell-фазой на основе Au компенсирует рост внутренней межфазной границы, связанной с увеличением доли объема, занимаемой core-фазой.
Дальнейшее уменьшение радиуса частиц приводит к бóльшим величинам отклонения равновесных фазовых составов от их макроскопических значений. Например, для сферических частиц с радиусом менее 100 нм в состоянии с shell-фазой на основе платины растворимость Au в Pt приближается к 2.5 ат. % по сравнению с ~1.5 ат. % для частиц с радиусом 300 нм. При этом зависимости растворимостей от размера и формы всюду остаются монотонными с сохранением изложенных выше тенденций (расчеты не дают основания ожидать экстремального характера зависимостей растворимости от геометрических факторов, подобного описанному в публикации [22]).
При уменьшении размера частиц проявляется еще один интересный эффект. Для частиц с эффективным радиусом менее 100 нм характерно наличие наряду с двумя гетерогенными третьего равновесного состояния – гомогенного, отвечающего отсутствию внутренней межфазной границы (x1c = x2c = 0). Возможность такого состояния также объясняется одним из возможных путей понижения наносистемой вклада поверхностной энергии – подавлением расслаивания и нахождением в пересыщенном состоянии без образования core–shell-границы. Этот эффект, полученный нами ранее и для ряда других расслаивающихся в твердом состоянии систем [14, 19, 23], свидетельствует о теоретической возможности получения гомогенных во всей области составов частиц расслаивающихся растворов при температурах существенно ниже “табличной” верхней критической температуры расслаивания для макросистем.
Следует отметить, что для состояния с shell-фазой на основе Pt повышение растворимости золота при увеличении коэффициента формы k (уменьшении D) позволяет ожидать, согласно результатам [1], существенного повышения КА в рассмотренных в данной работе химических превращениях. Как уже отмечалось выше, высокие значения k, характерные для структур сложной морфологии (рис. 1б), могут быть реализованы и, например, в протяженных в одном направлении частицах. Величина k = 2.25, соответствующая частице с rэф = 300 нм и D = 2.80, также отвечает, скажем, “вытянутому” эллипсоиду вращения с отношением осей a/b > 5 и “сплюснутому” эллипсоиду вращения с отношением осей a/b > 3. Это позволяет ожидать вызванного изменением равновесного состава приповерхностной фазы повышения КА и, например, в протяженных в одном или двух направлениях частицах. Адсорбция реагирующих компонентов (в частности, водорода в реакциях гидрирования [1]) в приповерхностном слое наночастиц катализатора способна вызвать существенное уменьшение поверхностных энергий твердых растворов на внешней (shell) границе раздела, однако изложенные выше тенденции сохраняются даже при падении величин поверхностных энергий более чем на 50%. (Более подробный анализ влияния поверхностной энергии внешней границы core–shell-наночастиц на состав сосуществующих фаз приведен в публикации [24].)
Таким образом, при рассмотрении каталитических свойств наночастиц расслаивающихся растворов наряду с зависимостями величин удельной поверхности, числа активных центров катализа и т.д. [25], монотонно растущими с уменьшением размера и усложнением формы, необходим также учет влияния геометрических фактов на равновесный фазовый состав частиц. В ряде органических реакций [1, 2] зависимость каталитической активности частиц от их фазового состава может иметь сложный характер с одним или множественными экстремумами, что может привести к задаче о поиске оптимальных геометрических характеристик наночастиц катализатора.
БЛАГОДАРНОСТИ И ФИНАНСИРОВАНИЕ РАБОТЫ
Термодинамические основания модели разработаны В.Б. Федосеевым при поддержке Российского научного фонда (проект № 15-03-00137-П). Модельные расчеты с применением методов фрактальной геометрии выполнены А.В. Шишулиным в соответствии с государственным заданием ИМХ РАН, а также при поддержке РФФИ (проект № 18-08-01356А).
Список литературы
Mallát T., Petró J. // Appl. Catal. 1982. V. 4. P. 257.
Zhang H., Toshima N. // J. Colloid Interface Sci. 2013. V. 394. P. 166.
Xu H., Yan B., Li S., Wang J., Wang C., Guo J., Du Y. // Chem. Eng. J. 2018. V. 334. P. 2638.
Guo C., Zhang M., Tian H., Wang T., Hu J. // J. Electrochem. Soc. 2013. V. 160. № 11. P. 1187.
Каталитические, сорбционные, микробиологические и интегрированные методы для защиты и ремедиации окружающей среды / Под ред. Таран О.П., Пармона В.Н. Новосибирск: Изд-во СО РАН, 2013. 298 с.
Xiao-ning X., Yu-ping R., Chang-fa L., Song L., Gao-wu Q. // Trans. Nonferrous Met. Soc. China. 2012. V. 22. P. 1432.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. № 2. С. 167.
Monji F., Jabbareh M.A. // CALPHAD. 2017. V. 58. P. 1.
Федосеев В.Б., Шишулин А.В., Титаева Е.К., Федосеева Е.Н. // ФТТ. 2016. Т. 58. № 10. С. 2020.
Шишулин А.В., Федосеев В.Б. // Неорган. материалы. 2018. Т. 54. № 6. С. 574.
Шишулин А.В., Федосеев В.Б. // Неорган. материалы. 2019. Т. 55. № 6. С. 70.
Guisbiers G., Mendoza-Pérez R., Bazán-Díaz L., Mendoza-Cruz R., Velázquez-Salazar J.J., Yakamán M.J. // J. Phys. Chem. 2017. V. 121. № 12. P. 6930.
Cui M., Lu H., Jiang H., Cao Z., Meng X. // Sci. Rep. 2017. № 7. P. 1.
Федосеев В.Б., Шишулин А.В. // ФТТ. 2018. Т. 60. № 7. С. 1382.
Keene B.J. // Int. Mater. Rev. 1993. V. 38. № 4. P. 157.
Mori T., Hegmann T. // J. Nanopart. Res. V. 18. № 10. P. 295.
Bimetallic Nanostructures: Shape-Controlled Synthesis for Catalysis, Plasmonics and Sensing Applications / Ed. Zhang Y.-W. Wileyandsons: Hoboken, 2018. 514 p.
Федосеев В.Б. // Письма о материалах. 2012. Т. 2. С. 78.
Шишулин А.В., Федосеев В.Б., Шишулина А.В. // ЖТФ. 2019. Т. 89. № 4. С. 556.
Cuenya B.R. // Thin Solid Films. 2010. V. 518. № 12. P. 3127.
Машковский И.С., Марков П.В., Брагина Г.О., Баева Г.Н., Бухтияров А.В., Просвирин И.П., Бухтияров В.И., Стахеев А.Ю. // Кинетика и катализ. 2017. Т. 58. № 4. С. 499.
Shishulin A.V., Fedoseev V.B. // J. Mol. Liq. 2019. V. 278. P. 363.
Shishulin A.V., Potapov A.A., Fedoseev V.B. Advances in Artificial Systems for Medicine and Education II / Eds. Hu Z., Petoukhov S., He M. Springer: Cham, 2019. P. 377.
Шишулин А.В., Федосеев В.Б., Шишулина А.В. // Бутлеров. сообщ. 2017. Т. 51. № 7. С. 31.
Крылов О.В. Гетерогенный катализ. М.: Академкнига, 2004. 679 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


