Кинетика и катализ, 2019, T. 60, № 3, стр. 388-393
Гидротермальный синтез платина-хромовых катализаторов окисления на металлических носителях
Е. Н. Тупикова 1, *, И. А. Платонов 1, Д. С. Хабарова 1
1 Самарский национальный исследовательский университет им. академика С.П. Королева
443076 Самара, Московское шоссе, 34, Россия
* E-mail: nil-6ssau@mail.ru
Поступила в редакцию 20.09.2018
После доработки 10.01.2019
Принята к публикации 22.01.2019
Аннотация
С использованием реакций гидротермального разложения комплексов [Pt(NH3)4]CrO4 и [Cr(NH3)5Cl][PtCl4] получены катализаторы, содержащие высокодисперсные частицы металлической платины в матрице оксидов хрома с различной степенью окисления, на металлических носителях. В качестве металлических носителей использовали сплавы Х18Н10Т и Х20Н80 в виде стружки или блока из “металлорезины”. Свойства катализаторов изучены в модельных реакциях полного окисления пропана и н-гексана.
В настоящее время множество работ направленно на получение и исследование многокомпонентных каталитических систем, включающих благородный и цветной металлы. Такие каталитические системы исследуются в качестве катодов топливных элементов [1–8], в процессах очистки водорода от примеси угарного газа [9, 10], разложения пероксида водорода [11], окисления спиртов [12] и CO [13].
Как правило, нанесенные катализаторы получают методом пропитки. В его основе лежит сорбция пористым носителем соединения-предшественника из раствора, с последующей сушкой и прокаливанием, в ходе чего протекают твердофазные превращения на поверхности носителя. В ряде публикаций отмечается перспективность использования в качестве соединений-предшественников двойных комплексных солей (ДКС) благородных и цветных металлов [9–11, 13, 14], термолиз которых, в зависимости от состава атмосферы, приводит к образованию полиметаллических или смешанных оксидно-металлических фаз [15–17]. Однако процесс получения катализаторов этим методом является длительным, многостадийным и требует применения материалов с большой сорбционной емкостью. К его недостаткам можно отнести также образование побочных токсичных газообразных продуктов, что требует проведения дополнительных природоохранных мероприятий.
Превращение соединений-предшественников в конечные каталитические фазы в гидротермальных условиях в автоклавах позволяет избежать указанных недостатков. Известно, что в автоклавных условиях некоторые простые комплексы платиновых металлов превращаются в дисперсные металлические фазы [18, 19]. Например, в щелочной среде внутрисферный аммиак необратимо восстанавливает платиновые металлы из их аммиакатов. При внесении в раствор какого-либо твердого материала, способного выполнять функцию носителя катализатора, происходит одновременное формирование каталитических фаз и осаждение их на поверхность, что упрощает процесс и сокращает время приготовления катализатора. При этом в качестве носителя можно использовать сорбционно-инертные материалы, такие как металлы и их сплавы, что позволяет изготавливать термостабильные, механически прочные катализаторы практически любой геометрической формы. Полученные таким образом катализаторы [20] с различными комбинациями платиновых металлов являются весьма эффективными в процессах полного окисления органических соединений и гидрирования ненасыщенных углеводородов.
Однако в процессе выделения твердой фазы из раствора, включающего стадии гомогенного зародышеобразования, которые служат центрами кристаллизации, и гетерогенной стадии роста частиц, возможно образование довольно крупных агломератов платиновых металлов. Сочетание в исходном соединении платинового и цветного металлов в автоклавных условиях может привести к образованию многофазного порошка, состоящего из металлической платины и оксидов цветного металла, выступающих в качестве “микрореактора”, стенки которого будут ограничивать рост платиновых частиц. Оксиды цветных металлов в составе получаемого из этих соединений катализатора могут выступать как структурообразующие или активирующие промоторы. Поэтому требуется поиск и исследование подходящих для этих целей комплексных соединений.
Изучение поведения двойных комплексов [Ni(NH3)6][PtCl4] и [Co(NH3)5Cl][PtCl4] в гидротермальных условиях [21, 22] показало, что из комплекса, содержащего аммиакат никеля, образуется пористая матрица оксида никеля, включающая частицы металлической платины, тогда как из [Co(NH3)5Cl][PtCl4] формируются довольно крупные частицы оксида кобальта, на поверхности которых восстанавливается платина. При этом на катализаторах, полученных из [Ni(NH3)6][PtCl4], наблюдается более высокая конверсия пропана в реакции его полного окисления, чем на катализаторах из [Co(NH3)5Cl][PtCl4]. Разложение в автоклавных условиях комплекса [Pt(NH3)4]CrO4 приводит к образованию высокодисперсного порошка, состоящего из однородных частиц, включающих платину предположительно в металлическом состоянии и оксиды хрома переменной валентности (CrxOy) [23].
Целью данной работы было получение нанесенных платина-хромовых катализаторов путем гидротермального разложения комплексов тетрахлороплатинат(II)хлоропентаамминхрома(III) [Cr(NH3)5Cl][PtCl4] и хромата тетраамминплатины(II) [Pt(NH3)4]CrO4 и провести сравнительное исследование их свойств в реакциях полного окисления углеводородов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений
Комплексы K2[PtCl4], [Pt(NH3)4]Cl2 · H2O и [Cr(NH3)5Cl]Cl2 синтезировали из платиновой черни (99.99%) и K2Cr2O7 (“х. ч.”) путем последовательных реакций по известным методикам [24, 25].
Комплексы, используемые в качестве соединений-предшественников, синтезировали реакцией ионного обмена. Хромат тетраамминплатины(II) осаждали из раствора хлорида тетраамминплатины(II) раствором K2CrO4 (“х. ч.”), взятым с избытком 2% от стехиометрического количества. Двойной комплекс тетрахлороплатинат(II)хлоропентамминхрома(III) получали смешением растворов хлороплатината калия и избытка хлорида хлоропентамминхрома(III).
ИК-спектры синтезированных комплексов регистрировали на ИК-Фурье-спектрометре Nicolet iS50 (“Thermo Fisher Scientific”, США).
ИК-спектр [Pt(NH3)4]CrO4: 3110, 3006 (${{\nu }_{{{\text{N}}{{{\text{H}}}_{3}}}}}$), 1600 ($\delta {{{\text{a}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$), 1316 ($\delta {{{\text{s}}}_{{{\text{N}}{{{\text{H}}}_{3}}}}}$), 849, 803 ($\rho {{{\text{r}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$).
ИК-спектр [Cr(NH3)5Cl][PtCl4]: 3217 (${{\nu }_{{{\text{N}}{{{\text{H}}}_{3}}}}}$), 3153 ($\nu {{{\text{s}}}_{{{\text{N}}{{{\text{H}}}_{3}}}}}$), 1593 ($\delta {{{\text{a}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$), 1279, 1300, 1309, 1341 ($\delta {{{\text{s}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$), 742 ($\rho {{{\text{r}}}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$), 312, 320 (νPtCl), 260(νCrCl).
Металлические носители
Носители для катализаторов изготавливали из нержавеющей стали (НС) марки Х18Н10Т или нихрома (НХ) марки Х20Н80 в виде блоков цилиндрической формы высотой 20 мм и диаметром 9 мм путем холодного прессования специальным образом уложенной проволочной спирали. Объемная доля пустот в полученном таким образом материале, так называемой “металлорезине” (МР) [26], была равна 0.8. Также использовали дробленую стружку, полученную на токарном станке, из нержавеющей стали той же марки.
Для увеличения поверхности металлического материала и лучшего сцепления с ней наносимых каталитических фаз создавали дополнительный оксидный слой путем окисления на воздухе при температуре 450°С (НС) или 700°С (НХ).
Приготовление катализаторов
Во фторопластовый вкладыш помещали металлический носитель и раствор соответствующего комплекса ([Cr(NH3)5Cl][PtCl4], [Pt(NH3)4]CrO4 или [Pt(NH3)4]Cl2 · H2O). Навеску комплекса рассчитывали таким образом, чтобы масса платины составляла 0.1% от массы носителя. При этом концентрация комплексной соли в растворе не превышала 0.7 ммоль/л. Для разложения [Cr(NH3)5Cl][PtCl4] и [Pt(NH3)4]Cl2 в раствор добавляли KOH до pH 8–9. Раствор деаэрировали путем вакуумирования в течение 1 ч с последующим насыщением азотом. Автоклав герметизировали, нагревали при перемешивании до 190°C и выдерживали при данной температуре в течение 150 мин. После охлаждения автоклав вскрывали, полученный катализатор отфильтровывали, промывали дистиллированной водой и сушили при комнатной температуре.
Каталитические испытания
Каталитические свойства полученных катализаторов исследовали в реакциях полного окисления пропана и н-гексана на проточной установке с анализом реакционной смеси газохроматографическим методом (ГХ) на хроматографе Кристалл 2000 М (Россия) с пламенно-ионизационным детектором (стальная колонка, сорбент Al2O3).
Содержание пропана в смеси составляло 0.04 об. %, соотношение пропана и кислорода соответствовало стехиометрическому (скорость подачи реакционной смеси 5000 ч–1).
Концентрация н-гексана в смеси составляла 0.2 об. %, объемное соотношение С6Н14 : О2 = 1 : 100 (скорости подачи реакционной смеси 2500, 5000 и 10 000 ч–1).
Степень превращения углеводорода (x) рассчитывали по результатам анализа концентрации углеводорода на входе и выходе из реактора при заданной температуре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Предварительно перед получением катализаторов из [Cr(NH3)5Cl][PtCl4] провели автоклавный термолиз этого соединения и полученный порошкообразный продукт исследовали методами растровой электронной микроскопии и энергодисперсионной рентгеновской (EDX) спектроскопии на сканирующем электронном микроскопе Tescan Vega (“TESCAN”, Чехия) с приставкой Inga Energy.
На полученном изображении (рис. 1а) видны темные частицы неправильной формы, включающие светлые сферические частицы, размером 100–300 нм (рис. 1б). Резкое различие контраста позволяет говорить о разном химическом составе и предположить, что сферические частицы, состоящие из металлической платины, сформированы на матрице из оксида хрома. Для сравнения продукт автоклавного термолиза [Pt(NH3)4]CrO4 (рис. 1в) состоит из конгломератов однородных по плотности (одинакового контраста на изображении) частиц тех же размеров (рис. 1г).
Рис. 1.
Электронные изображения продуктов автоклавного термолиза комплексов [Cr(NH3)5Cl][PtCl4] (а, б) и [Pt(NH3)4]CrO4 (в, г).

Элементный состав порошка, по данным EDX-спектроскопии, представлен в табл. 1. Из EDX-спектра были вычтены пики, относящиеся к элементам подложки (C, Al). Высокое содержание кислорода в спектрах обусловлено сигналом от алюминиевой подложки, на которую была нанесена проба исследуемого порошка. Среднее по поверхности атомное соотношение платины и хрома близко к 1, что соответствует стехиометрии комплекса. В EDX-спектре, полученном с частицы, присутствуют линии обоих металлов, причем интенсивность сигнала хрома, составляющего основу, несколько выше, чем платины, образующей дисперсные частицы на поверхности.
Таблица 1.
Элементный состав продукта автоклавного термолиза [Cr(NH3)5Cl][PtCl4] по данным EDX-спектроскопии
| Спектр | Содержание элемента в продукте, ат. % | ||
|---|---|---|---|
| O | Cr | Pt | |
| Общий | 95.7 | 2.3 | 2.0 |
| Частица | 87.6 | 7.3 | 5.1 |
Полученные данные позволяют предположить, что в первую очередь подвергается превращению катионная часть комплекса и образуется гидратированный оксид хрома по уравнению:
(I)
$\begin{gathered} {{\left[ {{\text{Cr}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{5}}}}{\text{Cl}}} \right]}^{{{\text{2 + }}}}} + {\text{3O}}{{{\text{H}}}^{ - }} \to \\ \to \,\,{\text{CrOOH + 5N}}{{{\text{H}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O + C}}{{{\text{l}}}^{ - }}{\text{.}} \\ \end{gathered} $В анионной части комплекса протекают процессы лигандного обмена и последующего восстановления до металла по уравнениям (II)–(IV):
(II)
$\begin{gathered} {\text{2}}{{\left[ {{\text{PtC}}{{{\text{l}}}_{{\text{4}}}}} \right]}^{{{\text{2}} - }}} + {\text{4N}}{{{\text{H}}}_{{\text{3}}}} \to \\ \to \,\,\left[ {{\text{Pt}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]\left[ {{\text{PtC}}{{{\text{l}}}_{{\text{4}}}}} \right] + {\text{4C}}{{{\text{l}}}^{ - }}{\text{,}} \\ \end{gathered} $(III)
$\begin{gathered} \left[ {{\text{Pt}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]\left[ {{\text{PtC}}{{{\text{l}}}_{{\text{4}}}}} \right] + {\text{4N}}{{{\text{H}}}_{{\text{3}}}} \to \\ \to \,\,{\text{2}}{{\left[ {{\text{Pt}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]}^{{{\text{2 + }}}}}{\text{ + 4C}}{{{\text{l}}}^{ - }}{\text{,}} \\ \end{gathered} $(IV)
$\begin{gathered} {\text{3}}{{\left[ {{\text{Pt}}{{{\left( {{\text{N}}{{{\text{H}}}_{{\text{3}}}}} \right)}}_{{\text{4}}}}} \right]}^{{{\text{2 + }}}}}{\text{ + 6O}}{{{\text{H}}}^{ - }} \to \\ \to \,\,{\text{3Pt + }}{{{\text{N}}}_{{\text{2}}}} + {\text{10N}}{{{\text{H}}}_{{\text{3}}}} + {\text{6}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Центры кристаллизации металлических частиц, образующихся по уравнению (IV), формируются на поверхности полученных первоначально по уравнению (I) оксидных частицах. При внесении в автоклав соответствующего носителя образующиеся, в конечном итоге, многокомпонентные каталитические фазы осаждаются на его поверхности.
Результаты каталитических испытаний в реакции полного окисления пропана на полученных из различных соединений-предшественников катализаторах, отличающихся также материалом и формой носителя, сведены в табл. 2.
Таблица 2.
Результаты каталитических испытаний в реакции полного окисления пропана
| Соединение-предшественник | Носитель: материал/форма | Степень превращения пропана, % | ||||
|---|---|---|---|---|---|---|
| Температура, °С | ||||||
| 200 | 250 | 300 | 350 | 400 | ||
| [Cr(NH3)5Cl][PtCl4] | НС/стружка | 3.3 | 18.1 | 65.2 | 90.9 | 97.2 |
| НС/МР | 6.0 | 9.4 | 25.4 | 74.2 | 98.0 | |
| НХ/МР | 3.6 | 25.1 | 83.8 | 95.0 | 96.7 | |
| [Pt(NH3)4]CrO4 | НС/стружка | 17.6 | 21.2 | 76.6 | 91.0 | 95.6 |
| НС/МР | 2.5 | 3.5 | 10.1 | 50.5 | 89.4 | |
| [Pt(NH3)4]Cl2 | НС/стружка | 2.2 | 34.8 | 90.2 | 94.8 | 96.6 |
| НС/МР | 2.1 | 5.7 | 29.6 | 87.6 | 98.6 | |
Из анализа данных табл. 2 следует, что промотирующий эффект оксидов хрома в наибольшей степени проявляется при низких температурах (200–250°С). При этих температурах степень превращения пропана на платина-хромовых катализаторах выше, чем на монометаллическом платиновом образце, полученном в тех же условиях и на тех же носителях.
Сравнение платина-хромовых катализаторов, полученных из различных соединений-предшественников, показывает, что на каталитических фазах, осажденных из [Pt(NH3)4]CrO4 на стружку из нержавеющей стали, наблюдается степень превращения пропана 17.56 и 21.18% при 200 и 250°С соответственно, тогда как на катализаторе из [Cr(NH3)5Cl][PtCl4] на том же носителе – 3.27 и 18.12%. На блочных катализаторах из нержавеющей стали каталитические фазы, полученные из [Cr(NH3)5Cl][PtCl4], показывают более высокую активность (конверсия 6.04 и 9.43% при 200 и 250°С соответственно), чем те же из [Pt(NH3)4]CrO4 (2.47 и 3.53%). Такое расхождение, вероятно, связано со случайным характером формирования твердой фазы на поверхности носителя, и для достоверного утверждения о преимуществе первого или второго соединения-предшественника требуется получение и исследование большего количества образцов.
Катализатор, полученный на блочном носителе МР из нихрома, осаждением из двойного комплекса [Cr(NH3)5Cl][PtCl4] проявляет заметно более высокую активность по сравнению с аналогичным образцом на нержавеющей стали. Разница в степенях превращения пропана при 300°С составляет ~60%. Это может быть связано со сродством оксидного слоя носителя из нихрома и осажденных каталитических фаз.
В реакции полного окисления н-гексана был исследован Pt–Cr-катализатор, полученный из [Cr(NH3)5Cl][PtCl4] на блочном носителе МР из нержавеющей стали. Результаты приведены в табл. 3. Степень превращения н-гексана несколько выше, чем пропана на том же катализаторе при скорости подачи смеси 5000 ч–1 и одинаковых температурах.
Таблица 3.
Результаты каталитических испытаний в реакции полного окисления н-гексана
| Скорость подачи реакционной смеси, мл/мин | Время контакта, с | Конверсия н-гексана, % | ||||
|---|---|---|---|---|---|---|
| Температура, °С | ||||||
| 200 | 250 | 300 | 350 | 400 | ||
| 125 | 0.61 | 11 | 24 | 65 | 82 | 98 |
| 250 | 0.30 | 7 | 16 | 41 | 82 | 97 |
| 500 | 0.15 | 4 | 7 | 24 | 52 | 82 |
Кинетические параметры реакции окисления н-гексана рассчитывали при температуре 250 и 300°С. В этих условиях степень конверсии не превышает 45%. Реакцию проводили в условиях псевдопервого порядка по кислороду.
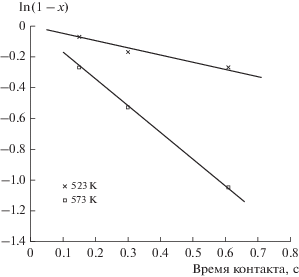
В координатах кинетического уравнения первого порядка были получены прямолинейные зависимости (рис. 2), что свидетельствует о первом порядке реакции по н-гексану. Тангенс угла наклона прямых равен константе скорости реакции.
В табл. 4 представлены кинетические параметры реакции полного окисления на исследованном платина-хромовом катализаторе и для сравнения приведены данные для катализатора на таком же блочном носителе, полученном автоклавным термолизом комплекса [Pt(NH3)4]Cl2 [20]. Удельная константа скорости реакции при 250°С на биметаллическом катализаторе ниже, чем на платиновом. Также наблюдается более высокая энергия активация. При этом значение предэкспоненциального множителя на биметаллическом катализаторе выше. Полученные данные свидетельствуют, что геометрия каталитического центра на исследованном катализаторе отличается от геометрии каталитического центра платинового катализатора. При этом число каталитических центров платина-хромового катализатора значительно больше, что может быть связано с более высокодисперсным состоянием платины, полученной при автоклавном термолизе двойного комплекса.
Таблица 4.
Кинетические параметры реакции полного окисления н-гексана
| Катализатор | T, °С | kуд, c–1 ${\text{г }}_{{{\text{к а т }}}}^{{ - 1}}$ | Eакт, кДж/моль | lg A, c–1 |
|---|---|---|---|---|
| Pt–Cr | 250 | 0.26 | 62.6 | 5.7 |
| 300 | 0.90 | |||
| Pt [20] | 250 | 4.95 | 32 | 3.9 |
ЗАКЛЮЧЕНИЕ
В работе впервые показана возможность получения многокомпонентных дисперсных фаз, состоящих из оксидов хрома и металлической платины с размерами частиц в сотни нанометров, реакцией разложения двойного комплекса [Cr(NH3)5Cl][PtCl4] в водных растворах при повышенных температурах.
С использованием комплексов [Pt(NH3)4]CrO4 и [Cr(NH3)5Cl][PtCl4] в качестве соединений-предшественников в гидротермальных условиях получены нанесенные на металлические носители катализаторы. Металлическими носителями служили сплавы Х18Н10Т и Х20Н80 в виде стружки или блока из “металлорезины”. Показано, что в модельных реакциях полного окисления пропана и н-гексана полученные катализаторы проявляют высокую активность, которая практически не зависит от природы исходного комплекса, но определяется материалом и формой металлического носителя. Промотирующий эффект оксидов хрома в наибольшей степени проявляется при низких температурах (200–250°С).
Таким образом, исследованные в работе комплексные соединения перспективны в качестве соединений-предшественников для получения каталитически активных фаз с использованием автоклавных технологий.
Список литературы
Гринберг В.А., Кулова Т.Л., Майорова Н.А., Доброхотова Ж.В., Пасынский А.А., Скундин А.М., Хазова О.А. // Электрохимия. 2007. Т. 43. № 1. С. 77.
Гутерман В.Е., Пустовая Л.Е., Гутерман А.В., Высочина Л.Л. // Электрохимия. 2007. Т. 43. № 9. С. 1147.
Тарасевич М.Р., Кузов А.В., Клюев А.Л., Титова В.Н. // Альтернативная энергетика и экология. 2007. Т. 46. № 2. С. 113.
Богдановская В.А., Тарасевич М.Р., Кузнецова Л.Н., Жутаева Г.В., Лозовая О.В. // Электрохимия. 2010. Т. 46. № 8. С. 985.
Богдановская В.А., Тарасевич М.Р. // Электрохимия. 2011. Т. 47. № 4. С. 404.
Богдановская В.А., Тарасевич М.Р., Лозовая О.В. // Электрохимия. 2011. Т. 47. № 7. С. 902.
Myoungki M., Hasuck K. // Int. J. Hydrogen Energy. 2016. V. 41. P. 17557.
Duanghathai K., Sirapath Y., Supatini S., Mali H. // Int. J. Hydrogen Energy. 2018. V. 43. P. 5133.
Потемкин Д.И., Конищева М.В., Задесенец А.В., Снытников П.В., Филатов Е.Ю., Коренев С.В., Собянин В.А. // Кинетика и катализ. 2018. Т. 59. № 4. С. 499.
Potemkin D.I., Filatov E.Yu., Zadesenets A.V., Rogozhnikov V.N., Gerasimov E.Yu., Snytnikov P.V., Korenev S.V., Sobyanin V.A. // Mater. Lett. 2019. V. 236. P. 109.
Домонов Д.П., Печенюк С.И., Гостева А.Н. // Журн. физ. химии. 2014. Т. 88. № 6. С. 926.
Печенюк С.И., Семушина Ю.П., Кузьмич Л.Ф., Иванов Ю.В. // Журн. физ. химии. 2016. Т. 90. № 1. С. 22.
Олексенко Л.П., Луценко Л.В. // Журн. физ. химии. 2013. Т. 87. № 2. С. 200.
Пaт. 2294240 PФ, 2007.
Плюснин П.Е., Шубин Ю.В., Юсенко К.В., Байдина И.А., Корда Т.М., Коренев С.В. // Журн. неорган. химии. 2004. Т. 49. № 8. С. 1253.
Шубин Ю.В., Задесенец А.В., Венедиктов А.Б., Коренев С.В. // Журн. неорган. химии. 2006. Т. 51. № 2. С. 245.
Юсенко К.В., Васильченко Д.Б., Задесенец А.В., Байдина И.А., Шубин Ю.В., Коренев С.В. // Журн. неорган. химии. 2007. Т. 52. № 10. С. 1589.
Belousov O.V., Sirotina A.V., Belousova N.V., Fesik E.V., Borisov R.V., Malchikov G.D. // Журн. СФУ. Сер. Техника и технологии. 2014. Т. 7. № 2. С. 138.
Борисов Р.В., Белоусов О.В. // Журн. СФУ. Сер. Химия. 2014. Т. 7. № 3. С. 331.
Тупикова Е.Н. Дисс. … канд. хим. наук. Самара: СГАУ, 2003.
Хабарова Д.С., Тупикова Е.Н. // Теоретические и практические вопросы интеграции химической науки, технологии и образования. Матер. конф. Улан-Удэ: ВСГУТУ, 2016. С. 219.
Tupikova E.N., Platonov I.A., Khabarova D.S. // AIP Conf. Proc. 2018. V. 1989. P. 030017; https://doi.org/10.1063/ 1.5047735
Tupikova E.N., Platonov I.A., Lykova T.N. // AIP Conf. Proc. 2016. V. 1724. P. 020052; https://doi.org/10.1063/1.4945172
Синтез комплексных соединений металлов платиновой группы / Под ред. Черняева И.И. М.: Наука, 1964. С. 9.
Руководство по неорганическому синтезу (в 6 томах) / Под ред. Брауэра Г. М.: Мир, 1985. С. 1780, 1789.
Чегодаев Д.Е. Конструирование рабочих органов машин и оборудования из упругопористого материала МР. Самара: НПЦ “Авиатор”, 1994. С. 15.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ