Кинетика и катализ, 2019, T. 60, № 4, стр. 471-478
Превращения гексадекана на алюмоникелевом катализаторе
В. В. Чесноков a, *, А. С. Чичкань a, **, Е. А. Паукштис a, Ю. А. Чесалов a, А. В. Краснов a
a ФГБУН “Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. акад. Лаврентьева, 5, Россия
* E-mail: chesn@catalysis.ru
** E-mail: AlexCsh@yandex.ru
Поступила в редакцию 17.12.2018
После доработки 07.02.2019
Принята к публикации 19.02.2019
Аннотация
ИК-спектроскопическим и каталитическим методами исследованы превращения гексадекана на катализаторе 4%Ni/Al2O3 в интервале температур 20–300°С. Показано, что при 20–100°С происходит дегидрирование гексадекана с последующим формированием ароматических продуктов, однако скорости этих процессов очень низкие. С ростом температуры реакции до 200°С наблюдается максимальная активность катализатора 4%Ni/Al2O3, высокая селективность образования 1-гексадецена, а в продуктах реакции присутствуют также ароматические соединения и продукты крекинга. При дальнейшем повышении температуры реакции каталитическая активность значительно падает. Это связано с тем, что в области температур 200–300°С на поверхности катализатора постепенно накапливаются полиароматические отложения.
ВВЕДЕНИЕ
Современная добыча нефти затрудняется уменьшением количества извлекаемой, так называемой легкой нефти. На базе существующих технологий из нефти получают такие ценные продукты, как бензин, керосин, дизельное топливо. Утилизация тяжелых остатков перегонки создает все больше проблем для нефтеперерабатывающих заводов (НПЗ), так как доля тяжелой нефти в номенклатуре сырья растет, а рынок тяжелых остаточных нефтяных топлив сокращается. Поэтому задача совершенствования существующих и разработка новых технологий, направленных на увеличение глубины переработки тяжелых нефтей и нефтяных остатков, весьма актуальна [1, 2].
Коксование – один из наиболее экономически целесообразных путей конверсии тяжелых нефтяных остатков, позволяющий при минимуме затрат дополнительно получать ценные нефтепродукты, тем самым увеличивая глубину переработки нефти [3, 4]. Самый распространенный способ коксования – замедленное коксование. При рассмотрении вопросов интенсификации процесса коксования внимание исследователей сосредоточено на технологических аспектах: времени пребывания сырья и температурных полях в объеме реактора, составе сырья и др. [5]. В последнее время разрабатываются также методы, предусматривающие использование каталитических добавок при термолизе тяжелых фракций нефти. Было установлено [6], что введение никельсодержащих микродобавок в количестве до 2000 ppm в сырье для замедленного коксования способствует не только повышению выхода легких дистиллятных фракций, но и к существенному улучшению свойств нефтяного кокса. Несмотря на то, что внесение никеля приводит к интенсификации процесса коксования, точный механизм этого влияния не изучен. Известно [7], что парафиновые углеводороды, являющиеся основным компонентом нефти, склонны к реакциям термического крекинга по радикально-цепному механизму.
В настоящее время общепринятым механизмом процесса коксования нефтяных остатков считается “консекутивная схема” уплотнения углеводородов – ряд последовательных реакций образования “мономеров уплотнения” и промежуточных продуктов уплотнения на основе конденсации и полимеризации, дегидроциклизации, связывания ароматических колец и обеднение водородом вплоть до графитовой структуры [8–12].
Исследовать превращения углеводородных смесей слишком сложно, поэтому испытания проводят с применением какого-нибудь одного углеводорода. Наиболее часто в качестве модельного углеводорода используется гексадекан, который в реакционных условиях претерпевает как радикально-цепные, так и каталитические превращения.
В литературе термические реакции гексадекана описаны подробно [13–19]. Было показано, что под действием температуры его трансформация протекает по радикально-цепному механизму Райса–Коссякова. Термический крекинг н-гексадекана при умеренных (330–375°C) температурах изучали в жидкой и газовой фазах. Было установлено [13], что распределение продуктов сильно зависит от фазового состояния реагента. При низких конверсиях в процессе жидкофазного крекинга наблюдалось эквимолярное распределение н-алканов и 1-алкенов для углеводородных продуктов C3–C13, а при увеличении конверсии алканов было больше, чем алкенов. В противоположность этому в продуктах газофазного крекинга всегда преобладали алкены.
В 80–90 гг. был раскрыт и изучен неизвестный ранее механизм “карбидного цикла” образования углерода на металлах подгруппы железа [20, 21], который открывает новые возможности в совершенствовании технологии процесса замедленного коксования [22]. Наибольшей активностью в образовании углеродных наноматериалов обладает металлический никель. Механизм “карбидного цикла” образования углерода из углеводородов С1–С4 на металлическом никеле включает два этапа:
1. Этап химический, на котором происходит каталитическое разложение углеводорода на поверхности металлической частицы, образование атомов углерода и рост их концентрации до предельных значений;
2. Этап физический, на котором происходит формирование центров кристаллизации (зародышей) фазы графита на определенных участках поверхности металлической частицы, миграция (диффузия через массу металлической частицы) атомов углерода от мест их образования к центрам кристаллизации графитовой фазы и ее рост с формированием углеродных нановолокон. Из механизма “карбидного цикла” вытекает, что диффузия атомов углерода происходит под действием градиента концентраций атомов углерода в металле.
Каталитические превращения на металлическом никеле в случае высокомолекулярных углеводородов изучены недостаточно.
Настоящая работа посвящена исследованию адсорбции и превращений гексадекана на алюмоникелевом катализаторе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализатора Ni/Al2O3
Никель на γ-Al2O3 марки А-1 наносили методом пропитки по влагоемкости из водного раствора Ni(NO3)2. Воду выпаривали досуха, сухой остаток перемещали в фарфоровую чашку и прокаливали в муфельной печи при 500°С в течение 30 мин. Содержание никеля в синтезированном катализаторе составляло 4 мас. %. После прокаливания алюмоникелевый катализатор восстанавливали в реакторе с весами Мак-Бена в потоке водорода при температуре 700°С в течение 1 ч.
Проведение каталитических исследований
Каталитическую активность и селективность превращения гексадекана исследовали в проточном реакторе при температурах 200–300°С. В работе использовали гексадекан производства компании “Компонент-реактив” (Россия), ГОСТ 12525-85. Чистота гексадекана была не менее 98 мас. %. Алюмоникелевый катализатор в количестве 2 г загружали в проточный реактор. После нагрева в аргоне до заданной температуры включали насос и подавали гексадекан. Каталитический эксперимент проводили при 200°С в течение 30 мин и анализировали составы газовой и жидкой фаз, затем температуру реакции повышали до 250°С и далее до 300°С. Объемная скорость подачи гексадекана составляла 1 ч–1. Газ анализировали с помощью газового хроматографа Кристалл-2000 (“ИЭМЗ КУПОЛ”, Россия), колонка с носителем Activated charcool, а жидкую фазу – на хромато-масс-спектрометре Agilent 7000B (“Agilent”, США), колонка DB-5ms (30 м × 0.25 мм × × 0.25 мкм).
Рентгенографическое исследование образцов
Фазовый состав образцов исследовали рентгенографическим методом. Рентгенограммы образцов были получены на дифрактометре Thermo ARL X’TRA (“Thermo Fisher Scientific”, Швейцария), CuKα-излучение с длиной волны 1.54184 Å, сканирование по точкам. Интервал сканирования углов 2θ составлял 5°–90°, шаг сканирования – 0.05°, накопление в точке – 5 с. Для идентификации фаз пользовались базами дифракционных (PC-PDF) и структурных (ICSD) данных. Размеры областей когерентного рассеяния (ОКР) определяли, используя интегральную ширину пиков по формуле Селякова–Шеррера.
ИК-спектроскопическое исследование образцов
В статических ИК-экспериментах образец прессовали в тонкую пластину без связующего с поверхностной плотностью 15 мг/см2, загружали в ИК-кювету и прокаливали в вакууме в течение 1 ч при 500°С. Далее образец охлаждали до комнатной температуры (Ткомн) и регистрировали фоновый спектр. После этого в кювету напускали 4 мкл жидкого гексадекана (что эквивалентно 5 ммоль/г катализатора). Гексадекан при Ткомн имеет низкое давление насыщенных паров – менее 1 мм рт. ст., поэтому его подавали с помощью микрошприца на стенку кюветы на расстоянии ~20 см от таблетки и в течение 1.5 ч наблюдали за изменением спектров. Сначала спектры регистрировали при комнатной температуре спустя 5, 15, 30 и 70 мин после напуска гексадекана. Далее последовательно нагревали образец до 200, 300, 400, 450 и 500°С с выдерживанием при каждой температуре в течение 10 мин. Спектры записывали на спектрометре FTIR 8300 (“Shimadzu”, Япония) в области 400–6000 см–1 с разрешением 4 см–1 и накоплением 200 сканов. В проточных экспериментах ИК-спектры регистрировали на Фурье-ИК-спектрометре Cary 660 FTIR (“Agilent Technologies”, США) в диапазоне 4000–600 см–1 с разрешением 4 см–1 и накоплением 40 сканов. Для ИК-исследований катализатор напыляли при помощи напылительный колонки на окно BaF2. Процедуру повторяли многократно до достижения оптимальной толщины слоя катализатора, которую контролировали по пропусканию ИК-излучения. Окно с напыленным катализатором помещали в кварцевую ИК-кювету-реактор. Перед началом эксперимента образец тренировали 1 ч в потоке гелия при температуре 300°С непосредственно в ИК-кювете-реакторе. Затем кювету с образцом катализатора охлаждали до заданной температуры в среде гелия. Гексадекан подавали путем насыщения потока гелия барботированием через испаритель с гексадеканом при комнатной температуре. Реакционная газовая смесь поступала в ИК-кювету-реактор со скоростью 120 мл/мин.
Все спектры, приведенные в настоящей работе, разностные, т.е. получены вычитанием из зарегистрированных спектров фонового спектра, который снимали после тренировки образца и охлаждения его до заданной температуры адсорбции.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фазовый состав алюмоникелевого катализатора исследовали рентгенографическим методом. На основании дифракционных данных установлено, что в составе катализатора присутствует фаза γ-Al2O3 с параметром элементарной ячейки 7.923 Å и размером ОКР 55 Å и фаза металлического никеля с размером ОКР 80 Å.
На рис. 1 приведены спектры, зарегистрированные при комнатной температуре после напуска гексадекана на катализатор Ni/Al2O3.
Рис. 1.
ИК-спектры гексадекана, адсорбированного на катализаторе 4 мас. % Ni/Al2O3, зарегистрированные в статической кювете при комнатной температуре после напуска 4 мкл жидкого гексадекана через 5 (1), 15 (2), 30 (3) и 70 мин (4).
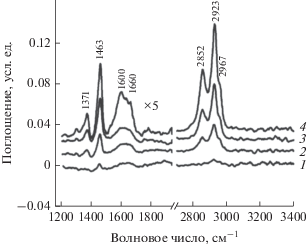
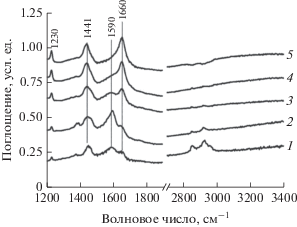
Гексадекан имеет низкое давление насыщенных паров и поэтому адсорбируется медленно. Полосы при 1371, 1463, 2852, 2923 и 2967 см–1 относятся к деформационным и валентным колебаниям СН2- и СН3-групп гексадекана. Кроме того, в спектрах появляются две новых полосы при 1590 и 1660 см–1. Первая из них может быть отнесена к колебаниям соединений, содержащих ароматические кольца, или кокса, а вторая – к концевым олефиновым фрагментам в составе углеводородных отложений. При повышении температуры реакции наблюдается постепенный рост интенсивности полосы 1660 см–1 (рис. 2). При 300°С полоса при 1590 см–1, относящаяся к коксу или ароматическим продуктам, достигает максимальной интенсивности, а полосы гексадекана в области 2800–2970 см–1, напротив, полностью исчезают из спектра. Таким образом, на поверхности образца гексадекан постепенно превращается в коксовые отложения.
Рис. 2.
ИК-спектры гексадекана, адсорбированного на катализаторе 4 мас. % Ni/Al2O3, зарегистрированные в статической кювете после прогрева при температурах 200 (1), 300 (2), 400 (3), 450 (4) и 500°С (5). Условия: напуск 4 мкл жидкого гексадекана и выдерживание 10 мин.
Адсорбцию и конверсию гексадекана на поверхности катализатора 4 мас. % Ni/Al2O3 исследовали также методом ИК-спектроскопии in situ в проточных условиях. При подаче реагента при комнатной температуре в замкнутый объем кюветы мы наблюдали за медленным процессом превращений адсорбированного гексадекана без взаимодействия поверхностных продуктов с новыми порциями гексадекана. В проточном эксперименте на катализаторе 4 мас. % Ni/Al2O3 реакции протекают так же, как в реальном каталитическом реакторе.
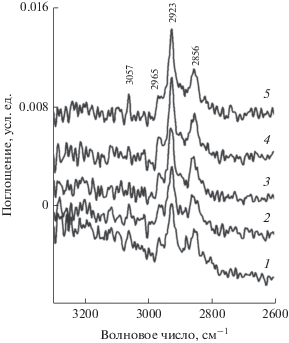
На рис. 3 показаны спектры поверхностных соединений (ПС) гексадекана на Ni/Al2O3-катализаторе, зарегистрированные при пропускании реакционной смеси (С16Н34 в Не) через ИК-ячейку-реактор с образцом катализатора при 100°С в течение 1 (кривая 1), 3 (кривая 2), 10 (кривая 3), 15 (кривая 4) и 30 мин (кривая 5). В спектрах присутствуют полосы при 2965, 2923 и 2856 см–1, относящиеся к валентным колебаниям СН3- и СН2‑групп адсорбированного гексадекана. После 30 мин пропускания смеси в спектрах появляется полоса при 3057 см–1, соответствующая валентному колебанию СН-группы при двойной связи. Возможно, что этот же фрагмент характеризует и полоса 1660 см–1 в спектрах на рис. 1 и рис. 2. Таким образом, при 100°С протекает реакция дегидрирования гексадекана с образованием алкенов.
Рис. 3.
ИК-спектры поверхностных соединений гексадекана на катализаторе 4 мас. % Ni/Al2O3, зарегистрированные при пропускании реакционной смеси через ячейку-реактор с образцом катализатора при 100°С в течение 1 (1), 3 (2), 10 (3), 15 (4) и 30 мин (5).
При температурах 160–200°С наблюдается постепенное уменьшение концентрации ПС (рис. 4а и 4б). При этом новые полосы в спектрах не появляются, т.е. дальнейшего превращения гексадекана и олефинов не происходит, а значит снижение концентрации ПС при повышении температуры связано с более быстрым ростом скорости десорбции поверхностных соединений по сравнению со скоростью их образования.
Рис. 4.
ИК-спектры поверхностных соединений гексадекана на катализаторе 4 мас. % Ni/Al2O3, зарегистрированные при пропускании реакционной смеси через ячейку-реактор с образцом катализатора: а – в условиях термопрограммированного нагрева от 100 до 200°С со скоростью 5°С/мин при 100 (1), 140 (2), 160 (3), 180 (4) и 200°С(5); б – при 200°С в течение 1 (1), 3 (2), 10 (3) и 30 мин (4).
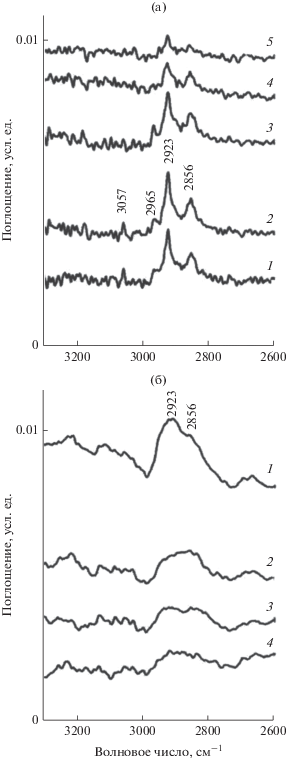
При 300°С (рис. 5 ) в ИК-спектрах имеются широкие полосы в области 1600–1100 см–1, относящиеся к ароматическим соединениям и коксовым отложениям. Следовательно, при 300°С олефины претерпевают дальнейшее превращение в ароматические соединения и кокс.
Рис. 5.
ИК-спектры поверхностных соединений гексадекана на катализаторе 4 мас. % Ni/Al2O3, зарегистрированные при пропускании реакционной смеси через ячейку-реактор с образцом катализатора при 300°С в течение 1 (1), 3 (2), 10 (3) и 30 мин (4).

В проточном реакторе исследование каталитической активности и селективности катализатора 4 мас. % Ni/Al2O3 в превращении гексадекана проводили при температурах 200, 250 и 300°С. На рис. 6 в качестве примера приведены хроматограмма продуктов реакции, включающих 44 углеводорода, при 200°С, а в табл. 1 – их состав.
Рис. 6.
Хроматограмма продуктов превращения гексадекана на катализаторе 4 мас. % Ni/Al2O3, полученных при температуре 200°С.
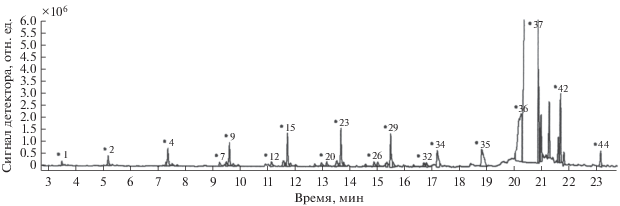
Таблица 1.
Состав продуктов превращения гексадекана на катализаторе 4 мас. % Ni/Al2O3 при температуре 200°С
| № | Углеводороды | Конц., % | № | Углеводороды | Конц., % |
|---|---|---|---|---|---|
| 1 | Гептан | 0.05 | 23 | Додекан | 0.45 |
| 2 | Октан | 0.14 | 24 | 2-Додецен | 0.05 |
| 3 | пара-Ксилол | 0.05 | 25 | * | 0.03 |
| 4 | Нонан | 0.24 | 26 | Гексилбензол | 0.08 |
| 5 | 3-Нонен | 0.03 | 27 | * | 0.08 |
| 6 | 2-Нонен | 0.01 | 28 | * | 0.09 |
| 7 | мета-Этилтолуол | 0.08 | 29 | Тридецен | 0.48 |
| 8 | 1-Децен | 0.07 | 30 | изо-Тетрадекан | 0.08 |
| 9 | Декан | 0.29 | 31 | * | 0.03 |
| 10 | 3-Децен | 0.05 | 32 | Гептилбензол | 0.07 |
| 11 | 4-децен | 0.02 | 33 | (1-Метилгексил)-бензол | 0.08 |
| 12 | пара-Пропилтолуол | 0.09 | 34 | Тетрадекан | 0.37 |
| 13 | * | 0.12 | 35 | Пентадекан | 0.62 |
| 14 | 1-Ундецен | 0.03 | 36 | 1-Гексадецен | 2.39 |
| 15 | Ундекан | 0.38 | 37 | Гексадекан | 93.2 |
| 16 | 2-Ундецен | 0.05 | 38 | * | 0.97 |
| 17 | 1-Ундецен | 0.01 | 39 | * | 0.62 |
| 18 | пара-(1-Метилпропил)-толуол | 0.03 | 40 | (1-этилоксил)-бензол | 0.59 |
| 19 | Пентилбензол | 0.06 | 41 | Децилбензол | 0.27 |
| 20 | пара-Бутилтолуол | 0.07 | 42 | (1-Метилнонил)-бензол | 0.78 |
| 21 | Додецен | 0.12 | 43 | Гептадекан** | 0.14 |
| 22 | * | 0.03 | 44 | Октадекан** | 0.2 |
Результаты изучения влияния температуры реакции на конверсию и групповой состав продуктов превращения гексадекана в присутствии 4 мас. % Ni/Al2O3 представлены в табл. 2.
Таблица 2.
Влияние температуры реакции на конверсию и групповой состав продуктов превращения гексадекана на катализаторе 4 мас. % Ni/Al2O3
| Температура, °С | Конверсия, % | Парафины, % | Ароматические углеводороды, % | Олефины*, % | Гексадецен-1, % |
|---|---|---|---|---|---|
| 200 | 6.8 | 3.02 | 0.75 | 0.64 | 2.39 |
| 250 | 2.22 | 1.18 | 0.23 | 0.20 | 0.61 |
| 300 | 1.40 | 0.81 | 0.03 | 0.04 | 0.52 |
Исходя из ИК-спектроскопических и каталитических данных следует, что активность алюмоникелевого катализатора с повышением температуры от 150 до 200°С растет. При температурe реакции выше 200°С активность падает в результате постепенной дезактивации катализатора за счет отложения кокса на катализаторе. Таким образом, катализатор 4 мас. % Ni/Al2O3 обладает максимальной активностью при температуре 200°С.
Проведенные в [23] исследования свойств катализаторов Ni/Al2O3 и NiO/Сибунит в образовании углеродных нановолокон из высокомолекулярных алканов (гексана, ундекана и гексадекана) показали, что в интервале температур 450–600°С скоростьконтролирующей стадией реакции является стадия взаимодействия молекулы парафина с поверхностью металлического никеля. Однако осталось неясным, почему реакционная способность изученных углеводородов значительно уменьшается в следующем ряду: гексан > > ундекан > гексадекан.
Следует также отметить, что при Т < 350°С парафины С1–С4, адсорбированные на поверхности никеля, претерпевают разрыв С–Н-связей, атомы углерода образуют фазу карбида никеля, и далее очень медленно происходит зауглероживание поверхности катализатора [24]. При Т > 350°С на никелевом катализаторе из углеводородов С1–С4 с высокой скоростью отлагаются углеродистые отложения по механизму “карбидного цикла”. Для легких углеводородов фактически невозможно наблюдать реакцию дегидрирования, т.к. олефины быстро превращаются в углеродные нановолокна. Иная ситуация характерна для гексадекана. При температурах 200–300°С с высокой селективностью протекает дегидрирование гексадекана в гексадецен-1. Атомы водорода отрываются от крайних атомов углерода в углеводороде, поэтому можно сделать вывод о том, что гексадекан взаимодействует с двумя атомами никеля. Поскольку полного разложения гексадекана не происходит, следовательно, на поверхности металлического никеля отсутствуют крупные мультиплетные активные центры, необходимые для адсорбции всей молекулы гексадекана.
Для сравнения были проведены испытания по превращению гексадекана в присутствии оксида алюминия при температурах 250–450°С. Из представленных в табл. 3 результатов следует, что оксид алюминия обладает гораздо меньшей активностью в конверсии гексадекана по сравнению с катализатором 4 мас. % Ni/Al2O3 (табл. 2).
Таблица 3.
Влияние температуры реакции на конверсию гексадекана в присутствии оксида алюминия
| Температура, °С | 250 | 350 | 450 |
| Конверсия, % | 0.2 | 0.3 | 0.48 |
Насыщенные углеводороды не зауглероживают оксид алюминия. Однако с повышением температуры реакции и переходом гексадекана из жидкого в газообразное состояние улучшаются процессы массопереноса. Возможно, это приводит к тому, что десорбирующиеся с поверхности металлического никеля олефины начинают взаимодействовать с поверхностью оксида алюминия. Известно [25], что при адсорбции олефинов на поверхности Al2O3 вначале образуются карбонатно-карбоксилатные группы, а затем коксовые отложения. В результате этого поверхность оксида алюминия зауглероживается по консекутивному механизму. Вероятно поэтому при температурах реакции выше 300°С селективность по гексадецену-1 на катализаторе 4 мас. % Ni/Al2O3 падает (табл. 2).
ЗАКЛЮЧЕНИЕ
Таким образом, основным направлением превращения гексадекана на поверхности никельсодержащего катализатора является его дегидрирование. При комнатной температуре имеет место дегидрирование с последующим образованием ароматических продуктов, однако скорость данных процессов очень низкая. При повышении температуры реакции до 100°С скорость этих реакций незначительно возрастает. При Т = 200°С наблюдается максимальная активность и высокая селективность катализатора 4 мас. % Ni/Al2O3 в дегидрировании гексадекана в 1-гексадецен. В продуктах реакции определяются ароматические соединения и продукты крекинга, что, вероятно, обусловлено наличием кислотных центров оксида алюминия. При дальнейшем росте температуры каталитическая активность образца значительно падает. Связано это с тем, что в области 200–300°С на поверхности катализатора постепенно накапливаются полиароматические отложения. Результаты каталитических исследований согласуются со спектральными данными, которые свидетельствуют, что при Т > 300°С на поверхности катализатора 4 мас. % Ni/Al2O3 формируются коксовые продукты, о чем свидетельствует наличие полосы около 1590 см–1 в ИК-спектре полученных образцов.
Список литературы
Сурков В.Г., Певнева Г.С., Головко А.К. // Нефтепереработка и нефтехимия. 2015. № 12. С. 6.
Serrano-Ruiz J.C. Applied Industrial Catalysis. N. Y.: Arcler Press, 2017. P. 149.
Гэри Дж.Х., Хэндверк Г.Е., Кайзер М.Дж. Технологии и экономика нефтепереработки. Санкт-Петербург: ЦОП “Профессия”, 2013. С. 118.
Походенко Н.Т., Брондз Б.И. Получение и обработка нефтяного кокса. М.: Химия, 1986. С. 93.
Кретинин М.В. Механотехнологические аспекты производства нефтяного кокса. Уфа: Изд-во ГУП ИНХП РБ, 2009. 328 с.
Kelemen S.R., Siskin M., Gorbaty M.L., Ferrughelli D.T., Kwiatek P.J., Brown L.D., Eppig C.P., Kennedy R.J. // Energy Fuels. 2007. V. 21. № 2. P. 927.
Васильева Н.А. Дис. … докт. хим. наук. Новосибирск: ИК СО РАН, 1999.
Красюков А.Ф. Нефтяной кокс. М.: Химия, 1966. 264 с.
Левинтер М.Е. Медведева М.И., Панченков Г.М., Асеев Ю.Г., Недошивин Ю.Н., Финкельштейн Г.Б., Галиакбаров М.Ф. // Химия и технология топлив и масел. 1966. № 9. С. 31.
Левинтер М.Е., Медведева М.И., Панченков Г.М., Агапов Г.И. // Химия и технология топлив и масел. 1966. № 11. С. 25.
Руденко А.П. Современные проблемы физической химии. М.: Изд-во МГУ. 1968. Т. 3. С. 263
Буянов Р.А. Закоксование катализаторов. Новосибирск: Наука, 1983. С. 16.
Wu G., Katsumura Y., Matsuura C., Ishigure K. // Ind. Eng. Chem. Res. 1996. V. 35. P. 4747.
Wangen E.S., McCaffrey W.C., Kuznicki S., Hoff A., Blekkan E.A. // Top. Catal. 2007. V. 45. № 1–4. P. 213. https://doi.org/10.1007/s11244-007-0268-x
Khorasheh F., Gray M.R. // Ind. Eng. Chem. Res. 1993. V. 32. P. 1853.
Bounaceur R., Scacchi G., Marquaire P.-M., Domine F., Bre’vart O., Dessort D., Pradier B. // Ind. Eng. Chem. Res. 2002. V. 41. P. 4689.
Watanabe M., Tsukagoshi M., Hirakoso H., Adschiri T., Arai K. // AIChE J. 2000. V. 46. № 4. P. 843.
Ford T.J. // Ind. Eng. Chem. Res. 1986. V. 25. P. 240.
Fabuss B.M., Smith J.O., Lait R.I., Borsanyi A.S., Satterfield C.N. // Industrial & Engineering Chemistry Process Design and Development. 1962. V. 1. № 4. P. 293.
Чесноков В.В., Буянов Р.А. // Успехи химии. 2000. Т. 69. № 7. С. 675.
Буянов Р.А., Чесноков В.В. // Катализ в промышленности. 2006. № 2. С. 3.
Чесноков В.В., Чичкань А.С., Пармон В.Н. // Катализ в промышленности. 2018. Т. 18. № 1. С. 67.
Чесноков В.В., Чичкань А.С., Зайковский В.И., Пармон В.Н. // Кинетика и катализ. 2013. Т. 54. № 2. С. 222.
Chesnokov V.V., Podyacheva O.Y., Shmakov A.N., Kibis L.S., Boronin A.I., Ismagilov Z.R. // Chin. J. Catal. 2016. V. 37. № 1. P. 169.
Прокудина Н.А., Чесноков В.В., Паукштис Е.А., Буянов Р.А. // Кинетика и катализ. 1989. Т. 30. С. 949.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


