Кинетика и катализ, 2019, T. 60, № 4, стр. 464-470
Влияние способа получения на структуру катализаторов Ag–CeO2 и их активность в окислении сажи
М. В. Садливская a, Н. Н. Михеева a, В. И. Зайковский b, c, Г. В. Мамонтов a, *
a ФГАОУ ВО Томский государственный университет
634050 Томск, просп. Ленина, 36, Россия
b ФГБУН “Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. акад. Лаврентьева, 5, Россия
c ФГАОУ ВО Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
* E-mail: GrigoriyMamontov@mail.ru
Поступила в редакцию 29.11.2018
После доработки 09.03.2019
Принята к публикации 14.03.2019
Аннотация
В выхлопных газах автомобильного транспорта содержатся недогоревшие частицы сажи, которые загрязняют окружающую среду и оказывают пагубное влияние на здоровье человека. Решение этой проблемы требует разработки новых высокоэффективных каталитических систем, желательно не содержащих дорогостоящих Pt и Pd, для окисления сажи в выхлопных газах. В настоящей работе катализаторы на основе композиции Ag–CeO2 были синтезированы двумя способами (соосаждением и пропиткой по влагоемкости) и исследованы комплексом физико-химических методов (низкотемпературная адсорбция азота, рентгенофазовый анализ (РФА), просвечивающая электронная микроскопия (ПЭМ) и ПЭМ высокого разрешения, температурно-программированное окисление (ТПО)). Каталитические свойства полученных систем изучены в реакции окисления сажи. Показано, что катализатор Ag–CeO2, приготовленный методом соосаждения, наиболее активен в окислении сажи. Повышенная активность катализатора связана с формированием в нем сложной структуры, представляющей агломерат сильно взаимодействующих частиц серебра и оксида церия, что, как показано методом ТПО, оказывает значительное влияние на низкотемпературную активацию кислорода на поверхности катализатора.
ВВЕДЕНИЕ
Транспорт – один из основных источников загрязнения окружающей среды. В выхлопных газах автотранспорта содержатся летучие органические соединения (ЛОС), оксиды азота (NOx), твердые частицы сажи (soot) и несгоревшие углеродные соединения [1–3]. Частицы сажи не только приносят вред окружающей среде, но также провоцируют частые головные боли и слабость, нарушение сна, являются раздражителями легких и дыхательных путей, оказывают негативное влияние на работу сердечно-сосудистой системы человека [4]. По оценкам ЕС в 2015 г. загрязнение воздуха вызвало 100 млн больничных и 350 тыс. преждевременных смертей в Европе [5]. В связи с ростом количества автомобилей с дизельными двигателями, представляющих собой основные источники выбросов сажи, следует ожидать усугубление этой проблемы.
Образующаяся из выхлопных газов дизельного топлива сажа может выгорать при температурах выше 600°C, в то время как значения типичных температур выхлопа дизельных двигателей находятся в пределах от 200 до 500°C [6, 7]. Поэтому необходимы катализаторы для увеличения скорости окисления сажи при относительно низких температурах. Среди катализаторов окисления наиболее перспективны катализаторы на основе CeO2, поскольку они обладают превосходными окислительно-восстановительными свойствами [8]. Как активность, так и стабильность оксида церия могут быть дополнительно увеличены при добавлении редкоземельных, переходных, щелочных и щелочноземельных или благородных металлов. Кроме того, оксид церия способен защищать нанесенные частицы металла от спекания при высоких температурах [9], стабилизировать благородные металлы в одноатомном состоянии [10, 11]. Перенос (spillover) активного кислорода от оксида церия к металлу обеспечивает повышение активности систем “благородный металл–оксид церия” и сильно зависит от морфологии и размера частиц оксида церия [12, 13], а также от особенностей границы раздела металл–оксид церия [14].
Широко исследованы для различных окислительных процессов катализаторы на основе палладия, платины и золота, нанесенных на оксид церия и другие оксидные носители [5, 15]. В настоящей работе акцент сделан на изучении каталитической композиции Ag–CeO2, которая более привлекательна для практического использования из-за относительно низкой стоимости серебра по сравнению с другими благородными металлами и которая все чаще используется в окислительном катализе, в том числе фотокатализе и электрокатализе [16]. Предполагается, что синергетический эффект серебра и активного носителя СеО2 [17], а также сильное взаимодействие металл–носитель в катализаторах Ag–CeO2 [18, 19] может эффективно способствовать окислению сажи (soot).
В настоящей работе синтезированы и исследованы катализаторы Ag–CeO2 при варьировании способа получения: соосаждения и пропитки. Изучено влияние способа приготовления катализатора на его текстурные характеристики, распределение серебра на поверхности оксида церия, способность активации молекулярного кислорода и каталитическую активность в окислении углерода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализаторов
Оксид церия и серебросодержащие катализаторы на его основе готовили методами осаждения [20] и пропитки по влагоемкости [21]. Методом осаждения получали образец CeO2 и катализатор Ag–CeO2. Для синтеза катализатора навески AgNO3 (2.14 г) и Ce(NO3)3 ⋅ 6H2O (16.39 г) растворяли в 40 мл дистиллированной воды, затем к смеси нитратов при интенсивном перемешивании приливали водный раствор аммиака (25 мас. %) до достижения рН ~ 10, выдерживали в автоклаве 10 мин при 120°С. Образовавшийся осадок отфильтровывали, промывали дистиллированной водой до достижения нейтрального рН, затем прокаливали при 500°С в течение 5 ч. Образец CeO2 синтезировали в аналогичных условиях при осаждении нитрата церия(III) раствором аммиака.
Приготовленный методом осаждения оксид церия использовали в качестве носителя для получения катализатора методом классической пропитки по влагоемкости с применением водного раствора нитрата серебра (образец Ag/CeO2). Катализатор сушили при 120°С в течение 10 ч и затем прокаливали при 500°С в течение 5 ч. Расчетное содержание Ag во всех серебросодержащих образцах составляло 20 мол. % (~13.6 мас. %).
Методы исследования
Определение характеристик пористой структуры образцов проводили по данным адсорбции азота при температуре –196°С на автоматическом газо-адсорбционном анализаторе TriStar 3020 (“Micromeritics”, США). Величину удельной поверхности (Sуд) находили с использованием многоточечного метода БЭТ по спрямлению изотермы адсорбции в диапазоне Р/Р0 от 0.05 до 0.30. Перед началом измерений навески образцов массой 100–120 мг дегазировали в вакууме при температуре 200°С в течение 2 ч.
Фазовый состав образцов исследовали методом рентгенофазового анализа (РФА) с помощью дифрактометра Miniflex 600 (“Riguku”, Япония) с применением CuKα-излучения (λ = 1.5418 Å) с монохроматором. Условия съемки: скорость сканирования 2 град/мин, шаг 0.2 град/мин, диапазон углов 2θ = 10°–90°. Анализ фазового состава проводили с использованием баз данных PCPDFWIN и программы полнопрофильного анализа POWDER CELL 2.4.
Структуру образцов, а также морфологические и кристаллографические особенности нанесенного серебра и оксида церия изучали методом просвечивающей электронной микроскопии высокого разрешения (ПЭМ ВР) на микроскопе JEM-2200 FS (“JEOL”, Япония) с разрешением 0.1 нм при ускоряющем напряжении 200 кВ.
Активацию молекулярного кислорода на поверхности восстановленных образцов исследовали методом температурно-программируемого окисления (ТПО-О2) на приборе AutoChem HP (“Micromeritics”, США) в токе газовой смеси 10% O2 в He (20 мл/мин) при линейном нагреве от –50 до 700°С со скоростью 10 град/мин. Для работы в области отрицательных температур использовали специальную приставку CryoCooler (“Micromeritics”, США), дозирующую жидкий азот в печь прибора. Перед ТПО-экспериментом образцы предварительно восстанавливали в токе газовой смеси 10% H2 в Ar (20 мл/мин) при 500°С в течение 20 мин.
Каталитический эксперимент
Перед каталитическим экспериментом все катализаторы предварительно обрабатывали в токе воздуха при 500°С в течение 20 мин. Каталитические свойства образцов изучали в реакции окисления сажи на приборе синхронного термического анализа STA 449 F1 Jupiter analyzer (“NETZSCH-GeraetebauGmbH”, Германия), сопряженном с газовым масс-спектрометром QMS 403 Aeolos (“NETZSCH-GeraetebauGmbH”, Германия). При интенсивном истирании в ступке смешивали 95 мг катализатора и 5 мг углерода CarbonBlack (“Micromeritics”, США) для более плотного и равномерного контакта между частицами катализатора и сажи [7]. Из полученной смеси отбирали ~10 мг и помещали в корундовый тигель для проведения каталитического эксперимента. Эксперимент осуществляли при нагревании смеси катализатора с сажей до 800°С со скоростью нагрева 10 град/мин в токе синтетического воздуха (60 мл/мин). Для исследования некаталитического горения сажи углерод смешивали с кварцем в массовом соотношении 95 : 5. Процесс каталитического и некаталитического окисления сажи оценивали по потере массы образца, экзотермическому пику и масс-спектрометрическому сигналу выделения СО2 в качестве основного продукта окисления углерода.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Свойства катализаторов
Характеристики пористой структуры образцов по данным низкотемпературной адсорбции азота приведены на рис. 1 и в табл. 1. Все образцы имеют преимущественно мезопористую структуру, на что указывает наличие на изотермах адсорбции–десорбции азота петли гистерезиса в области относительных давлений от 0.8 до 1.0 [22]. Образец СеО2 имеет удельную поверхность Sуд = 30.4 м2/г с преобладанием пор размером 6–60 нм.
Рис. 1.
Изотермы адсорбции–десорбции азота (а) и распределение пор по размерам (по методу BJH-desorption) (б) для полученных образцов.
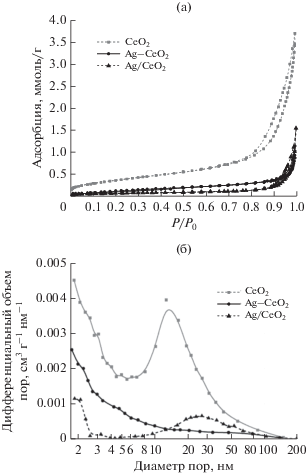
Таблица 1.
Текстурные характеристики полученных образцов
| Образец | Sуд, м2/г | Vпор, см3/г |
|---|---|---|
| CeO2 | 30.4 | 0.129 |
| Ag–CeO2 | 11.9 | 0.039 |
| Ag/CeO2 | 5.6 | 0.053 |
Из представленных данных видно, что для образца Ag–CeO2 по сравнению с CeO2 наблюдается значительное уменьшение удельной поверхности и объема пор (Vпор), что обусловлено окислительно-восстановительной реакцией между Ag+ и Се3+ при осаждении в щелочной среде [20]:
В результате протекания представленных выше реакций формирование частиц Ag происходит непосредственно в процессе соосаждения. Значительное изменение пористой структуры Ag–CeO2 по сравнению с образцом CeO2, полученным в близких условиях, указывает на сильное влияние серебра на формирование Ag–CeO2 катализатора на стадии осаждения.
Катализатор, приготовленный пропиткой по влагоемкости, характеризуется более низкими значениями Sуд и Vпор, но близким в сравнении с CeO2 распределением пор по размерам (рис. 1б). Таким образом, при синтезе катализатора методом пропитки введение серебра не оказывает существенного влияния на предварительно сформированные частицы оксида церия, однако внесение большого количества (20 мол. %) серебра в катализатор значительно снижает его удельную поверхность и объем пор. Из распределений пор по размерам видно, что катализатор Ag/CeO2 характеризуется меньшим вкладом пор размером 30 нм по сравнению с исходным носителем СеО2, что указывает на распределение серебра преимущественно в мелких и средних мезопорах носителя.
Фазовый состав полученных образцов исследовали методом РФА. Образец СеО2 характеризуется кубической фазой оксида церия со значениями области когерентного рассеивания (ОКР) 8.8 нм (рис. 2, табл. 2). Для образца Ag–CeO2, приготовленного соосаждением, наблюдается существенное увеличение ОКР для фазы оксида церия (16.7 нм), что подтверждает влияние серебра на процесс формирования структуры образца Ag–CeO2 и объясняет уменьшение удельной поверхности до 11.9 м2/г. Также для этого образца на рентгенограмме наблюдаются выраженные рефлексы металлического серебра, что доказывает протекание окислительно-восстановительной реакции на стадии осаждения с восстановлением предшественника серебра до металлического состояния.
Рис. 2.
Рентгенограммы исследуемых образцов (а) и рефлексы фаз оксида церия и серебра, согласно базе PDF (б).
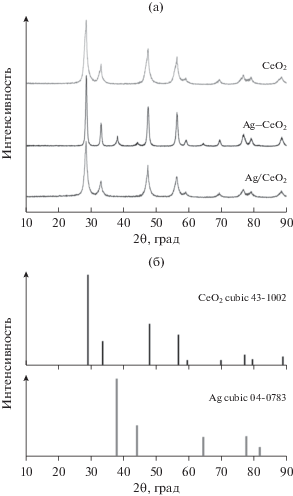
Таблица 2.
Результаты РФА для исследуемых образцов
| Образец | Фазы | d111(СeO2), нм | ОКР (${\text{CeO}}_{2}^{{111}}$), нм | ОКР (Ag111), нм |
|---|---|---|---|---|
| CeO2 | CeO2 | 0.3131 | 8.8 | – |
| Ag–CeO2 | CeO2, Ag | 0.3121 | 16.7 | 17.0 |
| Ag/CeO2 | CeO2 | 0.3130 | 9.9 | – |
Для Ag/CeO2 размер кристаллитов СеО2 возрастает незначительно, что также свидетельствует о малом влиянии серебра на структуру предварительно сформированного оксида церия при получении катализатора методом пропитки. Отсутствие рефлексов Ag-содержащих фаз для образца Ag/CeO2 указывает на его высокодисперсное рентгеноаморфное состояние или формирование частиц размером менее 3–4 нм, т.е. вне области детектирования методом РФА.
Структуру образцов изучали методом просвечивающей электронной микроскопии высокого разрешения. ПЭМ-изображения катализатора Ag–CeO2, приготовленного методом соосаждения, представлены на рис. 3. Для этого образца характерно образование сферических агломератов размером 400–500 нм. В центре эти агломераты светлее (рис. 3а), что указывает на их меньшую толщину в этой области, соответственно, агломераты предположительно полые. На снимках высокого разрешения видно, что они состоят из смеси частиц серебра (d111 = 2.3 Å) и оксида церия (d111 = 3.1 Å). На микроснимке ПЭМ-ВР (рис. 3в) заметно, что на поверхности более крупных частиц оксида церия (~20 нм) стабилизированы мелкие частицы серебра размером 3–8 нм.
Катализатор Ag/CeO2, полученный методом пропитки, представляет собой агломерат частиц оксида церия размером ~5–10 нм (рис. 4), что согласуется с данными низкотемпературной адсорбции азота и РФА. На поверхности частиц СеО2 стабилизированы частицы металлического серебра (d111 = 2.3–2.4 Å) размером 1–3 нм.
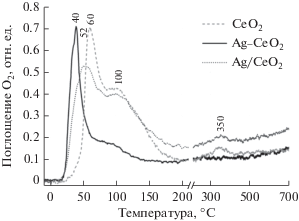
Известно, что при нанесении серебра на поверхность оксида церия наблюдается изменение окислительно-восстановительных свойств оксида церия. Так, ранее методом ТПВ-Н2 было показано, что восстановление поверхности оксида церия (переход Се4+ в Се3+) происходит в диапазоне температур 350–600°С [23], но при наличии контакта между частицами серебра и СеО2 область восстановления смещается до 100–250°С [18, 19]. В окислительно-восстановительных каталитических процессах, помимо склонности систем к восстановлению, важную роль играет их способность к реокислению, и именно стадия активации молекулярного кислорода на предварительно восстановленных активных центрах катализатора может быть лимитирующей. Особенности окисления катализаторов исследовали методом температурно-программируемого окисления кислородом (ТПО-О2). На рис. 5 представлены профили ТПО-О2 для образцов, предварительно восстановленных при 500°С. Окисление CeO2 наблюдается с ~25°С с характерными пиками поглощения кислорода при 60 и 100°С, а также небольшим пиком с максимумом при 350°С.
Для катализатора Ag–CeO2 реокисление начинается при температуре ~15°С, затем следует интенсивный пик поглощения кислорода с максимумом при 40°С и плечом при 90°С. Поглощения кислорода в области выше 200°С не происходит. Низкотемпературная активация кислорода может происходить на частицах серебра, которые легко реокисляются при комнатной температуре [24, 25]. Смещение основных пиков поглощения кислорода в присутствии серебра в более низкотемпературную область указывает на то, что взаимодействие Ag с CeO2 способствует не только повышению восстанавливаемости оксида церия, но и его склонности к реокислению.
Для катализатора Ag/CeO2, полученного методом пропитки, профиль ТПО имеет форму, схожую с таковой для исходного носителя СеО2. Поглощения кислорода начинается при температуре ~15°С, что может быть связано с окислением дисперсного серебра. Пики поглощения кислорода при 100 и 350°С идентичны пикам для образца СеО2 и относятся к реокислению поверхности СеО2, по-видимому, без участия серебра в активации кислорода. Таким образом, на основании данных ТПО-О2 можно сделать выводы, что серебро способствует более легкому реокислению предварительно восстановленного оксида церия, а сильное взаимодействие серебра с оксидом церия, наблюдаемое для катализатора Ag–CeO2, значительно повышает реокисляемость катализатора.
Каталитические свойства приготовленных катализаторов исследовали в реакции окисления сажи при смешении катализатора с углеродом в массовом соотношении 95 : 5. Некаталитическое окисление сажи происходит при температуре 550–700°С (рис. 6). Присутствие катализатора сдвигает процесс окисления в область более низких температур. Так, на чистом CeO2 сажа окисляется при 360–550°С (пик выделения СО2 с максимумом при 456°С).
Рис. 6.
Каталитические свойства синтезированных образцов в реакции окисления сажи: термогравиметрический сигнал (а) и масс-спектрометрические данные выделения СО2 (б).
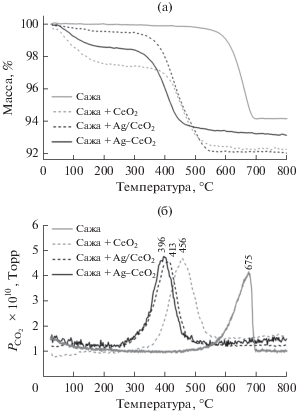
Активность серебросодержащих катализаторов в окислении сажи выше по сравнению с чистым оксидом церия. Катализаторы, полученные методом пропитки и соосаждения, имеют близкие активности, однако пик выделения СО2 для образца Ag–CeO2 смещен в низкотемпературную область (396°С). По-видимому, структура Ag–CeO2, полученного методом соосаждения, более благоприятна для протекания процесса окисления сажи.
Высокая активность оксида церия и катализаторов на его основе в окислении сажи определяется, в первую очередь, возможностью обратимых переходов Ce4+$ \rightleftarrows $ Ce3+ в структуре оксида церия и образованием соответствующих поверхностных и объемных кислородных вакансий [16, 26]. Введение серебра на поверхность оксида церия, несмотря на значительное уменьшение удельной поверхности, приводит к росту активности в окислении сажи. С одной стороны, причиной возрастания активности может быть увеличение количества кислородных вакансий на поверхности оксида церия в присутствии серебра, что было показано в ряде работ методом КР-спектроскопии [19, 27]. С другой стороны, повышенную активность катализатора, полученного методом соосаждения, можно связать с большей дефектностью получаемой системы за счет сильного взаимодействия серебра и оксида церия, обусловленного протеканием окислительно-восстановительной реакции между Се3+ и Ag+ при образовании смешанного осадка. Катализатор, приготовленный соосаждением, характеризуется сложной структурой: агломератов, состоящих из смеси частиц серебра и оксида церия. В работе [28] при исследовании композитов Ag–CeO2 со структурой “core–shell” (“ядро–оболочка”) показано, что усиленное межфазное взаимодействие Ag и CeO2 является основной причиной роста активности катализаторов в реакции окисления СО благодаря увеличению количества кислородных вакансий и соответствующему повышению скорости активации кислорода.
Активность в окислительных процессах определяется способностью активации молекулярного кислорода поверхностью катализатора. Из данных ТПО-О2 (рис. 4) следует, что оксид церия обладает высокой способностью к активации кислорода, начиная с комнатной температуры, а введение серебра приводит к возрастанию скорости реокисления. Таким образом, серебро играет ключевую роль не только в увеличении количества кислородных вакансий на поверхности СеО2, но и в способности катализатора активировать молекулярный кислород при пониженных температурах. В работе [20] при исследовании аналогичных агломератов Ag–CeO2 со структурой “rice-ball” (“рисовые шарики”) в качестве катализаторов окисления сажи было показано, что серебро способствует более низкотемпературной активации кислорода с последующим переносом адсорбированного кислорода от серебра к СеО2. Исходя из этого, синергетический эффект серебра и активного носителя СеО2 при их сильном межфазном взаимодействии облегчает активацию молекулярного кислорода как на серебряных, так и Се-содержащих центрах, что приводит к росту активности в окислении сажи.
ЗАКЛЮЧЕНИЕ
Итак, синтезированные катализаторы Ag–CeO2 эффективны в окислении сажи. Способ получения катализатора – пропитка или соосаждение – влияет на их структуру и активность в реакции. Ag–CeO2, приготовленный методом соосаждения, проявляет повышенную активность за счет более сложной структуры и сильного взаимодействия серебра и оксида церия. Введение серебра на поверхность оксида церия приводит к увеличению реакционной способности катализатора в поверхностной активации молекулярного кислорода, что является одной из ключевых причин роста активности катализаторов в окислительных процессах, в частности, в окислении сажи.
Список литературы
Aneggi E., de Leitenburg C., Trovarelli A. / Catalysis by ceria and related materials, 2nd ed., London: Imperial College Press, 2013. P. 565.
Heck R.M., Farrauto R.J., Gulati S.T. / Catalytic air pollution control: commercial technology, 3nt ed., Hoboken, New Jersey: Wiley-VCH, 2006. P. 518.
Lox E.S.J., Ertl G., Knözinger H., Schüth F., Weitkamp J. // Handbook of Heterogeneous Catalysis (2nd ed.). Weinheim: Wiley-VCH, 2008. P. 2274.
Frank B., Schlögl R., Su D.S. // Env. Sci. Technol. 2013. V. 47. P. 3026.
Fino D., Bensaid S., Piumetti M., Nunzio M.P. // Appl. Catal. A: Gen. 2015. V. 509. P. 75.
Oi-Uchisawa J., Obuchi A., Wang S., Nanba T., Ohi A. // Appl. Catal. B: Env. 2003. V. 43. P. 117.
Neyertz C.A., Banus E.D., Mirό E.E., Querini C.A. // Chem. Eng. J. 2014. V. 248. P. 394.
Trovarelli A., Llorca J. // ACS Catal. 2017. V. 7. P. 4716.
Farmer J.A., Campbell C.T. // Science. 2010. V. 329. P. 933.
Dvorak F., Farnesi Camellone M., Tovt A., Tran N.D., Negreiros F.R., Vorokhta M., Skala T., Matolinova I., Myslivecek J., Matolin V., Fabris S. // Nat. Commun. 2016. V. 7. Article number: 10801.
Jones J., Xiong H.F., Delariva A.T., Peterson E.J., Pham H., Challa S.R., Qi G.S., Oh S., Wiebenga M.H., Hernandez X.I.P., Wang Y., Datye A.K. // Science. 2016. V. 353. P. 150.
Carrettin S., Concepcion P., Corma A., Nieto J.M.L., Puntes V.F. // Angew. Chem. Int. Ed. 2004. V. 43. P. 2538.
Vayssilov G.N., Lykhach Y., Migani A., Staudt T., Petrova G.P., Tsud N., Skala T., Bruix A., Illas F., Prince K.C., Matolin V., Neyman K.M., Libuda J. // Nat. Mater. 2011. V. 10. P. 310.
Mudiyanselage K., Senanayake S.D., Feria L., Kundu S., Baber A.E., Graciani J., Vidal A.B., Agnoli S., Evans J., Chang R., Axnanda S., Liu Z., Sanz J.F., Liu P., Rodriguez J.A., Stacchiola D.J. // Angew. Chem. Int. Ed. 2013. V. 52. P. 5101.
Wei Y., Wu Q., Xiong J., Li J., Liu J., Zhao Z. // Catal. Today. 2019. V. 327. P. 143.
Grabchenko M.V., Mikheeva N.N., Mamontov G.V., Salaev M.A., Liotta L.F., Vodyankina O.V. // Catalysts. 2018. V. 8. № 7. Article number: 285.
Mamontov G.V., Grabchenko M.V., Sobolev V.I., Zaikovskii V.I., Vodyankina O.V. // Appl. Catal. A: Gen. 2016. V. 528. P. 161.
Грабченко М.В., Мамонтов Г.В., Зайковский В.И., Водянкина О.В. // Кинетика и Катализ. 2017. Т. 58. № 5. С. 654.
Grabchenko M.V., Mamontov G.V., Zaikovskii V.I., Parola V.La, Liotta L.F., Vodyankina O.V. // Catal. Today. 2018.https://doi.org/10.1016/j.cattod.2018.05.014
Yamazaki K., Kayama T., Dong F., Shinjoh H. // J. Catal. 2011. V. 282. P. 289.
Liu S., Wu X., Liu W., Chen W., Ran R., Li M., Weng D. // J. Catal. 2016. V. 337. P. 188.
Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Kenneth S.W. // Pure Appl. Chem. 2015. V. 87. P. 1052.
Mikheeva N.N., Zaikovskii V.I., Mamontov G.V. // Micropor. Mesopor. Mater. 2019. V. 277. P. 10.
Dutov V.V., Mamontov G.V., Zaikovskii V.I., Vodyankina O.V. // Catal. Today. 2016. V. 278. P. 150.
Dutov V.V., Mamontov G.V., Zaikovskii V.I., Liotta L.F., Vodyankina O.V. // Appl. Catal. B: Env. 2018. V. 221. P. 598.
Fino D., Bensaid S., Piumetti M., Russo N. // Appl. Catal. A: Gen. 2016. V. 509. P. 75.
Kibis L.S., Svintsitskiy D.A., Kardash T.Yu., Slavinskaya E.M., Gotovtseva E.Yu., Svetlichnyi V.A., Boronin A.I. // Appl. Catal. A: Gen. 2019. V. 570. P. 51.
Zhang J., Li L., Huang X., Li G. // J. Mater. Chem. 2012. V. 22. P. 10480.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ