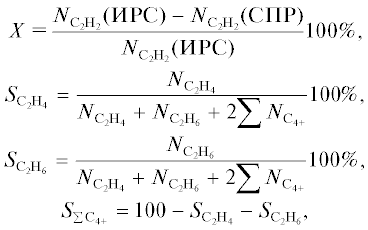Кинетика и катализ, 2019, T. 60, № 4, стр. 479-485
Гидрирование ацетилена в этилен в обогащенной водородом газовой смеси на катализаторе Pd/Сибунит
Д. А. Шляпин a, Д. В. Глыздова a, Т. Н. Афонасенко a, *, В. Л. Темерев a, П. Г. Цырульников a
a ФГБУН Институт проблем переработки углеводородов СО РАН
644040 Омск, ул. Нефтезаводская, 54, Россия
* E-mail: atnik@ihcp.ru
Поступила в редакцию 20.12.2018
После доработки 28.01.2019
Принята к публикации 04.02.2019
Аннотация
Изучены закономерности протекания реакции газофазного гидрирования ацетилена на катализаторе Pd/Сибунит в зависимости от мольного отношения H2 : C2H2, температуры процесса и присутствия монооксида углерода. Показано, что для реакционной смеси состава H2 : C2H2 < 20 скорость реакции зависит от концентрации водорода и не зависит от концентрации ацетилена, тогда как при отношении реагентов H2 : C2H2 > 20, напротив, порядок по водороду становится нулевым и скорость реакции определяется содержанием ацетилена в реакционной смеси. Установлено, что повышение температуры реакции (от 30 до 85°С) приводит к увеличению вклада полного гидрирования в этан. Введение СО в реакционную смесь до мольного отношения CO : C2H2 = 0.1 сопровождается практически полным блокированем центров реадсорбции C2H4, что выражается в резком росте селективности по этилену от 4 до 73%. При дальнейшем увеличении соотношения CO : C2H2 постепенно уменьшается количество центров, доступных для адсорбции водорода, и, соответственно, снижается конверсия.
В настоящее время получение этилена является актуальной задачей, поскольку он служит исходным сырьем в нефтехимических процессах полимеризации, а также используется для получения различных промышленных продуктов (ацетальдегид, оксид этилена, уксусная кислота и т.д.) [1–3]. В промышленности этилен получают, главным образом, пиролизом нефтяного сырья (этана, С3–С4-углеводородов, прямогонного бензина и т.д.) [4, 5]. При пиролизе попутно с этиленом в незначительных количествах (<2 об. %) образуется ацетилен, который оказывает необратимое дезактивирующее действие на катализаторы, используемые на последующих этапах переработки этилена [6–8]. Важнейшим промышленным способом удаления следов ацетилена является процесс газофазного селективного гидрирования, посредством которого концентрацию ацетилена в этилене удается снизить до допустимого уровня (<10 м. д.). В этом случае реакционная смесь содержит относительно небольшое количество водорода (не более 22 мол. %) во избежание вовлечения этилена в реакцию гидрирования [8].
Гидрирование обогащенных ацетиленом и водородом газовых смесей, где ацетилен выступает уже не в качестве примеси, а в виде основного компонента, который необходимо количественно превратить в этилен, также представляет большой научный и практический интерес. Данный процесс является ключевым этапом перспективной опытно-промышленной технологии GTL (gas-to-liquid) переработки легких углеводородов природного или попутного нефтяного газа в более ценные продукты, включающей стадии окислительного пиролиза сырья, абсорбции полученного ацетилена растворителем, жидкофазного гидрирования ацетилена в этилен и последующую олигомеризацию с получением С6–С11-углеводородов с высоким октановым числом [9, 10]. Как известно [11], содержание ацетилена в продуктах окислительного пиролиза природного газа составляет 8–10% при содержании водорода до 55% и СО до 28%.
Ранее нами были проведены исследования, связанные с изучением закономерностей жидкофазного гидрирования обогащенных ацетиленом газовых смесей на палладиевых катализаторах, нанесенных на графитоподобный углеродный материал Сибунит [12–17]. По сравнению с Al2O3 Сибунит не содержит кислотных центров, способствующих протеканию побочной реакции олигомеризации ацетилена. В этих исследованиях была показана возможность достижения высокой селективности по этилену в условиях, когда сам состав реакционной газовой смеси способствует протеканию реакций исчерпывающего гидрирования (основной компонент газовой смеси – водород) и олигомеризации (высокое содержание ацетилена в смеси (2–4 об. % и более) путем введения металлов-модификаторов и монооксида углерода в реакционную смесь.
Таким образом, газофазное гидрирование ацетилена используется для удаления его примесей из этилена, тогда как жидкофазное гидрирование позволяет превращать более концентрированные по ацетилену смеси при существенном избытке водорода. С практической точки зрения представляет интерес возможность гидрирования обогащенных ацетиленом и водородом газовых смесей в отсутствие растворителя в широком интервале соотношений С2Н2 : Н2. В связи с этим целью настоящей работы являлось изучение закономерностей процесса селективного гидрирования обогащенных ацетиленом смесей в газовой фазе в зависимости от состава реакционной смеси, температуры реакции и присутствия СО. В качестве катализатора применяли Pd/Сибунит, который хорошо зарекомендовал себя в жидкофазном варианте процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализатора
В качестве носителя использовали углерод-углеродный композит Сибунит (опытное производство ИППУ СО РАН), который был предварительно обработан 5%-ной азотной кислотой для увеличения количества кислородсодержащих функциональных групп, являющихся центрами хемосорбции предшественников палладия. Удельная поверхность Сибунита составляла 320 м2/г. Для приготовления катализатора использовали фракцию носителя 0.07–0.09 мм.
Нанесение палладия в количестве 0.5 мас. % на Сибунит проводили из раствора Pd(NO3)2 методом пропитки по влагоемкости. Далее образец сушили при 120°С в течение 2 ч и восстанавливали в токе водорода при температуре 500°С в течение 3 ч.
Каталитические испытания
Каталитические испытания проводили на установке газофазного гидрирования ацетилена в этилен в проточном режиме при атмосферном давлении. Навеску катализатора (5–50 мг) смешивали с инертным разбавителем (в качестве разбавителя применяли кварц (фракция 0.07–0.09 мм) для формирования слоя объемом 1 см3) и переносили в стеклянный реактор проточного типа длиной 20 см и диаметром 1 см. Реактор помещали в термостат с заранее заданной температурой. Каталитические испытания проводили в температурном интервале 30–85°С. Исходная реакционная газовая смесь включала ацетилен (2–10.5 об. %), водород (89.5–98 об. %), в некоторых случаях гелий (для баланса) и СО (0.1–4 об. %). Общая скорость потока реакционной смеси во всех экспериментах составляла 100 мл/мин.
Реакционную смесь на входе и выходе из реактора (газообразная часть) анализировали на хроматографе Хромос ГХ-1000 (Россия), снабженном капиллярной колонкой (25 м × 0.32 мм, SiO2, рабочая температура 60°С) и пламенно-ионизационным детектором. В качестве газа-носителя использовали азот. Отбор проб исходной реакционной смеси (ИРС) и смеси после реакции (СПР) производили попеременно посредством переключения 6-ходового крана, периодичность отбора составляла 35 мин.
Степень превращения ацетилена (Х, %) и селективностей образования этилена (${{S}_{{{{{\text{C}}}_{2}}{{{\text{H}}}_{4}}}}},$ %), этана (${{S}_{{{{{\text{C}}}_{2}}{{{\text{H}}}_{6}}}}},$ %) и олигомеров (${{S}_{{\sum {{{{\text{C}}}_{{4 + }}}} }}},$ %) рассчитывали методом внутренней нормализации по площадям соответствующих пиков на хроматограмме:
где N – содержание (в мол. %) соответствующих соединений.В качестве меры активности катализаторов принимали количество превращенного в минуту ацетилена, отнесенное к массе катализатора, равной 1 г:
Текущие концентрации ацетилена ${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ и водорода ${{C}_{{{{{\text{H}}}_{2}}}}},$ необходимые для расчета порядка реакции по этим реагентам, оценивали, предполагая установившийся (стационарный) режим работы реактора. Данное допущение позволяет приравнять величину текущей концентрации реагента к его концентрации на выходе из реактора и использовать формулу ${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ = С0(1 – Х), где С0 – концентрация ацетилена в ИРС, Х – степень превращения ацетилена на выходе из реактора. Текущую концентрацию водорода рассчитывали по степени превращения ацетилена.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно опубликованным ранее результатам просвечивающей электронной микроскопии [17], в катализаторе Pd/Сибунит после восстановительной обработки при 500°С палладий существует в виде сферических металлических частиц, которые равномерно распределены по структуре носителя. Для них характерно узкое распределение по размерам с максимумом гистограммы распределения 6–8 нм, а средний размер частиц палладия составляет 7.8 нм. Согласно [18, 19], увеличение размера наночастиц палладия от 2–3 до 10–20 нм способствует повышению селективности гидрирования алкинов. При этом оптимальные результаты достигаются на наночастицах палладия размером 8–15 нм.
Влияние концентрации ацетилена в реакционной смеси
Влияние содержания ацетилена в реакционной газовой смеси на каталитические свойства катализатора Pd/Сибунит было рассмотрено в интервале концентрации С2Н2 в исходной газовой смеси 2–10.5 об. %. При выборе такого интервала ориентировались на литературные данные [9–11] о содержании ацетилена в смеси продуктов окислительного пиролиза метана. Результаты каталитических испытаний представлены на рис. 1.
Рис. 1.
Влияние содержания ацетилена в реакционной смеси на активность (1 – W) и селективность (2 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}}}},$ 3 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}}}},$ 4 – ${{S}_{{\sum {{{\text{C}}}_{{{\text{4 + }}}}}}}}$) катализатора Pd/Сибунит. Состав газовой смеси С2Н2 (2–10.5 об. %) + Н2 (89.5–98 об. %), Т = 35°С, mкат = 5 мг.
Как видно, на графике зависимости каталитической активности от текущей концентрации ацетилена в реакционной смеси можно выделить два участка. В интервале ${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ = 1–4 об. % скорость реакции возрастает прямо пропорционально содержанию ацетилена в газовой смеси. В интервале 4–10 об. % скорость остается практически постоянной. Наблюдаемая точка перегиба соответствует составу реакционной смеси H2 : C2H2 ≈ 20 : 1. Так как характер зависимости W = = f${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ при варьировании концентрации ацетилена существенно изменяется, то для каждого из выделенных интервалов концентраций определяли порядок реакции. Согласно дифференциальному методу Вант–Гоффа при допущении, что один из реагентов (в данном случае водород) находится в большом избытке, для области ${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ = = 1–4 об. % порядок реакции по ацетилену составляет 0.6, тогда как для области ${{C}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{2}}}}}$ ≥ 4 об. % он близок к нулю.
Наблюдаемая зависимость, вероятно, обусловлена конкурентной адсорбцией ацетилена и водорода на поверхности палладия. Очевидно, что при малых концентрациях ацетилена поверхность катализатора покрыта преимущественно водородом. Несмотря на более низкую теплоту адсорбции водорода на палладии (88–96 кДж/моль [20] по сравнению с ацетиленом (112 кДж/моль [21]), водород при содержании в объеме реакционной смеси на два порядка более высоком, чем С2Н2, является эффективным конкурентом в сорбционных процессах на активных центрах катализатора Pd/Сибунит. В этих условиях скорость гетерогенной каталитической реакции зависит от концентрации вещества, находящегося в недостатке на поверхности катализатора, т.е. ацетилена, о чем свидетельствует порядок реакции по С2Н2, равный 0.6. Однако при дальнейшем повышении концентрации ацетилена степень покрытия им поверхности катализатора резко возрастает, и уже при объемном соотношении ацетилен : водород в газовой фазе, равном 1 : 25, ацетилен (как более прочно адсорбирующийся агент) вытесняет водород с большей части поверхности, следствием чего является приближение к нулевому значению порядка по ацетилену.
Изменение концентрации С2Н2 оказывает незначительное влияние на распределение продуктов реакции. Как показано на рис. 1, реакция гидрирования ацетилена протекает с преимущественным образованием целевого продукта – этилена. Среди продуктов реакции также присутствует этан, который образуется в результате полного гидрирования С2Н2. Кроме того, как известно [22], гидрирование ацетилена сопровождается протеканием процессов гидроолигомеризации, в результате чего в газообразных продуктах реакции хроматографически определяются С4+-углеводороды – бутан и бутены. С повышением содержания ацетилена в исходной реакционной смеси от 2 до 10.5% селективность образования этилена постепенно понижается от 65 до 57%. В то же время наблюдается рост вклада полного гидрирования ацетилена до этана, о чем свидетельствует увеличение значения ${{S}_{{{{{\text{С }}}_{2}}{{{\text{Н }}}_{6}}}}}$ от 13 до 24%, при этом селективность по гидроолигомерам изменяется несущественно – с 22 до 19%.
Влияние содержания водорода в реакционной смеси
Влияние содержания водорода в реакционной смеси на процесс гидрирования ацетилена на катализаторе Pd/Сибунит было исследовано при постоянном содержании С2Н2, равном 4 об. %. Содержание водорода варьировали в интервале 50–96 об. %. Для поддержания постоянства скорости реакционного потока в систему вводили некоторое количество гелия (до баланса 100 мл/мин).
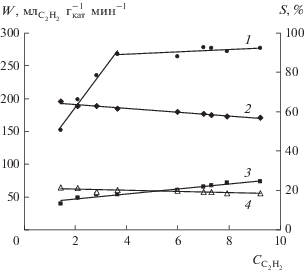
На рис. 2 приведена зависимость каталитической активности от текущей концентрации водорода. Она представляет собой кривую, похожую на ту, что была получена при варьировании содержания ацетилена. Так, в интервале ${{C}_{{{{{\text{H}}}_{2}}}}}$ = 50–80 об. % скорость реакции линейно возрастает с ростом содержания водорода. Расчет порядка реакции указывает на то, что для этой области концентрации Н2 характерен порядок по водороду, близкий к первому. При содержании водорода в реакционной смеси более 80% скорость реакции практически перестает зависеть от концентрации водорода, и порядок реакции приближается к нулевому. Наблюдаемое явление, как и в случае изменения содержания ацетилена, может быть объяснено конкурентной адсорбцией реагентов на поверхности палладия. Следует также иметь в виду, что поверхность палладиевых частиц в условиях реакции (в той или иной степени в зависимости от состава исходной смеси) модифицирована отложениями продуктов олигомеризации, что также влияет на прочность адсорбции реагентов и их количество на поверхности [8].
Рис. 2.
Влияние содержания водорода в реакционной смеси на активность (1 – W) и селективность (2 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}}}},$ 3 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}}}},$ 4 – ${{S}_{{\sum {{{\text{C}}}_{{{\text{4 + }}}}}}}}$) катализатора Pd/Сибунит. Состав газовой смеси С2Н2 (4 об. %) + Н2 (50–96 об. %) + + Не (баланс), Т = 35°С, mкат = 5 мг.
Сопоставление зависимостей каталитической активности от концентрации ацетилена и водорода (рис. 1 и 2) позволяет установить общую закономерность: изменение порядка реакции по каждому из реагентов (перегиб кривой) происходит при мольном отношении H2 : C2H2 ≈ 20. Для реакционной смеси, состав которой соответствует отношению H2 : C2H2 < 20, скорость реакции зависит от концентрации водорода и не зависит от концентрации ацетилена. В случае смеси состава H2 : C2H2 > 20 наблюдается противоположная зависимость. Можно предположить, что наблюдаемые изменения кинетики реакции гидрирования ацетилена обусловлены конкурентной адсорбцией ацетилена и водорода на активных центрах катализатора, которая, в свою очередь, зависит от соотношения данных реагентов в реакционной смеси. В литературе имеются сведения [23], согласно которым реакция гидрирования ацетилена характеризуется первым порядком по водороду и нулевым или отрицательным – по ацетилену. При этом порядок реакции по С2Н2 может варьироваться от 0 до –1 в зависимости от концентрации ацетилена. Отрицательный порядок чаще проявляется при больших концентрациях С2Н2 и характеризует торможение реакции газофазного гидрирования избытком ацетилена [24].
Как было упомянуто выше, реакция газофазного гидрирования ацетилена применяется, главным образом, для очистки этилена от сопутствующих примесей ацетилена, содержание которых составляет 0.5–2 об. %. При существенном избытке этилена в реакционной смеси варьирование отношения реагентов водород : ацетилен ограничено во избежание вовлечения этилена в реакцию гидрирования. По этой причине в смесь (ацетилен + этилен) водород вводят в количестве, не превышающем 10–20 об. % [25]. При этом соотношение H2 : C2H2 невелико и составляет 1–10 [26, 27], т.е. находится в области H2 : C2H2 < 20, за пределами которой можно наблюдать смену порядка реакции по реагентам.
Селективности по основным продуктам реакции в интервале концентраций водорода 50–96 об. % остаются практически неизменными (рис. 2). Селективность по этилену составляет 61–63% при селективностях по этану и олигомерам 19–20% и 18–19% соотвественно.
Влияние температуры
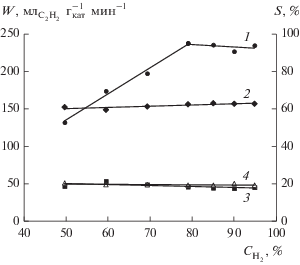
Температура является важным фактором, который оказывает значительное влияние как на каталитическую активность, так и на распределение продуктов реакции. На рис. 3 представлены результаты исследования влияния температуры (от 30 до 85°С с шагом 5 град) на каталитические свойства Pd/Сибунит. Как видно, с ростом температуры от 30 до 85°С величина конверсии ацетилена возрастает от 20 до 96%. В интервале температур 30–45°С полученная зависимость линейна, а при дальнейшем повышении температуры сменяется асимптотическим приближением величины конверсии к пределу в 100%. Наблюдаемая энергия активации Еа в интервале 30–45°С, рассчитанная по уравнению Аррениуса, составляет 52 кДж/моль, что указывает на протекание процесса в кинетической области, где скорость реакции определяется скоростью химического превращения. Полученное в данной работе значение Ea гидрирования ацетилена хорошо согласуется с величинами, представленными в литературе: 12.1 ккал/моль (50.6 кДж/моль) по данным [28], 11.0 ккал/моль (46.0 кДж/моль) по результатам [29] и 10.6 ккал/моль (44.4 кДж/моль) согласно [30].
Рис. 3.
Влияние температуры на конверсию (1 – ${{X}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$) и селективность (2 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}}}},$ 3 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}}}},$ 4 – ${{S}_{{\sum {{{\text{C}}}_{{{\text{4 + }}}}}}}}$) катализатора Pd/Сибунит. Состав газовой смеси С2Н2 (4 об. %) + Н2 (96 об. %), mкат = 5 мг.
С ростом температуры реакции наблюдается снижение селективности олигомеров, в то время как селективность образования этана увеличивается. Согласно представлениям [18, 31], на поверхности палладиевого катализатора существует А- и Е-типы реакционных центров, которые представляют собой участки доступной поверхности палладия, окруженные слоем углеродных отложений. А-центры характеризуются малыми размерами, поэтому на них более вероятна адсорбция меньшей по размеру молекулы ацетилена (3.4 Å) по сравнению с этиленом (4.3 Å) с последующим гидрированием в этилен. Е-центры по природе одинаковы с А-центрами, но имеют большие размеры, в связи с чем могут сорбировать молекулы всех реагирующих веществ. На Е-центрах помимо образования этилена протекает его гидрирование в этан, а также превращение бутадиена в бутен и бутан. С увеличением температуры реакции адсорбированные углеводороды частично десорбируются с поверхности металла и повышается вероятность появления более крупных активных Е-центров, ответственных за образование этана [18]. Другой возможной причиной нарастания концентрации этана в продуктах реакции с повышением температуры может являться стабилизация на поверхности катализатора интермедиатов ацетилена, адсорбированных в мультиплетной форме – этилидена и этилидина [8]. Как известно, гидрирование таких частиц ведет к образованию преимущественно этана [22, 32].
Влияние присутствия СО
Монооксид углерода является эффективным газовым модификатором процесса гидрирования ацетилена, способствующим избирательному протеканию реакции в направлении превращения ацетилена в этилен. Модифицирующее действие СО заключается в подавлении стадии гидрирования этилена, что связано с разной способностью ацетилена и этилена к конкуренции с монооксидом углерода за активные центры катализатора. За счет разницы в величинах теплот адсорбции С2Н4 и СО на палладии происходит вытеснение этилена с поверхности и, соответственно, достигается практически полное подавление стадии гидрирования этилена в этан. Вместе с тем, СО, адсорбированный на поверхности катализатора, также уменьшает количество активных центров адсорбции водорода, приводя тем самым к снижению каталитической активности [33–35].
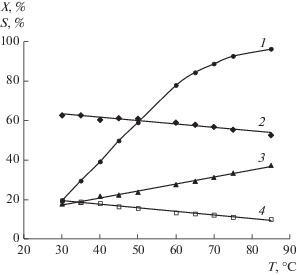
В настоящем исследовании было изучено влияние добавки СО на каталитические свойства образца Pd/Сибунит. Результаты каталитических испытаний представлены на рис. 4. Добавление в реакционную смесь СО в количестве 0.1 об. % (что соответствует мольному отношению CO : C2H2 = = 0.03) оказывает существенное влияние на распределение продуктов реакции: селективность образования этилена возрастает с 4 до 35% при снижении значений селективности по этану с 80 до 53% и по олигомерам с 16 до 12%. При этом величина конверсии не изменяется и остается на уровне 100%. Одновременное повышение селективности образования целевого продукта при отсутствии дезактивирующего эффекта от введения СО можно объяснить конкурентным адсорбционным взаимодействием, при котором монооксид углерода вытесняет с поверхности катализатора этилен, препятствуя его гидрированию далее в этан. При этом высокое значение конверсии ацетилена позволяет подположить, что покрытие поверхности катализатора ацетиленом все еще остается значительным.
Рис. 4.
Влияние присутствия СО на конверсию (1 – ${{X}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}}}}$) и селективность (2 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}}}},$ 3 – ${{S}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}}}},$ 4 – ${{S}_{{\sum {{{\text{C}}}_{{{\text{4 + }}}}}}}}$) катализатора Pd/Сибунит. Состав газовой смеси С2Н2 (4 об. %) + СО (0–4 об. %) + Н2 (92–96 об. %), Т = 75°С, mкат = 50 мг.
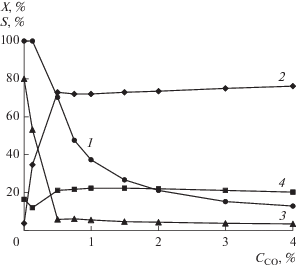
С увеличением концентрации СО в реакционной смеси до 0.5 об. % (CO : C2H2 ≈ 0.1) за счет высокого сорбционного взаимодействия с поверхностью катализатора он начинает проявлять себя как каталитический яд, что сопровождается снижением конверсии ацетилена до 70% и увеличением селективностей по этилену до 73% и по олигомерам – до 21%. Этан перестает быть основным продуктом реакции, его доля в продуктах не превышает 6%. Дальнейшее увеличение концентрации СО в интервале CO : C2H2 = 0.1–1 оказывает существенное влияние только на величину конверсии ацетилена, которая экспоненциально снижается вплоть до 13%. При этом прирост селективности по С2Н4 составляет 3% и обуславливается уменьшением селективности по С2Н6 при постояннном значении ${{S}_{{\Sigma {{{\text{C}}}_{{4 + }}}}}}.$ Слабое изменение в распределении продуктов реакции при CO : C2H2 = = 0.1–1 свидельствует о том, что уже при CO : C2H2 = = 0.1 наступает блокирование центров реадсорбциии С2Н4, на которых происходит его последующее гидрирование до этана. Вместе с тем, судя по изменению конверсии с увеличением отношения CO : C2H2, можно предположить постепенное уменьшение количества центров, доступных для адсорбции водорода.
ЗАКЛЮЧЕНИЕ
Изучены закономерности протекания реакции газофазного гидрирования ацетилена на катализаторе 0.5%Pd/Сибунит в зависимости от состава реакционной смеси, температуры реакции и присутствия СО. Показано, что для реакционной смеси состава H2 : C2H2 < 20 скорость реакции зависит от концентрации водорода и не зависит от концентрации ацетилена, тогда как при отношении реагентов H2 : C2H2 > 20 характерна противоположная зависимость. Наблюдаемая закономерность, с высокой вероятностью, обусловлена конкурентной адсорбцией ацетилена и водорода на активных центрах катализатора.
Установлено, что с ростом температуры реакции (от 30 до 85°С) селективность образования этилена и олигомеров постепенно понижается, что cопровождается увеличением доли этана в продуктах реакции. Предположительно это происходит за счет появления на поверхности катализатора более крупных реакционных центров, доступных для реадсорбции этилена.
Показано, что при добавлении СО в реакционную смесь до мольного отношения CO : C2H2 = 0.1 практически полностью блокируются центры реадсорбциии С2Н4, на которых происходит его последующее гидрирование до этана, и селективность по этилену резко возрастает от 4 до 73%. Дальнеешее увеличение отношения CO : C2H2 до 1 приводит к постепенному уменьшению количества центров, доступных для адсорбции водорода, и к закономерному подавлению каталитической активности.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена в рамках государственного задания ИППУ СО РАН в соответствии с Программой фундаментальных научных исследований государственных академий наук на 2013–2020 гг. по направлению V. 46 (проект V. 46.2.5, номер госрегистрации в системе ЕГИСУ НИОКТР № AAAA-A17-117021450096-8).
Список литературы
Арутюнов В.С., Савченко В.И., Шмелев В.М., Седов И.В., Шаповалова О.В., Фокин И.Г., Никитин А.В., Стрекова Л.Н., Тарасов А.И., Дмитрук А.С., Тимофеев К.А. // Горение и взрыв. 2015. Т. 8. № 1. С. 71.
Белов Г.П. // Катализ в пром-сти. 2014. № 3. С. 13.
Тюрин А.А., Еременко Б.А., Удалова Е.А. // Башкир. хим. журн. 2013. Т. 20. № 1. С. 149.
Мухина Т.Н., Барабанов Н.Л., Бабаш С.Е. Пиролиз углеводородного сырья. М.: Химия, 1987. С. 147.
Погосян Н.М., Погосян М.Д., Шаповалова О.В., Стрекова Л.Н., Таванян Л.А. // Нефтегазохимия. 2016. № 2. С. 38.
Liu X., Li Y., Lee J.W., Hong C.-Y., Mou C.-Y., Jang B.W.L. // Appl. Catal. A. Gen. 2012. V. 439. P. 8.
Yan X., Wheeler J., Jang B., Lin W.-Y., Zhao B. // Appl. Catal. A. Gen. 2014. V. 487. P. 36.
Borodziski A., Bond G.C. // Catal. Rev. 2006. V. 48. P. 91.
Pat. US20070191655 A1 USA, 2007.
Pat. US20070021638 A1 USA, 2007.
Лапидус А.Л., Голубева И.А., Жагфаров Ф.Г. Газохимия. М.: ЦентрЛитНефтеГаз, 2008. 450 с.
Шитова Н.Б., Шляпин Д.А., Афонасенко Т.Н., Кудря Е.Н., Цырульников П.Г., Лихолобов В.А. // Кинетика и катализ. 2011. Т. 52. № 2. С. 259.
Smirnova N.S., Shlyapin D.A., Mironenko O.O., Anoshkina E.A., Temerev V.L., Shitova N.B., Kochubey D.I., Tsyrul’nikov P.G. // J. Mol. Catal. A. Chem. 2012. V. 358. P. 152.
Smirnova N.S., Shlyapin D.A., Shitova N.B., Kochubey D.I., Tsyrul’nikov P.G. // J. Mol. Catal. A. Chem. 2015. V. 403. P. 10.
Смирнова Н.С., Шляпин Д.А., Тренихин М.В., Кочубей Д.И., Цырульников П.Г. // Изв. вузов. Химия и хим. технология. 2015. Т. 58. № 7. С. 31.
Глыздова Д.В., Смирнова Н.С., Леонтьева Н.Н., Герасимов Е.Ю., Просвирин И.П., Вершинин В.И., Шляпин Д.А., Цырульников П.Г. // Кинетика и катализ. 2017. Т. 58. № 2. С. 152.
Glyzdova D.V., Vedyagin A.A., Tsapina A.M., Kaichev V.V., Trigub A.L., Trenikhin M.V., Shlyapin D.A., Tsyrulnikov P.G., Lavrenov A.V. // Appl. Catal. A. 2018. V. 563. P. 18.
Borodziski A., Bond G.C. // Catal. Rev. 2008. V. 50. P. 379.
Рассолов А.В., Марков П.В., Брагина Г.О., Баева Г.Н., Криворученко Д.С., Машковский И.С., Якушев И.А., Варгафтик М.Н., Стахеев А.Ю. // Кинетика и катализ. 2016. Т. 57. № 6. С. 865.
Барбов А.В., Филиппов Д.В., Меркин А.А., Прозоров Д.А. // Журн. физ. химии. 2014. Т. 88. № 6. С. 1026.
Vattuone L., Yeo Y.Y., Kose R., King D.A. // Surf. Sci. 2000. V. 447. P. 1.
Николаев С.А., Занавескин Л.Н., Смирнов В.В., Аверьянов В.А., Занавескин К.Л. // Успехи химии. 2009. Т. 78. № 3. С. 248.
Pradier C.M., Mazina M., Berthier Y., Oudar J. // J. Mol. Catal. 1994. V. 89. P. 211.
Тeмкин О.Н., Шестаков Г.К., Трегер Ю.Ф. Ацетилен. Химия. Механизмы реакций. Технология. М.: Химия, 1991. 416 с.
Bos A.N.R., Westerterp K.R. // Chem. Eng. Process. 1993. V. 32. P. 1.
Liu Y., McCue A.J., Miao C., Feng J., Li D., Anderson J.A. // J. Catal. 2018. V. 364. P. 406.
Garcia-Mota M., Bridier B., Perez-Ramirez J., Lopez N. // J. Catal. 2010. V. 273. P. 92.
Zhang Y., Diao W., Williams C.T., Monnier J.R. // Appl. Catal. A. 2014. V. 469. P. 419.
Bond G.C., Wells P.B. // J. Catal. 1965. V. 5. P. 65.
Inoue Y., Yasumori I. // J. Phys. Chem. 1971. V. 75. P. 880.
Borodziński A., Gołȩbiowski A. // Langmuir. 1997. V. 13. № 5. P. 883.
Li J.N., Pu M., Ma C.C., Tian Y., He J., Evans D.G. // J. Mol. Catal. A. Chem. 2012. V. 359. P. 14.
Al-Ammar A.S., Webb G. // J. Chem. Soc. Faraday Trans. 1979. V. 75. P. 1900.
Larsson M., Jansson J., Asplund S. // J. Catal. 1998. V. 178. № 1. P. 49.
López N., Bridier B., Pérez-Ramírez J. // J. Phys. Chem. C. 2008. V. 112. P. 9346.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ