Кинетика и катализ, 2019, T. 60, № 4, стр. 486-498
Окислительные катализаторы Pt–Pd/MnOx–Al2O3: перспективы применения для контроля за содержанием сажи в отработанных газах дизеля
С. А. Яшник a, *, З. Р. Исмагилов a
a ФГБУН “Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. акад. Лаврентьева, 5, Россия
* E-mail: yashnik@catalysis.ru
Поступила в редакцию 24.12.2018
После доработки 28.02.2019
Принята к публикации 28.02.2019
Аннотация
Вместе с отработанными газами автотранспорта с дизельными двигателями в окружающую среду выбрасываются сажа и токсичные оксиды азота. В настоящей работе рассмотрена возможность удаления дизельной сажи на поверхности окислительного катализатора Pt–Pd/MnOx–Al2O3 с пониженным содержанием Pt–Pd. Скорость и энергия активации каталитического окисления дизельной сажи кислородом и NOx изучены в изотермическом режиме и сопоставлены с кинетическими характеристиками окисления угольной сажи и двух образцов синтетических саж (Printex U, Vulkan XC-72). Физико-химические свойства саж, такие как нано- и микроструктура, элементный состав, состав функциональных групп поверхности, определяют ее реакционную способность к окислению, которая выше в смесях с NOx, чем в кислородсодержащих смесях.
ВЕДЕНИЕ
Начиная с 2015 г. дизельный автотранспорт, невзирая на высокую экономичность и низкую эмиссию диоксида углерода, подвергается критике за высокое количество оксидов азота и сажи, выбрасываемых с выхлопными газами в окружающую среду. Страны Европы существенно опережают Россию по ужесточению стандартов к составу вредных выбросов от автотранспорта. В сравнении с нормами Евро-4, стандарт Евро-5, действовавший в странах Евросоюза с 2009 г. [1] и вступивший в силу на территории России с 2016 г. [2], требует заметного снижения содержания сажи (в 5 раз) и NOx (на 30%) в выхлопных газах дизельного двигателя. Существенным нововведением Евро-5 было ограничение числа взвешенных частиц в выхлопных газах. С 1 сентября 2015 г. в странах Евросоюза введен стандарт Евро-6. Он предусматривает дальнейшее уменьшение содержания NOx для легких грузовых автомобилей до 80 мг/км вместо 180 мг/км в Евро-5 [1], а для тяжелого грузового транспорта сокращение NOx в 5 раз (с 2 до 0.4 г/кВт-ч), взвешенных частиц вдвое (с 0.02 до 0.01 г/кВт-ч) и несгоревших углеводородов в 3.5 раза [3]. В Евро-6 запланировано также введение нового протокола испытаний, отражающего реальные дорожные условия [1, 4]. Сроки введения Евро-6 на территории России пока не оговорены, поэтому есть время для поиска новых и совершенствования существующих каталитических систем очистки отработанных газов.
Для соответствия требованиям Евро-5 и Евро-6 по содержанию токсичных компонентов в отработанных газах, легковой и грузовой дизельный автотранспорт оснащают сложной системой очистки (нейтрализации) отработанных газов. Система очистки включают комбинацию отдельных модулей с окислительным катализатором, сажевым фильтром и катализатором селективного восстановления оксидов азота или модуль, совмещающий указанные функции в одном [5–7]. Сажевые фильтры закрытого типа (так называемые Diesel Particulate Filter (DPF)) позволяют удалять до 95 мас. % сажи с размерами частиц до 100 нм [8] путем фильтрации отработанных газов через пористые стенки керамического блока, изготовленного из корунда или карбида кремния [5, 8]. Дизайн сажевых фильтров, нашедших практическое приложение, основан на блоках сотовой структуры с симметричными [5, 6, 8, 9] или ассиметричными [5, 10] каналами, поочередно закрытыми с одного конца. Такая конструкция обеспечивает фильтрацию газов через стенки пористого материала и ее отложение в/на стенках фильтра. Однако после фильтрации в отработанных газах остаются твердые частицы размером менее 50 нм, наносящие наиболее опасный вред здоровью человека [11] и жестко регламентируемые в современных стандартах [1, 3]. Совершенствование конструкций сажевых фильтров путем совмещения фильтрации газов и каталитического окисления сажи (в слое нанесенного на стенки фильтра катализатора) позволило повысить эффективность удаления сажи до 99–99.9% [6, 11]. Каталитические сажевые фильтры делают возможным также эффективное снижение содержания монооксида углерода и несгоревших углеводородов в отработанных газах [6], а также способствуют снижению температур пассивной и активной регенерации [5]. Требования к фильтрам сажевых частиц, такие как высокая эффективность фильтрации, небольшое газодинамическое сопротивление, низкий коэффициент термического расширения, высокая устойчивость к термическим нагрузкам и химическому воздействию зольных оксидов, сформулированы в работе [9]. Особенности конструкций и свойств материалов, которые гарантируют соответствие фильтров указанным требованиям, подробно проанализированы в обзорных работах [5, 8, 11].
Научные лаборатории и автомобильные компании исследуют различные составы каталитических покрытий для сажевых фильтров, однако практическое применение нашли преимущественно катализаторы с нанесенными частицами Pt, такие как Pt/CeO2 и Pt/TiO2 [5, 6, 11–15]. Повышения окислительной способности Pt/CeO2 достигают путем модифицирования CeO2 оксидами Zr, La, Sm, Y, Pr и другими [5, 11, 16]. Предпочтение Pt отдано в силу ее высокой активности в окислении NO до NO2 [15, 17–19]. Диоксид азота, как известно, инициирует окисление сажи при температурах 250–350°С [20, 21], что на 150–200°С ниже по сравнению с кислородсодержащими смесями [5, 6, 8]. В реакции окисления NO активны крупные частицы Pt (20–22 нм для Pt/SiO2 [17] и Pt/Al2O3 [19]), что обуславливает необходимость введения в катализатор больших концентраций Pt (до 7 мас. % [22]) и высокую стоимость сажевого фильтра [6].
Для очистки отработанных газов дизельных двигателей от СО и углеводородов нами был предложен блочный катализатор сотовой структуры с Pt–Pd/MnOx–Al2O3 в качестве каталитического покрытия [23]. Катализатор имеет пониженное содержание благородных металлов (10–15 г/фут3 или 0.17–0.35 г/л), однако не уступает по каталитической эффективности известным промышленным аналогам окислительного катализатора с высоким содержанием Pt–Pd (55–75 г/фут3 [12]). Высокая эффективность Pt–Pd/MnOx–Al2O3 связана с эффектами термоактивации Mn–Al–O-системы [24–26] и синергизма между Pt/Pd и дефектным Mn3O4 в реакциях окисления углеводородов и CO [27–29]. Однако проблема удаления сажи, наиболее остро касающаяся дизельных двигателей, для этой каталитической системы нами ранее не рассматривалась.
С целью выявления перспективности использования Pt–Pd/MnOx–Al2O3 для каталитических сажевых фильтров было проведено сравнительное исследование его кинетических характеристик в окислении саж разного происхождения: дизельной, угольной и коммерческих образцов (Printex U, Vulkan XC-72), различающихся составом функциональных групп поверхности, химическим составом, текстурными и морфологическими свойствами. В качестве дизельной сажи для экспериментов взята сажа, накопившаяся в центробежном циклоне в ходе натурных испытаний системы очистки отработанных газов грузового автомобиля КАМаЗ с дизельным двигателем [30].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализатора
Химический и фазовый состав катализатора Pt–Pd/MnOx–Al2O3 идентичен составу каталитического покрытия, использованного нами для приготовления блочного катализатора с пониженным содержанием Pt–Pd в [23]. Процедура его синтеза, подробно описанная в работе [23], заключается в последовательной пропитке по влагоемкости порошка Al2O3 растворами солей активного компонента – Mn, Pt и Pd. Для приготовления катализатора применяли Al2O3 марки Puralox (“Condea Chemie GmbH”), фазовый состав которого соответствует (γ + 40% χ)-Al2O3, удельная поверхность по БЭТ составляет 285 ± 5 м2/г, а влагоемкость – 0.85 см3/г. Порошок Al2O3 пропитывали раствором нитрата марганца (Mn(NO3)2 ⋅ ⋅ 6H2O, х. ч., “Химреактив”), затем сушили и прокаливали при 900°С в течение 4 ч. Pt и Pd вводили в прокаленный порошок MnOx/(γ + 40% χ)-Al2O3 из водно-аммиачного раствора платины динитродиамина (Pt(NH3)2(NO2)2, х. ч., “Аурат”) с концентрацией 0.01 М и водного раствора нитрата палладия (Pd(NO3)2, 25%-ный раствор, х. ч., “Аурат”) с концентрацией 0.04 М, подкисленного азотной кислотой. Между пропитками образец сушили и прокаливали при 450°С в течение 2 ч. Окончательную термическую обработку образца Pt–Pd/MnOx–Al2O3 проводили на воздухе при температуре 600°С в течение 4 ч.
Содержание марганца по данным атомно-адсорбционной спектроскопии с индуктивно-связанной плазмой составляло 4.2 мас. %. Содержание Pt и Pd по данным рентгеноспектрального флуоресцентного анализа было 0.25 ± 0.01 и 0.50 ± 0.02 мас. % соответственно. В процессе термической обработки формировалась высокодисперсная фаза Mn3O4 и твердого раствора γ-Al2O3, допированного катионами Mn3+ [23, 29].
Физико-химические методы исследования образцов саж
В работе использовано четыре типа сажи: 1) дизельная; 2) угольная; 3) Printex U; 4) Vulkan ХС-72. В табл. 1 представлена информация о химическом составе саж, а в табл. 2 – данные об их фазовом составе и основных физико-химических характеристиках.
Таблица 1.
Химический состав саж
| № | Образец | Содержание, мас. % | Содержание* Н2О, мас. % | Зольность*, мас. % |
||||
|---|---|---|---|---|---|---|---|---|
| С | H | N | S | O | ||||
| 1 | Дизельная сажа (Д) | 55.9 | 1.8 | 2.2 | 1.7 | 5.2 | 4.9 | 20.0 |
| 2 | Угольная сажа (У) | 68.8 | 4.6 | 2.3 | 0.4 | 8.6 | 3.9 | 26.1 |
| 3 | Сажа Д/окисл. 400°С | 37.5 | 0.7 | 1.2 | 1.1 | 8.3 | – | – |
| 4 | Сажа У/окисл. 400°С | 47.8 | 2.0 | 1.9 | 0.3 | 13.8 | – | – |
| 5 | Printex U | 94.2 | 0.8 | 0.2 | 0.4 | 3.1 | 1.8 | 2.9 |
| 6 | Vulkan ХС-72 | 98.8 | 0.2 | 0.0 | 0.7 | 0.2 | 0.3 | 0.3 |
Таблица 2.
Фазовый состав и текстурные характеристики образцов сажи
| № | Образец | Фазовый состав | ID/IGа | CO/CO2б | Текстурные характеристики | Размер частиц (по ПЭМ), нм | |||
|---|---|---|---|---|---|---|---|---|---|
| SБЭТв, м2/г | Stг, м2/г | VΣд, см3/г | Vмикрое, см3/г | ||||||
| 1 | Дизельная сажа (Д) | Аморфный углерод | 10.2 | 0.62 | 23 | 24 | 0.04 | 0.00 | 50 ± 10, сросшиеся |
| 2 | Угольная сажи (У) | Аморфный углерод | * | 1.13 | 5 | 3.7 | 0.013 | 0.00 | 80 ± 15 |
| 3 | Сажа Д/окисл. 400°С | Аморфный углерод | – | 1.88 | 273 | 142 | 0.27 | 0.04 | 20 ± 15, сросшиеся |
| 4 | Сажа У/окисл. 400°С | Аморфный углерод | – | 1.38 | 85 | 51 | 0.06 | 0.01 | 30 ± 15, сросшиеся |
| 5 | Printex U | Графитоподобный углерод | 23.1 | 3.03 | 82 | 82 | 0.74 | 0.00 | 20–25 |
| 6 | Vulkan ХС-72 | Графитоподобный углерод | 5.1 | 5.25 | 210 | 97 | 0.35 | 0.05 | 40 ± 10 |
Содержание углерода, водорода, азота, серы и кислорода (CHNS/O-анализ) в образцах саж определяли на анализаторе Vario MicroCube (“Elementar Analysensysteme GmbH”, Германия), снабженном детектором по теплопроводности.
Текстурные характеристики образцов саж (удельную поверхность (SБЭТ), внешнюю поверхность кристаллитов (St), объем пор (VΣ) и объем микропор (Vмикро)) изучали на автоматизированном волюмометрическом приборе ASAP 2400 (“Micromeritics”, США) путем измерения изотерм низкотемпературной адсорбции азота при 77 K и их последующей обработки. Предобработку образцов проводили при 150°С в течение 16 ч.
Рентгенофазовый анализ (РФА) образцов сажи осуществляли методом порошковой рентгеновской дифракции на дифрактометре HZG-4С (“Freiberger Prazisionmechanik”, Германия) в монохроматизированном CuKα-излучении (λ = = 1.5418 Å) с последующей идентификацией фаз с помощью картотеки JCPDS.
Размер частиц сажи определяли по снимкам просвечивающей электронной микроскопии (ПЭМ), полученным на электронном микроскопе JEM–2010 (“JEOL”, Япония) при ускоряющем напряжении 200 кВ.
Термический анализ саж, включающий дифференциальный термический (ДТА), термогравиметрический (ТГА) и дифференциальный термогравиметрический (ДТГ) анализы, выполняли на термоанализаторе NETZSCH STA 449 C (“NETZSCH-Geratebau GmbH”, Германия) в интервале температур 25–900°С со скоростью подъема температуры 10°С/мин в атмосфере воздуха.
Спектры комбинационного рассеивания (КР) регистрировали на КР-Фурье-спектрометре RFS 100/S (“Bruker”, Германия). В качестве источника возбуждения использовали линию 1064 нм Nd-YAG лазера мощностью 30–50 мBт.
Природу функциональных групп на поверхности саж изучали методом ИК-спектроскопии, регистрируя спектры на приборе Cary-660 FTIR (“Agilent Technologies”, США) в режиме диффузного отражения на приставке DiffusIRTM (“Pike Technology”, США) в интервале частот 4000–250 см–1 с разрешением 4 см–1 и накоплением 256 сканов. Образцы саж предварительно разбавляли KBr в соотношении 1/100. ИК-спектры диффузного отражения (ИКС-ДО) представлены в координатах: функция Кубелки–Мунка, F(R)–волновое число.
Содержание кислородсодержащих групп определяли из профилей термо-программируемого разложения (ТПД) саж в аргоне. ТПД-профили получали в проточном кварцевом реакторе, расположенном внутри электрической печи и оснащенном контрольной и измерительной термопарами типа хромель–алюмель. Образец в количестве 50 мг с фракционным составом 0.25–0.50 мм загружали в реактор, продували час потоком Ar (100 см3/мин) при 100°С для удаления адсорбированной воды. Реактор с образцом нагревали в токе Ar (100 см3/мин) от 100 до 950°С со скоростью 5 град/мин, регистрируя количество выделяющихся СО и СО2 с помощью газоанализатора Тест-1 (ООО “Бонер”, Россия) с оптическим датчиком на СО2 и электрохимическим датчиком на СО.
Каталитические тесты по окислению сажи
Эксперименты проводили в изотермических условиях, поддерживая температуру в слое катализатора равной 375, 400, 425, 450, 475°C и др. в зависимости от вида сажи. В экспериментах использовали реактор (из кварца) с внутренним диаметром 4 мм, навеску катализатор/сажа в количестве 50 мг, объемное соотношение скорости потока газа к объему образца составляло 90 000 ч–1. Навеску катализатора и сажи смешивали в массовом соотношении 9/1, растирали в ступке для обеспечения контакта между частицами сажи и катализатора, затем прессовали в таблетки и дробили на фракцию с размером 0.25–0.5 мм. Далее образец катализатор/сажа перемешивали в соотношении 1/1 с кварцем того же фракционного состава для исключения перегрева при протекании экзотермической реакции.
Перед проведением эксперимента образец катализатор/сажа нагревали в потоке аргона со скоростью 10°С/мин до заданной (изотермической) температуры, выдерживали в течение 30 мин. Затем Ar заменяли на реакционную смесь, которая в первой серии экспериментов содержала 10 об. % О2 в Ar, а во второй – 10 об. % О2 и 450 м. д. NO в Ar. Смесь газов подавали в реактор со скоростью 150 см3/мин. Регистрировали температуру в слое катализатора и концентрации компонентов газовой смеси на выходе из реактора на протяжении всего эксперимента, который завершали после достижения стационарного состава газовой смеси. Газовую смесь анализировали на газоанализаторе ТЕСТ-1 (ООО “Бонер”, Россия) с электрохимическими (CO, NO, NO2) и оптическими (O2 и CO2) датчиками. Точность определения была 5 м. д. для NO, NO2, CO; 0.05 об. % CО2; 0.1 об. % O2.
Для контроля масс-баланса по углероду в каждом эксперименте после достижения стационарных значений концентрации СО/СО2 в газовой смеси на выходе из реактора находили количество сажи, невыгоревшей при заданной изотермической температуре. Для этого проводили нагрев образца катализатор/сажа от заданной температуры до 700°С (900°С для Vulkan XC-72) со скоростью 10 град/мин и регистрировали СО/СО2 на выходе из реактора. Общее количество СО/СО2, зафиксированное в изотермическом и программируемом режимах, относили к массе сажи, загруженной в реактор.
Методика математической обработки экспериментальных данных по окислению сажи в изотермическом режиме подробно обсуждается в [31–33]. Скорость реакции при изотермической температуре (W Т, мольсажи ${\text{г }}_{{{\text{к а т }}}}^{{--1}}$ с–1), отнесенную на грамм катализатора, рассчитывали путем дифференцирования кривой концентрации сажи в реакторе от времени, предполагая псевдопервый порядок реакции по саже и постоянство концентрации кислорода в реакционной смеси (в силу избытка кислорода):
(1)
${{W}^{T}} = - {{k}_{{{\text{э ф ф }}}}}\left[ {C_{{{\text{soot}}}}^{t}} \right]{{P}_{{{{{\text{O}}}_{{\text{2}}}}}}},$Содержание невыгоревшей сажи $C_{{{\text{soot}}}}^{t}$ от времени вычисляли по экспериментальному профилю суммарной концентрации СО2 и СО от времени. Кинетические данные аппроксимировали Аррениусовской зависимостью (ln WТ – 1/T) и находили энергию активации (Еа) (кДж/моль) окисления сажи при заданной степени ее превращения (10, 20, 30 и т.д.), используя уравнение:
(2)
${\text{ln}}\left( {{{W}^{T}}} \right) = {\text{ln}}({{k}_{{{\text{э ф ф }}}}}) + {\text{ln}}\left( {f\left( {C_{{{\text{soot}}}}^{t}} \right)} \right) - \frac{{{{E}_{{\text{a}}}}}}{R}\frac{1}{T},$В экспериментах по окислению сажи в присутствии NO и кислорода в реакционной среде предполагали, что сажа окисляется диоксидом азота [20], образующимся в результате взаимодействия NO с кислородом. Для расчета скорости этой реакции использовали приведенные выше уравнения, полагая, что: 1) парциальное давление кислорода в реакторе постоянно, так как оно намного выше давления NO, и 2) NO не расходуется в процессе удаления сажи.
Приведенные выше условия экспериментов по окислению сажи обеспечивают кинетический режим процесса. Ранее в работе [34] были проведены эксперименты по протоколам тестов Koros–Nowak [35] и Madon–Boudart [36], позволившие исключить область внешнедиффузионных торможений реакции окисления сажи на поверхности катализатора Pt–Pd/MnOx–Al2O3. Было показано, что при объемной скорости потока 90 000 ч–1, температурах 475°С и ниже, массовом соотношении катализатора к дизельной саже 9/1 и разбавлении кварцем в системе катализатор–сажа–окислитель отсутствуют торможения, связанные с внешнедиффузионными массопереносами реагентов и продуктов реакции. Отклонение регистрируемой температуры от заданного значения не превышало 1°С, что доказывало отсутствие эффектов теплопереноса в реакторе.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор температур изотермического окисления саж
Температурные интервалы изотермических экспериментов по каталитическому окислению саж были выбраны с учетом склонности саж разного происхождения к некаталитическому окислению кислородом (10 об. %) и смесью О2 (10 об. %) с NO (500 м. д.). Результаты температурно-программируемого окисления (ТПО) саж суммированы в табл. 3. Некаталитическое окисление образцов дизельной и угольной саж протекает в близких температурных областях и практически не зависит от состава окислительной среды. Процесс инициируется при 340–390°С, достигает максимальной скорости при 510–540°С и завершается при 715–720°С. Состав окислительной среды оказывает влияние на степень превращения сажи в СО/СО2, которая в NO-содержащей среде была несколько выше, составляя 80% для дизельной сажи и 70% для угольной сажи (против 70 и 64% соответственно, в присутствии только кислорода). Следует отметить, что с учетом данных термогравиметрического анализа достигаемая в ТПО экспериментах 80 и 70%-ная степень превращения указанных саж в СО/СО2 близка к 99%-ному выгоранию углерода в них. По данным ТГ зольность дизельной и угольной саж составляла 20 и 26 мас. % соответственно (табл. 1). Энергии активации окисления саж кислородом в отсутствии и в присутствии NO различались слабо и составляли 44–47 кДж/моль для угольной сажи и 49–53 кДж/моль для дизельной.
Таблица 3.
Температуры инициирования окисления сажи (10%), достижения ее 50%-ного и максимального превращения, энергия активации, рассчитанные из экспериментов по некаталитическому окислению сажи в режиме ТПО
| Сажа | Окислительная среда | Температуры (ТХ%, °С) достижения Х%-ной степени превращения сажи | Концентрация СО, м. д. (при температурах, °С) | Еа, кДж/моль | ||
|---|---|---|---|---|---|---|
| Т10% | Т50% | Тmax% (Хmах) | ||||
| Дизельная | 10 об. % О2 | 390 | 540 | 715 (70%) | 35 (200–600) | 49 ± 1 |
| Угольная | 340 | 525 | 720 (64%) | 760 (270–590) | 44 ± 1 | |
| Printex U | 460 | 625 | 860 (95%) | 1500 (490–730) | 120 ± 1 | |
| Vulkan ХС-72 | 625 | 725 | 800 (99%) | 270 (590–800) | 197 ± 2 | |
| Дизельная | 10 об. % О2 + 450 м. д. NO | 385 | 530 | 830 (80%) | 25 (200–600) | 53 ± 1 |
| Угольная | 380 | 510 | 640 (70%) | 540 (270–620) | 47 ± 1 | |
| Printex U | 470 | 640 | 860 (95%) | 890 (490–730) | 142 ± 1 | |
| Vulkan ХС-72 | 660 | 705 | 800 (99%) | 860 (590–800) | 204 ± 2 | |
Температуры инициирования, 50%-ной и максимальной степени превращения дизельной и угольной саж (в СО и СО2) оказались на 85–130 и 180–200°С ниже, чем аналогичные показатели для саж Printex U и Vulkan XC-72 (табл. 3) соответственно. Так же, как и окисление образцов дизельной и угольной саж в режиме ТПО, окисление образцов коммерческих саж смесями О2–Ar и О2–NO–Ar протекало в одном температурном интервале. Однако энергии активации их окисления были значительно выше по сравнению с дизельной и угольной сажами и составляли 120–140 и ~200 кДж/моль для Printex U и Vulkan XC-72 соответственно. Кроме того, для сажи Vulkan XC-72 был характерен достаточно узкий температурный диапазон ее некаталитического окисления, локализованный в области 625–800°С, тогда как при окислении остальных саж выделение СО/СО2 наблюдалось в широком интервале температур. Такое различие в поведение саж в ТПО может быть обусловлено однородностью частиц сажи Vulkan XC-72 по размерам и высокой степенью ее графитизации в отличие от остальных изученных саж. Следует также отметить, что дизельная сажа окислялась наиболее селективно до СО2, найденные при ее некаталитическом окислении концентрации СО не превышали 35 м. д. С наименьшей селективностью окислялся Printex U – концентрации СО доходили до 1500 м. д.
Таким образом, с учетом данных ТПО эксперименты по каталитическому окислению саж в изотермическом режиме проводили в интервале температур 375–450°С для дизельной и угольной саж, 400–550°С для Printex U и 450–600°С для Vulkan XC-72.
Окисление саж на катализаторе Pt–Pd/MnOx–Al2O3 в изотермическом режиме
В контексте настоящей работы интересно проанализировать не только эффективность катализатора Pt–Pd/MnOx–Al2O3 в окислении дизельной сажи, но и сопоставить с результатами по окислению других саж: угольной и коммерческих образцов. Реакционную способность углеродных материалов к окислению кислородом и NOx изучали в изотермическом режиме. Для удобства сопоставления кривые окисления дизельной и угольной саж представлены в виде зависимости скорости реакции, нормированной на массу катализатора, от степени превращения сажи в СО2/СО (рис. 1), а для коммерческих саж (окисляющихся медленнее) – степени превращения от времени (рис. 2).
Рис. 1.
Зависимость скорости выгорания дизельной (а) и угольной (б) саж на катализаторе Pt–Pd/MnOx–Al2O3 от степени ее превращения в СО2/СО в смесях, содержащих 10% О2 (1-2, 1-3, 1-4, 1-5) и 10% О2 + 450 м. д. NO (2-1, 2-2, 2-3, 2-4, 2-5), в изотермическом режиме при различных температурах: 375 (2-1), 400 (1-2, 2-2), 425 (1-3, 2-3), 450 (1-4, 2-4) и 475°С (1-5). Скорость выгорания сажи нормирована на массу катализатора.
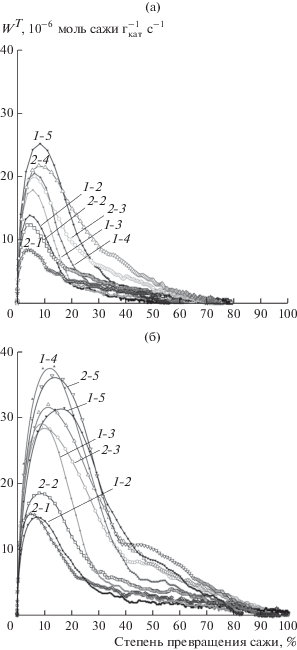
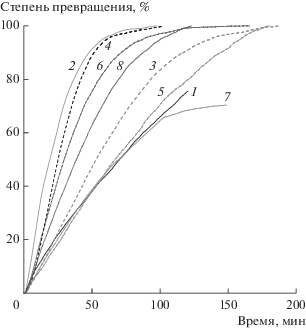
Рис. 2.
Степень превращения в СО2/СО сажи Printex U (1–4) и Vulkane XC-72 (5–8) на катализаторе Pt–Pd/MnOx–Al2O3 от времени в смесях, содержащих 10% О2 (1, 2, 5, 6) и 10% О2 + 450 м. д. NO (3, 4, 7, 8), в изотермическом режиме при различных температурах: 425 (3), 475 (1, 4, 7), 525 (8), 550 (2, 5) и 600°С (6).
Каталитические эксперименты показали, что все сажи окисляются легче при добавлении NOx в реакционную среду, что многократно обсуждалось для дизельной сажи и Printex [37]. Каталитическое окисление NO до NO2 способствует снижению температур окисления сажи и повышению скорости реакции вследствие окисления сажи диоксидом азота, который обладает бóльшим окислительным потенциалом по сравнению с кислородом [20, 21, 38, 39] и реагирует с поверхностью сажи с формированием активных нитратных комплексов [21, 39–42]. Образование NO2 из NO катализируют оксиды марганца [23, 43, 44] и Pt [17, 19]. Окисление дизельной и угольной саж оксидами азота с заметными скоростями протекает при температурах 350 (не приведено на рис. 1) и 375°С (рис. 1, кривая 2–1), обеспечивающими, соответственно, превращение 85 и 99% (в расчете на углерод) за 1.5 ч. Время достижения максимальной конверсии сажи сокращается с ростом температуры: при выбранных скоростях потока (90 000 ч–1) и 425°С для 99%-ного сжигания дизельной сажи требуется 50 мин, а угольной – 40 мин. Для сравнения, в кислороде при 425°С за тоже время выгорает 85% угольной сажи и 75% дизельной.
Скорость окисления угольной и дизельной саж была максимальной при конверсиях 5–12%, а затем существенно падала. При конверсии 25–45% скорость реакции снижалась не так быстро, что наиболее заметно для кривых окисления угольной сажи смесью кислорода и NO (450 м. д.). После достижения конверсии 50–60% для дизельной сажи и 70–80% для угольной сажи замедление скорости ее окисления было значительным, и количество CO2/СО, фиксируемое на выходе из реактора, сопоставимо с точностью анализатора Тест-1, поэтому эти точки для расчета скорости реакции не учитывали. Снижение скорости окисления сажи, наблюдаемое в изотермическом режиме, обсуждается в литературе как в случае ее каталитического [8, 38, 45], так и некаталитического [39] окисления. Оно связано с уменьшением количества сажи, скорость реакции от которого имеет линейную зависимость.
Сопоставление рис. 1а и 1б показывает, что скорость каталитического окисления угольной сажи как кислородом, так и оксидом азота в интервале температур 375–475°С выше по сравнению с таковой для дизельной сажи. Скорости их окисления в среде кислорода различаются на 40% при 425°С и на 20% при 475°С, а в NOx-содержащей среде – на 45% при 375°С и на 30–33% при 400–475°С.
Каталитические эксперименты с образцами коммерческих саж (рис. 2) показали, что они окисляются значительно медленнее. Скорости реакции в кислороде становились заметными при температурах выше 450°С для Printex и 525°С для Vulkan XC-72. При меньших температурах конверсия для Printex U не превышала 20% (450°С) и для ее достижения требовалось около 4 ч, а для Vulkan XC-72 составляла 25% при 525°С. Высокая устойчивость к некаталитическому окислению сажи Vulkan XC-72 обсуждалась в [46].
Скорости окисления сажи на катализаторе Pt–Pd/MnOx–Al2O3 хорошо линеаризируются в координатах Аррениуса для степеней превращения сажи в интервале 5–40% при использовании в качестве окислителя O2 и 5–60% в случае NOх. Рассчитанные из Аррениусовских зависимостей энергии активации представлены в табл. 4. Видно, что величины энергии активации окисления саж кислородом несколько различаются для разных степеней их превращения, но Ea дизельной и угольной саж находятся в пределах 80–100 кДж/моль, Printex U – 100–116 кДж/моль, а для Vulkan XC-72 они самые высокие и равны 140–167 кДж/моль. Зависимость энергии активации от степени превращения может быть связана с увеличением поверхности сажи и ее пористости в ходе окисления. Например, поверхность дизельной сажи увеличивается в 12 раз, а угольной – в 17 раз при конверсии 25–30% при 400°С (табл. 2). Аналогичные предположения уже рассматривались ранее для дизельной сажи в [32, 40], где авторы наблюдали возрастание ее удельной поверхности в 2–4 раза после достижения 25%-ной конверсии при 500°С.
Таблица 4.
Энергия активации, рассчитанная из экспериментов по окислению саж в изотермическом режиме
| № | Сажа | Окислительная среда |
Температурный интервал, °С | Энергия активации Еа (кДж/моль) при степени превращения сажи Х (%) | |||||
|---|---|---|---|---|---|---|---|---|---|
| 10 | 20 | 30 | 40 | 50 | 60 | ||||
| 1 | Дизель | 10 об. % О2 | 400–475 | 79 ± 14 | 128 ± 5 | 101 ± 4 | 90 ± 10 | – | – |
| 10 об. % О2 + + 450 м. д. NO | 375–475 | 68 ± 8 | 78 ± 8 | 66 ± 5 | 66 ± 7 | – | – | ||
| 2 | Угольная сажа | 10 об. % О2 | 400–475 | 78 ± 19 | 108 ± 8 | 128 ± 24 | 95 ± 8 | 88 ± 10 | 81 ± 13 |
| 10 об. % О2 + + 450 м. д. NO | 375–425 425–475 |
58 ± 6 18 ± 1 |
91 ± 8 31 ± 4 |
91 ± 19 29 ± 3 |
73 ± 3 23 ± 13 |
73 ± 26 24 ± 14 |
64 ± 8 28 ± 17 |
||
| 3 | Prirex-U | 10 об. % О2 | 400–550 | 112 ± 6 | 116 ± 7 | 114 ± 6 | 109 ± 18 | 98 ± 24 | 94 ± 9 |
| 10 об. % О2 + + 450 м. д. NO | 400–425 425–475 |
157 ± 28 57 ± 14 |
167 ± 38 70 ± 7 | 173 ± 29 75 ± 13 | 151 ± 65 72 ± 7 |
– 71 ± 3 |
– 73 ± 3 |
||
| 4 | Vulkan XC-72 | 10 об. % О2 | 525–600 | 140 ± 20 | 145 ± 21 | 150 ± 17 | 167 ± 23 | 139 ± 34 | 130 ± 24 |
| 10 об. % О2 + + 450 м. д. NO | 450–525 | 74 ± 19 | 83 ± 19 | 91 ± 11 | 130 ± 13 | 46 ± 10 | 43 ± 10 | ||
Схожие тенденции наблюдаются для окисления саж разного происхождения оксидами азота, однако величины Еа этого процесса были заметно ниже. Они составляют около 66–70 кДж/моль для дизельной сажи и 75–90 кДж/моль для Vulkan XC-72. Отметим, что для угольной сажи и Printex U энергия активации зависит от температурного интервала, например, для угольной сажи она равна 73–91 кДж/моль при 375–425°С, но ее значение уменьшается втрое при повышении температуры до 450–475°С, что, возможно, обусловлено внешнедиффузионными ограничениями.
В целом, наблюдаемая нами меньшая энергия активации каталитического окисления сажи смесью, содержащей NOх, по сравнению с одним кислородом согласуется с литературными данными [15, 20, 21, 38, 42], однако сами величины Еа отличаются. Это может быть связано как с разной природой (дизельная и коммерческая) и микроструктурой (поверхность, пористость, степень графитизации, функциональные группы, и др.) сажи [31, 33, 40, 42, 45], так и природой катализатора [33, 38], используемыми авторами в вышеуказанных исследованиях. Энергия активации окисления сажи кислородом на катализаторе Pt–Pd/MnOx–Al2O3 ниже величин, характерных для каталитического окисления на 1%Pt/Al2O3 (139–169 кДж/моль [38]), а также некаталитического окисления дизельной сажи (137 ± 9 [32]) и Printex U (133 [32] и 169 кДж/моль [45]).
Каталитические свойства Pt–Pd/MnOx–Al2O3 vrs физико-химических свойств саж
Различие в температурах выгорания дизельной сажи и Printex U, наиболее часто применяемой для моделирования процессов пассивной и активной регенерации каталитических сажевых фильтров, связывают с бóльшим содержанием летучих органических соединений [6, 37, 47] (преимущественно углеводородов), адсорбированных на дизельной саже. Учитывая этот вывод, сопоставим реакционную способность саж разного происхождения с их химическим и фазовым составом, природой функциональных групп поверхности, а также с текстурными и морфологическими свойствами саж. Основные физико-химические характеристики коммерческих саж Printex U [47, 48] и Vulkan XC-72 [46, 49] достаточно подробно описаны в литературе, в нашей работе они использованы для объяснения некоторых кинетических закономерностей окисления саж различного происхождения на поверхности катализатора Pt–Pd/MnOx–Al2O3. Физико-химические свойства образцов саж приведены в табл. 1 и 2.
Дизельная и угольная сажи состоят из частиц аморфного углерода, наблюдаемого на дифрактограммах в виде гало в области углов 2θ = 24°–25°. Сажи Printex U и Vulkan XC-72, согласно литературным данным [46, 48], имеют турбостратную структуру (промежуточную между аморфным углеродом и графитом). КР-спектры дизельной и коммерческих саж содержат полосы при 1600–1607 см–1 (G-линия) и 1290–1320 см–1 (D-линия), являющиеся характеристическими для углеродных материалов со структурой графита и дефектной (разупорядоченной) структурой графитных слоев соответственно [50]. Анализ G- и D-линий показывает, что Vulkan XC-72 лучше окристаллизован, чем Printex U и дизельная сажа, поскольку G- и D-полосы в его спектре ýже, а соотношение интенсивностей ID/IG, указывающее на степень разупорядоченности графитоподобных структур [37, 51], меньше (5.1 против 23 и 10.2 соответственно, табл. 2). Отметим, что в КР-спектре дизельной сажи имеется широкий пик (около 1520 см–1) между G- и D-линиями, который относится к аморфному углероду в sp3-гибритизации [50]. Таким образом, для образцов дизельной и коммерческих саж прослеживается взаимосвязь между их наноструктурой и реакционной способностью. Аморфный углерод дизельной сажи и более разупорядоченная структура сажи Printex U легче окисляются кислородом и NOx на катализаторе Pt–Pd/MnOx–Al2O3, чем сажа Vulkan XC-72 с более графитизированной структурой. Эта тенденция согласуется с литературными данными, доказывающими лучшую реакционную способность к окислению частиц сажи с неупорядоченной наноструктурой (с высокими значениями ID/IG [52, 53]) и низкой степенью графитизации (с большой полушириной D1-линии [53, 54]) в сравнении с окристаллизованными сажами с упорядоченными графеновыми слоями [45, 51, 52, 54, 55]. С другой стороны, скорость окисления сажи, получаемой при сжигании биодизельного топлива, выше по сравнению с дизельной сажей, хотя первый образец характеризуется более упорядоченной графитоподобной структурой, меньшим содержанием аморфного углерода и значительной степенью графитизации [56].
На ПЭМ-снимках первичные частицы угольной и дизельной саж имеют сферическую форму с концентрической графитоподобной наноструктурой приповерхностного слоя и соединены в цепочечные агломераты, достигающие в некоторых случаях микронных размеров. Первичные частицы угольной сажи были несколько крупнее (65–95 нм против 40–60 нм для дизельной сажи), что объясняет меньшую величину ее удельной поверхностью (5 против 23 м2/г, табл. 2). Отметим, что размер частиц дизельной и угольной саж был больше, чем характерно для Printex U (25–30 нм [37]) и Vulkan [46], хотя нано- и микроструктура их частиц похожи [37, 46, 48]. Таким образом, текстурные и морфологические свойства дизельной и угольной саж существенно отличаются от свойств коммерческих образцов Printex U и Vulkan (табл. 2) из-за различия в размерах первичных частиц. Сопоставление данных по каталитическому окислению саж кислородом/NOx с их текстурными характеристиками указывает на обратную зависимость между реакционной способностью сажи и их удельной поверхностью (размером частиц), что противоречит тенденциям, описанным для дизельной [56] и биодизельной [57] саж. Вместе с тем, прокаливание дизельной и угольной саж в кислородсодержащей смеси (10 об. %) при 400°С даже в течение 15 мин сопровождается ростом поверхности (в 12–17 раз) и пористости частиц (в 5–6 раз), после чего величины удельной поверхности и поверхности кристаллитов приближаются к характеристикам Printex U и Vulkan (табл. 2). Несмотря на это, реакционная способность к окислению у угольной сажи, как следует из экспериментов в изотермическом режиме, не снижается, а, наоборот, несколько повышается после достижения 25–30%-ной конверсии в окислительных средах (рис. 1б). Причина такого поведения может быть связана с изменением элементного состава саж и состава функциональных групп поверхности при окислительной обработке.
По данным СНNS/O-анализа, ИК-спектроскопии и ТПД-Ar элементный состав и поверхностные свойства дизельной, угольной и коммерческих саж существенно различаются. Содержание углерода в дизельной и угольной сажах заметно ниже, чем в коммерческих образцах (около 56 и 69 мас. % соответственно против 94–99 мас. %, табл. 1). Кислорода и водорода в угольной саже больше в 1.7/2.5 раза, чем в дизельной саже, и в 2.8/5.8 раза – чем в Printex U, тогда как в Vulkan XC-72 эти элементы практически отсутствуют (табл. 1). Сера в заметных количествах (1.7 мас. %) присутствует только в дизельной саже. Кроме того, дизельная и угольная сажи имеют высокую зольность (20–26 мас. %), химический состав золы определяется оксидами Fe, Al, Si, Ca, Ba, K [58]. Эксперименты по некаталитическому окислению сажи в режиме ТПО (табл. 3) и каталитическому окислению в изотермическом режиме (рис. 1 и рис. 2) показали, что дизельная и угольная сажи выгорали быстрее и при меньших температурах в сравнении с коммерческими сажами. Сажи с 3–8 мас. % кислорода имели близкие энергии активации их окисления (90–110 кДж/моль для 40%-ной конверсии сажи), тем не менее, тенденция к росту скорости реакции и Ea с уменьшением количества кислорода в саже все же прослеживается: Еа составляла 90 ± 10, 109 ± 18 и 167 ± 23 кДж/моль для дизельной, Printex U и Vulkan XС-72 соответственно (табл. 4). Улучшение реакционной способности с повышением содержания кислорода в саже уже обсуждалась при сравнении свойств дизельной сажи с Printex U и углеродных материалов, полученных пиролизом битума [37] и сжиганием кислородсодержащих углеводородных топлив [56, 57, 59].
В ИК-спектрах дизельной (рис. 3, кривая 1) и угольной (рис. 3, кривая 3) саж присутствуют несколько полос поглощения (п. п.), относящихся к различным функциональным группам. Во-первых, п. п. 2930 и 3050 см–1, которые соответствуют колебаниям C–H ароматического кольца [47, 60]. Во-вторых, п. п. 1618 см–1, характеризующая валентные колебания карбонильных групп (C=O) [61–63] и подтверждающая присутствие хинонных групп (О=С–R–C=O) на поверхности саж. Хинонные и ароматические группы достаточно стабильны и, по-видимому, не подвергаются окислению при 400°С (во всяком случае, в течение первых 15 мин), поскольку интенсивность их полос практически не изменяется при окислительной обработке дизельной (рис.3, кривая 2) и угольной (рис. 3,кривая 4) саж. В-третьих, п. п. 2856, 2920, 2958 см–1, характерные для колебаний С–Н насыщенных углеводородов (от СН2- и СН3-групп [47, 60, 61, 64]), указывают на наличие в составе саж углерода с sp3-гибридизацией (например, аморфного). Это согласуется с наблюдением широкой полосы при 1520 см–1 и D-линии в КР-спектре дизельной сажи. Дополнительные полосы 1457 и 1368 см–1 в спектре угольной сажи относятся к деформационным колебаниям СН2- и СН3-групп [64]. Судя по интенсивности п. п. 2856, 2920, 2958 см–1 доля алифатических углеводородов выше в угольной саже, но их количество снижается практически вдвое после окислительной обработки как угольной, так и дизельной саж. Кроме вышеупомянутых групп на поверхности дизельной и угольной саж имеется незначительное число эфирных, ангидридных и фенольных групп (–С=О, ν = 1085–1160 и 3426 см–1 соответственно [21, 61–63]). Высокая интенсивность полос 1720, 1272 и 3230 см–1 (от валентных колебаний –С=О [37, 62], –С–О [37, 61] и –О–Н [61, 62]) в спектре дизельной сажи указывает на высокую концентрацию поверхностных карбоксильных (–COOH) и лактонных (–С(О)С=О) групп [60, 61], причем их доля снижается при окислительной обработке. На поверхности угольной сажи карбоксильные группы отсутствуют, но возможно присутствие карбоксилатных групп (–RCOO–, ν = 1368 cм–1 [61]).
Рис. 3.
ИКС-ДО дизельной (1, 2) и угольной (3, 4) саж до (1, 3) и после их окисленная при 400°С с течение 15 мин (2, 4).
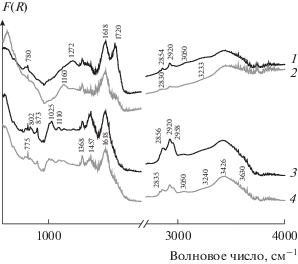
В ИК-спектре Printex U [37, 48] и Vulkan XC-72 обычно не регистрируются колебания С–Н, С=О и –С=Н (ароматического кольца), что указывает на их углеродный каркас и отсутствие адсорбированных углеводородов и кислородсодержащих групп на их поверхности [21, 37, 48].
Данные ИК-спектроскопии о составе кислородсодержащих функциональных групп саж разного происхождения подтверждены методом термопрограммируемого разложения в аргоне (ТПД-Ar). Известно, что кислородсодержащие группы углеродных материалов разлагаются при разных температурах нагрева с выделением CO2 и/или CO. Как правило, пики появления СО2 при 250–400 и 350–550°С связывают с разложением карбоксильных [61, 63, 65–67] и лактонных [63, 66, 67] групп соответственно. СО2 и СО, образующиеся в одном интервале температур (550–650°С [61, 63]), указывают на ангидридные группы. С выделением СО в высокотемпературной области разлагаются фенольные (600–700°С [61, 63]), эфирные (700°С [63]), карбонильные и хинонные (700–950°С [61, 63, 68]) группы. Анализ температурных профилей выделения CO2 и CO (рис. 4), фиксируемых в ТПД-Ar экспериментах с сажами, показывает, что максимальное количество кислородсодержащих групп содержит дизельная сажа. Они представлены в основном карбоксильными и лактонными группами (рис. 4а, кривая 1); ангидридные, фенольные и хинонные группы присутствуют в меньшей концентрации (рис. 4б, кривая 1). Число кислородсодержащих групп уменьшается после обработки дизельной сажи в окислительной смеси (10 об. % O2 в аргоне) при 400°С в течение 15 мин, преимущественно за счет удаления ‒СООН-групп и значительного снижения доли лактонных групп (рис. 4а, кривая 2). Угольная сажа содержит ангидридные и фенольные группы (рис. 4а, кривая 3), но при окислительной обработке на ее поверхности формируется некоторое количество карбоксильных групп (рис. 4а, кривая 4). В коммерческих сажах Printex U и Vulkan XC-72 обнаружены только хинонные группы, что согласуется с литературными данными [37, 46].
Рис. 4.
Концентрационные кривые выделения СО2 (а) и СО (б) в ходе термо-программируемого разложения саж в аргоне: дизельная (1), дизельная, окисленная при 400°С в течение 15 мин (2), угольная (3), угольная, окисленная при 400°С в течение 15 мин (4), Printex U (5), Vulkan XC-72 (6).
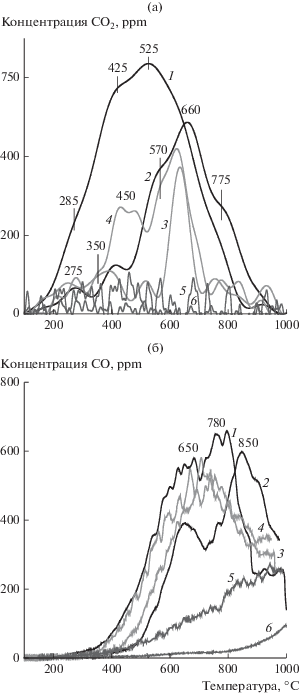
Сравнение данных о составе функциональных групп на поверхности саж разного происхождения с результатами кинетических экспериментов показывает, что лучше окисляются угольная и дизельная сажи, в состав которых входят алифатические углеводороды. Чем выше их содержание, тем легче протекает процесс, что объясняет бóльшую склонность к окислению угольной сажи в сравнении с дизельной. Наблюдаемая тенденция согласуется с литературными данными о повышенной реакционной способности сажи, формирующейся при сгорании биодизеля [69, 70], и дизельной сажи, образующейся при работе легких дизельных двигателей [48], в сравнении с сажей от тяжелых грузовых двигателей [48] и Printex U [37, 47] благодаря высокому содержанию алифатических углеводородов. Меньшее влияние на реакционную способность сажи оказывают кислородсодержащие группы, вклад которых, по-видимому, снижается от карбоксильных и лактонных к ангидридным группам. Формирование карбоксильных групп в угольной саже в ходе окислительной обработки позволяет объяснить некоторое увеличение скорости ее окисления по достижению 25–30%-го превращения. Наличие только хинонных групп в составе коммерческой сажи Vulkan ХС-72 является одной их причин ее высокой устойчивости к окислению.
ЗАКЛЮЧЕНИЕ
Сравнительное исследование окислительного катализатора Pt–Pd/MnOx–Al2O3 с пониженным содержанием Pt–Pd показало его высокую активность в окислении дизельной и угольной саж кислородом и оксидами азота при температурах 400–450 и 375–425°С соответственно, что говорит о перспективности его применения в каталитических системах очистки отработанных газов дизельных двигателей.
Сопоставление кинетических характеристик (скорости и энергии активации), полученных в экспериментах по окислению саж в изотермическом режиме, с физико-химическими свойствами дизельной, угольной и коммерческих (Printex U, Vulkan XC-72) образцов саж свидетельствует, что реакционная способность саж к окислению зависит от многих параметров, но преимущественно от нано- и микроструктуры и состава функциональных групп поверхности.
Обнаружено, что среди изученных образцов сажи легче всего окисляется угольная сажа. Скорость ее окисления несколько возрастает после достижения 30%-й конверсии (Ea = 91 ± 19 vs. 73 ± 25 Дж/моль). Влияние NO (450 м. д.) на окисление дизельной, угольной и коммерческих образцов (Printex и Vulkan) саж оказалось достаточно заметным.
Список литературы
Regulation (EC) No. 715/2007 of the European Parliament and of the Council of 20 June 2007 on type approval of motor vehicles with respect to emissions from light passenger and commercial vehicles (Euro 5 And Euro 6) and on access to vehicle repair and maintenance information.
Постановление Правительства Российской Федерации от 12.10.2005 № 609 (ред. от 30.07.2014) об утверждении Технического регламента “О требованиях к выбросам автомобильной техникой, выпускаемой в обращение на территории Российской Федерации, вредных (загрязняющих) веществ”.
Regulation (EC) No. 595/2009 of the European Parliament and of the Council of 18 June 2009 on type-approval of motor vehicles and engines with respect to emissions from heavy duty vehicles (Euro VI) and on access to vehicle repair and maintenance information and amending Regulation (EC) No. 715/2007 and Directive 2007/46/EC and repealing Directives 80/1269/EEC, 2005/55/EC and 2005/78/EC.
Commission Regulation (EU) 2017/1154 of 7 June 2017 amending Regulation (EU) 2017/1151 supplementing Regulation (EC) No. 715/2007 of the European Parliament and of the Council on type-approval of motor vehicles with respect to emissions from light passenger and commercial vehicles (Euro-5 and Euro-6) and on access to vehicle repair and maintenance information, amending Directive 2007/46/EC of the European Parliament and of the Council, Commission Regulation (EC) No 692/2008 and Commission Regulation (EU) No. 1230/2012 and repealing Regulation (EC) No. 692/2008 and Directive 2007/46/EC of the European Parliament and of the Council as regards real-driving emissions from light passenger and commercial vehicles (Euro-6).
Guan B., Zhan R., Lin H., Huang Z. // J. Env. Management. 2015. V. 154. P. 225.
Fino D., Bensaid S., Piumetti M., Russo N. // Appl. Catal. A: Gen. 2016. V. 509. P. 75.
Johnson T.V., Joshi A. // Combustion Engines. 2016. V. 166. № 3. P. 3.
Van Setten B.A.A.L., Makkee M., Moulijn J.A. // Catal. Rev. Sci. Eng. 2001. V. 43. P. 489.
Schaefer-Sindlinger A., Lappas I., Vogt C.D., Itoa T., Kurachi H., Makino M., Takahashi A. // Top. Catal. 2007. V. 42–43. P. 307.
Nakamura K., Konstandopoulos A.G., Kostoglou M., Shibata T., Hashizume Y. // SAE Technical Paper. 2014. 2014-01-1512.
Prasad R., Bella V.R. // Bull. Chem. React. Eng. Catal. 2010. V. 5. P. 69.
Russell A., Epling W.S. // Catal. Rev. Sci. Eng. 2011. V. 53. P. 337.
Trovarelli A. // Catal. Rev. Sci. Eng. 1996. V. 38. № 4. P. 439.
Darcy P., Costa P., Mellottee H., Trichard J.M., Djega-Mariadassou G. // Catal. Today. 2007. V. 119. P. 252.
Jeguirim M., Tschamber V., Ehrburger P. // Appl. Catal. B: Env. 2007. V. 76. P.235.
Aneggi E., de Leitenburg C., Trovarelli A. // Catal. Today. 2012. V. 181. P. 108.
Xue E., Seshan K., Ross J.R.H. // Appl. Catal. B: Env. 1996. V. 11. P. 65.
Despres J., Elsener M., Koebel M., Krocher O., Schnyder B., Wokaun A. // Appl. Catal. B: Env. 2004. V. 50. P. 73.
Mulla S.S., Chen N., Cumaranatunge L., Blau G.E., Zemlyanov D.Y., Delgass W.N., Epling W.S., Ribeiro F.H. // J. Catal. 2006. V. 241. P. 389.
Setiabudi A., Makkee M., Moulijn J.A. // Appl. Catal. B: Env. 2003. V. 42. P. 35.
Setiabudi A., Makkee M., Moulijn J.A. // Appl. Catal. B: Env. 2004. V. 50. P. 185.
Maunula T., Matilainen P., Louhelainen M., Juvonen P., Kinnunen T. // SAE Technical Paper. 2007. 2007-01-0041.
Yashnik S.A., Denisov S.P., Danchenko N.M., Ismagilov Z.R. // Appl. Catal. B. 2016. V. 185. P. 322.
Цырульников П.Г., Сальников В.С., Дроздов В.А., Стукен С.А., Бубнов А.В., Григоров Е.И., Калинкин А.В., Зайковский В.И. // Кинетика и катализ. 1991. Т. 32. С. 439.
Yashnik S.A., Ismagilov Z.R., Kuznetsov V.V., Ushakov V.V., Rogov V.A., Ovsyannikova I.A. // Catal. Today. 2006. V. 117. P. 525.
Yashnik S.A., Ismagilov Z.R. // Top. Catal. 2012. V. 55. № 11–13. P. 818.
Yashnik S.A., Kuznetsov V.V., Ismagilov Z.R., Ushakov V.V., Danchenko N.M., Denisov S.P. // Top. Catal. 2004. V. 30/31. P. 293.
Yashnik S.A., Porsin A.V., Denisov S.P., Danchenko N.M., Ismagilov Z.R. // Top. Catal. 2007. V. 42–43. P. 465.
Yashnik S.A., Ishchenko A.V., Dovlitova L.S., Ismagilov Z.R. // Top. Catal. 2017. V. 60. P. 52.
Staroseltsev Yu.M., Yashnik S.A., Vityugov A.P., Ismagilov Z.R., Danchenko N.M. / In: Abstract Book, Professor V.V. Popovskii Memorial Seminar. Regularity of Deep Oxidation on Solid Catalysts, May 22, 2000, Novosibirsk. P. 137. (in Russian).
Stanmore B.R., Brilhac J.F., Gilot P. // Carbon. 2001. V. 39. P. 2247.
Yezerets A., Currier N.W., Kim D.H., Eadler H.A., Epling W.S., Peden C.H.F. // Appl. Catal. B: Env. 2005. V. 61. P. 120.
Reichert D., Finke T., Atanassova N., Bockhorn H., Kureti S. // Appl. Catal. B: Env. 2008. V. 84. P. 803.
Яшник С.А., Исмагилов З.Р. // Химия в интересах устойчивого развития. 2018. Т. 26. С. 657.
Koros R.M., Nowak E.J. // Chem. Eng. Sci. 1967. V. 22. P. 470.
Madon R.J., Boudart M. // Ind. Eng. Chem. Fund. 1982. V. 21. P. 438.
Nejar N., Makkee M., Illan-Gomez M.J. // Appl. Catal. B: Env. 2007. V. 75. P. 11.
Gimenez-Manogil J., Garcia-Garcia A. // Fuel Proc. Techn. 2015. V. 129. P. 227.
Matarrese R., Castoldi L., Lietti L. // Chem. Eng. Sci. 2017. V. 173. P. 560.
Tighe C.J., Twigg M.V., Hayhurst A.N., Dennis J.S. // Combustion and Flame. 2012. V. 159. P. 77.
Muckenhuber H., Grothe H. // Carbon. 2006. V. 44. P. 546.
Stanmore B.R., Tschamber V., Brilhac J.-F. // Fuel. 2008. V. 87. P. 131.
Tikhomirov K., Kroecher O., Elsener M., Wokaun A. // Appl. Catal. B: Env. 2006. V. 64. P. 72.
Liu S., Wu X., Weng D., Li M., Lee H-R. // Chem. Eng. J. 2012. V. 203. P.25.
Neeft J.P.A., Nijhuis T.X., Smakman E., Makkee M., Moulijn J.A. // Fuel. 1997. V. 76. № 12. P. 1129.
Lazaro M.J., Calvillo L., Celorrio V., Pardo J.I., Perathoner S., Moliner R. / Study and application of Vulcan XC-72 in low temperature fuel cells. In: Carbon Black: Production, Properties and Uses. Edrs. Sanders I.J., Peeten T.L. Nova Science Publishers, Inc. 2011. P. 1. ISBN: 978-1-61209-535-6.
Wang L., Song C., Song J., Lv G., Pang H., Zhang W. // Proceedings of the Combustion Institute. 2013. V. 34. P. 3099.
Liu J., Zhao Z., Xu C., Duan A., Jiang G. // Energy Fuels. 2010. V. 24. P. 3778.
Kumar S.M.S., Herrero J.S., Irusta S., Scott K. // J. Electroanal. Chem. 2010. V. 647.P. 211.
Sadezky A., Muckenhuber H., Grothe H., Niessner R., Poschl U. // Carbon. 2005. V. 43. P. 1731.
Knauer M., Schuster M.E., Su D., Schlogl R., Niessner R., Ivleva N.P. // J. Phys. Chem. A. 2009. V. 113. P. 13871.
Song J., Alam M., Boehman A., Kim U. // Combust. Flame 2006. V. 146. P. 589.
Castoldi L., Matarrese R., Brambilla L., Serafini A., Tommasini M., Lietti L. // Aerosol Sci. Technol. 2016. V. 50. № 4. P. 405.
Lu T., Cheung C.S., Huang Z. // Aerosol Sci. Technol. 2012. V. 46. № 12. P. 1349.
Seong H.J., Boehman A.L. // Energy Fuels. 2013. V. 27. P. 1613.
Xu Z., Li X., Guan C., Huang Z. // Aerosol Sci. Technol. 2013. V. 48. P. 128.
Lapuerta M., Oliva F., Agudelo J.R., Boehman A.L. // Combust. Flame. 2012. V. 159. P. 844.
Яшник С.А., Исмагилов З.Р. // Химия в интересах устойчивого развития. 2016. Т. 24. С. 524.
Xu Z., Li X., Guan C., Huang Z. // Energy Fuels. 2013. V. 27. № 12. P. 7579.
Mckinnon J.T., Meyer E., Howard J.B. // Combust. Flame. 1996. V. 105. № 1–2. P. 161.
Zielke U., Huttinger K.J., Hoffman W.P. // Carbon. 1996. V. 34. № 8. P. 983.
Fanning P.E., Vannice M.A. // Carbon. 1993. V. 31. P. 721.
Figueiredo J.L., Pereira M.F.R., Freitas M.M.A., Orfao J.J.M. // Carbon. 1999. V. 37. P. 1379.
Nakanishi K. Infrared Absorption Spectroscopy, Tokyo: Holden Day, 1962. P. 216.
Puri B.R., Bansal R.C. // Carbon. 1964. V. 1. P. 451.
Papirer E., Dentzer J., Li S., Donnet J.B. // Carbon. 1991. V. 29. P. 69.
Zhuang Q.-L., Kyotany T., Tomita A. // Carbon. 1994. V. 32. P. 539.
Marchon B., Carrazza J., Heinemann H., Somorjai G.A. // Carbon. 1988. V. 26. P. 507.
Agudelo J.R., Alvarez A., Armas O. // Combust. Flame. 2014. V. 161. P. 2904.
Soriano J.A., Agudelo J.R., Lopez A.F., Armas O. // Carbon. 2017. V. 125. P. 516.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


