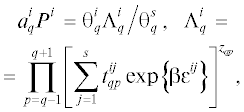Кинетика и катализ, 2019, T. 60, № 4, стр. 440-449
Самосогласованность расчета скоростей диссоциативной адсорбции и десорбции с изотермой адсорбции на шероховатой поверхности адсорбента
Е. С. Зайцева a, Ю. К. Товбин a, *
a ФГУПН Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский просп., 31, Россия
* E-mail: tovbinyk@mail.ru
Поступила в редакцию 26.02.2019
После доработки 28.02.2019
Принята к публикации 28.02.2019
Аннотация
Рассмотрено выполнение условия самосогласованности описания скоростей адсорбции и десорбции диссоциирующихся молекул пара на шероховатой поверхности адсорбента (равновесной и закаленной из равновесного состояния). Процесс адсорбции вызывает перестройку равновесной приповерхностной области адсорбента, но не меняет состояние закаленной поверхности. Скорости адсорбции–десорбции рассчитаны с учетом взаимодействия ближайших соседей в квазихимическом приближении. Рассмотрены четыре модели описания неоднородной структуры поверхности: исходная усредненная полислойная модель с разными типами центров адсорбции (и константами Генри), содержащая все доступные для адсорбции центры, и три типа ее усреднения. Первый тип усреднения связан с переходом к однослойной неоднородной поверхности, содержащей разные типы центров адсорбции с отличающимися константами Генри, второй – с переходом на совокупность эффективных однородных монослоев в полислойной переходной области, а третий – с переходом к однослойной эффективной однородной модели поверхности. Условие самосогласования выполняется в последних двух типах усреднения и нарушается в первом типе усреднения, а также в усредненной модели с учетом различий разных типов центров. Установлено, что состояние неоднородной поверхности (равновесное или закаленное) не влияет на самосогласованность описания скоростей адсорбции и десорбции в последних двух типах моделей. Показано влияние учета эффектов корреляции взаимодействия частиц на условие самосогласованности. Пренебрежение эффектами корреляции взаимодействующих частиц приводит к нарушению условия самосогласования во всех моделях.
Самосогласованность теории при описании скоростей элементарных стадий обратимых процессов и равновесного распределения компонентов реакционной смеси является одним из ключевых понятий физической химии конденсированных фаз. Его суть заключается в том, что, приравнивая выражения для скоростей прямого и обратного направления реакции, должно получаться такое уравнение на равновесное распределение компонентов реакционной смеси, которое непосредственно следует из построения уравнения в равновесной теории [1–4]. Идеальные реакционные системы всегда обладают этим свойством, так как теория имеет одночастичный характер. Хорошо известно, что принцип самосогласованности был использован в работе Лэнгмюра [5] при получении изотермы адсорбции из условия равенства скоростей адсорбции и десорбции. (Статистический вывод изотермы Лэнгмюра был дан впервые Темкиным М.И. [6], позже повторен Фаулером Р.Г. [7].) По тому же пути пошли авторы изотермы БЭТ [8], получив ее из кинетических построений. В кинетической теории разреженных газов требование согласованности новых разрабатываемых уравнений в газовой кинетике с уравнениями равновесного состояния газов является одним из необходимых элементов работы [9, 10].
Проблемы возникают при учете межчастичных взаимодействий, ответственных за неидеальное поведение реальных систем. В кинетической теории конденсированных фаз такого обязательного этапа работ не было. Это объяснялось двумя факторами: во-первых, при построении кинетических уравнений принцип детального равновесия закладывается с самого начала (но не проверяется, в какой степени он выполняется после всех процедур усреднения) и, во-вторых, нет уравнений состояний, с которыми можно было сравнивать. Этот вопрос по-прежнему остается одним из наименее изученных. Он обсуждался при разработке теории для неидеальных реакционных систем с разным радиусом потенциала взаимодействия на однородных [11, 12] и для ближайших соседей на неоднородной поверхностях [13]. В работе [14] было дано доказательство самосогласованности для любого радиуса потенциала взаимодействия между реагентами на дискретной неоднородной поверхности (см. также публикацию [15]). Общий результат, полученный для исходных распределенных моделей, относящихся к дискретной неоднородной поверхности, состоит в следующем. Было доказано, что теория обеспечивает самосогласованное описание динамики и равновесия на всех пространственных масштабах для любых плотностей, температур, интенсивностей латеральных взаимодействий и внешних полей только в случае учета эффектов корреляции взаимодействия частиц как минимум для ближнего порядка.
Дискретное описание неоднородной поверхности требует сложных алгоритмов, поэтому естественно перейти к более простым усредненным моделям совместного учета неидеальности реакционной системы и неоднородности поверхности. Концепция самосогласования является принципиальной при выборе модели для описания экспериментальных данных. В работе [16] было рассмотрено влияние разных способов усреднения описания строения неоднородной поверхности на самосогласованность описания скоростей элементарных стадий адсорбции–десорбции первого порядка и их равновесия для шероховатых поверхностей.
В данной работе исследуется аналогичная самосогласованность для диссоциативной адсорбции на шероховатой поверхности адсорбента (равновесной и закаленной из равновесного состояния). Элементарный процесс реализуется на двух соседних центрах, и здесь дополнительно возникает вопрос о роли эффектов корреляции. Эффекты корреляции были ключевыми при отказе от использования моделей, в которых они отсутствовали [3, 4, 11–14], а именно: приближение среднего поля (ПСП), хаотическое приближение и теория функционала плотности. Процесс адсорбции вызывает перестройку равновесной приповерхностной области адсорбента, но не меняет состояние закаленной поверхности. Скорости рассчитываются с учетом взаимодействия ближайших соседей в квазихимическом приближении (КХП) [3, 4, 11–17]. Проверка самосогласованности используемых моделей имеет важное практическое значение при выборе модели для описания экспериментальных данных.
Для анализа поставленной задачи использовалась молекулярно-кинетическая теория для трех агрегатных состояний, основанная на базе многочастичных функций распределений [3, 17], введенных Боголюбовым Н.Н. [18]. Теория построена на базе модели решеточного газа, которая применима для описания вещества, находящегося в трех агрегатных состояниях, поэтому она единственная обеспечивает равноточное описание трех границ раздела фаз. Основы этой теории были многократно опубликованы [3, 4, 14–16], поэтому не приводятся.
Теория отражает точку зрения Темкина М.И. [1, 2], который считал, что необходимо учитывать непосредственно межчастичные взаимодействия и их влияние на скорость элементарной стадии, в том числе через взаимодействия с активированным комплексом (АК) стадии (не вводя коэффициентов активностей реагентов). Это направление в дальнейшем получило логическое развитие в виде разработки теории неидеальных реакционных систем [3], которая применима ко всем агрегатным состояниям веществ [17]. Эта теория связана с представлением о быстром прохождении барьера АК, в отличие от концепции Эйринга, использовавшего представления о коэффициенте активированного комплекса элементарной стадии [19–21], т.е. о медленном прохождении барьера АК.
УСРЕДНЕНИЯ МОДЕЛИ ШЕРОХОВАТОЙ ПОВЕРХНОСТИ
Молекулярная модель адсорбции основана на модели решеточного газа [3, 15, 17]. Объем системы разбивается на отдельные элементарные ячейки со стороной размером с диаметр молекулы (λ) и объемом ячейки ${{\text{v}}_{0}}.$ Рассматривается плоская граница раздела жидкость–пар. На границе раздела ячейки объединяются в монослои (с номером q-прилегающего к границе монослоя жидкости), в которых они характеризуются числом связей с ближайшими соседями zqp из монослоя p. Значение q = 1 отвечает плотной фазе, а q = κ – паровой фазе. Обозначим в переходной области между сосуществующими фазами локальные плотности частиц адсорбента A через $\theta _{q}^{{\text{A}}}$ и локальные плотности молекул адсорбата В (или В2) через $\theta _{q}^{{\text{B}}}.$ Плотности для слоев q = 1 и q = κ считаются фиксированными (они находятся из условия расслаивания системы при исходной температуре T1).
Рассматриваются межмолекулярные взаимодействия между ближайшими соседями (в пределах одной координационной сферы). Параметры энергетических взаимодействий компонентов системы обозначим через $\varepsilon _{{qp}}^{{ij}}$ = εij.
На рис. 1 приведена схема распределения частиц адсорбента A (серые квадраты) и вакансий V (белые квадраты) в переходной области между фазами шириной (κ – 2) (где q = 1 – монослой конденсированной фазы, а q = 8 = κ – монослой пара). Эта схема отвечает исходной усредненной полислойной модели с разными типами центров адсорбции (характеризующиеся своими константами Генри), содержащей все доступные для адсорбции центры, и три типа ее усреднения [16].
Рис. 1.
Схема шероховатой поверхности. Жирной линией выделены кластеры, расположенные в переходной области между фазами. Серые квадраты – частицы адсорбента A, белые квадраты – вакансии, q – номер монослоя, κ – монослой пара. Стрелками указаны числа m* контактов пара с адсорбентом, находящихся внутри кластеров.
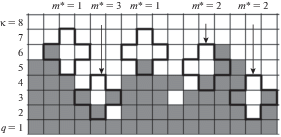
Адсорбция происходит на свободных узлах. На рис. 1 вокруг вакантных узлов выделены кластеры из их ближайшего окружения, тип которых определяется числом m* входящих в них частиц A. Значение m* определяет константу Генри центрального узла кластера. В первой модели вакантные узлы на рис. 1 распределяются по типам в зависимости от расстояния от плотной фазы, что задается номером монослоя q, и от состояния их окружения в кластере, что задается множеством чисел {mqp} частиц А в монослое p рядом с центральным узлом из монослоя q. Заданное множество чисел {mqp} отвечает номеру σ-конфигурации кластера с одним центральным узлом в монослое q.
Решение системы уравнений для первой модели требует решения системы уравнений большой размерности. Результаты анализа первой модели представлены в работе [16]. На практике стараются использовать различные усредненные модели с меньшей размерностью системы уравнений. Рассмотрим следующих три типа усреднений первой модели, подробно описанные в статье [16].
Модель 2, усредненная по монослоям с разделением типов по константе Генри. При данном усреднении различаются только узлы, имеющие разное значение константы Генри, т.е. характеризуются только собственным целочисленным значением m*. Всего в модели z типов узлов в переходной области.
Модель 3, усредненная по константе Генри внутри каждого монослоя. В данной модели шероховатой поверхности каждый тип узла, доступного для адсорбции, определяется только номером монослоя q, который однозначно задает усредненные нецелочисленные значения чисел А в окружении центрального узла по монослоям {${{\hat {m}}_{{qp}}}$}, усредненных по монослою q для каждого соседа p в отдельности. Всего в модели (κ – 2) типа узлов в переходной области.
Полностью усредненная модель 4. В данной модели шероховатой поверхности все узлы, доступные для адсорбции, принадлежат одному типу и описываются общим средним нецелочисленным значением $\hat {m}$ числа частиц А в окружении узла, усредненным по всему объему переходной области. Всего в модели 4 имеется единственный тип узлов, доступных для адсорбции.
На рис. 2 показано усреднение по трем моделям: а – модель 4, б – модель 3, в – модель 2. На рис. 2 (подобно рис. 1а) изображены схемы распределения частиц A (серые квадраты) с детальным разбиением вакантных ячеек на типы: белые ячейки – это вакантные места, полностью окруженные частицами А (т.е. изолированные), а заштрихованные ячейки – места, доступные для адсорбции. Доступным для адсорбции ячейкам одного типа (на схемах помечены другим типом штриховки) присвоены номера от 1 до 6. Так, в полностью усредненной модели 4 (рис. 2а) все ячейки, кроме занятых частицами А (серые) и изолированных (белые), помечены одинаковой штриховкой и обозначены номером 1.
Рис. 2.
Схемы усредненных моделей неоднородной области между фазами: 4 (а), 3 (б) и 2 (в). Серые квадраты – частицы адсорбента A, белые ячейки – вакантные места, полностью окруженные частицами А (т.е. изолированные), заштрихованные ячейки (1–6) – места, доступные для адсорбции ячейкам одного типа, q – номер монослоя.
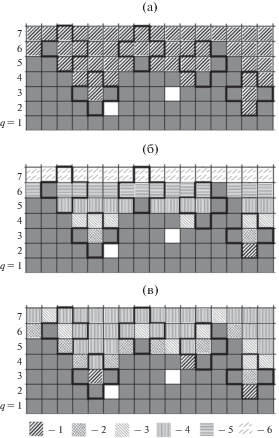
На рис. 2б на схеме переходной области модели 3 ячейки из одного монослоя q закрашены одним типом штриховки, которая в итоге меняется послойно от номера 1 до номера 6. А на рис. 2в штриховка ячейки зависит от общего числа m* частиц А в ближайшем ее окружении: например, штриховка номер 1 (если в ближайшем окружении ячейки имеется 3 частицы А), номер 2 (если 2 частицы А), номер 3 (если 1 частица А) и номер 4 (если нет ни одной частицы А). В итоге получаем, что в модели 2 номер 1 присвоен ячейкам, в которых наибольший потенциал поля адсорбента, и доля таких ячеек от всех заштрихованных минимальна. Чем больше номер штриховки ячеек, тем меньше в них потенциал поля адсорбента. В модели 4 потенциал поля для ячейки из монослоя q усреднен по всем ячейкам из данного монослоя, и, как следует из рис. 2б, потенциал поля адсорбента будет убывать с каждым последующим монослоем q (т.е. с ростом номера штриховки), а доля соответствующих ячеек от всех заштрихованных будет возрастать. Более подробно распределение узлов по энергетическим уровням описано в работе [22].
УРАВНЕНИЯ МОДЕЛИ ШЕРОХОВАТОЙ ПОВЕРХНОСТИ [22–24]
При равновесном состоянии поверхности адсорбента при температуре T1 граница адсорбента имеет шероховатую структуру из-за температурного размывания области границы. Если затем температура резко понижается до некоторой температуры Т < T1, при которой изучается адсорбция, то формируется профиль поверхности – закаленная равновесная поверхность. На этих двух типах поверхностей рассмотрим процесс адсорбции частиц В.
В равновесном состоянии шероховатой поверхности происходит перераспределение атомов А (идет перестройка границы раздела фаз) в ходе процесса адсорбции частиц В. Локальные плотности $\theta _{q}^{{\text{A}}}$ и $\theta _{q}^{{\text{B}}}$ получаются из решения следующей системы уравнений в КХП учета латерального взаимодействия между частицами при заданной температуре T:
где $a_{q}^{i}$ – локальная парциальная константа Генри для молекулы i на узле типа q, β = 1/(RBT), RB – газовая постоянная, Pi – давление компонента i, $t_{{qp}}^{{ij}}$ – условная вероятность нахождения молекул компонентов i и j (1 ≤ i, j ≤ s, где s – вакансии) в слоях q и p, εij – энергия взаимодействия частиц i и j, описываемая потенциальной функцией Леннард–Джонса. Функция неидельности $\Lambda _{q}^{i}$ учитывает весь спектр конфигураций соседних частиц.Адсорбция на закаленной поверхности рассчитывается в два этапа.
Первый этап. Сначала рассчитывается $\theta _{q}^{{\text{A}}}$ – профиль А в отсутствие В по уравнениям (1). Затем по профилю плотностей $\theta _{q}^{{\text{A}}}$ и условным вероятностям $t_{{qp}}^{{{\text{AA}}}}$ = $\theta _{{qp}}^{{{\text{AA}}}}$/$\theta _{q}^{{\text{A}}}$ рассчитывается локальная структура переходной области адсорбента [22] с помощью функций вероятности кластеров: 1) с одним центральным узлом из монослоя q и числами частиц A mqp в его окружении из монослоев p, $\Theta _{q}^{{{\text{V}}|\sigma }},$ где верхний индекс V|σ указывает, что в центральном узле располагается вакансия V, а состояние окружающих его узлов отвечает типу σ-конфигурации кластера с одним центральным узлом, и 2) c двумя центральными узлами из монослоев q и h и числами частиц A mqp и mhk в его окружении из монослоев p и k соответственно, $\Theta _{{qh}}^{{{\text{VV}}|\sigma \delta }},$ где верхний индекс VV|σδ указывает, что в центральных узлах располагаются вакансии VV, а состояние узлов, окружающих первый и второй центральные узлы, отвечает типам σ- и δ-конфигурации кластера с одним центральным узлом соответственно.
Второй этап. В переходной области “закаленного” твердого тела А рассчитывается профиль плотности адсорбата В, $\theta _{q}^{{{\text{B}}|\sigma }},$ по уравнению, в котором в знаменателе учитывается локальный потенциал поля $Q_{q}^{\sigma }$ адсорбента в константе Генри
(1а)
${{a}_{0}}{{P}^{{\text{B}}}} = \frac{{{\theta }_{q}^{{{\text{B}}|{\sigma }}}}}{{1 - {\theta }_{q}^{{{\text{B}}|{\sigma }}}}}\frac{{{{{\prod\limits_h {\left[ {\sum\limits_{\sigma } {d_{{qh}}^{{{\sigma \delta }}}S_{{qh}}^{{{\sigma \delta }}}} } \right]} }}^{{{{z}_{{qh}}} - {{m}_{{qh}}}}}}}}{{\exp \left\{ {{\beta }Q_{q}^{{\sigma }}} \right\}}},$Уравнения на парные функции распределения в КХП записываются в виде
Нормировочные соотношения для парных функций компонентов ${\theta }_{{qp}}^{{ij}}$ имеют вид: $\sum\nolimits_{i = 1}^s {{\theta }_{{qp}}^{{ij}}} = {\theta }_{p}^{j}$ и $\sum\nolimits_{j = 1}^s {{\theta }_{{qp}}^{{ij}}} = {\theta }_{q}^{i},$ а для унарных функций они равны $\sum\nolimits_{i = 1}^s {{\theta }_{q}^{i}} = 1.$
УРАВНЕНИЯ СКОРОСТЕЙ АДСОРБЦИИ–ДЕСОРБЦИИ
Скорости адсорбции–десорбции молекул B выражаются через введенные одноузельные ${\theta }_{q}^{i}$- и двухузельные $t_{{qp}}^{{ij}}$-корреляторы. Уравнения скоростей адсорбции и десорбции одноузельной стадии (без диссоциации) приведены в статье [16]. Ниже приводятся выражения скоростей адсорбции и десорбции двухузельной стадии (с диссоциацией) для полностью распределенной модели 1.
Скорость адсорбции двухузельной стадии на равновесной поверхности описывается уравнением (3а):
(3а)
$\begin{gathered} U_{{qh}}^{{{\text{VV}}}} = \hat {K}_{{gh}}^{{{\text{VV}}}}\theta _{{qh}}^{{{\text{VV}}}}S_{{qh}}^{{{\text{VV}}}}, \\ S_{{qh}}^{{{\text{VV}}}} = \prod\limits_{f \in z\left( q \right)} {{{{\left[ {\sum\limits_{j = {\text{A,B,V}}} {t_{{qf}}^{{{\text{V}}j}}\exp \left\{ {\beta \delta {{\varepsilon }^{{{\text{V}}j*}}}} \right\}} } \right]}}^{{{{z}_{{qf}}} - {{\Delta }_{{hf}}}}}}} \times \\ \times \,\,\prod\limits_{f \in z\left( h \right)} {{{{\left[ {\sum\limits_{j = {\text{A,B,V}}} {t_{{hf}}^{{{\text{V}}j}}\exp \left\{ {\beta \delta {{\varepsilon }^{{{\text{V}}j*}}}} \right\}} } \right]}}^{{{{z}_{{hf}}} - {{\Delta }_{{qf}}}}}}} , \\ \end{gathered} $Скорость десорбции двухузельной стадии на равновесной поверхности описывается уравнением (3б):
(3б)
$\begin{gathered} U_{{qh}}^{{{\text{BB}}}} = \hat {K}_{{gh}}^{{{\text{BB}}}}\theta _{{qh}}^{{{\text{BB}}}}S_{{qh}}^{{{\text{BB}}}}{\text{exp}}\left\{ { - \beta {{\varepsilon }^{{{\text{BB}}}}}} \right\}, \\ S_{{qh}}^{{{\text{BB}}}} = \prod\limits_{f \in z\left( q \right)} {{{{\left[ {\sum\limits_{j = {\text{A,B,V}}} {t_{{qf}}^{{{\text{B}}j}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{B}}j*}}}} \right\}} } \right]}}^{{{{z}_{{qf}}} - {{\Delta }_{{hf}}}}}}} \times \\ \times \,\,\prod\limits_{f \in z\left( h \right)} {{{{\left[ {\sum\limits_{j = {\text{A,B,V}}} {t_{{hf}}^{{{\text{B}}j}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{B}}j*}}}} \right\}} } \right]}}^{{{{z}_{{hf}}} - {{\Delta }_{{qf}}}}}}} , \\ \end{gathered} $Скорость адсорбции двухузельной стадии на закаленной поверхности описывается уравнением (3в):
(3в)
$\begin{gathered} U_{{qh}}^{{{\text{VV}}|\sigma \delta }} = \hat {K}_{{gh}}^{{{\text{VV}}|\sigma \delta }}\theta _{{qh}}^{{{\text{VV}}|\sigma \delta }}S_{{qh}}^{{{\text{VV}}|\sigma \delta }}, \\ S_{{qh}}^{{{VV|\sigma \delta }}} = \prod\limits_{f \in z\left( q \right)} {{{{\left[ {\sum\limits_{{{{\left\{ {{{m}_{{fg}}}} \right\}}}^{*}}} {d_{{qf}}^{{|{\sigma \delta }}}S_{{qf}}^{{{V|\sigma \delta }}}} } \right]}}^{{{{z}_{{qf}}} - {{m}_{{qf}}} - {{\Delta }_{{hf}}}}}}} \times \\ \times \,\,\prod\limits_{f \in z\left( h \right)} {{{{\left[ {\sum\limits_{{{{\left\{ {{{m}_{{fg}}}} \right\}}}^{*}}} {d_{{hf}}^{{|{\sigma \delta }}}S_{{hf}}^{{{V|\sigma \delta }}}} } \right]}}^{{{{z}_{{hf}}} - {{m}_{{hf}}} - {{\Delta }_{{qf}}}}}},} \\ S_{{qf}}^{{{V|\sigma \delta }}} = \sum\limits_{j = {\text{B,V}}} {t_{{qf}}^{{{\text{V}}j|{\sigma \delta }}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} , \\ S_{{hf}}^{{{V|\sigma \delta }}} = \sum\limits_{j = {\text{B,V}}} {t_{{hf}}^{{{\text{V}}j|{\sigma \delta }}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}.} \\ \end{gathered} $Скорость десорбции двухузельной стадии на закаленной поверхности описывается уравнением (3г):
(3г)
$\begin{gathered} U_{{qh}}^{{{\text{BB}}|\sigma \delta }} = \hat {K}_{{gh}}^{{{\text{BB}}|\sigma \delta }}\theta _{{qh}}^{{{\text{BB}}|\sigma \delta }}S_{{qh}}^{{{\text{BB}}|\sigma \delta }}{\text{exp}}\{ - \beta {{\varepsilon }^{{{\text{BB}}}}}\} , \\ S_{{qh}}^{{{BB|\sigma \delta }}} = \prod\limits_{f \in z\left( q \right)} {{{{\left[ {\sum\limits_{\left\{ {{{m}_{{fg}}}} \right\}*} {d_{{qf}}^{{{\sigma \delta }}}S_{{qf}}^{{{B|\sigma \delta }}}} } \right]}}^{{{{z}_{{qf}}} - {{m}_{{qf}}} - {{\Delta }_{{hf}}}}}}} \times \\ \times \,\,\prod\limits_{f \in z\left( h \right)} {{{{\left[ {\sum\limits_{\left\{ {{{m}_{{fg}}}} \right\}*} {d_{{hf}}^{{{\sigma \delta }}}S_{{hf}}^{{{B|\sigma \delta }}}} } \right]}}^{{{{z}_{{hf}}} - {{m}_{{hf}}} - {{\Delta }_{{qf}}}}}}} , \\ S_{{qf}}^{{{B|\sigma \delta }}} = \sum\limits_{j = {\text{B,V}}} {t_{{qf}}^{{{\text{B}}j|{\sigma \delta }}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{B}}j}}}} \right\}} , \\ S_{{hf}}^{{{B|\sigma \delta }}} = \sum\limits_{j = {\text{B,V}}} {t_{{hf}}^{{{\text{B}}j|{\sigma \delta }}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{B}}j}}}} \right\}} . \\ \end{gathered} $Применение усреднения к модели изменяет вид функций неидеальности $S_{{qh}}^{{ii}}$ и $S_{{qh}}^{{ii|\sigma \delta }}.$ Ниже выписаны примеры функций неидеальности для трех усредненных моделей закаленной равновесной поверхности (для равновесия они имеют аналогичный вид с добавлением в сумму по компонентам j компонент А).
В модели 4 с единственным типом узлов получаем:
(4а)
$\begin{gathered} {{U}^{{{\text{VV}}}}} = {{{\hat {K}}}^{{{\text{VV}}}}}{{{\theta }}^{{{\text{VV}}}}}{{S}^{{{\text{VV}}}}}, \\ {{S}^{{{\text{VV}}}}} = {{\left[ {\sum\limits_{j = {\text{B,V}}} {{{t}^{{{\text{V}}j}}}\exp \left\{ {{\beta \delta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} } \right]}^{{2\left( {z - \hat {m} - 1} \right)}}}. \\ \end{gathered} $В модели 3, усредненной по константе Генри внутри каждого монослоя q и h, имеем:
(4б)
$\begin{gathered} U_{{qh}}^{{{\text{VV}}}} = \hat {K}_{{gh}}^{{{\text{VV}}}}\theta _{{qh}}^{{{\text{VV}}}}S_{{qh}}^{{{\text{VV}}}}, \\ S_{{qh}}^{{{\text{VV}}}} = \prod\limits_{f \in z(q)} {{{{\left[ {\sum\limits_{j = {\text{B,V}}} {t_{{qf}}^{{{\text{V}}j}}\exp \left\{ {{\beta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} } \right]}}^{{{{z}_{{qf}}} - {{{\hat {m}}}_{{qf}}} - {{\Delta }_{{hf}}}}}}} \times \\ \times \,\,\prod\limits_{f \in z(h)} {{{{\left[ {\sum\limits_{j = {\text{B,V}}} {t_{{hf}}^{{{\text{V}}j}}\exp \left\{ {{\beta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} } \right]}}^{{{{z}_{{hf}}} - {{{\hat {m}}}_{{hf}}} - {{\Delta }_{{qf}}}}}}} . \\ \end{gathered} $В модели 2, усредненной по монослоям, с выделением типов ξ и ζ по константе Генри (в зависимости от числа контактов с адсорбентом m*), получаем:
(4в)
$\begin{gathered} U_{{\xi \zeta }}^{{{\text{VV}}}} = \hat {K}_{{\xi \zeta }}^{{{\text{VV}}}}\theta _{{\xi \zeta }}^{{{\text{VV}}}}S_{{\xi \zeta }}^{{{\text{VV}}}}, \\ S_{{{\xi \zeta }}}^{{{\text{VV}}}} = {{\left[ {\sum\limits_{{{m}_{{\psi }}} = 0}^{z - 1} {{{d}_{{{\xi \psi }}}}\sum\limits_{j = {\text{B,V}}} {t_{{{\xi \psi }}}^{{{\text{V}}j}}\exp \left\{ {{\beta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} } } \right]}^{{z - {{m}_{{\xi }}} - 1}}} \times \\ \times \,\,{{\left[ {\sum\limits_{{{m}_{{\psi }}} = 0}^{z - 1} {{{d}_{{{\zeta \psi }}}}\sum\limits_{j = {\text{B,V}}} {t_{{{\zeta \psi }}}^{{{\text{V}}j}}\exp \left\{ {{\beta }{{{\varepsilon }}^{{{\text{V}}j*}}}} \right\}} } } \right]}^{{z - {{m}_{{\zeta }}} - 1}}}. \\ \end{gathered} $ПАРАМЕТРЫ ЧИСЛЕННОГО АНАЛИЗА
Условие самосогласованности рассматривается на примере хемосорбции без диссоциации В и с диссоциацией В2 на поверхности твердого тела А, моделируемого для простоты изотропной решеткой с малой шириной переходной области κ = 5 (что отвечает температуре вблизи плавления вещества А). (Для более реальной модели твердого тела нужен учет присутствия других граней твердого тела.)
Напомним [3, 14], что взаимное отталкивание хемосорбированных частиц описывается отрицательными параметрами латерального взаимодействия, а притяжение физически адсорбированных частиц – положительными. За основу энергетических соотношений выбрана величина εАА энергии взаимодействия компонентов адсорбента А, и εАB = 0.15εAA и εBB = –0.33εAB. Величина εАА условно выбрана за единицу, что относит рассчитанные результаты к системам разного типа и дает относительные корреляции между ними.
Адсорбция газа B рассматривается при сверхкритической температуре. В качестве условной меры для давления в данной работе введена величина $P_{n}^{{\text{B}}},$ при которой числовая плотность флюида в объеме равна 0.5. По отношению к ней рассматриваются различные значения давлений указанных систем.
Для хемосорбции область изменения заполнения переходной области ограничена монослоем. Так как взаимодействие между адсорбентом и адсорбатом сильное, то монослой заполняется при давлениях $P_{{\text{m}}}^{{\text{B}}}$ в несколько раз меньше, чем $P_{n}^{{\text{B}}},$ а именно: $P_{{\text{m}}}^{{\text{B}}}$/$P_{n}^{{\text{B}}}$ равно 0.12 для закаленной равновесной поверхности, 0.375 для равновесной поверхности в КХП и 0.25 для равновесной поверхности в ПСП для рассматриваемых параметров.
КОНЦЕНТРАЦИОННЫЕ ПРОФИЛИ А И В НА ГРАНИЦЕ РАЗДЕЛА ФАЗ
Для того чтобы исследовать строго равновесный концентрационный профиль адсорбента А при адсорбции газа В в его переходной области около температуры плавления вещества А, необходимо рассмотреть ситуацию, когда в систему с двухфазным состоянием вещества А добавляется газ В, который смешивается с паром А и заполняет его переходную область А (но не растворяется внутри конденсированной фазы А). Адсорбция В меняет концентрационный профиль адсорбента.
На рис. 3 представлены концентрационные профили твердого вещества А (кривые 1) и газа В (кривые 2) в переходной области (1 < q < κ) вблизи температуры плавления. Множество кривых под одной цифрой (1 или 2) относится к различным значениям давления В (PB), которое варьируется от нуля до давления, при котором монослой на поверхности адсорбента заполняется до 50%. Стрелки рядом с цифрами 1 и 2 указывают, куда смещаются профили из соответствующего множества кривых с ростом давления PB в газе.
Рис. 3 показывает, что, начиная с некоторого давления, присутствие компонента В в переходной области изменяет профиль плотности А. В ходе дальнейшего увеличения PB плотность А в центральном монослое переходной области растет, приводя к уменьшению степени шероховатости поверхности твердого вещества А.
Кривые $\theta _{q}^{i}$ на рис. 3, представляющие собой доли от всего объема монослоя q, которые занимают частицы i, полностью согласуются с обычными представлениями о повышенной концентрации компонента В на поверхности адсорбента А. При расчете величины адсорбции требуется пересчитать плотность В в монослое q к доле объема монослоя q, свободного от частиц А, т.е. (1 – $\theta _{q}^{{\text{A}}}$). В результате получаем величину $\theta _{q}^{{\text{B}}}$/(1 – $\theta _{q}^{{\text{A}}}$), представляющую собой реальную плотность в данном монослое q, которая входит в полную изотерму адсорбции (рис. 4).
Рис. 3.
Концентрационные профили А (кривые 1) и B (кривые 2) в межфазной области адсорбента. Стрелки указывают, куда смещаются профили из соответствующего множества кривых с ростом давления PB в газе.
Рис. 4.
Изотермы хемосорбции В на равновесной неоднородной поверхности А: 1 – общее количество адсорбата ${\text{Г }}_{{\text{m}}}^{{\text{B}}}$ на монослое поверхности адсорбента А, отнесенное к емкости монослоя Mm, 2, 3 и 4 – локальные величины (${\text{Г }}_{{\text{m}}}^{{\text{B}}}$)q для монослоев q = 2, 3 и 4 соответственно, отнесенные к емкости монослоя Mm.
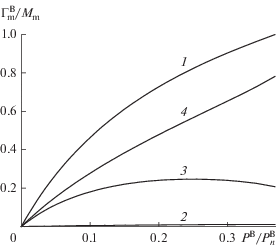
На рис. 4 представлены изотермы хемосорбции В на равновесной поверхности А при температуре вблизи плавления А для двух последних моделей: по модели 4 (полное усреднение) построена кривая 1 как общее количество адсорбата ${\text{Г }}_{{\text{m}}}^{{\text{B}}}$ на монослое поверхности адсорбента А, отнесенное к емкости монослоя Mm, и по модели 3 (различаются монослои) построены кривые 2, 3 и 4 как локальные величины (${\text{Г }}_{{\text{m}}}^{{\text{B}}}$)q для монослоев q = 2, 3 и 4 соответственно, отнесенные к емкости монослоя Mm. По оси абсцисс отложено давление В в газе (PB), нормированное на величину давления $P_{n}^{{\text{B}}}.$
Согласно рис. 4, величина адсорбции в монослое q = 2 (кривая 2) крайне мала. Это связано с малой долей адсорбционных мест, поскольку данный монослой практически полностью состоит из частиц А, плотность которых в нем близка к плотности твердой фазы А. В монослое q = 3 (кривая 3) величина адсорбции изменяется с появлением максимума на кривой. Снижение же величины адсорбции В в монослое q = 3 в области давлений 0.25 < PB < $P_{n}^{{\text{B}}}$ объясняется тем, что с повышением давления PB происходит перестройка поверхности адсорбента таким образом, что увеличивается концентрация его частиц в данном монослое q = 3 и, начиная с давления, когда адсорбат B заполняет все свободное пространство в монослое, дальнейшее увеличение концентрации А в монослое ведет к вытеснению частиц В (см. рис. 3). В монослое q = 4 (кривая 4) величина адсорбции увеличивается практически линейно с ростом PB благодаря увеличению площади поверхности адсорбента А, частицы которого лежат в монослое q = 3. В итоге суммарная величина адсорбции ${\text{Г }}_{{\text{m}}}^{{\text{B}}},$ получаемая по полностью усредненной модели 4, монотонно увеличивается (кривая 1), пока не достигает значения емкости монослоя на поверхности адсорбента Mm.
АНАЛИЗ СКОРОСТЕЙ АДСОРБЦИИ–ДЕСОРБЦИИ
На рис. 5 показаны скорости адсорбции–десорбции на поверхности твердого вещества А газа В (UV/UB) без диссоциации (рис. 5а) и газа В2 (UVV/UBB) с диссоциацией (рис. 5б). Все кривые адсорбции UV и UVV совпадают с соответствующими кривыми десорбции UB и UBB, поэтому на рис. 5 они помечены одним номером при температуре вблизи плавления А для двух последних моделей. По модели 4 построена кривая 1 как общая средняя скорость сорбции Ui без диссоциации (рис. 5а) и Uii с диссоциацией (рис. 5б), а по модели 3 построены кривые 2, 3 и 4 как локальные скорости сорбции $U_{q}^{i}$ без диссоциации (рис. 5а) и $U_{{qq}}^{{ii}}$ с диссоциацией (рис. 5б) в монослоях q = 2, 3 и 4 соответственно. Скорости сорбции $U_{{qq}}^{{ii}}$ на рис. 5б показаны на примере диссоциации на однотипных узлах, т.е. в рамках модели 3 это означает, что диссоциация происходит на узлах из одного монослоя q (см. рис. 2б).
Рис. 5.
Скорости адсорбции–десорбции на равновесной поверхности твердого вещества А газа В без диссоциации (а) и газа В2 с диссоциацией (б) в КХП: 1 – общая средняя скорость сорбции Ui без диссоциации (а) и Uii с диссоциацией (б), 2, 3 и 4 – локальные скорости сорбции $U_{q}^{i}$ без диссоциации (а) и $U_{{qq}}^{{ii}}$ с диссоциацией (б) в монослоях q = 2, 3 и 4 соответственно.
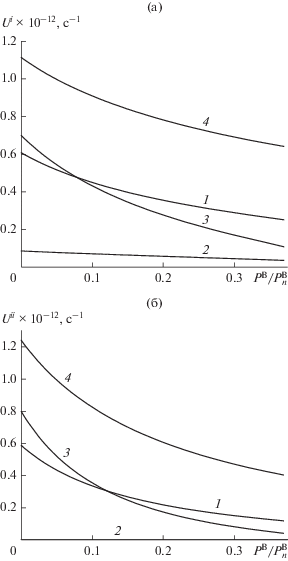
На рис. 5а и 5б видно, что все скорости адсорбции убывают с ростом PB. Для скоростей адсорбции без диссоциации (рис. 5а) получено, что все локальные значения адсорбции $U_{q}^{{\text{V}}}$ и общее среднее значение UV совпадают с соответствующими значениями $U_{q}^{{\text{B}}}$ и UB процесса десорбции и образуют с ними общую кривую. Аналогично для скоростей адсорбции с диссоциацией (рис. 5б) получено, что все локальные значения адсорбции $U_{{qq}}^{{{\text{VV}}}}$ и общее среднее значение UVV совпадают с соответствующими значениями $U_{{qq}}^{{{\text{BB}}}}$ и UBB процесса десорбции и образуют с ними общую кривую. Таким образом, для моделей 3 и 4 мы всегда получаем строгое выполнение самосогласования уравнения изотермы адсорбции с уравнениями скоростей адсорбции как без диссоциации В, так и с диссоциацией В2.
На рис. 6а представлены скорости адсорбции–десорбции газа В2, UVV/UBB (все кривые адсорбции UVV совпадают с соответствующими кривыми десорбции UBB, поэтому на рис. 6а они помечены одним номером) на закаленной равновесной поверхности твердого вещества А с диссоциацией при температуре вблизи плавления А для двух последних моделей: по модели 4 построена кривая 1 как общая средняя скорость сорбции Uii, и по модели 3 построены кривые 2, 3 и 4 как локальные скорости сорбции $U_{{qq}}^{{ii}}$ в монослоях q = 2, 3 и 4 соответственно. На рис. 6а, как и на рис. 5б, скорости адсорбции $U_{{qq}}^{{ii}}$ показаны на примере диссоциации на однотипных узлах.
Рис. 6.
Скорости адсорбции–десорбции газа В2 на закаленной равновесной поверхности твердого вещества А с диссоциацией по моделям 3 и 4 (а): 1 – общая средняя скорость сорбции Uii, 2, 3 и 4 – локальные скорости сорбции $U_{{qq}}^{{ii}}$ в монослоях q = 2, 3 и 4 соответственно, а также по модели 2 (б): 1–5 – локальные скорости сорбции $U_{{m*m*}}^{{ii}}$ в узлах с m* = 1–5 соответственно в КХП.
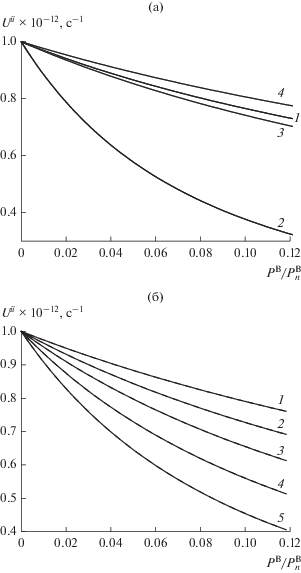
На рис. 6б представлены скорости адсорбции–десорбции газа В2, UVV/UBB (все кривые адсорбции UVV совпадают с соответствующими кривыми десорбции UBB, поэтому на рис. 6б они помечены одним номером) на закаленной равновесной поверхности твердого вещества А с диссоциацией при температуре вблизи плавления А для модели 2 (узлы различаются по величине константы Генри): построены кривые 1–5 как локальные скорости адсорбции $U_{{m*m*}}^{{ii}}$ с числом частиц адсорбента в ближайшем окружении m* от 1 до 5 соответственно. Скорости адсорбции $U_{{m*m*}}^{{ii}}$ на рис. 6б показаны на примере диссоциации на однотипных узлах, т.е. в рамках модели 2 это означает, что диссоциация происходит на узлах с одним значением числа частиц А в ближайшем окружении m* (см. рис. 2в).
На рис. 6 видно, что все скорости адсорбции убывают с ростом давления PB. Также получено, что все локальные значения адсорбции $U_{{m*m*}}^{{{\text{VV}}}}$ (рис. 6а) и $U_{{qq}}^{{ii}}$ и общее среднее значение UVV (рис. 6а) численно совпадают с соответствующими значениями $U_{{m*m*}}^{{{\text{BB}}}},$ $U_{{qq}}^{{ii}}$ и UBB процесса десорбции и образуют с ними общую кривую. Таким образом, для моделей 3 и 4 самосогласование уравнения изотермы адсорбции с уравнениями скоростей адсорбции с диссоциацией В2 выполняется строго при любых температурах и давлениях вне зависимости от природы адсорбата и адсорбента как на равновесной, так и на закаленной равновесной поверхности.
Модель 2 не обеспечивает строгого выполнения самосогласования и может только приблизить значения скоростей адсорбции и десорбции с конечной точностью в зависимости от внешних параметров и природы компонентов в системе. Например, в данной работе, где адсорбция рассчитывалась при высоких температурах (выше критической температуры компонента В), получено совпадение скоростей $U_{{m*m*}}^{{{\text{VV}}}}$ и $U_{{m*m*}}^{{{\text{BB}}}}$ с точностью 99.98%. В работе [16], где адсорбцию считали при низких температурах (вблизи тройной точки В), скорости адсорбции и десорбции без диссоциации вследствие нарушения самосогласования расходились примерно в 2 раза! Причина рассогласования связана с видом функции неидеальности (формула (4в)), в которой появляется сумма по состоянию соседних узлов: для данного усреднения задается не весь кластер центрального узла одновременно, а по отдельности рассматриваются его пары с соседним узлом (что является грубым описанием). В результате получается сумма вкладов в функции неидеальности, что приводит к нарушению самосогласования.
ЭФФЕКТЫ КОРРЕЛЯЦИИ
Выше было отмечено, что пренебрежение эффектами корреляции взаимодействующих частиц приводит к нарушению условия самосогласования. В данной работе было проверено влияние учета эффектов корреляции взаимодействия частиц на условие самосогласованности в рассматриваемой задаче о хемосорбции компонента В2 на равновесной шероховатой поверхности адсорбента. Для всех моделей пренебрежение эффектами корреляции взаимодействующих частиц приводит к нарушению условия самосогласования. Чтобы численно продемонстрировать эффект корреляции взаимодействия частиц, приведем данные расчета в ПСП (при тех же условиях в КХП самосогласование выполняется).
На рис. 7 представлены рассчитанные в приближении среднего поля скорости десорбции UBB (1) и адсорбции UVV (2) газа В2 (здесь кривые адсорбции UVV и десорбции UBB расходятся, поэтому на рис. 7 им присвоены разные номера) на равновесной поверхности твердого вещества А с диссоциацией при температуре вблизи плавления вещества А для модели 4 с полным усреднением.
Рис. 7.
Скорости десорбции UBB (1) и адсорбции UVV (2) газа В2 на равновесной поверхности твердого вещества А с диссоциацией в ПСП.
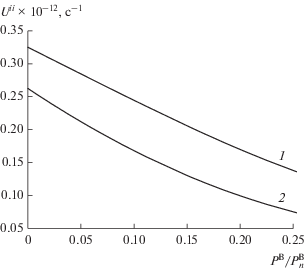
По сравнению с кривой 1 на рис. 5б, построенной в КХП, аналогичная кривая в ПСП лежит почти в 2 раза ниже, т.е. данная кривая в ПСП дает меньшие скорости сорбции. Также, согласно рис. 7, в приближении среднего поля условие самосогласованности выражений изотермы адсорбции и скоростей сорбции нарушается, так как наблюдаются расхождения до 45% (максимальные различия при ${{P_{{}}^{{\text{B}}}} \mathord{\left/ {\vphantom {{P_{{}}^{{\text{B}}}} {P_{n}^{{\text{B}}}}}} \right. \kern-0em} {P_{n}^{{\text{B}}}}}$ = 0.25) между скоростями адсорбции и десорбции.
ЗАКЛЮЧЕНИЕ
Анализ разных способов усреднений неоднородной поверхности показал, что нарушение условия самосогласования могут происходить в следующих случаях.
1. При использовании недостаточно точного усредненного описания адсорбционных центров кластера вокруг центрального узла на неоднородной поверхности (как в модели 2). В данной работе, где адсорбцию считали при высоких температурах, получено совпадение скоростей прямой и обратной реакции с точностью 99.98%, тогда как при низких температурах скорости мономолекулярной адсорбции и десорбции различались практически в 2 раза вследствие нарушения условия самосогласования [16].
2. При игнорировании эффектов корреляции. В случае неучета эффектов корреляции взаимодействия частиц при использовании приближения среднего поля нарушение самосогласования может приводить к различию в скоростях прямого и обратного направления реакции до 45%.
Установлено, что состояние неоднородной поверхности (равновесное или закаленное равновесное) не влияет на самосогласованность описания скоростей адсорбции и десорбции: модели 3 и 4 в рамках КХП всегда будут обеспечивать самосогласованность расчетов, тогда как модель 2 или использование ПСП приводят к нарушению самосогласованности.
Впервые проведенные исследования в данной работе и работе [16] показывают, что модели совместного учета неидеальности и неоднородности адсорбционной системы требуют контроля при их применении. Концепция самосогласования является принципиальной при выборе модели для описания экспериментальных данных. Например, для моделей 3 и 4 в КХП мы получаем строгое выполнение самосогласования уравнения изотермы адсорбции с уравнениями скоростей адсорбции при любых параметрах как без диссоциации В, так и с диссоциацией В2, что указывает на универсальность построенных моделей. Применимость модели 2 имеет ограничения по температурному диапазону, и, используя ее, нужно учитывать степень рассогласования, к которой она приводит. Если точность используемых уравнений недостаточна по уровню описания самосогласования или по точности учета физико-химических факторов, то следует перейти на более детальные модели [3, 15].
Проведенный анализ имеет практическое значение, так как выбор модели для описания экспериментальных данных должен обеспечивать точное отражение физических факторов реакционной системы, а именно: неоднородность поверхности и взаимное влияние адсорбированных частиц друг на друга за счет латеральных взаимодействий. На практике обычно ищут компромисс между простой математической моделью для описания ее свойств и необходимыми требованиями при ее использовании (самосогласованность и точность учета физических факторов.)
Список литературы
Темкин М.И. // ЖФХ. 1941. Т. 15. С. 296.
Темкин М.И. // ЖФХ. 1950. Т. 24. С. 1312.
Товбин Ю.К. Теория физико-химических процессов на границе газ–твердое тело. М.: Наука, 1990. 288 с.
Товбин Ю.К. // ЖФХ. 2018. Т. 92. № 6. С. 929.
Langmuir I. // J. Amer. Chem. Soc. 1916. V. 38. P. 2217.
Темкин М.И. // ЖФХ. 1933. Т. 4. С. 573.
Fowler R.H. // Proc. Cambridge Phil. Soc. 1935. V. 31. P. 260.
Brunauer S., Emmett P.H., Teller E. // J. Amer. Chem. Soc. 1938. V. 60. P. 309.
Климонтович Ю.Л. Кинетическая теория неидеального газа и неидеальной плазмы. М.: Наука, 1975. 352 с.
Ферцигер Дж., Капер Г. Математическая теория процессов переноса в газах. М.: Мир, 1976. 554 с.
Товбин Ю.К. // ЖФХ. 1981. Т. 55. № 2. С. 284.
Товбин Ю.К. // Кинетика и катализ. 1982. Т. 23. № 4. С. 821.; № 5. С. 1231.
Товбин Ю.К. // Кинетика и катализ. 1983. Т. 24. № 2. С. 308, 317.
Tovbin Yu.K. // Prog. Surf. Sci. 1990. V. 34. № 1–4. P. 1.
Товбин Ю.К. Молекулярная теория адсорбции в пористых телах. М.: Физматлит, 2012. 624 с.
Зайцева Е.С., Товбин Ю.К. // ЖФХ. 2019. Т. 93. № 4. С. 508.
Товбин Ю.К. Малые системы и основы термодинамики. М.: Физматлит, 2018. 404 с.
Боголюбов Н.Н. Проблемы динамической теории в статистической физике. М.: Гостехиздат, 1946. 94 с.
Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: Изд-во иностр. лит., 1948.
Энтелис С.Г., Tигep Р.П. Кинетика реакций в жидкой фазе. М.: Химия, 1973.
Мелвин-Хьюз Е.А. Равновесие и кинетика реакций в растворах. М.: Химия, 1975.
Товбин Ю.К., Зайцева Е.С., Рабинович А.Б. // ЖФХ. 2018. Т. 92. № 3. С. 473.
Зайцева Е.С., Товбин Ю.К. // ЖФХ. 2018. Т. 92. № 5. С. 816.
Зайцева Е.С., Товбин Ю.К. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. С. 365.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ