Кинетика и катализ, 2019, T. 60, № 5, стр. 665-673
Влияние структурных свойств носителя на процесс активации Fe-K/MgAl2O4-катализаторов в синтез-газе
Г. В. Панкина a, *, А. В. Шумянцев a, С. А. Черняк a, В. В. Лунин a
a ФГБОУ ВО Московский Государственный Университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: pankina5151@inbox.ru
Поступила в редакцию 31.10.2018
После доработки 04.02.2019
Принята к публикации 18.03.2019
Аннотация
Изучено влияние структурных свойств носителя алюмо-магниевой шпинели (АМШ) с различной удельной поверхностью на физико-химические свойства и динамику активации Fe-K-содержащих катализаторов в атмосфере синтез-газа. При активации Fe/АМШ и Fe-К/АМШ в токе СО/Н2 (1 : 1) для всех катализаторов наблюдается формирование карбида Хэгга χ-Fe5С2 с температурой Кюри Тθ = 257°С. Однако магнитометрическим методом in situ установлено, что количество образовавшегося карбида различно для алюмо-магниевой шпинели с разной удельной поверхностью.
ВВЕДЕНИЕ
Катализаторами синтеза Фишера–Тропша (СФТ), как известно, служат Fe и Со, нанесенные на оксиды алюминия, титана, силикагель и др. Наиболее тщательно вопрос активации железосодержащих каталитических систем СФТ исследовала группа ученых под руководством проф. Б. Дэвиса (Burtron Davis) [1–3]. Железонанесенные катализаторы в ряде случаев предпочтительнее кобальтовых, поскольку конверсия СО в их присутствии доходит до ~50%. Кроме того, они не разрушаются в течение сотен часов работы, что делает их более продуктивными [1].
По мнению Б. Дэвиса и сотр. [2, 3], активная фаза Fe-содержащих каталитических систем – это карбиды различного химического состава. Так, в работе [2] было указано, что структура стабильного железного катализатора состоит из ядра Fe3O4, окруженного слоем карбида железа, и что карбид железа является активной фазой в процессе гидрирования СО. Высокодисперсные карбиды железа могут формироваться в процессе активации железных катализаторов в токе СО или синтез-газа. В работе [3] было отмечено, что при активации железосодержащих систем в СО происходит почти полное превращение гематита сначала в магнетит, а после – в карбиды, которые затем в ходе эксплуатации катализатора постепенно окисляться до равновесного в заданных условиях отношения карбид–магнетит. При увеличении времени работы катализатора до 450 ч именно магнетит Fe3O4 – единственное обнаруживаемое соединение железа. Предполагается, что превращение карбидов железа в Fe3O4 сопровождается дезактивацией Fe-катализаторов в реакциях СФТ. По-видимому, стадиям активации СО, ответственным за образование поверхностных частиц карбида и удаление хемосорбированного кислорода, сопутствует дезактивация поверхности, что даже в присутствии восстановительной смеси реагентов и приводит к окислению карбида железа.
Однако в работе [4] отмечалось, что карбиды могут оставаться стабильными в широком диапазоне условий проведения реакции. Гипотезу о том, что карбиды железа, а именно карбид Хэгга, выполняет роль активной фазы в синтезе Фишера–Тропша, не так давно подтвердил Нимантсвердит (J.W. Niemantsverdriet) и сотр. [5]. Промотирование железосодержащих катализаторов различными металлами и соединениями позволяет достигать высокой активности и селективности по отношению к олефинам и углеводородам С5+ [6].
В процессе приготовления Ме-нанесенных катализаторов ключевая роль отводится адсорбции активного компонента на носителе, который, в свою очередь, характеризуется определенной структурой. От того, каким образом осуществляется стадия адсорбции, зависит то, как связывается активный компонент с носителем, равномерность его распределения по объему гранулы и, следовательно, каталитические свойства полученных систем. Известно, что калий, как промотор Fe-содержащих катализаторов, оказывает влияние на их физико-химические свойства, активность и селективность в реакции гидрирования СО (СФТ). Активация Fe-содержащих катализаторов в смеси Н2/СО, как правило, сопровождается структурными и химическими превращениями в нем, в процессе которых и формируются активные центры различного химического состава [7, 8]. Al2O3 – традиционный носитель как для железных, так и кобальтовых катализаторов СФТ. Однако нанесение железа и кобальта приводит при высоких конверсиях в процессе СФТ к образованию железо- и кобальт-алюмомагниевых шпинелей с достаточно малым размером кристаллитов металла, которые в дальнейшем поддаются восстановлению только при высоких температурах и не активны в СФТ [9, 10]. Часто для исключения оксид-оксидного взаимодействия с активным компонентом его модифицируют металлами и другими химическими соединениями, например, окисью магния или силикагелем [3, 11]. Так, стабилизация силикагелем (5 мас. %) носителя Al2O3 кобальсодержащего катализатора позволяет достигать в стандартных условиях СФТ активности порядка 49 ммольСО${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1, в то время как при использовании традиционных коммерческих носителей – оксида алюминия фирм “Sasol”, “St. Gobain” и “Alfa Aesar” – данный показатель ниже и составляет 26–39 ммольСО${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 [12]. Объяснением этому, по мнению авторов, служит формирование пористой структуры с бимодальным распределением пор по размерам и повышение термической стабильности (1100°C), что уже до стадии пропитки позволяет стабилизировать дисперсность кобальта [12].
По мнению авторов [13], добавка малых количеств силикагеля к оксиду алюминия может предотвратить образование неактивных алюминатов кобальта и, следовательно, дезактивацию катализатора в СФТ.
Настоящая работа посвящена изучению влияния структурных свойств носителя на физико-химические свойства и динамику активации катализаторов Fe-K/АМШ в атмосфере синтез-газа на примере алюмо-магниевых шпинелей (АМШ) с различными величинами удельной поверхности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
Катализаторы получали методом последовательной и совместной пропитки носителя – алюмо-магниевой шпинели – водными растворами Fe(NO3)2 · 9Н2О и КNO3 из расчета 2 мас. % калия и 15 мас. % железа в приготовленном прокаленном катализаторе. В качестве носителей использовали алюмо-магниевые стехиометрические шпинели вида AlxMgyOz фирмы “SASOL Germany GmbH”, марки Puralox MG 30 Spinel (S) c низкой удельной поверхностью и Puralox MG 30 Spinel precursor (SP) с высокой удельной поверхностью, обозначенные нами как АМШ-S и АМШ-SP соответственно. Технические характеристики носителей, предоставленные производителем, приведены в табл. 1.
Таблица 1.
Технические характеристики носителей от производителя фирмы “SASOL Germany GmbH”
| Образец | Содержание Al2O3, мас. % | Содержание MgO, мас. % | Sуд, м2/г | Объемная плотность, г/мл | Размер частиц D, мкм |
|---|---|---|---|---|---|
| АМШ-S | 72.3 | 27.7 | 23 ± 1 | 0.29 | 1.8 |
| АМШ-SР | 71.2 | 28.8 | 185 ± 2 | 0.35 | 47.5 |
Катализаторы сушили в течение 1 ч при 80°C в роторном испарителе, а затем прокаливали в токе азота в заданном программируемом режиме в течение 3 ч при 450°C (объемная скорость потока азота 1200 ч–1, скорость нагрева 8°C/мин). Процедуру сушки и отжига повторяли после каждого акта пропитки соответствующими солями нитратов. Далее по тексту полученные катализаторы обозначены как Fe/АМШ, Fe/K/АМШ, K/Fe/АМШ и FeК/АМШ. Катализаторы Fe/АМШ-S и Fe/АМШ-SР приготовлены 1-разовой пропиткой носителей раствором Fe(NO3)2 · 9Н2O; Fe/K/АМШ и K/Fe/АМШ – 1-разовой последовательной пропиткой носителей растворами: сначала КNO3, затем Fe(NO3)2 · 9Н2O и сперва Fe(NO3)2 · 9Н2O, потом КNO3 соответственно; FeК/АМШ-S–1-разовой совместной пропиткой растворами Fe(NO3)2 · 9Н2O и КNO3.
Физико-химические исследования
Низкотемпературная адсорбция азота. Пористая структура носителя и железосодержащих катализаторов на основе алюмо-магниевой шпинели (удельная поверхность (Sуд), удельная поверхность микропор (Sмкпор), удельный объем микропор (Vмкпор), средний размер пор (dср) в образцах) исследованы методом низкотемпературной адсорбции азота на абсорбтометре ASAP 2000 (“Micrometrics”, США). Непосредственно перед проведением эксперимента образцы массой 0.2–0.3 г дегазировали в вакууме (P < 10 мм. рт. ст.) при 300°C в течение 4 ч. Измерения осуществляли с интервалом 5 с при 77 K. Полученные результаты приведены в табл. 2.
Таблица 2.
Структурные свойства образцов, определенные по методу низкотемпературной адсорбции азота, и средний размер кристаллитов, найденный из рентгенограмм РФА
| Образец | Sуд, м2/г | Sмкпор, м2/г | Vмкпор, см3/г | dср, нм | ${{D}_{{{\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}},$ нм |
|---|---|---|---|---|---|
| АМШ-S | 14.8 | 7.1 | 0.003 | 7.5 | – |
| 15% Fe/АМШ-S | 21.4 | 2.5 | 0.008 | 9.4 | 8.1 |
| 2% K/15% Fe/АМШ-S | 14.5 | 4.9 | 0.002 | 10.9 | 6.5 |
| 15% Fe/2% /K/АМШ-S | 13.0 | 6.5 | 0.003 | 9.1 | 7.7 |
| 2% /K15% Fe/АМШ-S | 17.6 | 6.8 | 0.003 | 8.8 | 7.5 |
| АМШ-SP | 163.1 | 7.4 | 0.002 | 9.04 | – |
| 15% Fe/АМШ-SP | 125 | 4.7 | 0.0007 | 8.7 | – |
| 2% K/15% Fe/АМШ-SP | 101 | 12.0 | 0.005 | 10.2 | – |
| 15% Fe/2% K/АМШ-SP | 112 | 11.3 | 0.004 | 9.0 | – |
| 2% K15% Fe/АМШ-SP | 118 | 11.8 | 0.004 | 8.4 | – |
Определение элементного состава поверхности. Содержание элементов (мас. %) в образцах определяли методом энергодисперсионной спектроскопии (ЭДС) на сканирующем электронном микроскопе JSM-6390LA (“JEOL”, Япония). Для этого выполняли 3–4 измерения в произвольных точках пробы образца и вычисляли среднее значение. Результаты элементного анализа исходных образцов представлены в табл. 3.
Таблица 3.
Температуры, при которых достигаются максимальные скорости разложения образцов, величины тепловых эффектов и остаточные массы по результатам ДТА-ДТГ
| Образец | 1 пик | 2 пик | 3 пик | 4 пик | ∑∆Н, ккал/г |
∆m, % |
|||
|---|---|---|---|---|---|---|---|---|---|
| Т, °С | ∆Нразл, ккал/г |
Т, °С | ∆Нразл ккал/г |
Т, °С | ∆Нраз ккал/г |
||||
| Fe/АМШ-S | 117.8 | 279.2 | 194.0 | 398.2 | 256.0 | 479.1 | – | 1156.5 | 75.1 |
| FeK/АМШ-S | 118.9 | 198.3 | 180.0 | 402.3 | 252.0 | 460.9 | – | 1061.5 | 73.8 |
| Fe/АМШ-SP | 157.5 | 443.5 | 271.5 | 33.3 | 327.1 | 147.7 | 542.0 | 491.6 | 55.8 |
| FeK/АМШ-SP | 134.4 | 444.0 | 267.0 | 25.0 | 319.1 | 26.78 | 566.0 | 495.8 | 56.7 |
Рентгенофазовый анализ. Рентгенофазовый анализ (РФА) проводили с помощью дифрактометра ДРОН-3 (Россия) с CuKα-излучением и графитовым монохроматором в диапазоне 2θ = = 20°–70° в режиме пошагового сканирования с шагом 0.1° и временем экспозиции на точку 3 с. Для оценки размеров кристаллитов была выбрана съемка с шагом 0.02° и временем на точку 10 с. Рентгенограммы обрабатывали c использованием пакета программ [14]. Средний размер частиц гематита DHKL оценивали по формуле Шеррера [15]:
где λ – длина волны, составляющая 1.54 Å; β – интегральная полуширина линии, равная площади пика, деленной на интенсивность в максимуме; θ – угол отражения.Дифференциальный термический анализ (ДТА/ДТГ). Термоаналитические исследования (дифференциальный термический анализ (ДТА) и деривативную термогравиметрию (ДТГ) образцов проводили на приборе совмещенного анализа в термоанализаторе STA 449 C Jupiter (“NETZSCH”, Германия) в проточной инертной среде. Скорость потока аргона составляла 80 мл/мин, скорость нагрева 10°С/мин, интервал температур – от 40 до 600°С. Выделяющиеся в процессе термического разложения газы анализировали на квадрупольном масс-спектрометре QMS 403C (“NETZSCH”, Германия). Диапазон сканирования был от 10 до 50 m/z. Фиксировали следующие фрагменты: Н2О, О2, N2О, NO, N2 и NO2.
Температурно-программируемое восстановление (ТПВ) водородом. ТПВ водородом проводили на экспериментальной установке КЛ-1. В качестве детектора использовали катарометр. Смесь 5% Н2/Ar со скоростью 30 мл/мин пропускали через реактор с катализатором массой 40 мг при скорости нагрева 10°С/мин.
Магнитометрический метод in situ. Образцы исследовали на оригинальном вибрационном магнитометре (лабораторная установка) в режиме in situ с целью измерения намагниченности ферромагнитных компонентов, образующихся в ходе химической реакции [16]. Железо, магнетит и карбиды обладают значительными магнитными моментами, что и обуславливает намагниченность образцов. В ходе протекающих процессов при изменении температуры во времени намагниченность (J) изменяется, что позволяет следить за динамикой процесса восстановления во времени (dJ/dT) [16]. Магнитометрические измерения in situ особенно информативны, поскольку дают возможность в ходе химических превращений весьма точно определять состав крайне неустойчивых карбидов железа.
Катализаторы массой 10–20 мг восстанавливали в токе синтез-газа состава СО : Н2 = 1 : 1 при нагреве до температуры 600°С и скорости нагрева 10°/мин в измерительной ячейке вибрационного магнитометра. Ячейка вибрационного магнитометра представляла собой проточный кварцевый микрореактор объемом 0.3 см3, позволяющий изучать топохимические превращения в условиях in situ [17]. Газы предварительно пропускали через колонку с γ-Al2O3, нагретую до 300°С, для очистки от карбонилов железа. Исследуемый образец неподвижно фиксировали между двумя мембранами из пористого кварца. При нагреве непрерывно с частотой 1 Гц регистрировали изменение намагниченности. По достижении заданной температуры катализатор выдерживали в изотермическом режиме до постоянного значения намагниченности, свидетельствующей об окончании процесса восстановления. После восстановления образцы охлаждали в токе газа-восстановителя СО/Н2 со скоростью 10°C/мин, затем его заменяли на поток аргона и измеряли удельную намагниченность в зависимости от температуры, получая термомагнитную кривую (ТМК).
Найденные термомагнитные зависимости позволили с достаточно высокой точностью определить температуру Кюри образующейся фазы. Температуру Кюри находили как точку пересечения прямой, касательной к точке экстремума термомагнитной кривой, с осью абсцисс. Наличие перегибов на термомагнитной кривой свидетельствует о присутствии нескольких магнитных фаз. В этом случае по положению перегиба на кривой по температуре Кюри можно определить тип магнитной фазы. Анализ термомагнитных кривых при наличии 2-х магнитных фаз позволяет определять количественный состав магнитных фаз в образце [16].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве носителей Fe-, К-нанесенных катализаторов выбраны 2 пористые алюмо-магниевые коммерческие шпинели, представляющие собой белые порошкообразные вещества фракции 0.05–0.1 мм: АМШ-S и АМШ-SP. В табл. 2 приведены значения основных структурных параметров шпинелей и катализаторов на их основе согласно результатам, полученным методом низкотемпературной адсорбции азота. Анализ данных табл. 2 показал, что АМШ-S и АМШ-SP при разнице величин общей удельной поверхности на порядок имеют равные удельные поверхности микропор ~7 м2/г. Значения Sмкпор, рассчитанные методом БЭТ, уменьшаются в 3 раза для Fe/АМШ-S и в 2 раза для Fe/АМШ-SP по сравнению с чистыми носителями. Для калийсодержащих образцов величина Sмкпор зависит от последовательности введения калия. Так, при совместном введении Fe и К в АМШ-S удельная поверхность микропор катализатора становится соизмеримой с Sмкпор чистой шпинели, а в случае АМШ-SP она увеличивается в 1.6 раза. Следует отметить, что внесение Fe и K в матрицу АМШ-SP приводит к резкому уменьшению общей удельной поверхности (Sуд) образцов по сравнению с чистым носителем (с 163 до 11 м2/г), что вызвано интенсивным заполнением мезопор носителя наночастицами катализатора.
Согласно расчетным данным основной объем пор АМШ-SP (0.37 см3/г), приходится исключительно на мезопоры с dср = 9.0 нм, поскольку доля микропор в общем объеме пор ничтожна и составляет всего 0.5%. Для АМШ-S 89% объема пор (0.028 см3/г) распределено в мезопорах с dср = 7.5 нм, а остальные 11% (0.003 см3/г) – в микропорах.
Результаты энерго-дисперсионного анализа (ЭДС) изученных систем показали, что содержание Fe в образцах колеблется в интервале 17.7–25.7 мас. %, Mg – 11.7–14.2 мас. %, Al – 15.0–27.8 мас. %, кислорода – 29.0–39.6 мас. %, K – 0–2.4 мас. %. Согласно расчету чистые носители имеют формулу нестехиометрической шпинели типа MgxAlyOz, где х ≥ 1–1.2, у ≥ 2.0, z = 4–6. Анализ чистых шпинелей методом ЭДС свидетельствует об отсутствии в их составе посторонних примесей, которые могут оказывать влияние на физико-химические свойства синтезированных на их основе систем. Экспериментальное значение концентрации калия (2%) близко к расчетному, что говорит о равномерном распределении калия по поверхности носителя. Что касается концентрации железа, то она существенно отличается от расчетной. Связано это с тем, что ЭДС относится к поверхностным методам анализа. Для катализаторов на основе АМШ-SP наблюдается постоянное значение атомного соотношения К : Fe = 1 : 1.7, а в случае образцов на основе АМШ-S оно колеблется в пределах 1 : 6.6–11.2.
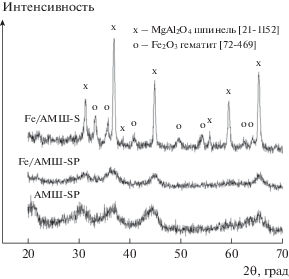
Из рентгенограммы РФА носителя АМШ-SP на рис. 1 видно, что это шпинель, хотя и хуже окристаллизованная, чем железный катализатор на ее основе. Дифрактограммы всех катализаторов на основе АМШ-SP идентичны, а сами они обладают достаточно аморфной структурой (рис. 1). Анализ рис. 1 показал, что образец Fe/АМШ-S в отличие от Fe/АМШ-SР достаточно хорошо окристаллизован, а рентгенограмма имеет четко выраженные пики. Из рентгенограмм катализаторов Fe/АМШ-S и Fe/АМШ-SР следует, что основные содержащиеся в них фазы – алюмо-магниевые шпинели и гематит. Рентгенофазовый анализ Fe-K-образцов свидетельствует об отсутствии фаз, в состав которых входит калий, что связано с малой концентрацией калия в катализаторе.
Наряду с определением фазового состава катализаторов на основании результатов РФА был оценен средний размер частиц гематита для катализаторов на основе АМШ-S с использованием уравнения Шеррера (табл. 1). Следует отметить, что размер области когерентного рассеяния (ОКР), найденный вышеуказанным методом [15], меньше либо равен реальному размеру частицы. Согласно полученным оценочным данным средний размер частиц гематита для Fe/АМШ-S составляет 7–8 нм и уменьшается в присутствии калия (FeК/АМШ-S).
Таким образом, исследованные промотированные калием Fe-содержащие катализаторы на основе шпинелей АМШ-SР и АМШ-S имеют различные структурные свойства и идентичный фазовый состав. Далее рассмотрим особенности топохимических превращений, протекающих на шпинелях в присутствии железа и калия, при приготовлении катализаторов.
Динамика термолиза нитратов в процессе приготовления FeК/АМШ-катализаторов
Динамику топохимических процессов при приготовлении катализаторов изучали методами термогравиметрии в комплексе с дифференциальной сканирующей калориметрией и масс-спектрометрическим анализом выделяющихся газов, сопровождающих синтез катализаторов.
Рассмотрим сначала результаты ДТА-ДТГ, полученные для чистых шпинелей и шпинелей, промотированных только ионами калия. Так, масса шпинели АМШ-S и образца К/АМШ-S при нагревании в токе аргона практически не изменяется, и общая потеря массы составляет порядка 0.2%. На термограмме ДТА при разложении К/АМШ-S отмечено 2 пика: эндотермический пик в области 100°С, связанный с удалением воды с поверхности образца, и небольшое плато в интервале температур 340–460°С, которое на основании анализа отходящих газов (m/z = 44) можно отнести к выделению N2O. Следует отметить, что характер зависимостей ДТА-ДТГ для чистой шпинели и К/АМШ-S схож. Принципиальное отличие состоит в том, что потеря массы К/АМШ-S выше на порядок и составляет 2%. Процесс потери массы сопровождается экзотермической реакцией разложения нитрата калия до нитрита калия при 362°С с выделением кислорода и NO (m/z = 30).
Результаты термического анализа (ДТА-ДТГ) прокаливания образца АМШ-SP в токе инертного газа (аргона) со скоростью нагрева 10 К/мин показали, что потеря массы образцом АМШ-SP проходит в 2 этапа. 1-й этап четко выраженный: по линии ДТА – от 40 до 301.7°С с максимумом при 129.7°С, по линии ДТГ – от 40 до 327.0°С с максимумом при 118.4°С при незначительном изменении массы на 4.79%. 2-й этап протекает монотонно: по линии ДТА от 301.7°С до окончания нагрева (600°С) и по линии ДТГ от 327.0°С до окончания нагрева при уменьшении массы на 1.08%. Некоторое различие в температурах связано с инерционностью весовой системы и временной задержкой передачи теплового импульса от вещества к сенсору. Таким образом, при 120°С наблюдается дегидратация/дегидроксилирование АМШ-SP с последующей монотонной потерей массы при Т > 350°С. Энтальпия эндотермического процесса составляет –143.7Дж/г. Сопоставимые данные получены для К/АМШ-SР.
Результаты ДТА-ДТГ для Fe-К-содержащих катализаторов на основе АМШ-S и АМШ-SР, представленные в табл. 3, существенно отличаются как от показателей для обсуждаемых выше носителей, так и между собой. При нагревании не промотированного образца Fe/АМШ-S на термограмме имеют место по крайней мере два четко выраженных пика при 117.8 и 194°С и третий слабовыраженный пик при 256°С. Первый пик характеризует эндотермический процесс удаления адсорбированной и химически связанной воды; второй и, по-видимому, третий пики относятся к экзотермическим процессом разложения нитрата железа. В случае FeK/АМШ-S образца на термограмме также присутствуют два ярко выраженных пика при 117.2 и 180°С и довольно четкий пик при 252°С, связанный с разложением нитрата калия. Для этих образцов отсутствует пик при 362°С, который наблюдается на ДТА-ДТГ-зависимости для К/АМШ-S.
На основании представленных результатов ДТА-ДТГ образцов Fe/АМШ-SP и FeK/АМШ-SР (табл. 3) можно выделить 4 последовательных процесса разложения при их нагревании: две перекрывающиеся стадии удаления адсорбированной и химически связанной воды (77–271.5°С для Fe/АМШ-SP и 58–260.8°С для FeK/АМШ-SР) и две стадии разложения нитрата железа (271.5–384 и 384–542°С для Fe/АМШ-SP и 260.8–399 и 399–568°С для FeK/АМШ-SР). Следует отметить, что наличие 2-х низкотемпературных пиков на кривой ДТА-ДТГ наблюдается в выбранных условиях термического анализа – при скорости нагрева 10°С/мин. После завершения всех четырех стадий разложения массы образцов при дальнейшем нагреве до 600°С практически не изменяются. Несмотря на различие в составе исследованных образцов, величины потери массы в процессе разложения достаточно близки: 27.63, 11.97 и 4.56 для Fe/АМШ-SP и 24.53, 13.9 и 4.9 для FeK/АМШ-SР. Заметные отличия между образцами проявляются в значении температур, при которых скорости процессов разложения наибольшие (Тразл): для Fe/АМШ-SP – 157.5, 327.1 и 459.5°С, а для FeK/АМШ-SР – 134.4, 321.8 и 455.5°С. Сдвиг максимумов на термограмме образца FeK/АМШ-SР по сравнению с Fe/АМШ-SP в область меньших температур обусловлен присутствием калия.
Помимо понижения Тразл в присутствии нитрата калия отмечено также снижение температур образования газообразных продуктов пиролиза по данным масс-спектрометрического анализа. Так, максимальную скорость выделения воды (m/z = 18) и окисла азота (m/z = 30) в непромотированном катализаторе Fe/АМШ-S зафиксировали при 143.1 и 334.1°С соответственно против 136.1 и 318.5°С для калийсодержащего образца. Характерно, что явно выраженное для Fe/АМШ-SP выделение кислорода (m/z = 32) при 132°С фактически совпадает с процессом обезвоживания (m/z = 18) при 136.1°С. Стоит заметить, что термолиз нитрата железа является сложным процессом, включающим в себя конденсацию четырех мономеров гидроксида железа с образованием азотной кислоты [18]. В масс-спектрах азотная кислота наблюдается как сумма газов N2O, NO2, NO и O2.
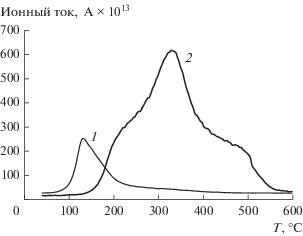
Сложный характер зависимостей скорости выделения NO (m/z = 30) (рис. 2) обусловлен последовательным удалением молекул азотной кислоты с ростом температуры [18]. Так, из приведенных на рис. 2 данных следуют очевидные различия в динамике термолиза FeK/АМШ-S и FeK/АМШ-SP. В последнем случае заметно повышение температуры максимумов скорости выделения NO. Кроме того, анализ влияния температуры на скорость выделения NO свидетельствует об изменении количества выделяющегося NO для каждого интервала температур.
Рис. 2.
Зависимость ионного тока от температуры в процессе термолиза для NO: 1 – FeК/АМШ-S, 2 – FeК/АМШ-SP.
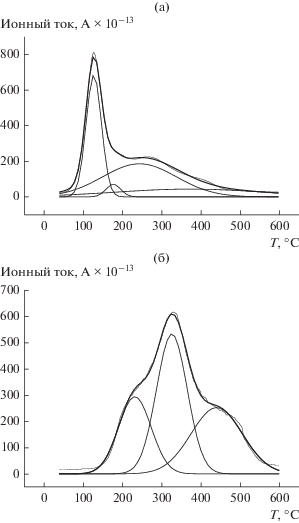
На рис. 3а и 3б представлены зависимости скоростей выделения NO от температуры для катализаторов FeК/АМШ-S и FeK/АМШ-SP, полученные аппроксимацией зависимости ионного тока от Т суммой Гауссовских пиков. Видно, что при переходе от системы FeK/АМШ-S (рис. 3а) к FeK/АМШ-SP (рис. 3б) изменяется не только температура максимумов скорости выделения NO, но и распределение количества выделяющегося NO по температурам (площадь под пиками). На наш взгляд, наблюдаемые отличия в динамике термолиза обусловлены явлениями массопереноса в катализаторе FeK/АМШ-SP с большей удельной поверхностью. Каждый пик на масс-спектрограммах (рис. 3) соответствует определенной стадии разложения нитрата железа и удаления нитрат-иона. Для образцов Fe/АМШ-S и Fe/АМШ-SP зависимости скорости выделения NO от температуры аналогичны (рис. 2 и 3).
Рис. 3.
Аппроксимация зависимости ионного тока от температуры суммой Гауссовских пиков для FeК/АМШ-S (а) и FeК/АМШ-SP (б).
Сравнительный анализ данных, приведенных в табл. 3 показал, что разложение нитрата железа в случае Fe/АМШ-S сопровождается значительным тепловым эффектом (∆Н), равным 1156.5 ккал/г, и остаточная масса (∆m) составляет 75.1%, в то время как для Fe/АМШ-SР тепловой эффект существенно ниже (491.61ккал /г), а остаточная масса меньше (55.8%). Аналогичная закономерность наблюдается для промотированных калием образцов: ∆Н составляет 1061.5 и 495.81 ккал/г, а ∆m – 73.76 и 55.68% при 599.9°С для FeК/АМШ-S и FeК/АМШ-SР соответственно (табл.3). Т.е. для систем на основе шпинели АМШ-S остаточные массы оказались выше, а потери массы – ниже на ~20%, чем для систем на основе АМШ-SР. При этом состав выделяющихся газов был практически идентичен. Следовательно, в случае катализатора Fe/АМШ-S эндотермический эффект при разложении выражен существенно сильнее, чем для Fe/АМШ-SР, благодаря особенностям структуры носителя – разнице удельных поверхностей.
Таким образом, полученные результаты свидетельствуют, что разложение катализаторов на основе АМШ-S происходит при меньших температурах, чем образцов, содержащих в качестве носителя АМШ-SР. Очевидно, что пониженные температуры разложения нитрата железа и высокие тепловые эффекты для катализаторов, приготовленных с использованием носителя АМШ-S, способствуют образованию более крупных частиц оксидов железа при нагревании по сравнению с образцами на основе АМШ-SР, что находится в соответствии с данными табл. 2.
Динамика топохимических превращений
Изучение динамики топохимических превращений, происходящих в Fe/АМШ-S , Fe/АМШ-SP, Fe/К/АМШ-S и Fe/K/АМШ-SР катализаторах, проводили магнитометрическим методом in situ путем регистрации изменения намагниченности в процессе протекающих реакций, сопровождаемых фазовыми превращениями [16].
На рис. 4а и 4б представлены профили температурно-программированного восстановления (ТПВ) катализаторов в смеси 5% Н2/Ar. Характер приведенных зависимостей отражает типичную последовательность процессов, протекающих на железосодержащих катализаторах и, как было показано ранее [16], соответствует реакциям превращения Fe2O3 → Fe3O4, Fe3O4 → FeO и FeO → → Fe. В табл. 3 приведены температуры начала образования магнетита, вюстита и железа. Из табл. 4 следует, что промотирование катализаторов калием во всех случаях существенно повышает температуру начала восстановления и смещает положение пиков в высокотемпературную область, причем наиболее заметен сдвиг 1-го пика (на 50–90°С). Сравнение Fe-К-содержащих образцов на основе носителей АМШ-S и АМШ-SР свидетельствует, что для Fe/АМШ-SР температуры начала восстановления (280, 460 и 530°) также значительно (на 50–80°С) выше, чем для Fe/АМШ-S (200, 410 и 470°С). Этот факт подтверждает присутствие более мелких частиц гематита в случае FeК/АМШ-SР. Следует подчеркнуть, что при прокаливании термолиз нитратов при нанесении их на АМШ-S протекает при более низкой температуре, и в результате, как уже было отмечено, образуются сравнительно более крупные частицы гематита, чем в случае носителя АМШ-SР.
Рис. 4.
Кривые ТПВ в токе 5% Н2/Ar: а – Fe/АМШ-S (1) и Fe/АМШ-SP (2); б – Fe/К/АМШ-S (1) и Fe/K/АМШ-SР (2).
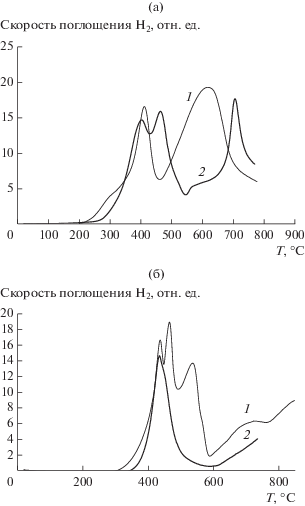
Таблица 4.
Температуры (°С) начала восстановления катализаторов для реакций по данным ТПВ (5% Н2/Ar)
| Образец | Стадии восстановления | ||
|---|---|---|---|
| Fe2O3 → F3O4 | Fе3O4 → FeO | FeO → Fe | |
| Fe/АМШ-S | 200 | 410 | 470 |
| K/Fe/АМШ-S | 290 | 440 | 485 |
| Fe/K/АМШ-S | 310 | 445 | 580 |
| FeK/АМШ-S | 320 | 445 | 580 |
| Fe/АМШ-SP | 280 | 460 | 530 |
| K/Fe/АМШ-SP | 330 | 450 | 560 |
| Fe/K/АМШ-SP | 360 | 450 | 600 |
| FeK/АМШ-SP | 340 | 435 | 610 |
Термомагнитный анализ позволяет определить качественный и количественный состав катализатора в среде инертного газа. На основании найденных значений температур Кюри и (или) отсутствия перегибов на термомагнитных зависимостях можно делать вывод о присутствии одной или нескольких магнитных фаз в каталитической системе. Известно, что форма ТМК и значение температуры Кюри (Тθ) зависят от размера частиц ферромагнетика [19], поэтому отличие найденных нами в настоящей работе значений Тθ от полученных для массивного вещества [19, 20], а также форма ТМК в области низких температур, возможно, объясняются малыми размерами наночастиц магнетика в синтезированных катализаторах.
Термомагнитные зависимости восстановленных в смеси СО/Н2 катализаторов на основе АМШ-S представлены на рис. 5. Из графиков следует, что значения намагниченности восстановленных катализаторов отличаются друг от друга более чем в 1.5 раза и возрастают в ряду: FeК/АМШ-S < Fe+К/АМШ-S < К/Fe/АМШ-S < < Fe/АМШ-S. Вычисленные из графиков значения Тθ вышеуказанных образцов составили 257 ± ± 5°С и соответствуют Тθ карбида Хэгга χ-Fe5С2 [19]. Характерно, что на термомагнитных зависимостях отсутствуют какие-либо перегибы, относящиеся к иным ферромагнитным фазам, кроме карбида χ-Fe5С2. Ранее в работе [3] упоминалось, что при активации железосодержащих катализаторов в СО происходит практически полное превращение оксида железа в карбиды, крайне неустойчивые даже в присутствии восстановительной смеси реагентов.
Рис. 5.
Зависимости намагниченности от температуры для Fe-содержащих катализаторов на основе шпинели АМШ-S в токе аргона: 1 – Fe/АМШ-S, 2 – К/Fe/АМШ-S, 3 – Fe+К/АМШ-S, 4 – Fe/К/АМШ-S.
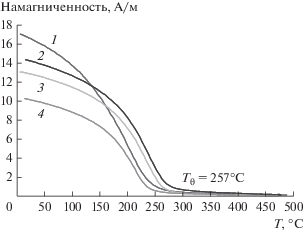
В табл. 5 приведены магнитные параметры систем, полученные из зависимостей намагниченности от величины магнитного поля, и вычисленные значения содержания карбида χ-Fe5С2 в образцах. Известно, что существует прямо пропорциональная зависимость между величиной намагниченности и содержанием в образце ферромагнитного компонента [16]. Зная массу навески, намагниченность восстановленного катализатора и удельную намагниченность χ-Fe5С2, равную 140 А см2/г, можно рассчитать количество карбида Хэгга в образце [21]. Анализ данных табл. 5 свидетельствует, что максимальное значение намагниченности и наибольшее содержание карбида (14%) принадлежит в этой серии образцов катализатору Fe/АМШ-S. Характерно, что введение калия в образцы на основе АМШ-S приводит к некоторому уменьшению намагниченности и, следовательно, понижению количества карбида в катализаторах. Промотирование калием образцов Fe/АМШ-SР практически не влияет на намагниченность и содержание в них карбида. Тем не менее, расчет показал, что при прочих равных условиях количество образовавшегося карбида Хэгга в катализаторах на основе АМШ-S и АМШ-SР неодинаково – первом случае оно выше в 2–3 раза. Отношение β(Fe/АМШ-S)/β(Fe/АМШ-SР) для непромотированных образцов составило 3.5. Анализ полевых зависимостей в ряде случаев позволяет сделать выводы о размерах частиц ферромагнетика. Если на полевой зависимости коэрцитивная сила (Нс) незначительна, т.е. практически отсутствует гистерезис, то система состоит преимущественно из суперпарамагнитных частиц. Если наблюдается гистерезис и Нс велика, то в системе присутствуют крупные частицы с размерами, отличными от суперпарамагнитных. Соотношение JR/JS позволяет произвести оценку доли несуперпарамагнитных частиц в катализаторе: чем меньше остаточная намагниченность JR и коэрцитивная сила Нс, тем намагниченность насыщения JS больше.
Таблица 5.
Магнитные параметры образцов
| Образец | Hc, Э | JR, А/м | JS, А/м | JR/JS | Тmax, °C (СО/Н2) | β, % |
|---|---|---|---|---|---|---|
| 15% Fe/АМШ-S | 98 | 3.3 | 20 | 0.17 | 293 | 14.0 |
| 2% K/15% Fe/АМШ-S | 439 | 5.5 | 15.5 | 0.35 | 334 | 11.0 |
| 15% Fe/2% /K/АМШ-S | 579 | 4.5 | 11.7 | 0.38 | 276 | 8.3 |
| 15% Fe + 2% K/АМШ-S | 497 | 5.2 | 15.6 | 0.33 | 311 | 11.2 |
| 15% Fe/АМШ-SP | 117 | 1.0 | 5.7 | 0.17 | 339 | 4.0 |
| 2% K/15% Fe/АМШ-SP | 177 | 0.98 | 5.0 | 0.19 | 310 | 4.5 |
| 15% Fe/2% K/АМШ-SP | 89 | 0.82 | 6.5 | 0.12 | 348 | 3.6 |
| 15% Fe + 2% K/АМШ-SP | 61 | 0.8 | 6.67 | 0.12 | 328 | 4.7 |
ЗАКЛЮЧЕНИЕ
Резюмируя вышеизложенное, можно сделать вывод, что по данным ДТА-ДТГ разложение Fe-катализаторов на основе АМШ с меньшей удельной поверхностью происходит при температурах ниже, нежели в случае АМШ с большей Sуд, что облегчает процесс разложения и, скорее всего, приводит к образованию более крупных частиц оксида железа. Анализ полученных результатов ТПВ (табл. 4) подтверждает, что чем крупнее частицы гематита, тем ниже температура начала восстановления в процессах Fe2O3 → Fe3O4, Fe3O4 → → FeO и FeO → Fe катализаторов – 200, 410 и 470°С для Fe/АМШ-S и 280, 460 и 530°С для Fe/АМШ-SР – и тем легче они восстанавливаются. А, значит, тем выше намагниченность восстановленного в синтез-газе катализатора, степень его восстановления, и, следовательно, больше количество образующегося карбида Хэгга (табл. 5). Действительно, использование в качестве носителя шпинели АМШ-S для железосодержащих катализаторов приводит при активации их в синтез-газе к образованию значительных количеств карбида Хэгга. Так, степень карбидирования β катализатора Fe/АМШ-S в 2–3 раза выше, чем для образцов на основе Fe/АМШ-SР (14 и 3.9% соответственно). Подобная закономерность отмечается и для промотированных катализаторов, приготовленных последовательным нанесением калия и железа.
Таким образом, особенности структурных свойств носителей – алюмо-магниевых шпинелей АМШ-S и АМШ-SР – проявляются в различии удельных поверхностей носителей, что напрямую влияет на количество образовавшегося карбида Хэгга при активации железо-нанесенных катализаторов в процессе гидрирования СО.
Список литературы
O’Brien R.J., Xu L., Bao S., Raje A., Davis B.H. // Appl. Catal. A: General. 2000. V. 196. P. 173.
Davis B.H. // Catal. Today. 2009. V. 141. P. 25
Li S., O’Brien R.J., Meitzner G.D., Hamdehd H., Davis B.H., Iglesia E. // Appl. Catal. A: General. 2001. V. 219. P. 215.
Dry M.E. Studies in Surface Science and Catalysis. Amsterdam: Elseveier, 2004. 533 p.
Gracia J.M., Prinsloo F.F., Niemantsverdriet J.W. // Catal. Lett. 2009. V. 133. P. 257.
de Smit E., Cinquini F., Beale A.M., Safonova O.V., van Beek W., Sautet P., Weckhuysen B.M. // J. Am. Chem. Soc. 2010. V. 132. P. 14928.
Wan H., Wu B., Zhang C., Xiang H., Li Y. // J. Mol. Catal. A: Chemical. 2008. V. 283. P. 33.
Chonco Z.H., Lodya L., Claeys M., van Steen E. // J. Catal. 2013. V. 308. P. 363.
Girardon J.-S., Lermontov A.S., Gengembre L., Chernavskii P.A., Griboval-Constant A., Khodakov A.Y. // J. Catal. 2005. V. 230. P. 339.
Jalama K., Coville N.J., Xiong H., Hildebrandt D., Glasser D., Taylor S., Carley A., Anderson J.A., Hutchings G.J. // Appl. Catal. A: General. 2011. V. 395. P. 1.
Панкина Г.В., Чернавский П.А., Лермонтов А.С., Лунин В.В. // Нефтехимия. 2002. Т. 42. № 4. С. 243.
Rahmati M., Huang B., Max K., Mortensen Jr., Keyvanloo K., Fletcher T.H., Woodfield B.F., Hecker W.C., Argyle M.D. // J. Catal. 2018. V. 359. P. 92.
Barradas S., Caricato E.A., van Berge P.J., van de Loosdrecht J. // Stud. Surf. Sci. Catal. 2000. V. 143. P. 55.
Горелик С.С., Скаков Ю.А., Расторгуев Р.Н. Рентгенографический и электроно-оптический анализ. М.: МИСИС, 2002. 352 с.
Тейлор А. Рентгеновская металлография. М.: Металлургия, 1965. 310 с.
Chernavskii P.A., Pankina G.V., Lynin V.V. // Russ. Chem. Rev. 2011. V. 80. P. 579.
Chernavskii P.A., Lunin B.S., Zakharyan R.A., Pankina G.V., Perov N.S. // Inst. Exp Tech. 2014. V. 57. P. 78.
Melnikov P.A., Nascimento V.A., Arkhangelsk I.V., Zanoni Consolo L.Z., de Oliveira L.C.S. // J. Therm. Anal. Calorim. 2014. V. 115. P. 145.
Selwood P.W. Magnetochemistry. N. Y.: Interscience Publ., 1956. 465 p.
Петров Ю.И. Физика малых частиц. М.: Наука, 1948. С. 256.
Чернавский П.А., Казак П.А., Панкина Г.В., Строкова Н.Е., Перфильев Ю.Д. // Кинетика и катализ. 2018. Т. 59. № 2. С. 251.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ