Кинетика и катализ, 2019, T. 60, № 5, стр. 618-623
Триметаллические катализаторы риформинга Pt–Sn–Zr/γ-Al2O3
В. Ю. Трегубенко a, *, К. В. Веретельников b, А. С. Белый a
a Центр новых химических технологий ИК СО РАН
644040 Омск, ул. Нефтезаводская, 54, Россия
b ФГБОУ ВО Омский государственный технический университет
644050 Омск, просп. Мира, 11, Россия
* E-mail: kalinina_ihcp1@mail.ru
Поступила в редакцию 20.09.2018
После доработки 19.02.2019
Принята к публикации 14.03.2019
Аннотация
Изучено влияние модифицирования катализатора Pt/Al2O3 соединениями Sn и/или Zr (влияние порядка введения предшественников металлов и содержания циркония) на адсорбционные и каталитические характеристики формирующихся платиновых центров в риформинге н-гептана.
Постоянное развитие процесса каталитического риформинга диктует новые требования к катализаторам, приводя к совершенствованию их структуры, усложнению состава и оптимизации состояния активного компонента. Современные направления развития технологии каталитического риформинга бензина заключаются в увеличении продолжительности межрегенерационного цикла. С этой целью традиционная каталитическая система Pt на кислотном оксиде алюминия обычно промотируется металлическими добавками (Re, Ir, Sn и др.) [1–7]. Промоторы вводят в катализатор на стадии приготовления носителя – оксида алюминия или на стадии нанесения платины и хлора. Готовый катализатор содержит промоторы в виде оксидов или металлов, которые могут взаимодействовать с платиной и увеличивать селективность (выход риформата С5+) и стабильность за счет уменьшения коксуемости.
В настоящее время триметаллические катализаторы для риформинга бензина вызывают повышенный интерес. В литературе можно найти работы по синтезу, исследованию физико-химических характеристик и использованию Pt–Re–Sn- [4–6], Pt–Ir–Sn- [7], Pt–Re–Ge- [4, 8] и других систем. Триметаллические катализаторы характеризуются большей селективностью и устойчивостью к образованию кокса, чем биметаллические.
Потенциальными добавками в катализатор риформинга к паре Pt–Re также являются элементы группы IVА (Ti, Zr) и IVB (Ge, Sn и Pb) периодической таблицы элементов. Оксиды этих элементов довольно устойчивы и частично восстанавливаются до металлического состояния при активации в условиях процесса риформинга бензина. Следовательно, только часть добавленных промоторов может взаимодействовать с Pt. Остальные остаются в окисленном виде на носителе, и их эффект заключается в изменении кислотности носителя [5, 6].
Платинооловянные катализаторы риформинга известны с 1960-х гг. К настоящему времени выполнен большой объем исследований по влиянию олова на свойства платиносодержащих катализаторов [4–6, 9]. По сравнению с монометаллическими катализаторами олово увеличивает селективность и стабильность катализатора [9]. Более того, олово препятствует агломерации частиц платины при выжиге кокса. Добавки 0.3 мас. % олова уменьшают общее число кислотных центров в алюмоплатиновом катализаторе (по данным температурно-программируемой десорбции NН3), при этом частично блокируются сильные кислотные центры, на которых протекают реакции гидрокрекинга и гидрогенолиза, тогда как центры средней силы, ответственные за изомеризацию и циклизацию, остаются [6].
Литературных данных по влиянию циркония на свойства Pt-, Pt–Re- и Pt–Sn-катализаторов риформинга гораздо меньше. В то же время при поиске перспективных систем катализаторы на основе оксида циркония (или оксида циркония, нанесенного на другой оксид) были исследованы во многих реакциях и обнаружены уникальные свойства таких систем. Например, цирконий может уменьшать кислотность и повышать эффективность катализаторов Pt/CeO2–ZrO2 для риформинга метана [10]. Pt-катализаторы с диоксидом циркония, включенным в диоксид кремния, в составе носителя характеризуются более высокой дисперсностью платины вследствие более сильного взаимодействия платины с модифицированным носителем [11]. В сравнительном исследовании катализаторов Pt и Pt–Sn, нанесенных на оксид алюминия и оксид циркония, было предположено [12], что более слабокислотный катализатор на основе носителя ZrO2 подавлял образование кокса и ингибировал дезактивацию катализатора в реакции дегидрирования н-октана. В работе [13] наблюдали увеличение конверсии и селективности по пропилену в дегидрировании пропана на Pt–Sn–In/Al2O3, модифицированном ZrO2. Для катализаторов гидрокрекинга также было обнаружено снижение кислотности (бренстедовской и льюисовской) ультрастабильного цеолита Y при введении циркония [14]. Ранее было показано, что Pt-содержащие катализаторы на основе оксида алюминия, модифицированного цирконием, также обладают более высокой каталитической активностью в ароматизации алканов по сравнению с нанесенными на оксид алюминия системами [15, 16].
Целью настоящей работы являлось изучение эффектов модифицирования катализаторов риформинга путем введения в их состав промоторов – соединений олова и/или циркония.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали сферический оксид алюминия γ-Al2O3 (“Sasol”, Германия) с диаметром гранул 1.6 мм. Непосредственно перед нанесением активных компонентов носитель прокаливали при 600°С в муфельной печи в течение 2 ч. Модификаторы вводили методом пропитки по влагоемкости. Пропиточный раствор содержал 3.0 мас. % щавелевой кислоты и предшественник модификатора (олово и/или цирконий).
Sn вводили в виде хлорида олова(IV) (SnCl4 ⋅ 5H2O), а Zr – в виде нитрата цирконила (ZrO(NO3)2 ⋅ 2H2O). Расчетное содержание олова составляло 0.2 мас. % Sn, а циркония – 0.5 и 1.0 мас. % Zr (табл. 1). Модифицированные носители сушили при 120°С и прокаливали в токе осушенного воздуха 550°С в течение 1 ч.
Таблица 1.
Содержание металлов и хлора в образцах с Pt
| Катализатор | Pt | Sn | Zr | Cl |
|---|---|---|---|---|
| мас. % | ||||
| Pt/Al | 0.28 | – | – | 1.1 |
| PtSn/Al | 0.27 | 0.17 | – | 1.2 |
| Pt/Sn/Al | 0.28 | 0.17 | – | 1.2 |
| Sn/Pt/Al | 0.26 | 0.17 | – | 1.2 |
| PtSn0.5Zr/Al | 0.27 | 0.18 | 0.65 | 1.2 |
| Pt/Sn0.5Zr/Al | 0.28 | 0.17 | 0.68 | 1.2 |
| Pt/Sn1.0Zr/Al | 0.26 | 0.18 | 1.03 | 1.2 |
Катализаторы готовили введением расчетных количеств Pt- и Cl-предшественников (H2PtCl6 ⋅ 5Н2О и HCl) методом пропитки в избытке раствора на оксид алюминия, промотированный оловом и/или цирконием, для получения содержания 0.25 мас. % Pt и 1.2 мас. % Cl. Приготовленные катализаторы сушили при 120°С в течение 1 ч, прокаливали в токе осушенного воздуха при 500°С (1 ч) и восстанавливали в токе водорода при 500°С (1 ч).
Были приготовлены следующие образцы:
Pt/Al – монометаллический катализатор,
PtSn/Al – биметаллический катализатор с нанесением активных компонентов совместной пропиткой,
Pt/Sn/Al и Sn/Pt/Al – биметаллические катализаторы с последовательной пропиткой растворами предшественников активных компонентов (порядок написания элементов соответствует порядку их введения в состав катализатора),
Pt/SnyZr/Al – триметаллические катализаторы на модифицированном оловом и цирконием носителе (где y – содержание циркония, мас. %),
PtSnyZr/Al – триметаллические катализаторы с нанесением активных компонентов совместной пропиткой (где y – содержание циркония, мас. %).
Содержание хлора в образцах определяли методом рентгеновской флуоресцентной спектроскопии.
Атомно-эмиссионная спектрометрия с индуктивно-связанной плазмой (АЭС-ИСП)
Содержание платины, олова и циркония определяли методом АЭС-ИСП на спектрометре Varian 710-ES (“Aglient Technologies”, США). Навески образцов для анализа готовили путем растворения катализаторов в серной кислоте.
Рентгенофазовый анализ (РФА)
РФА прокаленных при 600 и 550°С образцов проводили на порошковом рентгеновском дифрактометре D8 Advance (“Bruker”, Германия) в монохроматизированном CuKα-излучении в диапазоне углов дифракции 2θ = 10°–70° с шагом сканирования 0.05°. Размер области когерентного рассеяния (ОКР) определялся по формуле Селякова–Шеррера.
Определение SБЭТ
Текстурные характеристики предварительно прокаленных при 550°С образцов исследовали на адсорбционном приборе Sorptomatic-1900 (“Carlo Erbo”, Италия) по изотермам адсорбции–десорбции азота при 77.4 К. Перед измерениями образцы выдерживали в вакууме при температуре 300°С в течение 6 ч. Расчеты удельной поверхности по БЭТ (SБЭТ) выполняли в интервале равновесных относительных значений паров азота Р/Р0 = 0.05–0.33 по изотерме адсорбции. Значения адсорбционного объема пор (Vадс) определяли по величине адсорбции азота при Р/Р0 = 0.990.
Температурно-программируемое восстановление водородом (ТПВ-Н2)
ТВП-Н2 проводили на хемосорбционном анализаторе AutoChem II 2920 (“Micromeritics”, США) предварительно прокаленных при 500°С в течение 1 ч образцов катализаторов до конечной температуры 500°С со скоростью нагрева измерительной ячейки с образцом 10°С/мин, используя газовую смесь 10 об. % H2 с Ar при скорости потока 30 мл/мин.
Определение дисперсности платины
Для определения дисперсности платины в восстановленных катализаторах использовали метод газового титрования. Методики О2–Н2-титрования и химической адсорбции О2, примененные в данной работе для оценки дисперсности и состава платиновых центров катализаторов, подробно описаны в работе [17].
Риформинг н-гептана
Катализаторы испытывали в модельной реакции риформинга н-гептана в изотермическом реакторе в диапазоне температур от 460 до 520°С, при давлении 1 МПа, объемной скорости подачи сырья (ОСПС) 8.3–14 ч–1 и отношении водород : : сырье = 5 : 1 (моль/моль). Углеводородный состав получаемого продукта реакции анализировали в режиме онлайн на газовом хроматографе Цвет 800 (Россия), снабженном пламенно-ионизационным детектором и капиллярной колонкой HP-PONA (диметилполисилоксан) (“Restek”, США).
По результатам тестирования определяли значения констант скоростей основных направлений превращения н-С7 (ароматизация – kА, крекинг – kКр). Из температурной зависимости k = = f(Т) рассчитывали значения кажущейся энергии активации целевой реакции (EА, кДж/моль), а также селективность ароматизации (S) как соотношение kА/kΣ, где kΣ – суммарная константа скорости превращения н-С7. Интегральным критерием активности в целевой реакции является величина удельной производительности (УП, гтолуол${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 при Т = 490°С (усредненная в диапазоне температур 460–520°С).
По изменению величины УП в процессе длительных испытаний при 520°С рассчитывали константу дезактивации Kд, которая является критерием стабильности работы катализатора [18]. Коэффициент эффективности рассчитывали как Kэф = УПсрS Kд.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно проведенному рентгенофазовому анализу использованное модифицирование носителей не оказывает влияния на фазовый состав и параметры кристаллической структуры. Все образцы представляют собой γ-форму оксида алюминия с размером ОКР, равным 45 Å.
Текстурные характеристики катализаторов на основе исходного и модифицированных образцов Al2O3 представлены в табл. 2. Видно, что модифицированные катализаторы имеют несколько меньшие суммарный объем пор и удельную поверхность, чем у катализатора на основе исходного оксида алюминия. Обработка γ-Al2O3 раствором хлорида олова(IV) и/или нитрата цирконила в щавелевой кислоте незначительно повлияла на величину среднего диаметра пор катализатора: вид кривых распределения объемов пор по размерам для катализаторов при введении модификаторов не изменился.
Методом ТПВ-Н2 были изучены закономерности восстановления катализаторов, содержащих 0.25 мас. % Pt и 0.2 мас. % Sn/γ-Al2O3 и прокаленных при температуре 500°С, различающихся порядком введения металлов.
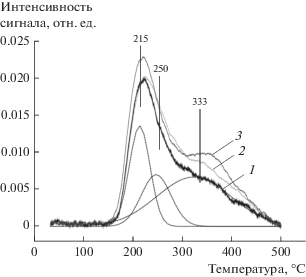
Как следует из рис. 1, ТПВ-профили обнаруживают две области поглощения водорода – низкотемпературную (с максимумом при 215°С с плечом при 250°С) и высокотемпературную (максимум при 333°С). Первый пик на кривых ТПВ для всех образцов соответствует восстановлению PtOСl2 на поверхности оксида алюминия [19]. Второй максимум при 333°C может быть отнесен как к восстановлению атомов Pt, более прочно связанных с носителем [19], так и к частичному восстановлению оксида олова. Введение сначала Pt, а затем Sn в носитель приводит к повышению интенсивности пика поглощения водорода при 333°С. Возможно, что данный максимум на кривой ТПВ для катализатора Sn/Pt/Al2O3 соответствует поглощению водорода при восстановлении оксида олова, которое катализируется платиной.
Согласно литературным данным, монометаллический образец Sn/Al2O3 характеризуется широким профилем восстановления и обнаруживает две основные области поглощения водорода при 200–300 и 380–520°С [5]. Это связывают сo взаимодействием оксида олова и оксида алюминия, вероятно, с образованием алюминатов олова. Однако в присутствии платины температура восстановления оксида олова снижается до температур 270–450°С с максимумом при 350°С [6]. В литературе также сообщается о том, что оксид олова(IV) восстанавливается до оксида олова(II), который по причине прочной связи с носителем не восстанавливается до металла [9, 20]. В публикации [6] отмечается, что Sn(IV), в основном, восстанавливается до Sn(II) и лишь небольшая доля – до Sn(0). При этом Sn(0) может взаимодействовать с Pt(0) с образованием сплавов [20, 21]. Основываясь на данных Мессбауэровской спектроскопии, в работе [22] сообщается о том, что восстановление Sn(IV) до Sn(0) для катализатора Sn/Pt/Al протекает в большей степени, чем для Pt/Sn/Al. Следовательно, оксид олова(IV) в условиях восстановления в присутствии платины может частично переходить в металлическое состояние.
Таким образом, увеличение количества поглощаемого водорода с максимумом при 333°С в ряду PtSn/Al2O3 < Pt/Sn/Al2O3 < Sn/Pt/Al2O3 на ТПВ-кривых образцов катализаторов (рис. 1) может быть объяснено либо увеличением доли прочносвязанных с носителем форм платины в катализаторах, либо увеличением степени восстановления оксида олова. При этом присутствие восстановленного олова в образцах может сказаться на каталитических свойствах исследуемых систем.
Дисперсность платины и состав платиновых центров для исследуемых Pt,Sn- образцов катализаторов представлены в табл. 3. В результате восстановления платиновых комплексов образцы катализаторов характеризуются высокой дисперсностью платины 69–92%. Наибольшие дисперсность и количество заряженных платиновых центров (Ptσ) в биметаллических системах установлены для образца, полученного совместной пропиткой оксида алюминия растворами Pt и Sn. Sn/Pt/Al2O3-катализатор характеризуется самым низким содержанием заряженных форм платины среди биметаллических образцов (табл. 3). Следовательно, на ТПВ-кривых высокотемпературную область поглощения водорода для Sn/Pt/Al2O3 и Pt/Sn/Al2O3 можно отнести, скорее всего, к восстановлению частиц олова, тогда как в PtSn/Al2O3-катализаторе эта область поглощения, вероятно, соответствует наиболее прочно связанным с оксидной поверхностью трудно восстанавливаемым формам платины.
Таблица 3.
Значения дисперсности нанесенной платины Pt-катализаторов. Состав платиновых центров
| Образец | Дисперсность Pt, % | Количество поверхностной Ptпов, мкмоль/гкат | |
|---|---|---|---|
| Ptσ | Pt0 | ||
| Pt/Al | 65 | 4.78 | 3.55 |
| PtSn/Al | 92 | 10.44 | 2.26 |
| Pt/Sn/Al | 92 | 9.25 | 3.96 |
| Sn/Pt/Al | 82 | 6.56 | 4.37 |
| PtSn0.5Zr/Al | 89 | 10.66 | 1.66 |
| Pt/Sn0.5Zr/Al | 91 | 10.46 | 2.61 |
| Pt/Sn1.0Zr/Al | 69 | 4.60 | 4.60 |
Влияние порядка введения Sn и Pt на активность и селективность Pt,Sn-образцов катализаторов в превращении н-гептана показано в табл. 4. Можно отметить, что последовательность добавления Sn и Pt оказывает определенный эффект на каталитические характеристики для биметаллических катализаторов Pt/Sn/Al2O3, PtSn/Al2O3 и Sn/Pt/Al2O3.
Таблица 4.
Результаты каталитических испытаний образцов Pt-катализаторов в риформинге н-гептана*
| Катализатор | УПср, гтолуол ${\text{г}}_{{{\text{кат}}}}^{{ - 1}}$ ч–1 |
S | Ea, кДж/моль | Kд (при 520°С) | Kэф |
|---|---|---|---|---|---|
| Pt/Al | 2.53 | 0.58 | 98 | 0.78 | 1.14 |
| PtSn/Al | 2.80 | 0.60 | 110 | – | – |
| Pt/Sn/Al | 2.75 | 0.55 | 130 | 0.81 | 1.22 |
| Sn/Pt/Al | 2.59 | 0.48 | 101 | – | – |
| PtSn0.5Zr/Al | 2.91 | 0.59 | 103 | – | – |
| Pt/Sn0.5Zr/Al | 2.84 | 0.57 | 116 | 0.86 | 1.39 |
| Pt/Sn1.0Zr/Al | 2.31 | 0.62 | 104 | – | – |
Катализатор Sn/Pt/Al2O3 показывает наиболее низкую активность и селективность ароматизации н-гептана по сравнению с остальными биметаллическими образцами серии (табл. 4) вследствие значительного увеличения выхода газов, а именно за счет большего содержания газов С3–С4 в продуктах. Это может быть связано с усилением кислотной функции катализатора.
Катализатор PtSn/Al показывает более высокую селективность (табл. 4) в модельной реакции ароматизации н-гептана по сравнению с остальными Pt,Sn-образцами серии. Количество центров, ведущих данную целевую реакцию, заметно больше на образце, приготовленном с использованием совместной пропитки оксида алюминия предшественниками Pt и Sn. Катализатор PtSn/Al также характеризуется максимальной дисперсностью платины 92% и количеством платины в заряженном состоянии по сравнению с остальными биметаллическими образцами серии.
Катализаторы с содержанием циркония 0.5 мас. % также имеют высокую дисперсность платины 89–92 мас. % с преобладающей долей Ptσ-центров (табл. 3).
Ионные формы платины представляют собой малолигандные кластеры платины – это система нескольких атомов металла со степенью окисления платины от +1 до +2, которая реализуется за счет присутствия в координационной сфере платины электроотрицательных атомов хлора, кислорода и серы. Ионная платина образуется в результате сильного взаимодействия предшественника активного компонента с носителем. В работе [15] было установлено, что Ptσ-центры платины являются специфическими активными центрами ароматизации парафиновых углеводородов.
Известно [15], что реакции крекинга и коксообразования протекают через стадии образования прочносвязанных переходных комплексов на активных центрах поверхности катализатора. Уменьшение выхода С1–С4 и увеличение доли газов С3–С4 в составе углеводородных газов, а также повышение устойчивости к дезактивации коксом катализаторов свидетельствуют о снижении образования прочносвязанных состояний. Это вызывает смещение превращений н-гептана в направлениях менее прочносвязанных состояний, т.е. в сторону реакций изомеризации и дегидроциклизации.
Влияние циркония на активность, селективность и стабильность Pt,Sn-образцов катализаторов в превращении н-гептана показано в табл. 4. С введением 0.5 мас. % Zr увеличивается активность катализаторов в реакции ароматизации н-гептана. Селективность по ароматическим углеводородам возрастает для Pt/Sn0.5Zr/Al2O3 до 0.57 по сравнению с Pt/Sn/Al (0.55). Повышение содержания циркония до 1.0 мас. % в катализаторе Pt/Sn1.0Zr/Al2O3 негативно сказывается на каталитических характеристиках в риформинге н-гептана, поскольку значительно снижает активность, хотя данный образец показывает максимальную селективность по ароматическим углеводородам при снижении степени превращения сырья. Катализатор Pt/Sn1.0Zr/Al2O3 с повышенным содержанием циркония имеет самые низкие показатели гидрогенолитической способности и способности катализировать реакции гидрокрекинга. Можно предположить, что цирконий значительно подавляет кислотную функцию катализатора в данном случае. Вероятно, с введением 1.0 мас. % Zr значительно снижается концентрация сильных льюисовских кислотных центров, которые отвечают за протекание реакций гидрогенолиза и гидрокрекинга. Рост концентрации слабых льюисовских кислотных центров приводит к интенсификации реакции изомеризации [14], снижению активности в реакции ароматизации н-алканов, что и наблюдается для образца Pt/Sn1.0Zr/Al2O3.
Для цирконийсодержащих образцов обнаружено заметное снижение энергии активации реакции ароматизации (табл. 4). Так, для образца Pt/Sn/Al2O3 энергия активации составляет 130 кДж/моль, а для Pt/Sn0.5Zr/Al2O3 – 116 кДж/моль. Столь существенное отличие кинетических параметров реакции свидетельствует о возможности изменения природы переходного комплекса на поверхности катализатора в результате изменения состояния платины.
Таким образом, влияние циркония на каталитические свойства Pt–Sn/Al2O3-систем при риформинге н-гептана может быть обусловлено воздействием как на металлическую, так и кислотную функции катализаторов.
Известно, что цирконий влияет на кислотные свойства катализаторов, снижая силу льюисовских кислотных центров [13, 16], в результате реакции гидрокрекинга, которые требуют присутствия сильных кислотных центров, подавляются, а реакции изомеризации, протекающие на более слабых центрах, преобладают. Так, например, в работе [16] было установлено, что с ростом содержания диоксида циркония в алюмоплатиновом катализаторе с 0.5 до 7.0 мас. % конверсия н-пентана снижается с 59.7 до 48.9%. При оптимальном содержании ZrO2 (0.5 мас. %) выход аренов в совместном превращении метана и н-пентана увеличивается по сравнению с немодифицированным образцом с 17.1 до 19.0 мас. %. Дальнейший же рост содержания циркония приводит к снижению выхода ароматических углеводородов до 13.1 мас. %. В этой же работе [16] была обнаружена также закономерность изменения выхода аренов от соотношения льюисовских кислотных центров средней силы типов 2 (υСО = 2190–2193 см–1) и 3 (υСО = 2195–2197 см–1), что может указывать на участие этих центров в реакции ароматизации. В данном случае при сравнении каталитических показателей Pt/Sn0.5Zr/Al2O3 и Pt/Sn1.0Zr/Al2O3 катализатор с содержанием циркония 0.5 мас. % показывает более высокую эффективность, чем с 1.0 мас. % Zr (табл. 4).
Ранее информация о влиянии циркония на стабильность PtSn-катализатора в реакции ароматизации н-гептана в литературе отсутствовала. Согласно [15], цирконий повышает стабильность Pt/Al2O3- и PtRe/Al2O3-катализаторов риформинга. Из табл. 4 следует, что введение 0.5 мас. % Zr увеличивает стабильность катализатора в превращении н-гептана по сравнению с биметаллической Pt/Sn/Al-системой. Константа дезактивации Kд для Pt/Sn/Al-катализатора составляет 0.81, а для Pt/Sn0.5Zr/Al2O3 – 0.86. Более высокая стабильность катализатора, модифицированного цирконием, может быть связана как со снижением кислотности катализатора при введении циркония (следствием чего является замедление скорости закоксовывания катализатора), так и с повышением доли заряженных форм платины в Pt/Sn0.5Zr/Al-катализаторе (что свидетельствует о влиянии циркония на состояние платины путем снижения интенсивности реакций, идущих через прочносвязанные переходные состояния (крекинг, коксообразование)).
ЗАКЛЮЧЕНИЕ
Каталитические свойства биметаллических платинооловянных систем определяются порядком введения соединений-предшественников платины и олова. Олово снижает общую кислотность оксида алюминия, блокируя сильные кислотные центры, ответственные за гидрогенолиз, при этом усиливается изомеризующая способность катализатора. При приготовлении катализатора Pt/Sn/Al2O3, в случае, когда олово вводится первым, а затем платина, олово сильнее взаимодействует с хлорированным оксидом алюминия и в большей степени проявляет описанное воздействие на свойства готового катализатора. При восстановлении Sn/Pt/Al2O3-катализатора, возможно, что часть олова переходит в металлическое состояние и при этом, скорее всего, изменяется соотношение кислотных центров средней силы в катализаторе. Это, в свою очередь, вызывает усиление реакций гидрокрекинга и снижение селективностей по изомерам и ароматическим углеводородам.
В случае использования биметаллических платинооловянных систем оптимальным способом приготовления является совместная пропитка соединениями-предшественниками платины и олова. При данном способе нанесения платина и олово не полностью восстанавливаются до металлического состояния, Pt-центры характеризуются высокой дисперсностью (92%) и проявляют высокую активность и селективность в реакции ароматизации н-гептана.
Результатом введения 0.5 мас. % Zr в алюмоплатинооловянные катализаторы является увеличение показателей выхода риформата, активности, селективности и стабильности. Цирконий в составе катализаторов риформинга способствует повышению стабильности Pt/Sn/Al-систем, вероятно, в результате снижения кислотности и скорости образования кокса на катализаторе.
Таким образом, проведенные исследования показали возможность создания триметаллических катализаторов риформинга бензина типа Pt–Sn–Zr/Al2O3 с более высокой эффективностью, чем традиционные Pt–Sn/Al2O3-катализаторы.
БЛАГОДАРНОСТИ
Физико-химические исследования исходных материалов и опытных образцов проведены с использованием приборной базы Омского регионального центра коллективного пользования СО РАН (Омск).
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в соответствии с Программой фундаментальных научных исследований государственных академий наук на 2013–2020 годы по направлению V.46, проект № V.46.2.4, этап 2 (Номер госрегистрации в системе ЕГИСУ НИОКТР AAAA-A17-117021450095-1).
Список литературы
Пaт. RU 2560152C1, 2014.
Пaт. RU (11) 2594482(13) C1, 2016.
Passos F.B., Aranda D.A.G., Schmal M. // J. Catal. 1998. V. 178. P. 478.
Carvalho L.S., Conceiςão K.C.S., Mazzieri V.A., Reyes P., Pieck C.L., do Carmo Rangel M. // Appl. Catal. A. Gen. 2012. V. 419–420. P. 156.
Mazzieri V.A., Grau J.M., Vera C.R., Yori J.C., Parera J.M., Pieck C.L. // Appl. Catal. A. Gen. 2005. V. 296. P. 216.
Carvalho L.S., Pieck C.L., Rangel M.C., F’ıgoli N.S., Grau J.M., Reyes P., Parera J.M. // Appl. Catal. A. Gen. 2004. V. 269. P. 91.
Carnevillier C., Epron F., Marecot P. // Appl. Catal. A. Gen. 2004. V. 275. P. 25.
Borgna A., Garetto T.F., Apestegu’ıa C.R. // Appl. Catal. A. Gen. 2000. V. 197. P. 11.
Antos G.J., Aitani A.M. Catalytic Naphtha Reforming: Science and Technology. N.Y.: Marcel Dekker Inc., 2004. 602 p.
Damyanova S., Pawelec B., Arishtirova K., Huerta M.V.M., Fierro J.L.G. // Appl. Catal. B. Environ. 2009. V. 89. P. 149.
Kim M.-Y., Park S., Seo G., Song K.-S. // Catalysts. 2013. V. 3. P. 88.
Hoang D.L., Farrage S.A.F., Radnik J., Pohl M.M., Schneider M., Lieske H., Martin A. // Appl. Catal. A. Gen. 2007. V. 333. P. 67.
Long L.-L., Xia K., Lang W.-Z., Shen L.-L., Yang Q., Yan X., Guo Y.-J. // J. Ind. Eng. Chem. 2017. V. 51. P. 271.
Cui Q., Zhou Y., Wei Q., Yu G., Zhu L. // Fuel Process. Technol. 2013. V. 106. P. 439.
Белый А.С. // Кинетика и катализ. 2008. Т. 49. № 4. С. 587.
Виниченко Н.В., Голинский Д.В., Затолокина Е.В., Паукштис Е.А., Муромцев И.В., Гуляева Т.И., Белый А.С. // Кинетика и катализ. 2019. Т. 60. № 2. С. 264.
Belyi A.S., Kiryanov D.I., Smolikov M.D., Zatolokina E.V., Udras I.E., Duplyakin V.K. // React. Kinet. Catal. Lett. 1994. V. 53. № 1. P. 183.
Островский Н.М., Белый А.С., Коломыцев Ю.Н., Дуплякин В.К. // Химия и технология топлив и масел. 1986. № 10. С. 13.
Lieske H., Lietz G., Spindler H., Völter J. // J. Catal. 1983. V. 81. № 1. P. 8.
Jumas J.-C., Sougrati M.T., Olivier-Fourcade J., Jahel A., Avenier P., Lacombe S. // Hyperfine Interactions. 2013. V. 217. № 1–3. P. 137.
Lieske H., Volter J. // J. Catal. 1984. V. 90. № 1. P. 46.
Cholley T. These de Doctorat, Universite Paris 6, Paris, 1997.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ