Кинетика и катализ, 2019, T. 60, № 6, стр. 770-775
ИЗМЕНЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ ВЫСОКОВАНАДИЕВЫХ ГЕТЕРОПОЛИКИСЛОТ В РЕДОКС-ПРОЦЕССАХ
Ю. А. Родикова a, Е. Г. Жижина a, *
a ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. акад. Лаврентьева, 5, Россия
* E-mail: zhizh@catalysis.ru
Поступила в редакцию 19.02.2019
После доработки 16.04.2019
Принята к публикации 17.04.2019
Аннотация
Впервые определены изменения значений удельной электропроводности (χ) растворов высокованадиевых Мо−V−Р-гетерополикислот (ГПК-х) в редокс-процессах на примере раствора ГПК-7 брутто-состава Н10Р3Мо18V7O84, являющегося высокоэффективным катализатором процессов окисления. Найдены зависимости χ от [ГПК-7] при разных температурах и степенях восстановления m, а также зависимость χ от m. Показана связь χ с равновесным составом раствора ГПК-7. Подтверждено, что регенерированные растворы ГПК-7 полностью восстанавливают свою электропроводность, как и другие физико-химические свойства (редокс-потенциал Е, плотность, вязкость, рН), доказывая тем самым высокую устойчивость в качестве гомогенных катализаторов окислительных процессов.
ВВЕДЕНИЕ
Растворы Mo−V−Р-гетерополикислот (ГПК-х, где х – число атомов V в составе ГПК-х) являются высокоэффективными катализаторами различных окислительных реакций [1–8], протекающих в соответствии с уравнением (I):
(I)
$\begin{gathered} {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{\text{Su}} + {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{ГПК - }}x \to \\ \to \,\,{m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{\text{SuO}} + {{{\text{Н}}}_{m}}{\text{ГПК - }}x. \\ \end{gathered} $Для катализа очень важно, что растворы ГПК-х обладают свойством обратимой окисляемости, т.е. их восстановленные формы (НmГПК-x, где m – степень восстановления ГПК-х, равная числу принятых электронов или числу ионов VIV) способны окисляться молекулярным кислородом с регенерацией исходной (окисленной) формы ГПК-х по реакции (II):
(II)
${{{\text{Н}}}_{m}}{\text{ГПК - }}x + {m \mathord{\left/ {\vphantom {m 4}} \right. \kern-0em} 4}{{{\text{O}}}_{2}} \to {\text{ГПК - }}х + {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Поэтому в присутствии растворов ГПК-х появляется возможность замкнуть каталитический цикл двухстадийной реакции (III) окисления субстрата Su кислородом, в которой обратимо действующий окислитель (ГПК-х) выступает в роли катализатора:
(III)
${\text{Su}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}}\xrightarrow{{{\text{ГПК - }}x}}{\text{SuO}}.$Регенерированный раствор ГПК-х может быть вновь использован в целевой реакции (I) на втором и последующих циклах, включающих реакции (I) + (II). Следует отметить, что в растворах ГПК-х только атомы ванадия принимают участие в редокс-превращениях VV$ \rightleftarrows $ VIV.
При двухстадийном режиме проведения реакции (III) наиболее эффективными катализаторами окислительных процессов оказались модифицированные высокованадиевые растворы ГПК-х некеггиновских составов (HaPzMoyVxOb, где x ≥ 6; z = 2–4; y = 12–18), в которых общая концентрация ванадия может достигать 2.5 М. Это значение в несколько раз больше предельных концентраций ванадия в растворах кеггиновских ГПК-х (Н3 + xPMo12 – xVxO40), что обеспечивает высокую окислительную емкость модифицированных растворов. Способы синтеза модифицированных растворов ГПК-х описаны нами в [9, 10].
Модифицированные растворы ГПК-х обладают высокой стабильностью, сохраняя свою гомогенность вплоть до 180°С (при регенерации) и обеспечивая большой срок жизни катализаторов на их основе [11].
Установлено, что в ходе редокс-процесса (III), протекающего в режиме нестационарного катализа, все физико-химические свойства раствора катализатора непрерывно изменяются. На стадии (I) возрастают рН, плотность (ρ) и вязкость (η) раствора, а значение редокс-потенциала Е снижается [12]. Однако в ходе регенерации по реакции (II) все эти свойства возвращаются к исходным значениям: рН, ρ и η уменьшаются, а Е увеличивается. В этой связи при проектировании опытных и промышленных установок для редокс-процессов с использованием растворов ГПК-х (например, для пилотной установки синтеза метилэтилкетона [13]) очень важно знать, каким образом по ходу процесса изменяются перечисленные физико-химические свойства этих растворов. Большое значение имеет и информация об изменении удельной электропроводности (χ) высокованадиевых растворов ГПК-х. К наиболее часто используемым нами растворам ГПК-х относится раствор брутто-состава Н10Р3Мо18V7O84 (ГПК-7). Поскольку в литературе отсутствуют сведения об удельной электропроводности высокованадиевых растворов ГПК-х, в настоящей работе на примере ГПК-7 мы впервые продемонстрировали, как изменяется χ такого раствора в ходе редокс-превращений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез раствора ГПК-7
Использованный в работе 0.25 М водный раствор ГПК-7 брутто-состава Н10Р3Мо18V7O84 синтезировали из V2O5, H3PO4, MoO3 и H2O2 по разработанной нами методике [9]. В начале синтеза V2O5 растворяли в охлажденном (4−5°C) и разбавленном растворе H2O2. Образовавшиеся пероксиванадиевые соединения самопроизвольно разлагались, образуя разбавленный раствор H6V10O28, который сразу же стабилизировали добавлением избытка H3PO4. Полученный раствор дробно добавляли к постепенно упариваемой суспензии (MoO3 + H3PO4). В итоге получали гомогенный 0.25 М раствор ГПК-7.
Методика экспериментов
Для проведения исследований электропроводности брали 120 мл 0.25 М раствора ГПК-7. Из них 60 мл восстановили добавкой 2.49 мл 9.8 М раствора N2H4 при перемешивании раствора магнитной мешалкой и нагревании до 70–80°С с последующим охлаждением до комнатной температуры. Таким образом, перед началом измерений имели по 60 мл окисленного (m = 0.4) и восстановленного (m = 6.6) растворов ГПК-7, что давало возможность комбинировать их для получения растворов с нужными промежуточными значениями m. Например, при соотношении V0.4 : V6.6 = 1 : 1 получен раствор с m = 3.5, при соотношении 1.95 : 1 – раствор с m = 2.5, а при соотношении 4.62 : 1 – раствор с m = 1.5.
В ходе исследований среднее значение m = = [VIV]/[ГПК-7] определяли по величине редокс-потенциала Е раствора ГПК-7 [12], либо титрованием раствором КMnO4 в присутствии Н3РО4.
Измерение удельной электропроводности растворов ГПК-7
Измерения электропроводности растворов ГПК-7 проводили с использованием настольного кондуктометра переменного тока Анион 4120 (“Аналитпромприбор”, Россия), имеющего один кондуктометрический и один температурный канал. В кондуктометре используется четырехэлектродная ячейка Кольрауша. Прибор состоит из основного блока с жидкокристаллическим дисплеем и выносного датчика, который опускают в исследуемый раствор. Используют переменный ток с частотой 1−10 кГц. Для контроля применимости заводской калибровки прибора измеряли χ стандартных растворов КСl (0.1 и 0.01 N) при 25°С. Введения поправочного коэффициента не потребовалось.
Результаты измерений представлены в величинах удельной электропроводимости χ (сименс м–1). Режим автоматической температурной компенсации для приведения результатов измерений к заданной температуре и специальное схемное решение датчика позволили быстро получать характерные для кондуктометрии характеристики растворов. Погрешность измерения удельной электропроводности не превышала ±2%, погрешность измерения температуры составила ±0.3°C.
Кроме того, для ряда растворов ГПК-7 измеренные на кондуктометре Анион 4120 значения χ были сравнены с аналогичными значениями, полученными с использованием реохордного моста Р-38 (ООО “Западприбор”, Россия), широко используемого в практике и представляющего собой четырехплечевой уравновешенный мост со ступенчато регулируемым плечом сравнения и плавно регулируемым отношением плеч. Прибор питается от сети переменного тока с частотой 50–500 Гц с напряжением 127 или 220 В через трансформатор, включенный в схему моста. Измеряемое сопротивление может изменяться в интервале 0.3–30000 Ом. Прибор содержит гальванометр типа М314, который служит нуль инструментом. Ошибка измерений составляет ±2.5%. В основе проведенных измерений лежит зависимость: σ = R χ, где σ – постоянная ячейки, R – измеренное значение сопротивления, Ом, χ – удельная электропроводность раствора электролита, [Ом–1 м–1] = сименс м–1.
При измерении χ с использованием реохордного моста Р-38 сначала определили постоянную ячейки σ, зависящую только от ее геометрии, используя два стандартных раствора КCl (0.01 и 0.1 N) с известной электропроводностью: χ0.01 = = 0.001411 Ом–1 см–1, а χ0.1 = 0.01289 Ом–1 см–1 при температуре 25°С. В результате измерений значений R для каждого из растворов КCl было получено свое значение каппа: σ0.01 = 0.001411 × 437.0 = = 0.617 см–1 и σ0.1 = 0.01289 × 48.0 = 0.619 см–1. В итоге было определено среднее значение постоянной ячейки: σ = 0.618 см–1. Далее, измеряя сопротивление R растворов ГПК-7 разных концентраций и разных степеней восстановления m, находили их χ – удельную электропроводность (в Ом–1 м–1 или сименс м–1) по формуле: χ = σ/R.
Полученные на двух разных приборах значения χ растворов ГПК-7 хорошо совпали в пределах ошибки измерений, поэтому при построении графиков были использованы обобщенные данные.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Значения удельной электропроводности (χ) растворов ГПК-7 были определены при разных степенях восстановления m и двух температурах (25 и 60°С). Для примера в табл. 1 представлены результаты экспериментов по изучению электропроводности растворов ГПК-7 с использованием реохордного моста Р-38.
Таблица 1.
Зависимость удельной электропроводности χ растворов ГПК-7 (Н10Р3Мо18V7O84) от их концентрации при 25 и 60°С и разных значениях m
| 0.25 М | 0.125 М | 0.062 М | 0.031 М | ||||
|---|---|---|---|---|---|---|---|
| R, Ом | χ, сименс м–1 | R, Ом | χ, сименс м–1 | R, Ом | χ, сименс м–1 | R, Ом | χ, сименс м–1 |
| 25°С, окисленные растворы (m = 0.4, Е = 1.11 В*) | |||||||
| 3.5 | 17.66 | 4.3 | 14.37 | 5.9 | 10.47 | 7.0 | 8.83 |
| 60°С, окисленные растворы (m = 0.4) | |||||||
| 0.05 | 1236.0 | 0.4 | 154.5 | 2.4 | 25.75 | 4.6 | 13.43 |
| 25°С, восстановленные растворы (m = 6.6, Евосст. = 0.715 В*) | |||||||
| 19.0 | 3.25 | 17.3 | 3.57 | 25.1 | 2.46 | 42.7 | 1.45 |
| 60°С, восстановленные растворы (m = 6.6) | |||||||
| 7.3 | 8.47 | 7.0 | 8.83 | 11.1 | 5.57 | 18.4 | 3.36 |
| 60°С, восстановленные растворы (m = 3.5) | |||||||
| 2.3 | 26.87 | Не измеряли | |||||
| 60°С, восстановленные растворы (m = 1.5) | |||||||
| 0.15 | 412 | Не измеряли | |||||
Примечание. Измерения проведены с использованием реохордного моста Р-38; постоянная ячейки σ = 0.618 см–1.
* Значения Е растворов ГПК-7 при 25°С для m = 0.4 и m = 6.6 взяты из нашей статьи [13] для того, чтобы показать, насколько редокс-потенциал раствора ГПК-7 снижается при глубоком (на 94%) восстановлении.
Как указано в экспериментальной части, для предотвращения ошибок эксперимента, связанных с неточностью приготовления растворов ГПК-7, все данные об электропроводности при различных значениях m получены на основе одного и того же 0.25 М раствора ГПК-7. Путем смешения в заданных соотношениях исходной (окисленной) части этого раствора (m = 0.4) с сильно восстановленной (m = 6.6 при максимальном значении m = 7) можно было быстро приготовить растворы с промежуточными значениями m. Этот прием прост и удобен для проведения экспериментов такого рода, поскольку хорошо известно, что в водных растворах высокованадиевых ГПК-х равновесия диспропорционирования по степени восстановления ГП-аниона (ГПА) устанавливаются быстро, за несколько минут [9, 11].
В растворах кислот ионы Н+ присутствуют в значительном количестве. Они обладают аномально высокой подвижностью [14], поэтому удельная электропроводность водных растворов ГПК-7, являющихся сильными бренстедовскими кислотами, достаточно высока.
Из полученных нами данных следует, что в исходных окисленных растворах при температуре 25°С значение χ с увеличением концентрации ГПК-7 постепенно возрастает (рис. 1, кривая 1). Эта же зависимость для наглядности обсуждения приведена в другом масштабе на рис 2 (кривая 1). Линейный рост χ с повышением концентрации ГПК-7 в разбавленных растворах (0.03–0.1 М) согласуется с увеличением количества носителей зарядов (ионов), характерным как для сильных, так и для слабых электролитов. Однако в более концентрированных растворах (0.1–0.25 М) этот рост замедляется.
Рис. 1.
Удельная электропроводность окисленных (m = 0.4) растворов ГПК-7 в зависимости от концентрации при 25 (1) и 60°С (2).
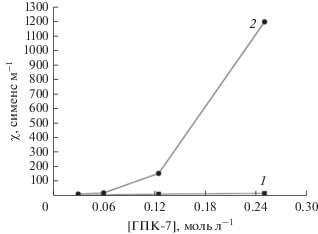
Рис. 2.
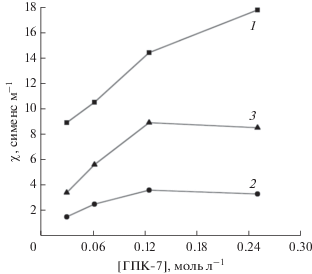
Удельная электропроводность растворов ГПК-7 в зависимости от их концентрации при разных температурах и степенях восстановления: m = 0.4, Т = = 25°С (1); m = 6.6, Т = 25°С (2); m = 6.6, Т = 60°С (3).
При повышении температуры до 60°С картина принципиально меняется: χ очень резко возрастает при переходе к концентрированным растворам ГПК-7 (рис. 1, кривая 2). Эти данные согласуются с тем, что электропроводность растворов увеличивается с температурой вследствие снижения степени сольватации ионов и вязкости растворителя [14]. Кроме того, наблюдаемое явление непосредственно связано с изменением под действием температуры сложного равновесного состава растворов высокованадиевых Mo−V−P-ГПК-х [15–19], в которых имеют место равновесия кислотной диссоциации, равновесия отщепления оксокатионов ванадия от ГПА под действием Н+-ионов, а также реакции диспропорционирования ГПА по количеству атомов ванадия и по степени восстановления m, т.е. по числу ионов VIV в ГПА. В таких сложных растворах с повышением температуры многочисленные равновесия диссоциации смещаются вправо. Ключевым, наиболее важным для окислительного катализа, из вышеперечисленного является равновесие деструктивной диссоциации ГПА под действием собственных протонов с отщеплением оксокатионов ванадия − главных окисляющих частиц в растворах ГПК-х. Так, невосстановленные молекулы ГПК-х с х ≥ 2 под влиянием Н+-ионов претерпевают обратимую диссоциацию с отщеплением катионов ${\text{VO}}_{{\text{2}}}^{ + }$ и образованием ГПК-(х − 1) с меньшим числом атомов ванадия по уравнению (IV) [16–18]:
(IV)
$\begin{gathered} ({\text{13}} - х){{{\text{H}}}_{{{\text{3}} + х}}}{\text{P}}{{{\text{V}}}_{х}}{\text{M}}{{{\text{o}}}_{{{\text{12}} - х}}}{{{\text{O}}}_{{{\text{4}}0}}} + {\text{12}}{{{\text{H}}}^{ + }} \rightleftarrows \\ \rightleftarrows ({\text{12 }} - {\text{ }}х){{{\text{H}}}_{{{\text{2}} + х}}}{\text{P}}{{{\text{V}}}_{х}}_{{ - {\text{1}}}}{\text{M}}{{{\text{o}}}_{{{\text{13}} - х}}}{{{\text{O}}}_{{{\text{4}}0}}} + \\ + \,\,{\text{12VO}}_{{\text{2}}}^{ + } + {{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + {\text{12}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Полностью восстановленные ГПК-х диссоциируют в кислой среде с отщеплением катионов VO2+, а в частично восстановленных растворах будут присутствовать оба катиона ванадия, концентрация которых с ростом температуры увеличивается. Однако наиболее значительно с повышением температуры усиливается кислотная диссоциация, в ходе которой возрастает концентрация наиболее подвижных частиц (катионов Н+), ответственных за проводимость растворов ГПК-х.
В восстановленных растворах (при m = 6.6) с ростом концентрации ГПК-7 зависимость χ при 25°С проходит через пологий максимум (рис. 2, кривая 2), который становится более выраженным при повышении температуры до 60°С (рис. 2, кривая 3). Сравнивая кривые 1 и 2 на рис. 2, полученные при 25°С, можно оценить, что значения χ для окисленного 0.25 М раствора в среднем в 4−5.8 раз выше, чем для аналогичного восстановленного раствора с m = 6.6. В то же время видно, что рост температуры с 25 до 60°С увеличивает значение χ одного и того же восстановленного раствора ГПК-7 (m = 6.6) примерно в 2.5 раза (рис. 2, кривые 2 и 3). Таким образом, полученные результаты показали, что в сильно восстановленном растворе изменение χ с повышением температуры много меньше, чем в окисленном растворе (рис. 1). Эти данные хорошо согласуются с тем, что в восстановленных растворах, где проводимость обеспечивается катионами Н+ и VO2+, концентрация Н+-ионов значительно снижена за счет протонирования восстановленного ГП-аниона (НmГПК-х), образующегося в редокс-реакции при окислении субстрата Su раствором ГПК-х по уравнению (I). Это подтверждается тем, что значения рН растворов ГПК-х при восстановлении возрастают [12].
Что касается пологого максимума зависимости χ от концентрации ГПК-7, наблюдаемого в сильно восстановленных растворах (рис. 2, кривые 2, 3), то при концентрации выше 0.15 М расстояние между ионами становится настолько малым, что на них начинает действовать сила межионного взаимодействия, снижающая скорость движения ионов и приводящая к уменьшению χ. Движущиеся в электрическом поле Н+-ионы испытывают тормозящее действие как со стороны молекул растворителя (Н2О), так и со стороны противоположно заряженных ГП-анионов, окруженных утолщенной (за счет протонирования) сольватной оболочкой из протонов и воды. В результате этого высококонцентрированный восстановленный раствор ГПК-7 оказывает заметное сопротивление прохождению электрического тока по сравнению с окисленным раствором (рис. 2, кривая 1).
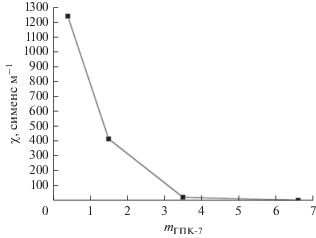
Также представляет интерес зависимость χ от степени восстановления 0.25 М ГПК-7 (рис. 3). Данные для нее получены при 60°С, когда абсолютные значения χ выше, чем при комнатной температуре, поэтому зависимость получилась более выраженной. Можно видеть, насколько быстро χ падает с ростом m (более чем на 2 порядка). Эти результаты хорошо согласуются с найденными нами ранее зависимостями вязкости растворов ГПК-7 от степени их восстановления m [12]. Установлено, что вязкость всех растворов Mo−V−P-ГПК-х, как и раствора ГПК-7 в частности, существенно возрастает с ростом m, наблюдаемая же проводимость растворов при этом закономерно падает. Как сказано выше, при восстановлении раствора ГПК-7 по уравнению (I) концентрация Н+-ионов уменьшается за счет протонирования восстановленных ГПА [12]. Таким образом, концентрация наиболее подвижных частиц (Н+) в растворе резко сокращается, а размеры и без того малоподвижных ГПА увеличиваются за счет утолщения сольватной оболочки, что приводит к снижению χ.
Полное восстановление физико-химических свойств растворов ГПК-х (рН, ρ, η, Е) в ходе многоцикловых редокс-процессов (III) [12] может говорить об их устойчивости в качестве гомогенных катализаторов. По логике вещей, электропроводность растворов ГПК-х, меняющаяся в ходе реакций (I) и (II), также должна полностью восстанавливаться от цикла к циклу.
Для оценки восстановления электропроводности раствора ГПК-7 после регенерации был проведен следующий опыт. По окончании измерений значений χ восстановленный 0.25 М раствор ГПК-7 (m = 6.6, Евосст = 0.715 В) был регенерирован кислородом при температуре 160°С в течение 15 мин по методике, описанной в [20]. В итоге редокс-потенциал регенерированного раствора ГПК-7 достиг значения Е = 1.09 В. Эту величину следует сопоставить с данными табл. 1, из которых следует, что исходный окисленный раствор имел Е = 1.11 В. Таким образом, степень восстановления регенерированного раствора ГПК-7, напрямую связанная с Е [12], также практически достигла первоначального значения (mрег = 0.42, mисх = 0.40). Далее для сравнения была определена удельная электропроводность регенерированного 0.25 М раствора ГПК-7 при 25°С: значение χ оказалось равным 17.52 сименс м–1, что практически совпадает с величиной χ для исходного раствора (17.66 сименс м–1) с точностью до значения m. Следовательно, полное восстановление электропроводности растворов ГПК-х после их регенерации можно считать доказанным на примере ГПК-7.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе на примере раствора ГПК-7 брутто-состава Н10Р3Мо18V7O84 впервые определены изменения удельной электропроводности (χ) высокованадиевых растворов Мо−V−Р-ГПК-х в ходе двухстадийных редокс-процессов. Найдены зависимости χ от [ГПК-7] при разных температурах и степенях восстановления m, а также зависимость χ от m. Показана связь χ с равновесным составом раствора ГПК-7.
В результате проведенного исследования на примере ГПК-7 было четко доказано, что при регенерации растворов ГПК-х восстанавливаются все физико-химические свойства, в том числе и их электропроводность. Это говорит о стабильности гомогенных катализаторов на основе модифицированных высокованадиевых ГПК-х и перспективности их практического использования в многоцикловых редокс-процессах (III).
Новые результаты подтвердили правильность нашего понимания поведения растворов ГПК-х в двухстадийных редокс-процессах.
Список литературы
Hill C.L., Prosser-McCartha C.M. // Coord. Chem. Revs. 1995. V. 143. P. 407.
Kozhevnikov I.V. // Chem. Rev. 1998. V. 98. P. 171.
Жижина Е.Г., Одяков В.Ф., Симонова М.В. // Кинетика и катализ. 2008. Т. 49. С. 816.
Neumann R. // Inorg. Chem. 2010. V. 49. P. 3594.
Mizuno N., Kamata K. // Coord. Chem. Revs. 2011. V. 255. P. 2358.
Zhizhina E.G., Odyakov V.F. // ChemCatChem. 2012. V. 9. P. 1405.
Kozhevnikov I.V. Catalysis by Polyoxometalates. John Wiley & Sons. Chichester, 2002. P. 175.
Khenkin A.M., Shimon L.J.W. and Neumann R. // Eur. J. Inorg. Chem. 2001. № 4. P. 789.
Odyakov V.F., Zhizhina E.G., Rodikova Yu.A., Gogin L.L. // Eur. J. Inorg. Chem. 2015. V. 2015. № 22. P. 3618.
Odyakov V.F., Zhizhina E.G., Maksimovskaya R.I. // Appl. Catal. A: Gen. 2008. V. 342. P. 126.
Zhizhina E.G., Odyakov V.F. // React. Kinet. Catal. Lett. 2009. V. 98. № 1. P. 51.
Zhizhina E.G., Odyakov V.F. // Appl. Catal. A: Gen. 2009. V. 358. № 2. P. 254.
Матвеев К.И., Жижина Е.Г., Одяков В.Ф., Пармон В.Н. // Катализ в промышленности. 2014. № 3. С. 32.
Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. М.: Высшая школа, 2015. С. 672.
Холдеева О.А., Максимовская Р.И. // Журн. неорган. химии. 1992. Т. 37. № 6. С. 1349.
Детушева Л.Г., Юрченко Э.Н., Ткачев С.В. // Координац. химия. 1983. Т. 9. № 9. С. 1220.
Souchay P., Chauveau F., Courtin P. // Bull. Soc. Chim. France. 1968. № 6. P. 2384.
Детушева Л.Г., Юрченко Э.Н. // Координац. химия. 1982. Т. 8. № 7. С. 948.
Детушева Л.Г., Юрченко Э.Н. // Координац. химия. 1990. Т. 16. № 7. С. 930.
Zhizhina E.G., Odyakov V.F. // Int. J. Chem. Kinet. 2014. V. 46. № 9. P. 567.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ