Кинетика и катализ, 2019, T. 60, № 6, стр. 741-755
Исследование роли стадии нанесения комплекса металла на носитель в формировании свойств нанесенных платиновых катализаторов
О. Б. Бельская a, *, В. К. Дуплякин a, В. А. Лихолобов b
a Центр новых химических технологий ФГБУН “Федеральный исследовательский центр
“Институт катализа им. Г.К. Борескова СО РАН”
644040 Омск, ул. Нефтезаводская, 54, Россия
b ФГБУН “Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: obelska@ihcp.ru
Поступила в редакцию 03.04.2019
После доработки 12.04.2019
Принята к публикации 18.04.2019
Аннотация
Тематика представленной обзорной работы связана с развитием представлений о механизме взаимодействия комплексных соединений платины, преимущественно H2[PtCl6], с алюмооксидными носителями и роли этого взаимодействия в формировании свойств соответствующих платиновых катализаторов. На основании исследования состава хлоридных комплексов Pt(IV), адсорбированных на поверхности γ-Al2O3, был предложен подход к их количественной дискриминации на внутри- и внешнесферные комплексы в соответствии с природой их связи с носителем. Установлено, что в составе закрепленных внешнесферных комплексов Pt(IV) преобладают хлоридные лиганды, а адсорбция комплексов на поверхности происходит за счет протонирования гидроксильных групп носителя без значительного изменения состава и геометрии комплексного аниона [PtCl6]2–. Закрепление Pt(IV) в составе внешнесферных комплексов приводит (после восстановления их водородом) к формированию частиц Pt, обладающих относительно низкой дисперсностью, которые содержат атомы платины преимущественно в состоянии, близком к Pt0, и характеризуются гидрирующей и дегидрирующей активностью. Внутрисферные комплексы платины(IV) представляют собой гидролизованные формы хлоридных комплексов, образующиеся при замещении хлоридных лигандов гидроксильными группами носителя. При их восстановлении формируются высокодисперсные частицы платины, содержащие значительную долю атомов в ионной форме, что способствует возрастанию активности катализатора Pt/Al2O3 в реакциях дегидроциклизации н-алканов. Предложены подходы, позволяющие варьировать соотношение между внешне- и внутрисферными комплексами платины(IV) (увеличение степени гидролиза комплексов, изменение природы поверхностных OH-групп алюмооксидного носителя) и, как следствие, модифицировать свойства катализатора. Возможность целенаправленного синтеза внешне- и внутрисферных комплексов платины(IV) при их закреплении на других носителях показана для системы Pt/MgAlOх. Использование особенностей структуры алюмомагниевых слоистых гидроксидов позволяет с высокой селективностью осуществлять закрепление платины(IV) в составе заданного типа комплексов и изменять, находясь в рамках одного химического состава катализатора, электронное состояние атомов Pt в ее частицах и их активность в реакции дегидрирования алканов.
ВВЕДЕНИЕ
Свойства нанесенных металлических катализаторов во многом определяются размером, морфологией, электронным состоянием металлических частиц. В свою очередь формирование этих параметров может зависеть от процессов, происходящих на ранних стадиях получения катализаторов, включающих превращения соединения предшественника активного компонента в пропиточном растворе, его взаимодействие с носителем и дальнейшую трансформацию на поверхности. В то же время рассмотрение многостадийной схемы приготовления катализатора часто сопровождается дискуссией о необходимости детального изучения процессов на начальных стадиях синтеза. В частности, полагают, что эти исследования имеют малое практическое значение вследствие того, что высокотемпературные обработки, использующиеся при получении катализаторов, приводят каталитическую систему к некоторому термодинамически устойчивому состоянию независимо от ее предшествующей “истории”. Вероятно, это утверждение справедливо в некоторых случаях, но не является общим правилом. В представленном кратком обзоре, подготовленном на основе исследований, выполненных в ИППУ СО РАН (в настоящее время – ЦНХТ ИК СО РАН), будет продемонстрировано, что начальные стадии синтеза каталитических систем платина–оксид алюминия и платина–алюмомагниевый оксид, базовых для ряда процессов превращения углеводородов [1–3], существенно влияют на их каталитические свойства. В качестве исходного молекулярного предшественника активного компонента в наших работах было выбрано комплексное соединение платины(IV) H2[PtCl6], которое вследствие стабильности и доступности на рынке наиболее часто применяется для приготовления промышленных катализаторов.
ИССЛЕДОВАНИЕ СТАДИИ ЗАКРЕПЛЕНИЯ ХЛОРИДНЫХ КОМПЛЕКСОВ ПЛАТИНЫ НА ОКСИДЕ АЛЮМИНИЯ
Уникальное сочетание кислотно-основных и текстурных характеристик носителя с физико-химическими свойствами дисперсного металла дает композиции Pt-Al2O3 богатый спектр каталитических свойств и делает ее незаменимой во многих каталитических процессах. В первую очередь она широко используется в нефтепереработке [1, 2]. Благодаря ее неизменной востребованности в процессе платформинга достигнут значительный прогресс в понимании “устройства” этого типа катализаторов [4, 5]. В течение нескольких десятилетий публиковались результаты многочисленных работ по изучению стадии закрепления комплексных соединений платины на оксидной поверхности, некоторые из которых, в том числе выполненных ранее в ЦНХТ ИК СО РАН, представлены в [6–18]. Следует отметить, что по мере накопления информации и развития физико-химических методов исследования представления о процессах, происходящих на начальной стадии приготовления катализаторов, и их роли в формировании свойств конечного катализатора претерпевали изменения. Одной из первых обзорных работ, посвященных адсорбции комплексов благородных металлов на минеральных оксидах, была работа Brunelle (1978) [6], в которой фиксация предшественника активного компонента на поверхности рассмотрена с позиции электростатической адсорбции. В настоящее время можно встретить различные термины, использующиеся для описания взаимодействия металлокомплекса с поверхностью: электростатически адсорбированные комплексы, ионобменные, внешнесферные, сильно/слабо адсорбированные, необратимо адсорбированные, селективно адсорбированные, специфично адсорбированные, привитые, внутрисферные (electrostatically adsorbed, ion exchanged, outer sphere complexes, strongly/weakly adsorbed, irreversibly adsorbed, selectively adsorbed, specifically adsorbed, grafted, anchored, inner sphere complexes) [7–14]. В то же время анализ процессов, лежащих в основе предложенных терминов, показал, что можно выделить две основных модели механизма закрепления хлоридных комплексов Pt(IV) на оксидной поверхности. Первая модель – формирование внешнесферных комплексов – предполагает электростатическое (физическое) взаимодействие между анионными комплексами платины и протонированной поверхностью оксида алюминия. Вторая модель – образование внутрисферных комплексов – основана на наличии химической реакции и утверждении, что платиновые комплексы закрепляются на поверхности посредством лигандного обмена с поверхностными группами оксидного носителя. Выполненные нами исследования позволяют согласиться с теми авторами, которые допускают возможность одновременной реализации обеих моделей механизмов закрепления платиновых комплексов на поверхности оксида алюминия. Это кажется вполне вероятным, исходя из того, что состав хлоридных комплексов платины в пропиточном растворе (при различных температурах, концентрациях, значениях рН) может меняться вследствие их гидролиза, а также неоднородности адсорбционных центров, присутствующих на поверхности оксида алюминия [7, 8, 11–13, 19].
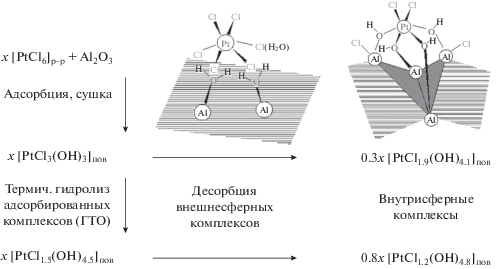
Для подтверждения или опровержения этого предположения необходимо было решить задачу разделения комплексов в зависимости от природы их взаимодействия с носителем с последующим выяснением их химического состава и роли в формировании свойств катализатора. Для этого был предложен подход, основанный на селективном удалении с носителя внешнесферных комплексов [19, 20]. Он заключался в проведении десорбции внешнесферных (способных к ионному обмену) платиновых комплексов посредством конкурентной адсорбции специально подобранных анионов, содержащихся в десорбирующем растворе (рис. 1а). В этом случае комплексы, которые удерживались на поверхности не электростатически, а за счет химических связей, не удалялись с поверхности. По мере увеличения концентрации и десорбирующей силы конкурентных анионов (градиентное элюирование (ГЭ)) происходило удаление “ионообменных” форм платины, и на основании анализа состава элюатов были построены кривые ГЭ (рис. 1б). Затем десорбированные и оставшиеся на поверхности формы платиновых комплексов были исследованы раздельно c использованием методов ионометрии, электронной спектроскопии, EXAFS. При проведении ГЭ состав десорбирующего раствора был выбран таким образом, чтобы избежать гидролиза комплексов и других изменений в координационной сфере Pt(IV), а условия элюирования исключали заметное растворение носителя. Полученные десорбционные профили (рис. 1б) указывают на неоднородность комплексов по прочности их закрепления на носителе и дают возможность выделить различные типы десорбирующихся платиновых комплексов (области на профиле градиентного элюирования, рис. 1б). Исследование элементного состава элюатов и спектральных характеристик комплексов, десорбированных в каждой области, также как и анализ EXAFS-спектров недесорбированных форм комплексов (табл. 1) позволили установить на качественном уровне зависимость между составом адсорбированного комплекса и силой его взаимодействия с носителем. Было показано, что более сильная связь реализуется в том случае, если платина находится в составе гидролизованных форм ее комплексов. Особо следует отметить, что часть платиновых комплексов (от 10 до 30% платины) не удалялась с поверхности носителя в условиях всех выполненных десорбционных экспериментов. Эти комплексы, согласно данным EXAFS (табл. 1), имеют состав PtCl2O4 и могут рассматриваться как внутрисферные, включающие в координационную сферу платины поверхностные гидроксильные группы оксида алюминия.
Рис. 1.
а – Изменение состава элюирующего раствора в ходе кислотного элюирования; б – результаты градиентного элюирования соединений платины растворами кислот (изменение количества десорбированных ионов платины(IV) и хлорид-ионов по мере увеличения силы элюента) [19]: I десорбционная область. Состав элюента: 1 N HClO4 + 0.1 N C2O4H2 + 0.01 N C6O7H8; II десорбционная область. Состав элюента: 1.8 N HClO4 + 0.5 N C2O4H2 + 0.3 N C6O7H8; III десорбционная область. Состав элюента: 1.2 N HClO4 + 0.6 N C2O4H2 + 0.7 N C6O7H8.
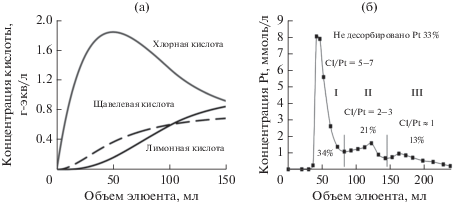
Таблица 1.
Данные EXAFS (L3 – края поглощения платины) для образцов комплексов Pt(IV), адсорбированных на поверхности γ-Al2O3, (С(Pt) = 2 мас. %): исходного (адсорбция H2[PtCl6], сушка 48 ч), оставшихся после последовательной десорбции поверхностных комплексов и полученных в результате термического гидролиза адсорбированного хлорплатината [19, 20]
| Образец | R(Pt–Cl) | N(Cl) | R(Pt–O) | N(O) |
|---|---|---|---|---|
| Исходный [PtCl(6 – x)(OH)x]/Al2O3 | 2.29 | 3.0 | 1.98 | 3.0 |
| – (I) Десорбированы слабосвязанные внешнесферные комплексы |
2.28 | 2.3 | 1.99 | 3.7 |
| – (I + II) Десорбированы две формы внешнесферных комплексов |
2.30 | 2.2 | 2.03 | 3.8 |
| – (I + II + III) Десорбированы три формы внешнесферных комплексов |
2.30 | 1.9 | 2.01 | 4.1 |
| [PtCl6]/Al2O3, ГТО 120°С | 2.32 | 1.7 | 2.00 | 4.3 |
| [PtCl6]/Al2O3, ГТО 150°С | 2.30 | 1.5 | 2.00 | 4.5 |
| [PtCl6]/Al2O3, ГТО 190°С | 2.30 | 1.5 | 2.01 | 4.5 |
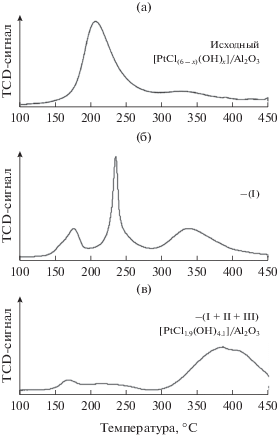
Чтобы исключить сомнения в полученных результатах (особенно в количественных значениях соотношения между внутри- и внешнесферными комплексами), вызываемые возможностью неоптимального выбора элюента или условий десорбционных экспериментов, был использован другой подход для разделения адсорбированных комплексов. Внешнесферные комплексы, закрепляющиеся посредством электростатического взаимодействия с протонированной поверхностью оксида алюминия, были удалены путем “перезарядки” поверхности. Для этого величину рН элюента постепенно увеличивали, и при достижении точки нулевого заряда поверхности происходила десорбция всех внешнесферных комплексов [19, 20]. В результате было показано, что независимо от выбранной методики десорбции часть закрепленных комплексов не удалялась с поверхности, и, следовательно, природа их взаимодействия с поверхностью была другой. Таким образом, предложенный метод градиентного элюирования может рассматриваться как подход для количественного дифференцирования предшественника активного компонента по природе его взаимодействия с носителем, а использование этого метода позволяет не только определять химический состав внешне- и внутрисферных комплексов, но и исследовать их свойства. Так, было показано, что по мере десорбции внешнесферных комплексов, отличающихся химическим составом и прочностью связи с носителем, температура, необходимая для восстановления водородом платины, находящейся в составе оставшихся на поверхности недесорбированных комплексов, монотонно повышалась (рис. 2). Введение стадии десорбции в схему синтеза катализатора (схема 1) позволило получить образец, содержащий платину исключительно в составе внутрисферных комплексов, восстановление которых происходило только при температуре выше 300°С.
Схема 1 . Схема трансформации хлорплатината в процессе взаимодействия с Al2O3 и последующих гидротермальной и десорбционной обработок (х – содержание платины в составе данного типа комплексов).
Рис. 2.
Профили ТПВ платиновых комплексов: а – исходный образец, содержащий все формы платины; б – образец после удаления легко десорбируемых комплексов (удалены формы комплексов платины, соответствующие области (I) на профиле градиентного элюирования (рис. 1б); в – образец, содержащий только недесорбируемые формы платины (удалены формы платины, соответствующие областям I, II и III на профиле градиентного элюирования (рис. 1б) [24].
Различия в условиях восстановления адсорбированных комплексов платины, как правило, оказывают влияние на адсорбционные и каталитические свойства образующихся частиц металла. Поэтому следующей задачей была разработка подходов к регулированию соотношения между находящимися на поверхности Al2O3 внешне- и внутрисферными формами комплексов платины для целенаправленного формирования платиновых центров с необходимыми каталитическими свойствами. Для ее решения возможность влиять на процесс закрепления и состав предшественника активного компонента на поверхности носителя следовало рассмотреть со стороны обоих участников синтеза катализатора – адсорбционных центров оксида алюминия и комплексов платины.
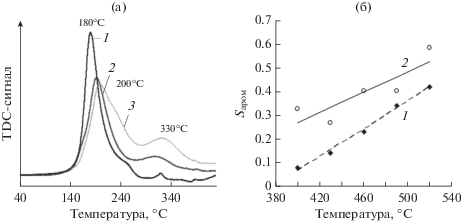
Поскольку, как было показано выше, закрепленные внутрисферные комплексы являются гидролизованными формами комплексов Pt(IV), можно было ожидать, что использование для нанесения на Al2O3 индивидуальных гидроксокомплексов платины (например, H2[Pt(OH)6]), приведет к увеличению содержания внутрисферных комплексов Pt(IV) на поверхности носителя. Однако гексагидроксоплатиновая кислота имеет низкую растворимость для приготовления ее водных растворов необходимых концентраций, поэтому было предложено осуществлять целенаправленный гидролиз хлоридных комплексов Pt(IV), предварительно адсорбированных на поверхности оксида алюминия. Для этого образцы H2[PtCl6]/Al2O3 выдерживали в гидротермальных условиях, а варьирование температуры (100–190°С) и времени (3–12 ч) гидротермальной обработки (ГТО) позволило изменять глубину гидролиза адсорбированных хлоридных комплексов платины. Так, согласно данным EXAFS, координационное число по кислороду достигало 4.5 при обработке образцов при 150°С и оставалось неизменным при дальнейшем повышении температуры гидролиза (табл. 1) [20]. Последующие десорбционные эксперименты показали, что введение предварительной стадии термического гидролиза в схему синтеза катализаторов способно увеличить долю адсорбированных внутрисферных комплексов Pt до 80% (рис. 3). По мере повышения температуры гидролиза максимум на профилях температурно-программируемого восстановления (ТПВ) монотонно смещался в высокотемпературную область с одновременным возрастанием доли комплексов, восстановление которых происходило при температуре >300°С (рис. 3) [21].
Рис. 3.
Влияние условий термического гидролиза адсорбированных хлоридных комплексов Pt(IV) на температуру восстановления платины (а) и селективность реакции ароматизации н-гептана (б): 1 – исходный, 2 – ГТО 120°С, 3 – ГТО 150оС. Условия реакции: C(Pt) = 1%, Р = 10 атм., расход 15 гсырья${\text{г}}_{{{\text{кат}}}}^{{ - 1}}{{{\text{ч}}}^{{ - 1}}}$, H2/C7 = 5 моль/моль [20, 21].
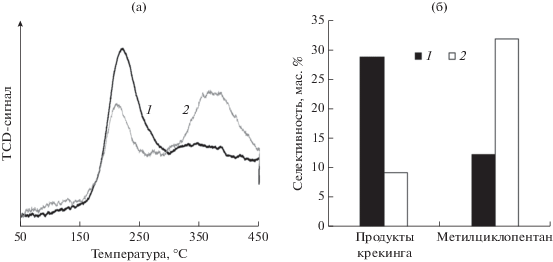
Катализаторы, полученные из образцов, содержащих преимущественно либо внешнесферные (обогащенные хлоридными лигандами), либо внутрисферные (гидролизованные) комплексы в качестве предшественников активного компонента, были подвергнуты одинаковой высокотемпературной (500°С) обработке в среде водорода и протестированы в модельных реакциях превращения углеводородов. Несмотря на близкие значения дисперсности, наблюдались существенные различия в свойствах катализаторов. Анализ результатов исследования катализаторов в низкотемпературной (50–90°С) реакции гидрирования бензола показал, что оба типа катализаторов обладали активными центрами с близкими свойствами. Об этом свидетельствовали одинаковая форма кинетических кривых в широком интервале конверсий с нулевым порядком по бензолу в области высоких парциальных давлений и близкие значения энергии активации (14–16 ккал/моль). Однако количество таких центров существенно различалось. Было продемонстрировано, что катализаторы, полученные из гидролизованных форм комплексов, имели меньшие значения удельной активности в реакции гидрирования бензола, т.е. содержали атомы платины, доступные для адсорбции тестовых молекул CO и Н2, но не обладающие гидрирующей активностью [21]. В то же время такой тип образцов (т.е. приготовленных из предшественника, закрепленного в виде гидролизованных внутрисферных комплексов) показал свое преимущество в высокотемпературной (400–520°С) реакции превращения н-гептана, которое заключалось в их большей активности в целевой реакции дегидроциклизации по сравнению c активностью в гидрогенолизе С–С-связей (рис. 3б) [21]. Аналогичный эффект наблюдался и в случае превращения н-гексана (250–450°С). Образцы, полученные с использованием в качестве предшественников адсорбированных гидролизованных форм платиновых комплексов, недесорбирующихся в условиях ГЭ, характеризовались более высокой температурой восстановления платины и обладали большей селективностью в образовании метилциклопентана по сравнению образцами, приготовленными из предшественников, содержащих десорбирующиеся в условиях ГЭ платиновые комплексы, при равных значениях конверсии н-гексана (рис. 4).
Рис. 4.
Профили ТПВ образцов 0.5% Pt/Al2O3 (предварительная обработка в окислительной среде 500°С) (а) и селективности образования продуктов C1–C3 и метилциклопентана при конверсии н-гексана 20% (предобработка образцов: ${{T}_{{{{{\text{O}}}_{2}}}}}$ = 500°С, ${{T}_{{{{{\text{H}}}_{2}}}}}$ = 500°С; условия реакции: импульсный режим, Т = 350°С) (б): 1 – образец получен адсорбцией хлоридных комплексов Pt(IV) и содержит преимущественно внешнесферные комплексы; 2 – образец получен после десорбции внешнесферных комплексов из образца 1% Pt/Al2O3 и содержит преимущественно внутрисферные комплексы.
Представленные результаты являются примером того, что различия в свойствах, наблюдаемые для катализаторов одного и того же химического состава, подвергнутых одинаковой термической обработке, могут определяться начальной стадией приготовления катализаторов. Вероятно, различия в природе связи металлокомплексного предшественника с носителем в дальнейшем приводят к формированию частиц платины, различающихся характером взаимодействия с поверхностью оксида алюминия, что, в свою очередь, может влиять на электронное состояние нанесенного металла. Это предположение иллюстрируют изменения в рентгено-фотоэлектронных спектрах образцов алюмоплатиновых катализаторов, полученных при включении в схему их синтеза стадии термического гидролиза адсорбированных комплексов платины (рис. 5).
Рис. 5.
Влияние степени гидролиза адсорбированного хлоридного комплекса платины(IV) на состояние платины в восстановленных Pt/Al2O3 образцах по данным РФЭС. С(Pt) = 1 мас. %, ${{T}_{{{{{\text{H}}}_{2}}}}}$ = 500°С [24].
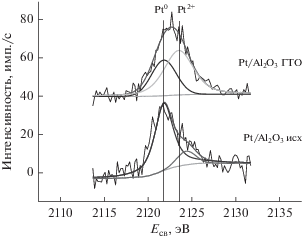
Следует отметить, что существенным ограничением применения рентгеновской фотоэлектронной спектроскопии (РФЭС) для исследования платиновых катализаторов, приготовленных с использованием носителей, содержащих атомы алюминия, являлось наложение наиболее интенсивной линии платины Pt4f на спектральную линию носителя Al2p при работе с традиционными рентгеновскими трубками с Al- или Mg-анодами [22, 23]. Разностные спектры не обеспечивали достоверный результат, особенно при изучении низкопроцентных катализаторов. В настоящее время использование более жесткого излучения AgLα c энергией hν = 2984.3 эВ решило проблему взаимного перекрывания линий активного компонента и носителя, поскольку в РФЭ-спектрах наиболее интенсивными являются линия Al1s с энергией связи Есв = 1560 эВ и линия Pt3d5/2 с Есв = 2122 эВ. Применяемая монохроматизация излучения приводит к значительному уменьшению энергетической полуширины изначально широкой линии AgLα и дает возможность надежно интерпретировать электронное состояние платины: Есв для металла равна 2121.8 эВ, для Pt2+ – 2123.5 эВ и для Pt4+ – 2125.3 эВ [22].
Анализ полученных РФЭ-спектров восстановленных образцов 1% Pt/Al2O3 позволил идентифицировать как платину в валентном состоянии, близком к металлу, так и ее заряженные формы. Было установлено [24], что в спектрах образцов, содержащих при закреплении предшественника высокую долю внутрисферных гидролизованных комплексов, линия платины смещается в сторону высоких энергий, и наблюдается присутствие большего количества платины в окисленном состоянии, близком к Pt2+ (рис. 5). Этот эффект может быть результатом частичного сохранения связи платины с поверхностными группами носителя. Поскольку с присутствием заряженных форм платины связывают высокую ароматизирующую активность катализаторов риформинга бензина [17, 25], то закрепление предшественника в составе внутрисферных комплексов можно рассматривать как перспективный подход к синтезу катализаторов для этого процесса без дополнительной модификации носителя и введения полиметаллических композиций.
Неоднородность физико-химического состояния частиц платины тесно связана с неоднородностью химического состава предшественника активного компонента, которая во многом обусловлена наличием на поверхности носителя различных типов адсорбционных центров. Так, известно [26–31], что гидроксогруппы на поверхности оксида алюминия обладают различными кислотными свойствами. Мостиковые ОН-группы представляют собой более сильные Бренстедовские кислотные центры по сравнению с терминальными. К оснóвными относят ОН-группы, связанные с окта- и пентакоординированными атомами алюминия [32]. Методом ИК-спектроскопии, который позволяет идентифицировать различные типы ОН-групп и определять их количество [26, 33], было показано, что содержание более оснóвных терминальных групп, с высокой вероятностью способных участвовать в формировании внутрисферных комплексов при закреплении платины, не превышает 30% от общего содержания гидроксогрупп на поверхности Al2O3. Этот результат хорошо согласуется с обнаруженным нами фиксированным количеством внутрисферных недесорбируемых форм комплексов, изначально формирующихся на поверхности оксида алюминия [19, 20]. Дополнительные эксперименты с варьированием содержания платины от 0.1 до 2.5 мас. % также свидетельствуют, что в низкопроцентных образцах практически вся платина закрепляется в составе внутрисферных недесорбируемых комплексов. По мере роста общего содержания платины количество внутрисферных комплексов увеличивается, но лишь до предельного значения, которое не превышает 0.6 мас. % в расчете на платину [34].
Среди подходов, способных влиять на адсорбционные свойства оксида алюминия, традиционными являются методы катионного или анионного модифицирования. В то же время существует возможность варьирования соотношения гидроксильных групп различной природы без изменения химического состава носителя. Так, было выполнено модифицирование функционального покрова поверхности γ-Al2O3 с использованием органических солей алюминия. Сущность подхода заключается в хемосорбционном закреплении комплексов алюминия с органическими лигандами, такими как ацетат, оксалат или цитрат, с последующим термическим разложением нанесенных комплексов [35]. Наиболее эффективным оказалось применение оксалата алюминия. Нанесение оксидных соединений алюминия (в количестве 3 мас. % в пересчете на Al2O3) проводили при хемосорбционном закреплении анионных оксалатных комплексов алюминия [Al(C2O4)2(H2O)2]– и [Al(C2O4)3]3– из водных растворов на поверхности γ-Al2O3 с последующей термообработкой при 550°С [36]. Использованный подход исключал формирование фазы оксида алюминия в поровом пространстве γ-Al2O3 после термического разложения закрепленных комплексов алюминия, а также изменения текстурных характеристик носителя. В результате при одинаковых химическом составе, структурных и текстурных характеристиках полученная система 3% Al2O3/γ-Al2O3 отличалась от исходного оксида алюминия соотношением функциональных групп поверхности, а также адсорбционной емкостью носителя по отношению к платиновым комплексам. Наблюдался рост доли прочно связанных с поверхностью соединений платины, характеризующихся более высокой температурой восстановления [36].
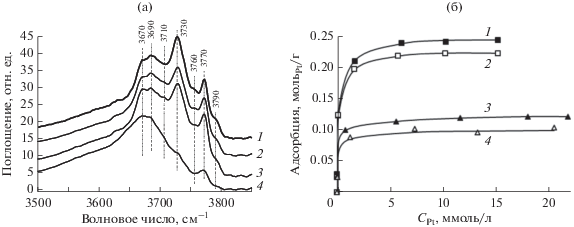
Другим приемом, который был использован авторами [37] для изменения состава функциональных групп поверхности без ее химического модифицирования, являлась предварительная гидротермальная обработка оксида алюминия с варьированием температуры от 50 до 200°С и времени от 0.5 до 12 ч. Если хемосорбция платиновых комплексов стабилизирует поверхность оксида алюминия в гидротермальных условиях, то исходный носитель при ГТО подвергается существенным изменениям, включающим фазовый переход оксидной фазы в фазу бемита [38–40]. Важно, что последующее прокаливание не обеспечивает полное восстановление адсорбционных свойств поверхности γ-Al2O3 по отношению к хлоридным комплексам Pt(IV), и адсорбционная емкость может уменьшиться вдвое (рис. 6). Количественный анализ данных ИК-спектроскопии показал (рис. 6а), что предварительная ГТО носителя приводит к увеличению доли мостиковых ОН-групп с полосами поглощения (п. п.) в низкочастотной области спектра (3710–3670 cм−1) с одновременным снижением концентрации терминальных групп с п. п. в области 3790–3760 см–1 и мостиковой Alо(OH)Alо (где Alo – ион Al(III), находящийся в октаэдрическом окружении) группы (3730 cм−1). Таким образом, наблюдается уменьшение доли более оснóвных ОН-групп, которые могут участвовать в лигандном замещении при формировании внутрисферных комплексов платины. В результате такого модифицирования происходит более однородное закрепление платины в составе обогащенных хлором внешнесферных комплексов. Этот вывод подтверждают как результаты анализа электронных спектров диффузного отражения, содержащих четкие полосы переноса заряда Cl → Pt, характерные для хлоридных комплексов Pt(IV), так и исследование закрепленных комплексов методом ВМУ ЯМР 195Pt.
Рис. 6.
ИК-спектры поглощения в области валентных колебаний гидроксильных групп γ-Al2O3 (а) и изотермы адсорбции H2[PtCl6] на алюмооксидных носителях (б) для γ-Al2O3 (1) и образцов Al2O3 после ГТО в течение 3 ч при 150 (2), 180 (3) и 200°С (4). Перед регистрацией спектров и получения изотерм образцы были прокалены при температуре 550°C [37].
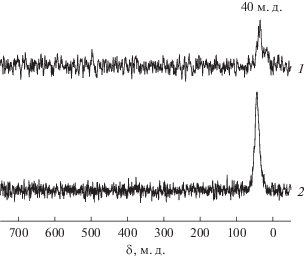
Известно, что вышеуказанный метод позволяет получать информацию не только о составе адсорбированных комплексов, но и о характере их взаимодействия с поверхностью [11, 41]. Сигналы ЯМР наблюдаются лишь при отсутствии химического взаимодействия с носителем, когда симметрия комплексов при их адсорбции искажается слабо. При изучении комплексов [PtCl6]2–, адсорбированных на поверхности оксида алюминия, было установлено, что сигналы ЯМР 195Pt присутствуют только в том случае, когда платина закреплена в составе внешнесферных комплексов, и октаэдрическая симметрия комплексов при адсорбции сохраняется [11, 41]. Формирование заметного количества внутрисферных комплексов с заменой хлоридных лигандов аниона [PtCl6]2– на гидроксильные группы носителя приводит к значительному уменьшению интенсивности и уширению пиков, либо сигналы ЯМР не обнаруживаются [11, 24, 41]. Традиционно при адсорбции хлоридных комплексов платины(IV) на поверхность γ-Al2O3 даже при их значительном количестве (например, 4.5% в пересчете на Pt) наблюдается слабый сигнал в области 40 м. д., соответствующий адсорбированному гексахлорплатинату (рис. 7). Сигналы в области химических сдвигов, характерной для аква- и гидроксокомплексов, отсутствуют вследствие их более прочной связи с оксидной поверхностью. В то же время в спектре ЯМР образца [PtCl6]2–/Al2O3 (2% Pt), схема получения которого включала предварительную стадию ГТО носителя, наблюдается более интенсивный и стабильный во времени резонанс, который по его химическому сдвигу можно отнести к адсорбированному гексахлорплатинату (рис. 7).
Рис. 7.
Спектры ВМУ ЯМР 195Pt адсорбированных платиновых комплексов: 1 – 4.5% Pt/γ-Al2O3, высушен при комнатной температуре в течение 6 ч; 2 – 2.0% Pt/Al2O3, высушен при комнатной температуре в течение недели (носитель предварительно был подвергнут ГТО при температуре 180оС в течение 3 ч) [37].
Преимущественная адсорбция платины в составе обогащенных хлором внешнесферных комплексов ведет к изменению условий формирования частиц нанесенной платины. При использовании метода ТПВ было показано, что ГТО носителя перед нанесением комплексов способствует снижению температуры восстановления платины более чем на 40 градусов [37]. Такая тенденция, как правило, является следствием ослабления связи предшественника с носителем, что в свою очередь приводит к его большей мобильности при термообработке и уменьшению дисперсности нанесенной платины. Следует отметить, что при формировании активных центров из внешнесферных комплексов меняется не только размер частиц, но и электронное состояние нанесенной платины. Анализ линии Pt3d5/2 в РФЭ-спектрах продемонстрировал, что при введении стадии ГТО оксида алюминия изменяется природа взаимодействия металлокомплекс–носитель и соотношение между окисленным (Pt2+) и металлическим (Pt0) состояниями платины в восстановленных катализаторах в сторону увеличения доли последней с Есв = 2121.8 эВ [37]. Если, как было показано ранее, повышение содержания окисленных форм платины при ее адсорбции в составе внутрисферных комплексов приводило к снижению активности катализатора в реакциях гидрирования–дегидрирования, то в нашем случае достигнутое модифицирование состояния металлических центров способствовало росту их активности в реакциях этого типа. Так, катализатор с высокой долей Pt0 в составе нанесенных частиц платины продемонстрировал бóльшую активность в реакции дегидрирования пропана до пропилена при меньшем вкладе побочных реакций гидрогенолиза С–С-связей [37].
ИССЛЕДОВАНИЕ СТАДИИ ЗАКРЕПЛЕНИЯ ХЛОРИДНЫХ КОМПЛЕКСОВ ПЛАТИНЫ НА АЛЮМОМАГНИЕВЫХ СЛОИСТЫХ ГИДРОКСИДАХ
Для ряда каталитических реакций, например, для процессов дегидрирования алканов, необходимы катализаторы, не содержащие кислых центров [42–45]. Для их приготовления традиционно выполняется модифицирование оксидных носителей щелочами или используются носители на основе смешанных полиметаллических оксидов, в том числе содержащие катионы магния. К ним также относятся алюмомагниевые оксиды, получаемые при прокаливании соответствующих слоистых двойных гидроксидов (СДГ). В присутствии магния подавляются реакции, идущие с участием кислотных центров носителя, что приводит к росту не только селективности, но и стабильности катализатора. Не менее важен и тот факт, что слоистая структура СДГ открывает дополнительные возможности для регулирования процесса взаимодействия предшественника активного компонента с носителем и позволяет реализовать различные варианты закрепления платиновых комплексов [46].
СДГ имеют общую формулу ${{[{\text{M}}_{{1 - x}}^{{2 + }}{\text{M}}_{x}^{{3 + }}{{{\text{(OH}})}_{2}}]}^{{x + }}}{\text{ - }}$ ${{[{{{\text{A}}}^{{n - }}}]}_{{{x \mathord{\left/ {\vphantom {x n}} \right. \kern-0em} n}}}} \cdot y{{{\text{H}}}_{2}}{\text{O}}$ и состоят из бруситоподобных октаэдрических слоев, в которых двухвалентные катионы M2+ частично изоморфно замещены трехвалентными катионами M3+, обладающими близкими ионными радиусами. При этом избыточный положительный заряд слоев компенсируется гидратированными анионами Аn–, находящимися в межслоевых пространствах [47, 48]. Особенности состава и строения СДГ обеспечивают ряд уникальных свойств, дающих преимущества носителям на их основе по отношению к другим оксидным системам и инициирующих многочисленные работы по их исследованию и применению [49–58]. Для создания гидроксидных слоев могут быть использованы пары из катионов различных металлов (иногда 3 катиона), что позволяет получать материалы с различными и контролируемыми свойствами. При этом распределение выбранных катионов, осуществляемое в структуре СДГ на атомном уровне, предотвращает их значительную сегрегацию в ходе дальнейших термообработок. Кроме того, варьирование состава СДГ дает возможность регулировать текстурные характеристики оксидного носителя и его кислотно-оснóвные свойства. Не менее важен состав межслоевых анионов, который обеспечивает необходимые обменные свойства и способен влиять на локализацию и механизм закрепления анионных комплексов активного металла.
Традиционно алюмомагниевые СДГ (MgAl-СДГ) получают методом соосаждения соответствующих гидроксидов из растворов солей металлов в щелочной среде раствора карбоната натрия или используют гидротермальный карбамидный синтез [59, 60]. В результате получают наиболее стабильные СДГ с карбонатными противоионами в межслоевом пространстве. Экспериментально обнаружена малая подвижность анионов ${\text{CO}}_{3}^{{2 - }},$ которые легко вытесняют из межслоевых пространств другие анионы, но сами мало склонны к ионному обмену. Наблюдаемый эффект объясняют взаимодействием карбонатных ионов с ОН–-группами гидроксидных слоев и возможностью их моно- и бидентатной координации [61]. Присутствие карбонатных ионов в межслоевых пространствах практически исключает интеркалирование анионов другой природы. В то же время применение СДГ с однозарядными межслоевыми анионами, обладающими хорошими обменными свойствами, позволяет проводить их обмен на более крупные, в том числе и комплексные анионы, имеющие больший заряд. Таким образом регулирование обменных свойств MgAl-СДГ при варьировании природы их межслоевых анионов дает возможность реализовать различные механизмы закрепления анионных хлоридных комплексов Pt(IV) при синтезе катализаторов Pt/MgAlOx и в дальнейшем влиять на состояние и каталитическую активность нанесенной платины [62–69].
При использовании карбонатной формы СДГ (MgAl–СО3) закрепление [PtCl6]2– не сопровождается изменением структурных параметров СДГ, характеризующих размер межслоевого пространства (параметр решетки с оставался неизменным). Адсорбция гексахлорплатината в этом случае, вероятно, осуществляется с участием ОН-групп гидроксидных слоев. Это предположение хорошо согласуется с данными метода ЭСДО, согласно которым платина на поверхности носителя закреплена в составе гидролизованных форм комплексов [62]. Отсутствие сигналов в спектре ВМУ ЯМР 195Pt свидетельствует о том, что закрепление платины происходит посредством образования внутрисферных комплексов [63]. В результате последующей восстановительной обработки адсорбированных комплексов были получены изометричные частицы платины с размерами 2–4 нм, расположенные на поверхности алюмомагниевого оксида (рис. 8а).
Рис. 8.
Электронно-микроскопические изображения образцов Pt/MgAlOx (JEM-2100, “JEOL”, Япония): предшественник носителя MgAl–СО3 (а); предшественник носителя MgAl–ОН (б). Перед измерениями образцы восстановлены в токе водорода при 500оС в течение 2 ч [62].

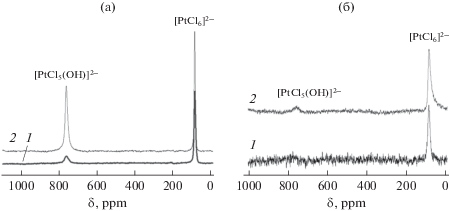
В качестве приема, позволяющего принципиально изменить локализацию предшественника активного компонента и закрепить гексахлорплатинат в межслоевом пространстве MgAl-СДГ, можно вводить [PtCl6]2– в процессе восстановления слоистой структуры СДГ (так называемый “эффект памяти”) при гидратации предварительно полученного смешанного алюмомагниевого оксида в водном растворе металлокомплекса. Кроме того, возможно применять предварительное введение в структуру СДГ специально подобранных анионов, имеющих в отличии от ${\text{CO}}_{3}^{{2 - }}$ хорошие обменные свойства. Чтобы избежать при этом изменения элементного состава катализатора можно использовать СДГ, содержащий в межслоевом пространстве преимущественно ионы ОН– (MgAl–OH). Его синтез прост и заключается в гидратации алюмомагниевого смешанного оксида в деионизированной воде. Межслоевые ОН-ионы обладают хорошими обменными свойствами по отношению к двухзарядному гексахлорплатинат-иону, что дает возможность ввести в межслоевое пространство необходимое количество этого металлокомплекса вплоть до близкого к стехиометрическому, позволяющему компенсировать избыточный положительный заряд гидроксидных слоев. В [62] осуществление процесса интеркалирования более крупных комплексных анионов было подтверждено как увеличением параметра решетки с СДГ от 2.318 до 2.464 нм, так и последующим формированием в стесненных условиях слоистой структуры частиц платины плоской морфологии (при введении большого количества платины). На представленной на рис. 8б фронтальной проекции такие 2D-частицы расположены на разных уровнях, а их протяженность в восстановленных образцах достигает 50 нм при толщине 0.75 нм, близкой к межслоевому расстоянию в MgAl–ОН. Интеркалированные платиновые комплексы в данном случае являются внешнесферными, так как они закреплены посредством электростатического взаимодействия с положительно заряженными гидроксидными слоями. Отсутствие существенного химического связывания с поверхностью подтверждается идентификацией методом ЭСДО обогащенных хлором форм комплексов [62], которые в спектрах ВМУ ЯМР 195Pt характеризуются интенсивными сигналами даже при невысоком содержании платины в исследуемых образцах. Наблюдаемые сигналы в области химических сдвигов, соответствующих хлоридному комплексу [PtCl6]2– и монозамещенному хлорогидроксокомплексу [PtCl5(OH)]2–, сохраняют свою интенсивность в течение длительного времени (рис. 9).
Рис. 9.
Спектры ВМУ ЯМР 195Pt платиновых комплексов, адсорбированных на MgAl–OH: а – образцы с содержанием платины 10 мас. %, высушенные при 25°С в течение 48 ч (1) и при 25°С в течение 300 суток (2); б – образцы, высушенные при 25°С в течение 48 ч и содержащие 2 (1) и 5 мас. % (2) платины.
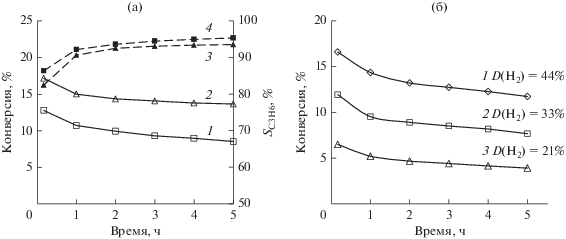
Различие в механизмах закрепления и локализации предшественника, достигнутое использованием алюмомагниевых СДГ с межслоевыми анионами ОН– и ${\text{CO}}_{3}^{{2 - }}$, ведет к формированию “платиновых центров”, различающихся дисперсным и электронным состояниями и каталитическими свойствами (табл. 2). Согласно хемосорбционным измерениям и данным просвечивающей электронной микроскопии независимо от весового содержания металла и условий предобработки дисперсность платиновых частиц в восстановленных образцах, полученных из карбонатного предшественника Pt/MgAlОх(${\text{CO}}_{3}^{{2 - }}$) (адсорбция платины посредством образования внутрисферных комплексов), выше, чем в образцах Pt/MgAlОх(OH–), где закрепление хлорплатината осуществлялось преимущественно в межслоевом пространстве носителя (адсорбция платины посредством образования внешнесферных комплексов). В то же время, обладая меньшей дисперсностью платины, образцы 0.3Pt/MgAlOx(ОН–) продемонстрировали бóльшие значения конверсии пропана при высоком уровне селективности образования пропилена, а также были стабильнее (рис. 10а) [63].
Таблица 2.
Данные хемосорбционных измерений и РФЭС о дисперсном и электронном состоянии платины в образцах Pt/MgAlОх, приготовленных с использованием СДГ, различающихся природой межслоевых анионов (MgAl–CO3 и MgAl–OH)*
| Образец | Дисперсность Pt D(H2), %** | Атомные отношения (РФЭС, Pt3d5/2) | ||
|---|---|---|---|---|
| Pt0/Pt2+ | Pt/Al | Cl/Al | ||
| 2.0% Pt/MgAlОх(${\text{CO}}_{3}^{{2 - }}$) | 46 | 0.6 | 0.018 | 0.023 |
| 2.0% Pt/MgAlОх(OH–) | 26 | 1.3 | 0.010 | 0.028 |
| 0.3% Pt/MgAlОх(${\text{CO}}_{3}^{{2 - }}$) | 73 | –*** | – | – |
| 0.3% Pt/MgAlОх(OH–) | 23 | – | – | – |
Рис. 10.
Конверсия пропана (1, 2) и селективность образования пропилена (3, 4) для образцов 0.3% Pt/MgAlOx(${\text{CO}}_{3}^{{2 - }}$) (1, 4) и 0.3% Pt/MgAlOx(ОН–) (2, 3) (а); конверсия пропана в присутствии образцов 0.3% Pt/MgAlOx(ОН–) с различным мольным соотношением Mg : Al : 1 – 2, 2 – 3, 3 – 4 (б). Условия реакции: Т = 550°C, Р = 0.1 МПа, H2/C3H8 = = 0.25 моль/моль, WHSV = 4.0 ч–1. D(H2) – дисперсность нанесенной платины, измеренная по хемосорбции водорода, исходя из соотношения H/Pt = 1.
Лучшая дегидрирующая активность катализатора, приготовленного из обогащенных хлором внешнесферных комплексов, локализованных в межслоевом пространстве СДГ, хорошо согласуется с большей долей металлической (Pt0) платины, присутствующей в этом катализаторе. На основании анализа линии Pt3d5/2 в РФЭ-спектрах установлено, что в образце 2.0% Pt/MgAlОх(${\text{CO}}_{3}^{{2 - }}$), полученном из гидролизованных форм комплексов, как и в случае алюмоплатиновой системы, преобладают окисленные формы платины (отношение интегральных интенсивностей спектральных линий Pt0/Pt2+ составило 0.6), менее активные в реакциях гидрирования–дегидрирования (табл. 2). Анализ состава поверхности (табл. 2) свидетельствует, что установленные различия в электронном состоянии нанесенной платины не могут быть связаны с размером частиц металла и их химическим окружением.
Таким образом, проведенные исследования показали, что в рамках каталитической системы Pt/MgAlOх возможность реализации различных механизмов закрепления хлоридных комплексов Pt(IV) связана с особенностями структуры и свойств гидроксидного предшественника оксидного носителя. В частности, введение межслоевого аниона с заданными свойствами при синтезе слоистых двойных гидроксидов позволяет не только изменять область локализации предшественника активного компонента при его адсорбции, но и получать катализаторы одинакового химического состава, принципиально различающиеся размером, электронным состоянием и каталитическими свойствами нанесенной платины.
Следует отметить, что понимание строения СДГ дает возможность и далее, в рамках методического подхода, адсорбировать ионы платины в составе внешнесферных комплексов (что приводит к формированию более активных катализаторов дегидрирования, содержащих преимущественно восстановленные формы Pt0) и влиять на свойства нанесенной платины. Например, варьирование содержания трехзарядного катиона изменяет заряд слоев и, тем самым, регулирует силу их электростатического взаимодействия с гексахлорплатинат-анионом, а в дальнейшем и размер частиц нанесенного металла [70, 71]. Так, повышение соотношения Al/Mg в гидроксидных слоях (и соответствующего роста их положительного заряда) позволяет в рамках одного механизма взаимодействия увеличить силу взаимодействия металлокомплекс–носитель и уменьшить мобильность анионных комплексов в межслоевом пространстве СДГ в ходе высокотемпературных обработок. В результате полученный катализатор содержит частицы нанесенной платины большей дисперсности и обладает повышенной дегидрирующей активностью (рис. 10б).
Эффективным подходом к модифицированию свойств платины, формирующейся из внешнесферных комплексов, локализованных в межслоевом пространстве, является введение специальных катионов-модификаторов в состав гидроксидных слоев посредством частичного замещения катионов алюминия или магния. Так, встраивание катионов Zn2+, Ga3+, Sn4+ в определенном количестве в структуру носителя привело к структурному и электронному модифицированию “платиновых центров”, в результате чего наблюдалось уменьшение размера частиц нанесенного металла и увеличение активности катализаторов в реакциях дегидрирования алканов [65, 66, 69, 72].
Использование СДГ для повышения дегидрирующей активности платины возможно также при введении СДГ в качестве модификатора в состав алюмооксидного носителя. Особенностью предложенного модифицирования γ-Al2O3 является то, что синтез MgAl-СДГ происходит с участием катионов Al3+ поверхности оксида алюминия [73]. При дальнейшем приготовлении катализаторов с применением такого носителя было показано, что модифицирование γ-Al2O3 СДГ ведет к преимущественной локализации платины на участках, содержащих нанесенную алюмомагниевую фазу [73]. В отличие от немодифицированного оксида алюминия присутствие нанесенного слоистого гидроксида MgAl–ОН приводит к сорбции Pt(IV) в составе обогащенных хлором комплексов, и электронные спектры диффузного отражения адсорбированных комплексов содержат полосы поглощения с волновыми числами 27 300 и 38 100 cм–1, характерными для гексахлорплатината. В спектрах ЯМР ВМУ 195Pt (в отличие от образцов, полученных с использованием немодифицированного оксида алюминия) наблюдаются интенсивные сигналы в области химических сдвигов, соответствующих хлоридным и монозамещенным хлорогидроксо-комплексам платины(IV), аналогичные сигналам, полученным при охарактеризовании этим методом комплексов платины на поверхности массивных СДГ. Это означает, что при взаимодействии комплексов платины с поверхностью носителя MgAl–OH/γ-Al2O3 происходит их преимущественная локализация в межслоевом пространстве нанесенной фазы MgAl–OH в виде внешнесферных комплексов. В результате платиновые катализаторы, приготовленные с использованием оксида алюминия, содержащего нанесенную фазу MgAl-СДГ, характеризовались не только более оснóвными свойствами поверхности, но и повышенной дегидрирующей активностью по сравнению с алюмоплатиновой системой [73].
ЗАКЛЮЧЕНИЕ
Исследования процесса адсорбции хлоридных комплексов платины(IV) на хорошо известных оксидных носителях – γ-Al2O3 и MgAlОх, выполняемые в ЦНХТ ИК СО РАН в течение последних десяти лет, позволили дополнить существующие представления о закономерностях взаимодействия H2[PtCl6] с поверхностью носителя и роли этого взаимодействия в формировании свойств конечных катализаторов. Наблюдаемая неоднородность адсорбированных хлоридных комплексов платины(IV) по их химическому составу и прочности связи с поверхностью оксида алюминия инициировала работу, направленную на изучение свойств комплексов различной природы (внешне- и внутрисферных комплексов) и на поиск подходов, позволяющих регулировать их соотношение на поверхности носителя. Актуальность таких исследований связана с необходимостью увеличения однородности в состояниях нанесенной платины и, как следствие, достижения высокой селективности катализатора.
Предложенное сочетание методов градиентной десорбции и спектральных методов изучения состава комплексов платины в растворах и адсорбированных на поверхности носителей позволило установить, что в составе внешнесферных комплексов [PtCl5(H2O)]– и/или [PtCl5(OH)]2– преобладают хлоридные лиганды, а адсорбция комплексов на поверхности происходит без значительного изменения их состава и геометрии. В восстановительной среде формирование частиц нанесенной платины из этих комплексов происходит при более низкой температуре, близкой к восстановлению платины в составе массивных комплексов. При этом нанесенные частицы платины в составе конечных катализаторов Pt/Al2O3 обладают относительно низкой дисперсностью и представлены кристаллитами атомов, преимущественно находящихся в состоянии близком к Pt0. В результате платиновые катализаторы, полученные из адсорбированных внешнесферных комплексов, характеризуются существенной гидрирующей и дегидрирующей активностью. Адсорбированные внутрисферные комплексы платины представляют собой гидролизованные формы хлоридных комплексов с координационным числом по кислороду близким к 5. Их восстановление происходит при большей температуре и приводит к формированию высокодисперсных частиц нанесенной платины. Эти частицы содержат значительную долю атомов платины в ионной форме близкой к Pt2+, а их присутствие увеличивает активность катализатора Pt/Al2O3 в реакциях дегидроциклизации н-алканов.
Показана возможность варьирования количественного соотношения между находящимися на носителе внешне- и внутрисферными комплексами платины и, как следствие, влияния на свойства конечных платиновых катализатора. Для этого в качестве эффективного подхода предложено изменение состава адсорбированного предшественника активного компонента путем повышения степени гидролиза хлоридных комплексов платины и/или изменения состава поверхностных групп алюмооксидного носителя.
Полученные данные о химическом составе внешне- и внутрисферных комплексов платины, их спектральных характеристиках и свойствах могут быть использованы для идентификации адсорбированных форм комплексов платины на других носителях. Так, при исследовании закрепления гексахлорплатината на алюмомагниевых слоистых гидроксидах эти данные дали возможность установить образование внешне- и внутрисферных комплексов и их роль в формировании свойств нанесенной платины без применения десорбционных методик, способных в данном случае разрушать структуру СДГ. Использование особенностей структуры СДГ (варьирование природы межслоевого аниона) позволило с высокой селективностью осуществить адсорбцию ионов платины(IV) в составе заданного типа комплексов. В результате была продемонстрирована возможность регулирования электронного состояния платины в конечном катализаторе и ее дегидрирующей активности в рамках одного химического состава катализатора.
Список литературы
Moser M.D., Bogdan P.L. / Handbook of Heterogeneous Catalysis. Eds. Ertl G., Knözinger H., Schüth F., Weitkamp J., Weinheim: Wiley-VCH, 2008. P. 2728.
Lloyd L. Handbook of Industrial Catalysts. New York: Springer, 2011. 490 p.
Siddiqi G., Sun P., Galvita V., Bell A.T. // J. Catal. 2010. V. 274. № 2. P. 200.
Davis B.H., Antos G.J. / Catalytic Naphtha Reforming. Eds. Antos G.J., Aitani A.M., New York: Marcel Dekker, 2004. P. 199.
Regalbuto J.R., Antos G.J. / Catalytic Naphtha Reforming, Eds. Antos G.J., Aitani A.M., New York: Marcel Dekker, 2004. P. 141.
Brunelle J.P. // Pure Appl. Chem. 1978. V. 50. P. 1211.
Marceau E., Carrier X., Che M., Clause O., Marcilly C. / Handbook of Heterogeneous Catalysis, Eds. Ertl G., Knözinger H., Schüth F., Weitkamp J., Weinheim: Wiley-VCH, 2008. P. 467.
Marceau E., Carrier X., Che M. / Synthesis of Solid Catalysts, Ed. K.P. de Jong, Weinheim: Wiley-VCH, 2009. P. 59.
Lamber J.F., Che M. Towards a better understanding and terminology of the Oxide/Transition Metal Complex interaction. Catalysis by Unique Metal Ion Structures in Solid Matrices / Catalysis by Unique Metal Ion Structures in Solid Matrices. Eds. Centi G., Wichterlová B., Bell A.T. NATO Science Series, V. 13. Dordrecht: Springer, 2001. P. 1.
Bourikas K., Kordulis C., Lycourghiotis A. // Catal. Rev. 2006. V. 48. № 4. P. 363.
Shelimov B.N., Lambert J.-F., Che M., Didillon B. // J. Mol. Catal. A: Chem. 2000. V. 158. P. 91.
Lambert J.-F., Che M. // J. Mol. Catal. A: Chem. 2000. V. 162 P. 5.
Lambert J.-F., Marceau E., Shelimov B., Lehman J., Le Bel de Penguilly V., Carrier X., Boujday S., Pernot H., Che M. / 12th International Congress on Catalysis, Ed. A. Corma, F.V. Melo, S. Mendioroz, J.L.G. Fierro, Amsterdam: Elsevier, 2000. P. 1043.
Mehrabadi B.A.T., Eskandari S., Khan U., White R.D., Regalbuto J.R. // Adv. Catal. 2017. V. 61. P. 1.
Kireeva T.V., Doronin V.P., Alt L.Ya., Dupluakin V.K. // React. Kinet. Catal. Lett. 1987. V. 34. № 2. P. 261.
Дуплякин В.К., Доронин В.П., Цымбал Т.В., Альт Л.Я., Белый А.С. // Докл. АН. 1985. Т. 281. № 1. С. 8993.
Белый А.С., Смоликов М.Д., Кирьянов Д.И., Удрас И.Е. // Рос. xим. журн. 2007. Т. 51. № 4. С. 38.
Бельская О.Б., Дуплякин В.К. // Рос. xим. журн. 2007. Т. 51. № 4. С. 29.
Бельская О.Б., Карымова Р.Х., Кочубей Д.И., Дуплякин В.К. // Кинетика и катализ. 2008. Т. 49. № 5. С. 754.
Бельская О.Б., Карымова Р.Х., Кочубей Д.И., Дуплякин В.К. // Кинетика и катализ. 2008. Т. 49. № 5. С. 764.
Бельская О.Б., Гуляева Т.И., Дуплякин В.К., Лихолобов В.А. // Кат. пром. 2013. № 6. С. 9.
Kalinkin A.V., Smirnov M.Yu., Nizovskii A.I., Bukhtiyarov V.I. // J. Electron Spectrosc. Relat. Phenom. 2010. V. 177. P. 15.
Shyu J.Z., Otto K. // Appl. Surf. Sci. 1988. V. 32. P. 246.
Belskaya O.B., Duplyakin V.K., Likholobov V.A. // Smart Nanocomposites. 2011. V. 1. № 2. P. 99.
Maesen T.L.M., Botman M.J.P., Slaghek Y.M., She Li-Qin, Zhang J.Y., Ponec V. // Appl. Catal. 1986. V. 25. P. 35.
Паукштис Е.А. Оптическая спектроскопия в адсорбции и катализе. Применение ИК спектроскопии. Новосибирск: Институт катализа им. Г.К. Борескова, 2010. С. 55.
Corma A. // Chem. Rev. 1995. V. 95. P. 559.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. Москва: Типография Паладин, 2010. С. 288.
Busca G. // Adv. Catal. 2014. V. 57. P. 319.
Khajiivanov K. // Adv. Catal. 2014. V. 57. P. 99.
Digne M., Sautet P., Raybaud P., Euzen P., Toulhoat H. // J. Catal. 2004. V. 226. P. 54.
Métivier R., Leray I., Lefèvre J.-P., Roy-Auberger M., Zanier-Szydlowski N., Valeur B. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 758.
Belskaya O.B., Danilova I.G., Kazakov M.O., Mironenko R.M., Lavrenov A.V., Likholobov V.A. / Infrared Spectroscopy – Materials Science, Engineering and Technology, Ed. T. Theophanides, Rijeka: InTech. 2012. P. 149.
Бельская О.Б., Маевская О.В., Арбузов А.Б., Киреева Т.В., Дуплякин В.К., Лихолобов В.А. // Кинетика и катализ. 2010. Т. 51. № 1. С. 106.
Мироненко Р.М., Бельская О.Б., Данилова И.Г., Талзи В.П., Лихолобов В.А. // Кинетика и катализ. 2011. V. 52. P. 640.
Мироненко Р.М., Бельская О.Б., Маевская О.В., Гуляева Т.И., Казаков М.О., Лавренов А.В., Лихолобов В.А. // Химия в интересах устойчивого развития. 2013. Т. 21. № 3. С. 317.
Mironenko R.M., Belskaya O.B., Talsi V.P., Gulyaeva T.I., Kazakov M.O., Nizovskii A.I., Kalinkin A.V., Bukhtiyarov V.I., Lavrenov A.V., Likholobov V.A. // Appl. Catal. A: Gen. 2014. V. 469. P. 472.
Jun-Cheng L., Lan X., Feng X., Zhan-Wen W., Fei W. // Appl. Surf. Sci. 2006. V. 253. P. 766.
Ferreira A.R., Küçükbenli E, de Gironcoli S., Souza W.F., Chiaro S.S.X., Konstantinova E., Leitão A.A. // Chem. Phys. 2013. V. 423. P. 62.
Li G., Liu Y., Tang Z., Liu C. // Appl. Catal. A: Gen. 2012. V. 79. P. 437.
Shelimov B.N., Lambert J.-F., Che M., Didillon B. // J. Catal. 1999. V. 185. № 2. P. 462.
Zhao Z-J., Chiu C., Gong J. // Chem. Sci. 2015. V. 6. P. 4403.
Jesper J.H. Sattler B., Ruiz-Martinez J., Santillan-Jimenez E., Weckhuysen B.M. // Chem. Rev. 2014. V. 114. I. 20. P. 10613.
Vora B.V. // Top. Catal. 2012. V. 55. P. 1297.
Nawaz Z. // Rev. Chem. Eng. 2015. V. 31. I. 5. P. 413.
Бельская О.Б., Лихолобов В.А. // Рос. хим. журн. 2018. Т. LXII. № 1–2. С. 24.
Takehira K. // Appl. Clay Sci. 2017. V. 136. P. 112.
Бельская О.Б., Леонтьева Н.Н., Гуляева Т.И., Дроздов В.А., Доронин В.П., Зайковский В.И., Лихолобов В.А. // Кинетика и катализ. 2011. Т. 52. № 5. С. 778.
Tian R., Liang R., Wei M., Evans D.G., Duan X. // Struct. Bond. 2017. V. 172. P. 65.
Desigaux L., Belkacem M.B., Richard P., Cellier J., Leone P., Cario L., Leroux F., Gueho C.T., Pitard B. // Nano Lett. 2006. V. 6. P. 199.
Nishimura S., Takagaki A., Ebitani K. // Green Chem. 2013. V. 15. P. 2026.
Fan G., Li F., Evans D.G., Duan X. // Chem. Soc. Rev. 2014. V. 43. I. 20. P. 7040.
Леонтьева Н.Н., Черепанова С.В., Дроздов В.А., Бельская О.Б., Цыбуля С.В., Степанова Л.Н. // Теорет. и эксперим. химия. 2012. Т. 48. С. 257.
Бельская О.Б., Леонтьева Н.Н., Гуляева Т.И., Черепанова С.В., Талзи В.П., Дроздов В.А., Лихолобов В.А. // Изв. АН. Сер. хим. 2013. № 11. С. 2349.
Cherepanova S.V., Leont’eva N.N., Arbuzov A.B., Drozdov V.A., Belskaya O.B., Antonicheva N.V. // J. Solid State Chem. 2015. V. 225. P. 417.
Степанова Л.Н., Бельская О.Б., Василевич А.В., Леонтьева Н.Н., Бакланова О.Н., Лихолобов В.А. // Кинетика и катализ. 2018. Т. 59. № 4. С. 506.
Stepanova L.N., Belskaya O.B., Salanov A.N., Serkova A.N., Likholobov V.A. // Appl. Clay Sci. 2018. V. 157. P. 267.
Леонтьева Н.Н., Дроздов В.А., Бельская О.Б., Черепанова С.В. // Рос. хим. журн. 2018. Т. LXII. № 1–2. С. 39.
Chubar N., Gilmour R., Gerda V., Mičušík M., Omastova M., Heister K., Man P., Fraissard J., Zaitsev V. // Adv. Colloid and Interface Sci. 2017. V. 245. P. 62.
Theiss F.L., Ayoko G.A., Frost R.L. // Rev. Appl. Surf. Sci. 2016. V. 383. P. 200.
Costa D.G., Rocha A.B., Souza W.F., X. Chiaro S.S., Leitão A.A. // J. Phys. Chem. 2012. V. 116. P. 13679.
Бельская О.Б., Гуляева Т.И., Леонтьева Н.Н, Зайковский В.И., Ларина Т.В., Киреева Т.В., Доронин В.П., Лихолобов В.А. // Кинетика и катализ. 2011. Т. 52. № 6. С. 899.
Бельская О.Б., Гуляева Т.И., Талзи В.П., Казаков М.О., Низовский А.И., Калинкин А.В., Бухтияров В.И., Лихолобов В.А. // Кинетика и катализ. 2014. Т. 55. № 6. С. 792.
Бельская О.Б., Степанова Л.Н., Гуляева Т.И., Голинский Д.В., Белый А.С., Лихолобов В.А. // Кинетика и катализ. 2015. Т. 56. № 5. С. 663.
Бельская О.Б., Степанова Л.Н., Гуляева Т.И., Леонтьева Н.Н., Зайковский В.И., Саланов А.Н., Лихолобов В.А. // Кинетика и катализ. 2016. Т. 57. №. 4. С. 554.
Belskaya O.B., Stepanova L.N., Gulyaeva T.I., Erenburg S.B., Trubina S.V., Kvashnina K., Nizovskii A.I., Kalinkin A.V., Zaikovskii V.I., Bukhtiyarov V.I., Likholobov V.A. // J. Catal. 2016. V. 341. P. 13.
Степанова Л.Н., Бельская О.Б., Казаков М.О., Лихолобов В.А. // Кинетика и катализ. 2013. Т. 54. № 4. С. 533.
Степанова Л.Н., Бельская О.Б., Лихолобов В.А. // Кинетика и катализ. 2017. Т. 58. № 4. С. 400.
Belskaya O.B., Stepanova L.N., Nizovskii A.I., Kalinkin A.V., Erenburg S.B., Trubina S.V., Kvashnina K.O., Leont’eva N.N., Gulyaeva T.I., Trenikhin M.V., Bukhtiyarov V.I., Likholobov V.A. // Catal. Today. 2018. V. 329. P. 187.
Степанова Л.Н., Бельская О.Б., Леонтьева Н.Н., Лихолобов В.А. // Журн. СФУ. Химия. 2012. Т. 5. № 4. С. 361.
Бельская О.Б., Степанова Л.Н., Леонтьева Н.Н., Казаков М.О., Гуляева Т.И., Черепанова С.В., Лавренов А.В., Лихолобов В.А. // Химия в интересах устойчивого развития. 2013. Т. 21. № 1. С. 37.
Степанова Л.Н., Бельская О.Б., Лихолобов. В.А. // Химия в интересах устойчивого развития. 2016. Т. 24. С. 61.
Belskaya O.B., Leont’eva N.N., Zaikovskii V.I., Kazakov M.O., Likholobov V.A. // Catal. Today. 2018. In press. https://doi.org/10.1016/j.cattod.2018.10.003
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ