Кинетика и катализ, 2020, T. 61, № 1, стр. 100-105
Кинетика Zr-катализируемого циклоалюминирования олефинов и ацетиленов в реакции Джемилева
И. Р. Рамазанов a, *, Р. Н. Кадикова a
a Институт нефтехимии и катализа Уфимского федерального исследовательского центра РАН
450075 Уфа, просп. Октября, 141, Россия
* E-mail: ilfir.ramazanov@gmail.com
Поступила в редакцию 11.02.2019
После доработки 27.07.2019
Принята к публикации 18.09.2019
Аннотация
Изучена кинетика и хемоселективность превращения 1-октена и 4-октина в условиях реакции циклоалюминирования под действием Et3Al в присутствии каталитического количества Cp2ZrCl2 в гексане при различных температурах и соотношениях реагентов. Установлено, что проведение реакции циклоалюминирования при повышенной температуре (40°C) и эквимольном соотношении непредельного соединения (4-октина и 1-октена) и Et3Al улучшает хемоселективность образования алюминациклопентанов и алюминациклопентенов, а также значительно сокращает ее продолжительность. Получены количественные характеристики реакционной способности ряда олефинов и ацетиленов, в том числе функционально замещенных.
ВВЕДЕНИЕ
Zr-катализируемое взаимодействие олефинов и триэтилалюминия, известное как реакция циклоалюминирования олефинов по Джемилеву [1, 2], впервые было открыто в 1989 г. и с тех пор широко использовалось для получения циклических алюминийорганических интермедиатов из разнообразных олефинов, ацетиленов и алленов, в том числе функционально замещенных. Высокая реакционная способность алюминациклопентанов и алюминациклопентенов позволила разработать эффективные однореакторные синтезы пятичленных сера-, селен- [3, 4] и фосфорсодержащих [5, 6] гетероциклов и спиросоединений [7, 8]. В ходе исследования реакции циклоалюминирования функционально замещенных ацетиленов нами была установлена существенная роль температурного эффекта. Так, реакция с пропаргиловыми спиртами проходила только при 40–50°C [9]. В связи с этим возник вопрос о роли вышеуказанного эффекта в циклоалюминировании олефинов и ацетиленов и о его влиянии на хемоселективность реакции. В настоящей работе нами изучалась кинетика превращения 1-октена и 4-октина в условиях реакции Джемилева при различных температурах и соотношениях реагентов (схема 1 ), а также реакционная способность ряда олефинов и ацетиленов, в том числе функционально замещенных.

Схема 1 . Циклоалюминирование 4-октина и 1-октена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные вещества и материалы
В работе использовали 98% Et3Al (ОАО “Редкинский опытный завод”). Для создания инертной атмосферы использовали аргон марки “чистый” (ГОСТ 10157-73). Исходные реагенты 1-октен и 4-октин коммерчески доступны.
Методы анализа и физико-химическое исследование
Продукты реакции анализировали методом газожидкостной хроматографии на хроматографе HRGC 5300 Mega Series (“Carlo Erba”, Италия), стеклянная капиллярная колонка Ultra-1 (“Hewlett Packard”, США), 25 × 0.2 мм, пламенно-ионизационный детектор, рабочая температура 50–170°С, газ-носитель – гелий.
Спектры ЯМР 1Н и 13С зарегистрированы на спектрометре Avance-400 (“Bruker”, Германия) с рабочей частотой 100.62 МГц для 13С и 400.13 МГц для 1Н. При регистрации спектров ЯМР 1Н и 13С в качестве внутреннего стандарта использовали SiMe4 и CDCl3 соответственно. Химические сдвиги (δ) даны в м. д. Элементный состав соединений определяли с помощью прибора СARLO ERBA-1106 (“Carlo Erba”, Италия). Выходы продуктов находили методом ГЖХ продуктов гидролиза соответствующих алюминийорганических соединений с использованием внутреннего стандарта.
Кинетическое исследование реакции циклоалюминирования
В стеклянный реактор объемом 50 мл, помещенный в водяную баню с температурой 40°C и установленный на магнитной мешалке, в атмосфере аргона последовательно загружали 2 ммоль олефина или ацетилена, 0.1 ммоль (0.028 г) Cp2ZrCl2, 5 мл гексана, 6 ммоль Et3Al и перемешивали при заданной температуре. ГХ-анализ продуктов гидролиза проводили через 5, 10, 15, 30, 60, 90, 120, 180, 240 и 480 мин после загрузки реагентов.
Исследование хемоселективности реакции циклоалюминирования 1-октена и 4-октина
В стеклянный реактор объемом 50 мл, помещенный в водяную баню с температурой 40°C и установленный на магнитной мешалке, в атмосфере аргона последовательно загружали 2 ммоль 1-октена или 4-октина, 0.1 ммоль (0.028 г) Cp2ZrCl2, 5 мл гексана, заданное количество Et3Al (2, 4 или 6 ммоль) и перемешивали при заданной температуре (20, 25 или 40°С). К реакционной массе приливали 5 мл гексана, при охлаждении реактора в ледяной бане добавляли по каплям 3 мл D2O и отфильтровали от выпавшего осадка. Водный слой экстрагировали диэтиловым эфиром, экстракт соединяли с органическим слоем, выдерживали над безводным CaCl2 и концентрировали в вакууме. Индивидуальные продукты выделяли на колонке с силикагелем. Элюент: этилацетат–гексан (1 : 10 → 1 : 5).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Первоначально изучали кинетику превращения 1-октена и 4-октина в условиях реакции циклоалюминирования: [4-октин или 1-октен] = 0.4 M, [Et3Al] = 1.2 M, [Cp2ZrCl2] = 0.02 M, гексан, температура 25°C (рис. 1 и 2). В этих условиях кинетическая кривая изменения концентрации исходного ненасыщенного соединения (1-октена или 4-октина) имеет область индукционного периода длительностью 2–3 ч. Для достижения 95% конверсии 4-октина и 1-октена требовалось не менее 5 ч. При температуре 0°С концентрация исходного 4-октина практически не изменялась даже через 24 ч после начала реакции. Для завершения реакции при 20°C в случае 4-октина требовалось не менее суток.
Рис. 1.
Зависимость концентрации 4-октина от времени при различных температурах в условиях реакции циклоалюминирования. Гексан, [4-октин] = 0.4 M, [Et3Al] = 1.2 M, [Cp2ZrCl2] = 0.02 M.
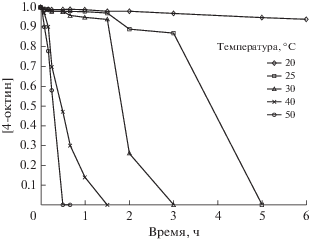
Рис. 2.
Зависимость концентрации 1-октена от времени при различных температурах в условиях реакции циклоалюминирования. Гексан, [1-октен] = 0.4 M, [Et3Al] = 1.2 M, [Cp2ZrCl2] = 0.02 M.
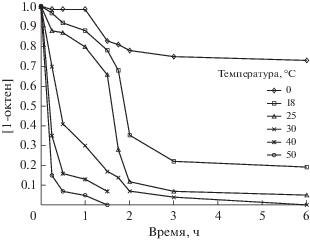
Длительность индукционного периода каталитической реакции связана с временем установления стационарной концентрации интермедиатов, участвующих в каталитическом цикле. Повышение температуры проведения реакции может ускорить этот процесс и уменьшить продолжительность индукционного периода. Действительно, при температуре 40°C и приведенном выше соотношении реагентов реакция значительно ускоряется (рис. 1 и 2). Следует отметить, что изменение характера кинетической кривой в реакции с 4-октином происходит в интервале температур 30–40°С, а с 1-октеном – 25–30°С.
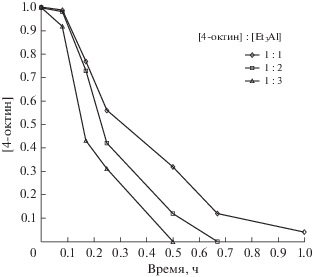
Использование пятикратного избытка Et3Al по отношению к 4-октину при комнатной температуре (22°С) не приводит к заметному уменьшению индукционного периода реакции. В то же время при повышенной температуре (40°C) и рационально обоснованном эквимольном соотношении 4-октина и Et3Al реакция проходит за 1 ч с конверсией ацетилена >95% (рис. 3).
Рис. 3.
Зависимость концентрации 4-октина от времени при различных мольных соотношениях октина-4 и Et3Al. Температура реакции 40°C, [4-октин] = 0.4 M, [Cp2ZrCl2] = 0.04 M, [Et3Al] равна 0.4 (1), 0.8 (2) и 1.2 M (3).
Следует отметить, что механизм циклоалюминирования олефинов и ацетиленов был ранее детально рассмотрен в работах Джемилева и Негиши [11, 12]. Однако до сих пор влияние температуры на скорость реакции не изучалось и не обсуждалось. Согласно недавнему теоретическому исследованию реакции циклоалюминирования пропена-1 [12] стадии формирования Cp2ZrEt2 и цирконациклопропана являются лимитирующими для всего процесса. Более ранее экспериментальная работа [13] также подтверждает вывод о том, что скорость образования цирконациклопропанового интермедиата контролирует скорость реакции циклометаллирования. Так, при смешении Cp2ZrCl2 и Et3Al в мольном соотношении 1 : 2 в ЯМР-ампуле максимальная концентрация цирконациклопропанового интермедиата была зарегистрирована примерно через 20 мин после начала реакции при температуре 20–25°С. В описанных нами каталитических условиях скорость генерирования цирконоценовых интермедиатов должна быть ниже. Таким образом, логично связать длительность индукционного периода рассматриваемой каталитической реакции со скоростью формирования цирконациклопропанового интермедиата и продолжительностью установления его стационарной концентрации в реакционной системе.
Поскольку реакция циклоалюминирования сопровождается образованием побочных продуктов, было изучено влияние температуры и соотношения реагентов на хемоселективность превращения. Известно, что в ходе каталитического циклоалюминирования дизамещенных ацетиленов наряду с алюминациклопент-2-енами получаются также продукты карбоалюминирования, гидроалюминирования и циклической димеризации (схема 2 ) [10, 11].
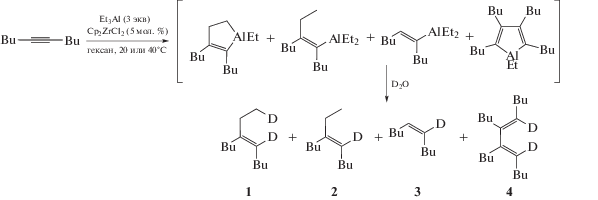
Схема 2 . Каталитическое циклоалюминирование 4-октина.
При использовании эквимольных количеств 5-децина и Et3Al при 40оС заметно возрастает селективность реакции по алюминациклопент-2-ену и уменьшается доля побочных продуктов (табл. 1). Увеличение содержания продукта гидроалюминирования 5-децина при применении 3 экв Et3Al можно связать с наличием примеси гидрида алюминия Et2AlH в Et3Al в количестве ~5% (оценивали по спектру ЯМР 1Н коммерческого образца Et3Al). Количество продуктов карбоалюминирования, оцениваемое по спектрам ЯМР 13С, во всех случаях не превышало 5%. Аналогичное исследование было проведено и для 1-октена. Согласно [12] катализируемое Cp2ZrCl2 взаимодействие α-олефинов с Et3Al проходит с преимущественным образованием алюминациклопентанов, однако в реакционной массе обнаруживали также продукты карбоалюминирования, гидроалюминирования и метиленалканы (схема 3 ) [13].
Таблица 1.
Влияние температуры проведения реакции и молярного соотношения [4-октин] : [Et3Al] на состав продуктов дейтеролиза реакционной смеси
| Температура, °С | Время, ч | Соотношение [4-октин] : [Et3Al] |
Выход 1, % | Выход 3, % | Выход 4, % |
|---|---|---|---|---|---|
| 20 | 18 | 1 : 3 | 65 | 26 | 9 |
| 40 | 2 | 1 : 1 | 74 | 12 | 14 |
| 40 | 2 | 1 : 2 | 59 | 19 | 22 |
| 40 | 2 | 1 : 3 | 54 | 21 | 25 |
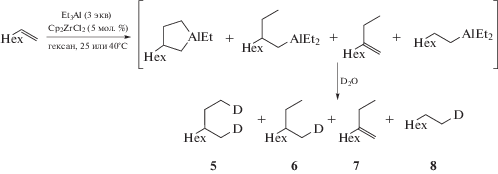
Схема 3 . Каталитическое циклоалюминирование 1-октена.
Установлено, что при проведении реакции при 40°С и эквимольном соотношении 1-октена и Et3Al хемоселективность превращения по алюминациклопентану несколько увеличивается по сравнению со стандартными условиями проведения реакции ([1-октен] : [Et3Al] = 1 : 3, 23°C). Кроме того, значительно сокращается время проведения реакции (табл. 2). Доля продуктов карбоалюминирования и метиленалканов, оцениваемая по спектрам ЯМР 13С, во всех случаях не превышала 5%. Таким образом, проведение реакции циклоалюминирования при повышенной температуре (40°C) и эквимольном соотношении непредельного соединения (4-октина и 1-октена) и Et3Al улучшает хемоселективность образования алюминациклопентанов и алюминациклопентенов, а также значительно сокращает ее продолжительность.
Таблица 2.
Влияние температуры проведения реакции и молярного соотношения [1-октен] : [Et3Al] на состав реакционной смеси
| Температура, °С | Время, ч | Соотношение [1-октен] : [Et3Al] |
Выход 5, % | Выход 8, % |
|---|---|---|---|---|
| 20 | 8 | 1 : 3 | 73 | 27 |
| 40 | 2 | 1 : 1 | 78 | 22 |
| 40 | 2 | 1 : 2 | 72 | 28 |
| 40 | 2 | 1 : 3 | 71 | 29 |
Для количественной оценки влияния природы заместителя при кратной связи на реакционную способность олефина или ацетилена в условиях реакции циклоалюминирования нами в аналогичных условиях при постоянной температуре (40°С) была изучена кинетика превращения ряда ненасыщенных соединений (табл. 3). ГХ-анализ продуктов гидролиза проводили через 10, 20, 30, 60, 90, 120, 180 мин после загрузки реагентов. Относительную реакционную способность определяли по соотношению величины времени полупревращения 1-октена или 1-октина ко времени полупревращения олефинового или ацетиленового субстрата. Из анализа кинетических кривых превращения ряда ненасыщенных соединений было установлено, что реакционная способность олефинов в условиях реакции циклоалюминирования падает в ряду: 1-октен > α-aллилнафталин > > стирол > аллилбензол > норборнен > триметилвинилсилан, а ацетиленов – в ряду: 1-октин > > фенилацетилен > 4-октин > бутил(триметилсилил)ацетилен > октил(триметилсилил)ацетилен. Таким же образом оценивали относительную реакционную активность функционально замещенных ацетиленов в изучаемой реакции. При постоянной температуре (40°С) изучали кинетику превращения 1-гексина, 5-децина, 2-гептинола, 3-октинола, 2-гептинил(диметил)амина в реакции с Et3Al (3 мольных эквивалента) в присутствии Cp2ZrCl2 (20 мол. % по отношению к ацетилену) в растворе гексана ([ацетилен] = 0.2 М, [Et3Al] = 0.6 М, [Cp2ZrCl2] = 0.04 М). Установлено, что реакционная способность ацетиленовых соединений уменьшается в ряду: 1-гексин (2.7) > > 5-децин (1.0) > гептинил(диметил)амин (0.5) > > 3-октинол (0.2) > 2-гептинол (0.1). Наименьшую активность в исследуемой реакции проявил алкилзамещенный пропаргиловый спирт. Следует отметить, что приведенную оценку реакционной способности функционально замещенных ацетиленов не следует воспринимать как характеристику активности тройной связи в вышеупомянутых соединениях по отношению к реакции циклоалюминирования, поскольку часть Et3Al идет на взаимодействие с гидроксильной группой и комплексацией с атомом азота или кислорода. Кроме того, наряду с процессом циклоалюминирования проходят побочные реакции гидроалюминирования и изомеризации промежуточных цирконациклопентенов (в случае алкилзамещенных пропаргиловых спиртов). Аналогичное исследование, проведенное в отношении функционально замещенных олефинов в одинаковых условиях (40°С, [олефин] = 0.2 М, [Et3Al] = 0.2 М, [Cp2ZrCl2] = 0.02 М), показало, что в целом введение атома азота, серы или кислорода в состав ненасыщенного соединения уменьшает его относительную реакционную способность в ряду: 1-октен (1.0) > 3-(гептилсульфанил)-1-пропен (0.21) > трет-октилаллиламин (0.18) ≈ 1-децен-4-ол (0.17).
Таблица 3.
Относительная реакционная способность ряда олефинов и ацетиленов в условиях реакции циклоалюминирования*
| Олефин | kотн. | Ацетилен | kотн. |
|---|---|---|---|
| 1-Октен | 1 | 1-Октин | 1 |
| α-Аллилнафталин | 0.22 | Фенилацетилен | 0.53 |
| Стирол | 0.18 | 4-Октин | 0.17 |
| Аллилбензол | 0.15 | Бутил(триметилсилил)ацетилен | 0.09 |
| Норборнен | 0.05 | Октил(триметилсилил)ацетилен | 0.06 |
| Триметилвинилсилан | 0.01 |
ЗАКЛЮЧЕНИЕ
Таким образом, нами впервые обнаружен индукционный период в реакции циклоалюминирования алкилзамещенных олефинов и ацетиленов. Установлено, что при повышении температуры проведения реакции циклоалюминирования алкил-, фенилзамещенных и кремнийорганических олефинов и ацетиленов до 40°C продолжительность индукционного периода существенно сокращается. Были получены количественные характеристики реакционной способности ряда олефинов и ацетиленов, в том числе функционально замещенных.
Список литературы
Джемилев У.М., Ибрагимов А.Г., Золотарев А.П., Муслухов Р.Р., Толстиков Г.А. // Изв. АН СССР. Сер. хим. 1989. С. 207.
Ибрагимов А.Г. // Химия в интересах устойчивого развития. 2008. Т. 16. № 6. С. 715.
D’yakonov V.A. Dzhemilev reaction in organic and organometallic synthesis. New York: Nova Science Publishers, 2010. 96 p.
D’yakonov V.A., Ibragimov A.G., Khalilov L.M., Makarov A.A., Timerkhanov. R.K., Tuktarova R.A., Trapeznikova O.A., Galimova L.F. // Chem. Heterocycl. Compd. 2009. V. 45. P. 317.
D’yakonov V.A., Tuktarova R.A., Islamov I.I., Khalilov L.M., Dzhemilev U.M. // Steroids. 2016. V. 108. P. 77.
D’yakonov V.A., Makhamatkhanova A.L., Agliullina R.A., Dilmukhametova L.K., Tyumkina T.V, Dzhemilev U.M. // Beilstein J. Org. Chem. 2016. V. 12. P. 406.
D’yakonov V.A., Makhamatkhanova A.L., Dilmukhametova L.K., Agliullina R.A., Tyumkina T.V, Dzhemilev U.M. // Organometallics. 2014. V. 34. P. 221.
Абакумов Г.А., Пискунов А.В., Черкасов В.К., Федюшкин И.Л., Анаников В.П., Еремин Д.Б., Гордеев Е.Г., Белецкая И.П., Аверин А.Д., Бочкарев М.Н., Трифонов А.А., Джемилев У.М., Дьяконов В.А., Егоров М.П., Верещагин А.Н. и др. // Успехи химии. 2018. Т. 87. № 5. С. 393.
D’yakonov V.A., Trapeznikova O.A., de Meijere A., Dzhemilev U.M. // Chem. Rev. 2014. V. 114. P. 5775.
Рамазанов И.Р., Кадикова Р.Н., Джемилев У.М. // Изв. АН. Сер. хим. 2011. № 1. С. 96.
Negishi E.-i., Kondakov D.Y., Choueiry D., Kasai K., Takahashi T. // J. Am. Chem. Soc. 1996. V. 118. P. 9577.
Tyumkina T.V., Islamov D.N., Parfenova L.V., Karchevsky S.G., Khalilov L.M., Dzhemilev U.M. // Organometallics. 2018. V. 37. P. 2406.
Балаев А.В., Парфенова Л.В., Губайдуллин И.М., Русаков С.В., Спивак С.И., Халилов Л.М., Джемилев У.М. // Докл. АН. 2001. Т. 381. № 3. С. 364.
Dzhemilev U.M., Ibragimov A.G., Zolotarev A.P. // Mendeleev commun. 1992. V. 2. P. 135.
Джемилев У.М., Ибрагимов А.Г., Золотарев А.П., Муслухов Р.Р., Толстиков Г.А. // Изв. АН. Сер. хим. 1990. № 12. С. 2831.
Parfenova L.V., Gabdrakhmanov V.Z., Khalilov L.M., Dzhemilev U.M. // J. Organomet. Chem. 2009. V. 694. P. 3725.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


