Кинетика и катализ, 2020, T. 61, № 2, стр. 247-253
Каталитические системы на основе металлокомплексов 1-алкил-4-аза-1-азониабицикло[2.2.2]октан бромидов
Е. П. Жильцова a, М. Р. Ибатуллина a, *, С. С. Лукашенко, И. Р. Низамеев b, М. К. Кадиров a, Л. Я. Захарова a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Академика Арбузова, 8, Россия
b Казанский национальный исследовательский технический университет им. А.Н. Туполева
420111 Казань, ул. К. Маркса, 10, Россия
* E-mail: marina_ibatullina@mail.ru
Поступила в редакцию 11.06.2019
После доработки 11.06.2019
Принята к публикации 02.07.2019
Аннотация
Показана каталитическая активность супрамолекулярных систем на основе комплексов 1-алкил-4-аза-1-азониабицикло[2.2.2]октан бромида (Aлк = CnH2n+ 1, n = 16, 18) с нитратом лантана в реакции гидролитического разложения 4-нитрофенил-О-алкилхлорметилфосфонатов (Aлк = CnH2n+ 1, n = 4, 6). Установлено, что ускорение реакции обусловлено формированием наноразмерных агрегатов различного размера и типа (небольших мицелл и более крупных надмолекулярных структур), которые эффективно связывают реагенты. Константы связывания фосфонатов с агрегатами составляют более 3–4 порядков. Каталитическая активность металлокомплексных систем проявляется при более низком, по сравнению с лигандами, содержании амфифила в растворе.
В области каталитической химии 1,4-диазабицикло[2.2.2]октан (ДАБЦО) известен как эффективный, селективный, нетоксичный катализатор широкого круга процессов, что нашло отражение как в авторских статьях, так и в обзорах [1–4]. Гидрофобизиция ДАБЦО по атомам азота и перевод его в солевую структуру (моно-, дикватернизованные и поликатионные структуры) придает ему новые практические свойства (антигидрофобный эффект [5], биологическая активность [6], функционирование в роли потенциал-управляемых блокаторов калиевых каналов [7], переносчиков нуклеотид- и нуклеозидфосфатов [8, 9], ионнообменников [10]). В синтетическом аспекте важной особенностью алкилированных ДАБЦО является их способность выступать в качестве компонентов ионных жидкостей для получения продуктов в условиях, удовлетворяющих требованиям зеленой химии [11, 12], катализаторов процессов N-алкилирования имидов [13], конденсации кремниевой кислоты до кремния [14], а также проявление каталитической активности в составе искусственных рибонуклеаз [15–17].
Важной особенностью длинноцепных производных ДАБЦО является их способность к самоассоциации в растворе и образованию агрегатов различной морфологии [18, 19]. Это создает условия для солюбилизации и концентрирования реагентов в мицеллярной фазе и ускорения процесса гидролиза 4-нитрофенилдифенилфосфата [18]. Ранее нами была исследована самоассоциация и каталитическая активность моно- и дизамещенных алкилированных производных ДАБЦО [20–22] и показано, что каталитический эффект этих веществ в щелочном гидролизе 4-нитрофениловых эфиров кислот фосфора зависит от заряженности и концентрации бициклического амфифила, гидрофобности субстрата (эфира) и поверхностно-активного вещества (ПАВ), а в случае наличия в растворе соли La3+ – количественного соотношения компонентов системы. Присутствие катионов лантана, способных к комплексообразованию с моноалкилированным ПАВ и к проявлению электрофильного катализа, усиливает результирующее влияние системы. Наблюдаемое для композиции 1-октадецил-4-аза-1-азониабицикло[2.2.2]октан бромид (D-18) + 0.2 мМ La(NO3)3 ⋅ ⋅ 6H2O + 1 мМ NaOH + Н2О ускорение щелочного гидролиза О-бутил-O-4-нитрофенилхлорметилфосфоната (БНХФ) выше, чем для индивидуального D-18 и достигает более двух порядков [21]. В мицеллярных растворах диалкилированного производного ДАБЦО, не способного к комплексообразованию с лантаном, присутствие катионов металла практически не сказывается на каталитической активности мицелл [21].
В настоящей работе спектрофотометрическим методом исследовано влияние супрамолекулярных систем на основе синтезированных комплексов 1-алкил-4-аза-1-азониабицикло[2.2.2]октан бромидов с нитратом лантана на гидролиз БНХФ и O-гексил-O-4-нитрофенилхлорметилфосфоната (ГНХФ).
Самоассоциация комплексов состава [D-14 ⋅ ⋅ La(NO3)3], [2D-16 ⋅ La(NO3)3] и [2D-18 ⋅ La(NO3)3] в водной среде ранее была показана методами тензиометрии, кондуктометрии, потенциометрии [23–25] (причем критическая концентрация мицеллообразования (ККМ)тенз равна 2.37, 0.33 и 0.097 ммоль/л соответственно), а в данной работе она подтверждена методами динамического и электрофоретического светорассеяния и просвечивающей электронной микроскопии (ПЭМ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Алкилированные производные 1,4-диазабицикло[2.2.2]октана (D-n, n = 14, 16, 18), выступавшие в качестве лигандов, получали кватернизацией ДАБЦО, соответственно, тетрадецил-, гексадецил- и октадецилбромидами по методике [26].
Синтез комплексов D-n c нитратом лантана проводили в метаноле по методике [23]. Неорганическую соль La(NO3)3 · 6Н2О (98%, “Acros Organics”, США) использовали без предварительной очистки. Строение и состав полученных металлоПАВ подтверждали методами ИК-, 1Н ЯМР-спектроскопии и элементного анализа [23, 24].
БНХФ и ГНХФ синтезировали по методике [27, 28].
Для приготовления растворов использовали воду, очищенную с помощью системы Direct-Q 5 UV (“Millipore SAS-67120”, Франция).
Размеры агрегатов определяли с использованием системы для характеристики наночастиц (“Malvern Zetasizer Nano”, Великобритания). Угол рассеяния света составлял 173°. Источником лазерного излучения служил газовый He–Nе-лазер c длиной волны 633 нм. Количественные данные обрабатывали способом, описанным в работе [29]. Перед измерениями исследуемые растворы пропускали через фильтр Millipore Millex (0.45 мкм).
ПЭМ-изображения получали на просвечивающем электронном микроскопе Libra 120 (“Carl Zeiss”, Германия) при ускоряющем напряжении 100 кВ. Пробы наносили на медную сетку 300 меш, покрытую непрерывным слоем формвара. Исходные концентрации растворов тетра- и октадецильных комплексов для метода ПЭМ составляли 0.6 и 0.05 ммоль/л соответственно.
Кинетику реакции гидролиза изучали спектрофотометрическим методом по появлению полосы поглощения 4-нитрофенола при 400 нм на спектрофотометре Specord UV-Vis (“Analytik Jena AG”, Германия). Измерения проводили в термостатируемых кварцевых кюветах (l = 10 мм) при 25 ± 0.1 и 30 ± 0.1°С. Концентрация субстрата в начале реакции составляла 5 × 10–5 моль/л. Наблюдаемые константы скорости реакций (kнабл, с–1) определяли по уравнению первого порядка. Разница значений констант скорости в параллельных измерениях не превышала 10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристика агрегатов, формирующихся в металлокомплексных системах
Методом динамического и электрофоретического светорассеяния был определен гидродинамический диаметр агрегатов (Dh, нм), образующихся в водных растворах комплексов D-n (n = 14, 16, 18) с нитратом лантана, лигандов и смесевых композиций лиганд + нитрат лантана, а также дзета-потенциал систем. Для всех исследуемых растворов, как правило, наблюдается бимодальное распределение частиц по размерам (табл. 1). В области ККМ в растворах гексадецильного и октадецильного комплексов преимущественно образуются агрегаты среднего размера (порядка 60–100 нм) и небольшое число частиц (не более 2.5%) более крупного размера (310–410 и 220–260 нм соответственно). При содержании комплексов, превышающем ККМ, для тетрадецильного и гексадецильного комплексов в основном образуются ассоциаты небольшого размера (порядка 4–7 нм) и незначительное число крупных частиц (325–425 нм). Для гексадецильного комплекса присутствует также небольшое количество средних частиц с диаметром 80–90 нм. В случае октадецильного гомолога при концентрациях, превышающих ККМ, формируются, главным образом, частицы среднего размера (40–50 нм) и небольшое число более крупных частиц (130–140 нм). При этом наблюдается и концентрационное снижение диаметра средних частиц. В растворах лиганда D-14 в области, близкой к ККМ, и соединения D-18 при близких концентрациях, но существенно превышающих ККМ, образуются агрегаты с размером порядка 60–100 нм и некоторое число частиц (как правило, не выше 2.8%) с размером 220–400 нм. В смешанных растворах D-16(18) + La(NO3)3 ⋅ 6Н2О (2 : 1) в области ККМ формируются частицы с размером 80–110 нм, которые с ростом концентрации ПАВ уменьшаются до 5 нм (D-16) и 40 нм (D-18). Число крупных частиц (130–400 нм) в этом случае не превышает 2.2%. В смешанных растворах D-14 + La(NO3)3 ⋅ ⋅ 6Н2О (1 : 1) преимущественное образование мелких частиц (4–7 нм) происходит уже при ККМ. Размер крупных частиц варьируется в пределах 170–350 нм.
Таблица 1.
Гидродинамический диаметр комплексов D-14, D-16 и D-18 с нитратом лантана, лигандов и смесей лиганд + нитрат лантана
| Соединение | С, мМ | Dh (по интенсивности), нм* | Dh (по числу частиц), нм* | PdI ** | Т, °С |
|---|---|---|---|---|---|
| [D-14 ⋅ La(NO3)3] | 20 | 7.2(85.2), 411(14.8) | 6.0 | 0.299 | 25 |
| 30 | 5.8 | 5.0 | 0.121 | ||
| D-14 | 3 | 107(33), 404(67.0) | 351(2.8), 91(97.2) | 0.425 | 25 |
| 4 | 86(28.1), 245(71.9) | 73 | 0.356 | ||
| 6 | 87(30.7), 229(69.3) | 75 | 0.468 | ||
| D-14 + La(NO3)3 · 6Н2О (1 : 1) | 10 | 6.7(76.3), 354(23.7) | 5.8 | 0.352 | 25 |
| 30 | 5.6(90.8), 224.0(9.2) | 4.5 | 0.224 | ||
| 40 | 5.8(82.7), 173(17.3) | 4.3 | 0.308 | ||
| [2D-16 ⋅ La(NO3)3] | 0.2 | 93(38.0), 310(62.0) | 69 | 0.384 | 25 |
| 0.3 | 104(27.9), 412(72.1) | 83(97.5), 339(2.5) | 0.463 | ||
| 0.5 | 3.7(10.6), 92(16.6), 325(72.8) | 3.6 | 0.534 | ||
| 0.6 | 6.2(7.5), 82(14.6), 424(77.9) | 5.6 | 0.581 | ||
| D-16 + La(NO3)3 · 6Н2О (2 : 1) | 0.3 | 64(14.0), 290(86.0) | 58(98.8), 255(1.2) | 0.359 | 25 |
| 0.4 | 133(35.0), 398(65.0) | 114 | 0.412 | ||
| 10 | 6.8(78.2), 371(21.8) | 5.4 | 0.352 | ||
| [2D-18 ⋅ La(NO3)3] | 0.1 | 76(46.1), 219(53.9) | 61 | 0.326 | 27 |
| 0.3 | 78(57.8), 256(42.2) | 60(99.7), 228(0.3) | 0.262 | ||
| 0.4 | 52(19.5), 138(80.5) | 42 | 0.234 | ||
| 1 | 47(16.7), 132(83.3) | 39 | 0.243 | ||
| D-18 | 5 | 91(31.6), 259(68.4) | 74(97.6), 232(2.4) | 0.363 | 30 |
| 10 | 81(25), 218(75) | 69 | 0.337 | ||
| 30 | 92(46.7), 248(53.3) | 62 | 0.380 | ||
| D-18 + La(NO3)3 · 6Н2О (2 : 1) | 0.1 | 92(27.3), 349(72.7) | 77(97.8), 295(2.2) | 0.404 | 30 |
| 0.2 | 72(11.0), 190(89.0) | 69 | 0.339 | 30 | |
| 0.3 | 78(57.8), 256(42.2) | 60(99.7), 228(0.3) | 0.262 | 27 | |
| 0.4 | 52(19.5), 138(80.5) | 42 | 0.234 | 27 | |
| 1 | 47(16.7), 132(83.3) | 39 | 0.243 | 27 |
Величина дзета-потенциала в области ККМ и выше для системы на основе тетрадецильного комплекса лежит в пределах 20–60 мВ, октадецильного комплекса – 50–60 мВ, лигандов D-14 и D-18 – 40–80 мВ, а для смесей D-14 + La(NO3)3 ⋅ ⋅ 6Н2О (1 : 1) и D-18 + La(NO3)3 ⋅ 6Н2О (2 : 1) – 20–60 и 60–110 мВ соответственно.
Таким образом, данные динамического светорассеяния свидетельствуют об образовании в исследуемых системах частиц различного размера и типа. Если для растворов тетрадецильного комплекса преимущественное образование частиц мицеллярного типа (с размером до 7 нм) происходит уже в области ККМ, а для гексадецильного металлоПАВ – в области концентраций, превышающих ККМ, то для октадецильного металлоПАВ образуются частицы с диаметром 40–60 нм с тенденцией их концентрационного уменьшения. Аналогичная картина наблюдается и для смесевых композиций лиганд + нитрат лантана. При этом, помимо сферических мицелл или частиц среднего размера, в металломицеллярных и смесевых растворах, как правило, образуется небольшое число агрегатов большого размера (130–425 нм). Возможными морфологическими структурами средних и крупных образований в растворах могут быть вытянутые мицеллы или агрегаты везикулярного типа.
Данные метода просвечивающей электронной микроскопии также свидетельствуют о разнообразии видов частиц, формирующихся в металломицеллярных системах. ПЭМ- снимки октадецильного комплекса указывают на образование вытянутых структур шириной порядка 60–107 нм, длиной до 240 нм и с соотношением сторон в пределах 2–3, сфероподобных образований порядка 95 нм, а также мелких сферических частиц размером 2–3 нм (например, последние представлены на рис. 1). На микрофотографиях тетрадецильного комплекса видны сферические частицы с размерами 44–47 и 2.5–4 нм.
Каталитические свойства металломицеллярных систем
Исследование влияния супрамолекулярных систем на основе комплексов D-16 и D-18 с нитратом лантана на гидролиз O-бутил- (БНХФ) и O-гексил-O-4-нитрофенилхлорметилфосфоната (ГНХФ) проводили с использованием трис-буфера (0.05 М, рН 8.0 и 8.3), позволяющего, в отличие от сильнощелочных растворов, проводить реакцию в существенно более мягких условиях. Процесс гидролиза протекает с выделением 4-нитрофенолят-аниона, фиксируемого спектрофотометрически по полосе поглощения при 400 нм, и образованием соответствующих алкилхлорметилфосфоновых кислот (схема 1 ). Об этом свидетельствуют данные 31Р ЯМР по гидролизу ГНХФ (табл. 2). В трис-буфере химический сдвиг сигнала ГНХФ (δ 31Р) лежит в области 18.0–18.7 м. д., а продукта его гидролиза – в области 14.8–15.0 м. д. Близкие значения химических сдвигов наблюдали также ранее в сильнощелочной среде для ГНХФ (табл. 2) и других фосфонатов [22].
Таблица 2.
Данные 31Р ЯМР-спектроскопии ГНХФ и продукта его гидролиза в отсутствие и в присутствии ПАВ при 25°С
| Система* | 31Р δ, м. д. | |
|---|---|---|
| фосфонат | продукт гидролиза | |
| ГНХФ–трис-буфер ГНХФ–трис-буфер–D-16 ГНХФ–NaOH** |
18.67 18.00 18.7 |
15.02 14.77 15.2 |
* СГНХФ = 0.02 моль/л, Стрис = 0.045 моль/л (рН 8.36), СD-16 = = 0.02 моль/л, СNaOH = 0.025 моль/л. ** Данные работы [22].
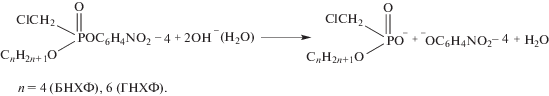
Схема 1 .
Полученные для металломицеллярных систем кинетические данные были сопоставлены с результатами для индивидуальных растворов лигандов D-16 и D-18, а также смесевой композиции лиганд (D-18) + нитрат лантана.
На рис. 2–4 видно, что увеличение выше ККМ содержания металлоПАВ и лигандов D-16(18) сопровождается возрастанием kнабл процесса и прохождением зависимостей через максимум. Экстремальный вид зависимостей характерен для мицеллярно-катализируемых процессов, протекающих в условиях высокой степени связывания реагентов с агрегатами, и обусловлен концентрационным размыванием солюбилизированных веществ в мицеллярной фазе [22].
Рис. 2.
Зависимость наблюдаемой константы ск-орости гидролиза БНХФ в растворах комплекса [2-D‑16 ⋅ La(NO3)3] от его концентрации (трис-б-уфер, рН 8.0, 25°С). Точки – эксперимент, кривые – расчет по уравнению (1).
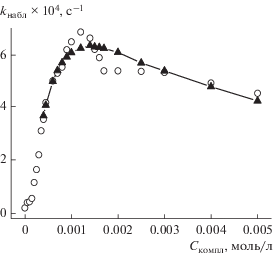
Рис. 3.
Зависимость наблюдаемой константы скорости гидролиза БНХФ в растворах лиганда D-16 от его концентрации (трис-буфер, рН 8.0, 25°С). Точки – эксперимент, кривые – расчет по уравнению (1).
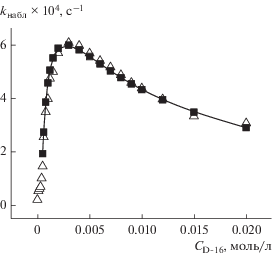
Рис. 4.
Зависимость от концентрации амфифила наблюдаемой константы скорости гидролиза ГНХФ в растворах: 1 – комплекса [2D-18 ⋅ La(NO3)3], 2 – D-18, 3 – смеси D-18 + La(NO3)3 ⋅ 6Н2О (2 : 1) (трис-буфер, рН 8.3, 30°С). Точки – эксперимент, кривые – расчет по уравнению (1).
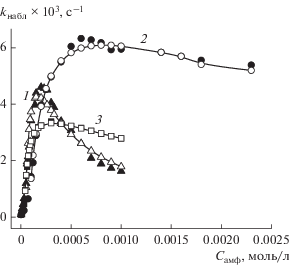
В рамках псевдофазной модели мицеллярного катализа (уравнения (1) и (2) [30]) определены параметры катализируемого гидролиза – константа скорости реакции в мицеллярной фазе (k2,m), константы связывания субстрата и нуклеофила с агрегатами (KS и KNu соответственно), а также факторы, определяющие эффективность мицеллярного катализа (Fm, Fc). (табл. 3).
(1)
$\begin{gathered} {{k}_{{{\text{2,набл}}}}} = \\ = \frac{{{{k}_{{2,0}}} + \left( {{{{{k}_{{2,m}}}} \mathord{\left/ {\vphantom {{{{k}_{{2,m}}}} V}} \right. \kern-0em} V}} \right){{K}_{{\text{S}}}}{{K}_{{{\text{Nu}}}}}\left( {{{C}_{{{\text{ПАВ}}}}} - {\text{ККМ}}} \right)}}{{\left[ {1 + {{K}_{{\text{S}}}}\left( {{{C}_{{{\text{ПАВ}}}}} - {\text{ККМ}}} \right)} \right]\left[ {1 + {{K}_{{{\text{Nu}}}}}\left( {{{C}_{{{\text{ПАВ}}}}} - {\text{ККМ}}} \right)} \right]}}, \\ \end{gathered} $где k2, набл – наблюдаемая константа скорости второго порядка, полученная при делении kнабл на концентрацию нуклеофила (в л моль–1 с–1), k2, 0 и k2, m – константы скорости второго порядка в массе растворителя и мицеллярной псевдофазе соответственно (в л моль–1 с–1), V – мольный объем ПАВ (в л/моль), KS и KNu – константы связывания субстрата (фосфоната) и нуклеофила (гидроксид-иона) с мицеллами (в л/моль), СПАВ – концентрация ПАВ (в моль/л).
Таблица 3.
Параметры реакции гидролиза О-алкил-O-4-нитрофенилхлорметилфосфонатов в водных металломицеллярных и мицеллярных системах (трис-буфер)
| Система | Фосфонат | k2m, л моль–1 с–1 |
KS × 10–3, л/моль |
KNu × 10–2, л/моль | (kнабл/ k0)max | Fm × 102 | Fc | FmFc | ККМ × 104, моль/л |
|---|---|---|---|---|---|---|---|---|---|
| [2D-16 · La(NO3)3]* | БНХФ | 1.07 ± 0.08 | 1.29 ± 0.01 | 4.36 ± 0.07 | 33 | 5.2 | 581 | 30 | 1.4 |
| D-16* | БНХФ | 2.56 ± 0.1 | 1.52 ± 0.05 | 1.14 ± 0.01 | 30 | 12.4 | 234 | 29 | 3.5 |
| [2D-18 · La(NO3)3]** | ГНХФ | 0.34 ± 0.03 | 11.7 ± 2.1 | 53 ± 4.2 | 49 | 0.71 | 6320 | 45 | 0.42 |
| D-18** | ГНХФ | 5.12 ± 0.39 | 6.81 ± 0.09 | 2.5 ± 0.2 | 67 | 10.8 | 593 | 64 | 0.74 |
| 2D-18 + La(NO3)3 · 6Н2О** | ГНХФ | 1.28 ± 0.08 | 24.9 ± 0.34 | 5.1 ± 0.3 | 36 | 2.7 | 1300 | 35 | 0.30 |
Максимальное ускорение реакции описывается уравнением (2), которое является модификацией уравнения (1):
(2)
${{\left( {{{{{k}_{{{\text{набл}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{\text{набл}}}}}} {{{k}_{0}}}}} \right. \kern-0em} {{{k}_{0}}}}} \right)}_{{\max }}} = \frac{{{{k}_{{2,m}}}}}{{{{k}_{{2,0}}}}}\frac{{{{K}_{{\text{S}}}}{{K}_{{{\text{Nu}}}}}}}{{V{{{\left( {K_{{\text{S}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}} + K_{{{\text{Nu}}}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} \right)}}^{2}}}},$Рассчитанные параметры катализируемого мицеллами процесса гидролиза БНХФ и ГНХФ приведены в табл. 3. Как видно, для исследуемых систем фактор смены микроокружения носит негативный характер (Fm < 1) и каталитическое влияние мицелл обусловлено фактором концентрирования реагентов. При этом следует отметить, что для всех растворов характерны высокие константы связывания субстрата (фосфоната, KS) более трех-четырех порядков, а для растворов комплексов и смесевой композиции (т.е. металлсодержащих систем) – наиболее высокие константы связывания нуклеофила (KNu) до трех порядков. Последнее может быть обусловлено более сильной заряженностью поверхностного слоя агрегатов, а также меньшей степенью гидратации углеводородного ядра из-за экранирующего эффекта катионов металла в слое Штерна. Такая ситуация обуславливает для металлокомплексных и смешанной систем более высокие значения фактора концентрирования реагентов (Fc) в мицеллярной псевдофазе. Однако ввиду наиболее неблагоприятного влияния фактора смены микроокружения реагентов при их переходе в мицеллярную фазу (Fm $ \ll $ 1) в металлсодержащих растворах результирующий каталитический эффект этих систем, равный произведению FmFc, либо близок к каталитическому эффекту раствора лиганда (в случае гексадецильного комплекса), либо уступает ему (для октадецильного комплекса). Наиболее неблагоприятное соотношение факторов в случае октадецильных амфифилов наблюдается для смесевой композиции, и каталитический эффект в этой системе имеет наименьшее значение.
Таким образом, металломицеллярные системы на основе комплексов алкилированных ДАБЦО (D-16, D-18) с нитратом лантана могут выступать в качестве каталитической композиции для проведения процесса гидролитического разложения аналогов фосфорорганических экотоксикантов в достаточно мягких условиях. При близкой или несколько более высокой каталитической активности систем на основе лиганда по сравнению с его металлокомплексом использование металлоПАВ является предпочтительным из-за его существенно более низкого необходимого содержания в растворе.
Список литературы
Baghernejad B. // Eur. J. Chem. 2010. V. 1. № 1. P. 54.
Yang H., Tian R., Li Y. // Front. Chem. China. 2008. V. 3. № 3. P. 279.
Kozlova S.G., Mirzaeva I.V., Ryzhikov M.R. // Coord. Chem. Rev. 2018. V. 376. P. 62.
Libni G., Ali B.M., Sathiyaraj S., Nasar A.S. // J. Macromol. Sci. A. Pure and Appl. Chem. 2018. V. 55. № 7. P. 552.
Cohen J.L.I., Traficante L., Schwartz P.W., Engel R. // Tetrahedron Lett. 1998. V. 39. P. 8617.
Engel R., Ghani I., Montenegro D., Thomas M., Klaritch-Vrana B., Castaño A., Friedman L., Leb J., Rothman L., Lee H., Capodiferro C., Ambinder D., Cere E., Awad C., Sheikh F., Rizzo J.L., Nisbett L.-M., Testani E., Melkonian K. // Molecules. 2011. V. 16. № 2. P. 1508.
Gordon E., Cohen J.L., Engel R., Abbott G.W. // Mol. Pharmacol. 2006. V. 69. № 3. P. 718.
Li T., Krasne S.J., Persson B., Kaback H.R., Diederich F. // J. Org. Chem. 1993. V. 58. № 2. P. 380.
Tabushi I., Imuta J.-I., Seko N., Kobuke Y. // J. Amer. Chem. Soc. 1978. V. 100. № 19. P. 6287.
Pat. EP 0883574B1, 2004.
Xu D.-Z., Liu Y., Shi S., Wang Y. // Green Chem. 2010. V. 12. P. 514.
Tong J., Huang L.-S., Xu D.-Z. // New J. Chem. 2017. V. 41. P. 3966.
Jaskowska J., Kowalski P. // J. Heterocycl. Chem. 2008. V. 45. P. 1371.
Robinson D.B., Rognlien J.L., Bauer C.A., Simmons B.A. // J. Mater. Chem. 2007. V. 17. № 20. P. 2113.
Буракова Е.А., Ковалев Н.А., Кузнецова И.Л., Зенкова М.А., Власов В.В., Сильников В.Н. // Биоорган. химия. 2007. Т. 33. № 5. С. 563.
Королева Л.С., Донина А.А., Тамкович Н.В., Ковалев Н.А., Зенкова М.А., Сильников В.Н. // Изв. АН. Сер. хим. 2005. № 11. С. 2596.
Тамкович Н.В., Малышев А.В., Коневец Д.А., Сильников В.Н., Зенкова М.А., Власов В.В. // Биоорган. химия. 2007. Т. 33. № 2. С. 251.
Menger F.M., Persichetti R.A. // J. Org. Chem. 1987. V. 52. № 15. C. 3451.
Zhou Q., Gao D., Liu J., Sun X., Zhang L., Qi B., Zhang H., Xia C., Zhou X. // J. Colloid Interface Sci. 2013. V. 410. P. 131.
Захарова Л.Я., Паширова Т.Н., Кашапов Р.Р., Жильцова Е.П., Гайсин Н.К., Гнездилов О.И., Конов А.Б., Лукашенко С.С., Магдеев И.М. // Кинетика и катализ. 2011. Т. 52. № 2. С. 186.
Жильцова Е.П., Лукашенко С.С., Паширова Т.Н., Захарова Л.Я., Коновалов А.И. // Изв. АН. Сер. хим. 2015. № 11. С. 2690.
Жильцова Е.П., Гимранова Р.Ф., Лукашенко С.С., Паширова Т.Н., Харлампиди Х.Э., Захарова Л.Я. // Кинетика и катализ. 2013. Т. 54. № 5. С. 583.
Жильцова Е.П., Ибатуллина М.Р., Лукашенко С.С., Валеева Ф.Г., Паширова Т.Н., Кутырева М.П., Захарова Л.Я. // Коллоид. журн. 2017. Т. 79. № 5. С. 580.
Жильцова Е.П., Ибатуллина М.Р., Лукашенко С.С., Кутырева М.П., Ануар М.М., Коваленко В.И., Захарова Л.Я. // Журн. общ. химии. 2017. Т. 87. № 11. С. 1881.
Ибатуллина М.Р., Жильцова Е.П., Лукашенко С.С., Волошина А.Д., Сапунова А.С., Ленина О.А., Низамеев И.Р., Кутырева М.П., Захарова Л.Я. // Журн. общ. химии. 2018. Т. 88. № 11. С. 1883.
Паширова Т.Н., Жильцова Е.П., Кашапов Р.Р., Лукашенко С.С., Литвинов А.И., Кадиров М.К., Захарова Л.Я., Коновалов А.И. // Изв. АН. Сер. хим. 2010. № 9. С. 1699.
Pat. 2922810 USA, 1960.
Бельский В.Е., Кудрявцева Л.А., Ильина О.М., Иванов Б.Е. // Журн. общ. химии. 1979. Т. 49. № 11. С. 2470.
Kashapov R.R., Bekmukhametova A.M., Petrov K.A., Nizameev I.R., Zakharova L.Ya. // Sens. Actuators. B. Chem. 2018. V. 273. № 10. P. 592.
Березин И.В., Мартинек К., Яцимирский А.К. // Успехи химии. 1973. Т. 42. № 10. С. 1729.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ



