Кинетика и катализ, 2020, T. 61, № 2, стр. 262-270
Влияние состава оксидных слоев, полученных методом плазменно-электролитического оксидирования, на механизм пероксидного окисления сероорганических соединений
А. А. Брыжин a, В. С. Руднев b, c, И. В. Лукиянчук b, М. С. Васильева b, c, И. Г. Тарханова a, *
a МГУ им. М.В. Ломоносова, химический факультет
119234 Москва, Ленинские горы, 1/3, Россия
b Институт химии ДВО РАН
690022 Владивосток, просп. 100-летия Владивостока, 159, Россия
c Дальневосточный федеральный университет
690091 Владивосток, ул. Суханова, 8, Россия
* E-mail: itar_msu@mail.ru
Поступила в редакцию 03.07.2019
После доработки 21.09.2019
Принята к публикации 29.10.2019
Аннотация
Исследовано пероксидное окисление тиофена, тиоанизола и дибензотиофена в присутствии оксидных слоев Ce, Zr, Ce + Zr, W, W + Zn на поверхности титана, сформированных методом плазменно-электролитического оксидирования. Установлено влияние состава полученных композиций на ряд активности и конверсию сероорганических субстратов. Методом радикального ингибирования показано различие в механизме каталитического действия композиций разного состава.
Одна из ключевых проблем создания гетерогенных катализаторов состоит в формировании активных композиций заданного состава на поверхности твердых носителей. Весьма актуальной является разработка новых способов синтеза моно- и биметаллических поверхностных структур, обладающих не только каталитической активностью, но и высокой химической и термической устойчивостью. Для их формирования перспективно применение плазменно-электролитического оксидирования (ПЭО) – метода получения оксидных слоев заданного состава в условиях реализации электрических искровых и микродуговых разрядов на поверхности металлов и сплавов [1, 2]. ПЭО-системы не обладают большой удельной поверхностью, но благодаря широким порам и равномерному распределению активных частиц такие композиции являются эффективными катализаторами ряда процессов, таких как окисление CO [3], окислительное дегидрирование циклогексана в циклогексен [4], превращение этанола в этилен [5], паровой риформинг нафталина [6], превращение метана в синтез-газ [7] и окисление сероорганических соединений [8, 9].
В связи с действующими ограничениями, направленными на защиту окружающей среды, за последние 20 лет допустимая концентрация серы в моторном топливе снизилась с 2000 до 10 ppm, что делает процесс сероочистки принципиально важной частью переработки нефтяного сырья [10]. Традиционная технология гидроочистки малоэффективна в отношении гетероциклических соединений [11]. Поэтому в дополнение к ней используют безводородные процессы, например, окислительное обессеривание – подход, направленный на увеличение полярности серосодержащих веществ с их последующим удалением методами адсорбции или экстракции [12]. В качестве гетерогенных катализаторов такого процесса используют индивидуальные и смешанные оксиды, содержащие ионы переходных металлов в высоких степенях окисления [8–17].
Разная эффективность катализаторов может быть обусловлена различными механизмами процесса окислительного обессеривания, зависящими от их состава [9, 17–19]. Известно, что окисление серосодержащих соединений, катализируемое полиоксометаллатами, протекает через нуклеофильное замещение в пероксокомплексах V, W и Mo, образующихся при взаимодействии ПОМ с H2O2 [14, 20–22]. С другой стороны, оксиды металлов (Cu, Fe, Ce и Ce + Zr) способны вступать во взаимодействие с пероксидом водорода по радикальному механизму без образования пероксокомплексов [23–28]. Скорость реакции гидроксильных радикалов с большинством органических соединений и скорость их рекомбинации ограничиваются только частотой столкновений с другими частицами, в связи с чем стационарная концентрация, необходимая для детектирования методом электронного парамагнитного резонанса, никогда не достигается. Поэтому для изучения радикальных механизмов можно применить метод ингибирования [29], основанный на использовании веществ, селективно реагирующих с одним из типов радикалов.
В настоящей работе мы поставили задачу установить участие гидроксильных радикалов и супероксид-ионов в окислении сероорганических соединений на примере ПЭО-композиций. В качестве катализаторов использовали W- и W–Zn-содержащие ПЭО-композиции, на которых может быть реализован механизм нуклеофильного замещения, и Ce- и/или Zr-содержащие, на которых может быть реализован радикальный механизм без образования пероксокомплексов. В качестве радикальных ингибиторов были выбраны широко используемые бензохинон [27, 28, 30, 31] и изопропанол [27, 32–34]. Таким образом, цель нашей работы состояла в установлении влияния состава биметаллических ПЭО-композиций на механизм пероксидного окисления сероорганических соединений (тиофена, дибензотиофена и тиоанизола). Применение поверхностей различного оксидного состава, формируемых методом ПЭО, и изучение процессов окисления с их использованием могло бы способствовать созданию высокоэффективных каталитических систем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Используемые реактивы
В работе для каталитических испытаний использовали реактивы производства фирмы “Sigma Aldrich”: тиофен (99%), дибензотиофен (99%), тиоанизол (99%), изооктан (99%), пероксид водорода (50%), изопропиловый спирт (99%) и бензохинон (99%). Электролиты для ПЭО готовили на основе дистиллированной воды и следующих реактивов: Na2WO4 · 2H2O (“ч. д. а.”), CH3COOH ледяная (“х. ч.”), NaOH (“ч. д. а.”), Zn(CH3COO)2 ⋅ ⋅ 2H2O (“ч. д. а.”), Ce2(SO4)3 (“х. ч.”) и Zr(SO4)2 · ⋅ 4H2O (“х. ч.”). Состав использованных электролитов и обозначение полученных в них образцов представлены в табл. 1.
Таблица 1.
Условия формирования, элементный и фазовый составы моно- и биметаллических ПЭО-покрытий
| Условное обозначение ПЭО-покрытия | Условия формирования | Характеристики композита | |||
|---|---|---|---|---|---|
| режим | электролит | фазовый состав | элементный состав, ат. % | структура слоев на Ti |
|
| W | i = 0.2 А/см2 t = 10 мин |
0.1 M Na2WO4 + 0.84 M CH3COOH + 0.01 M NaOH | WO3 TiO2 (анатаз) Na0.28WO3 |
15.8 W | WO3/TiO2 |
| 7.4 Ti | |||||
| 74.0 O | |||||
| 0.9 Na | |||||
| W + Zn | i = 0.2 А/см2 t = 10 мин |
0.1 М Na2WO4 + 0.1 M CH3COOH + 0.04 М Zn(CH3COO)2 | WO3 TiO2 (анатаз) ZnWO4 |
5.2 Zn | ZnOx, WO3/TiO2 |
| 17.7 W | |||||
| 6.4 Ti | |||||
| 65.6 O | |||||
| 4.6 C | |||||
| Ce + Zr | i = 0.05 А/см2 t = 10 мин |
0.012 М Ce2(SO4)3 + 0.03 М Zr(SO4)2 | TiO2 (анатаз, рутил) ZrTiO4 Ti2ZrO6 |
3.0 Ce | CeOx, ZrO2/TiO2 |
| 14.4 Zr | |||||
| 16.7 Ti | |||||
| 65.9 O | |||||
| Zr | i = 0.05 А/см2 t = 5 мин |
0.05 М Zr(SO4)2 | ZrO2 (моноклин. + кубич.) TiO2 (рутил) |
17.8 Zr | ZrO2/TiO2 |
| 13.4 Ti | |||||
| 68.8 O | |||||
| Ce | i = 0.05 А/см2 t = 5 мин |
0.05 М Ce2(SO4)3 | TiO2 (анатаз, рутил) | 2.4 Ce | CeOx/TiO2 |
| 30.8 Ti | |||||
| 66.8 O | |||||
Синтез композиций
Синтез композиций методом ПЭО подробно описан в наших предыдущих работах [8, 9, 35]. Оксидные слои формировали на образцах из сплавов титана ВТ1-0 размером 20 × 20 × 0.5 мм. Указанный сплав содержит Ti 99.2–99.7, O ≤ 0.2, Si ≤ 0.1 мас. %. Допускается также незначительная примесь металлов Fe (≤0.25 мас. %) и Al (≤0.7 мас. %). Предварительно образцы подвергали механической обработке, снимая заусеницы, затем химически полировали в смеси кислот (HF : HNO3 = 1 : 3), промывали вначале проточной, а затем дистиллированной водой, после чего сушили на воздухе. Электрохимическую обработку выполняли в ванне из нержавеющей стали с рубашкой водяного охлаждения. Противоэлектродом служил корпус ванны. Электролит перемешивали механической мешалкой. Источником тока служил управляемый компьютером тиристорный агрегат ТЕР4-100/460 (Россия), работающий в однополярном режиме. Покрытия на титановых образцах получали в течение 5–10 мин при эффективной анодной плотности тока 0.05–0.2 А/см2. Температура электролита не превышала 20°С. Образцы с ПЭО-покрытиями промывали дистиллированной водой и сушили на воздухе. Во всех случаях на титане формировались плотные пленки толщиной 5–8 мкм.
Определение состава покрытий
Фазовый состав покрытий определяли по рентгенограммам, полученным на рентгеновских дифрактометрах ДРОН-2 (“НПП “Буревестник”, Россия) и Bruker D8 ADVANCE (“Bruker”, Германия) в CuKα-излучении в соответствии со стандартной методикой. Идентификацию соединений проводили в автоматическом режиме с использованием программы поиска EVA с базой данных PDF-2.
Брутто-элементный состав ПЭО-покрытий (глубина анализа ~2–5 мкм) определяли на электронном рентгеноспектральном микроанализаторе JXA-8100 (“JEOL”, Япония) при сканировании не менее 5 отдельных площадок размерами 200 × 300 мкм (табл. 1). При этом усредняли значения концентраций элементов. В каталитических экспериментах использовали фрагменты пластинок шириной 0.5–1 мм.
Каталитические испытания
Для проведения каталитических испытаний в реактор с рубашкой, подсоединенный к термостату, помещали 10 мл модельной смеси (1 мас. % раствор тиофена, дибензотиофена или тиоанизола в изооктане), 0.1 г катализатора и 0.4 мл окислителя – 50%-ного раствора пероксида водорода. Содержимое реактора тщательно перемешивали с использованием верхнеприводной механической мешалки и термостатировали при 60°С, периодически отбирая пробы для анализа. В предварительных экспериментах было показано, что исходный сплав не обладает собственной активностью: конверсия субстратов не превышала 5%. Все опыты проводили при скорости мешалки не менее 500 об/мин, когда конверсия реагентов не зависит от интенсивности перемешивания.
Для проведения реакций с радикальными ингибиторами в реакционную смесь добавляли изопропанол или бензохинон в эквимольном соотношении с субстратами (тиофеном и тиоанизолом). Далее реакцию проводили по методике, описанной выше.
Анализ реакционных смесей
Органическую фазу реакционной смеси количественно анализировали методом газо-жидкостной хроматографии на приборе Кристалл 4000 (“НПФ “Мета-хром”, Россия), снабженном капиллярной колонкой Zebron ZB-1 длиной 30 м (жидкая фаза – 100% диметилполисилоксан) и пламенно-ионизационным детектором. Содержание тиофена, дибензотиофена и тиоанизола определяли в режиме линейного программирования при температурах 90–220°С с помощью метода внутреннего стандарта.
Идентификацию органических соединений в реакционной смеси проводили методом 1Н и 13С ЯМР-спектроскопии (прибор Bruker Avance-600, (600 МГц) при комнатной температуре), а также методом газовой хромато-масс-спектрометрии (ГХ/МС) на приборе THERMO TRACE DSQ II (“Termo Fisher Scientific”, США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
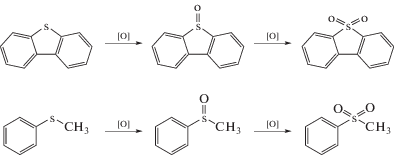
Для сравнения активности моно- и биметаллических композиций, полученных методом ПЭО (табл. 1), были проведены каталитические испытания по пероксидному окислению наиболее устойчивого к окислению сероорганического субстрата – тиофена [36]. Помимо низкой реакционной способности, интерес к окислению тиофена вызван широким набором возможных продуктов – согласно литературным данным процесс может происходить с образованием сульфат-аниона, углеводородов (например, стирола), карбоновых кислот (бензойной, муравьиной) или при более глубоком окислении – углекислого газа [37–40]. В настоящей работе методами 1Н и 13С ЯМР-спектроскопии, а также методом ГХ/МС при исследовании состава реакционной смеси органических продуктов окисления тиофена не обнаружено. Применение бариевого сульфатного метода позволило установить, что продуктом окисления серы в тиофене является сульфат-анион. Таким образом, происходит глубокое окисление тиофена с разрушением ароматической структуры, и этот продукт образуется при использовании всех исследованных катализаторов.
Достаточно низкая конверсия тиофена (рис. 1) даже при длительном протекании реакции является следствием побочной реакции разложения пероксида водорода. В окислении тиофена монометаллические ПЭО-системы с церием или цирконием обладают большей активностью, чем катализатор на основе оксида вольфрама. С другой стороны, использование биметаллических образцов Ce + Zr и W + Zn способствует увеличению конверсии на 5–30% по ряду причин. Введение цинка обеспечивает возможность регулирования электронной плотности на ионах вольфрама и способствует повышению электрофильности активного центра – пероксокомплекса, принимающего непосредственное участие в механизме процесса [41]. Модификация церийсодержащих оксидных композиций цирконием приводит к увеличению подвижности активного кислорода [42], что влияет на каталитическую активность в окислительно-восстановительных реакциях, протекающих по радикальному механизму.
Рис. 1.
Кинетические кривые окисления тиофена на моно- (W, Ce или Zr) и биметаллических (W + Zn и Ce + Zr) ПЭО‑катализаторах. Условия реакции: 60°С, 0.1 г катализатора, 0.4 мл H2O2, время реакции 4 ч.
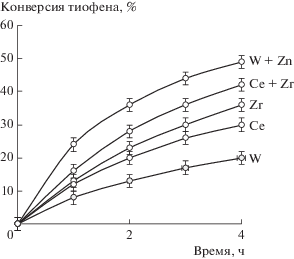
Для сравнения следует отметить, что максимальная конверсия тиофена на типичных катализаторах окисления обычно составляет 30–70% [43–46]. В нашей работе среди испытанных образцов максимальная конверсия (49%) была достигнута при использовании катализатора W + Zn.
Катализаторы W + Zn и Ce + Zr, обладающие повышенной активностью по сравнению с монометаллическими аналогами, были протестированы в окислении тиоанизола и дибензотиофена (рис. 2). Дибензотиофен и тиоанизол были выбраны в качестве модельных субстратов как типичные представители сульфидов и серосодержащих гетероциклов дизельного топлива [47, 48]. Как видно на рис. 2, процесс окисления тиоанизола протекает значительно быстрее, чем тиофена. В присутствии катализатора W + Zn полное превращение тиоанизола происходит через 0.5 ч после начала реакции, а в присутствии катализатора Ce + Zr максимальной конверсии можно достичь через 1.5 ч. При окислении дибензотиофена биметаллический церий-циркониевый катализатор оказался неэффективен. Такой результат стал неожиданным, поскольку известно, что замещенные тиофены окисляются значительно быстрее незамещенных [14, 20–22, 49, 50]. С другой стороны, для катализатора на основе оксидов W и Zn активность в отношении сероорганических субстратов снижается в ряду: тиоанизол > дибензотиофен > тиофен. Характер такой зависимости описан в литературе [49, 50], и его связывают с различиями в величине электронной плотности на атоме серы. Пероксидное окисление тиоанизола и дибензотиофена протекает согласно схеме 1 [14, 20–22].
Рис. 2.
Конверсия сероорганических субстратов на биметаллических ПЭО-катализаторах. Условия реакции: 60°С, 0.1 г катализатора, 0.4 мл H2O2, время реакции с тиоанизолом – 0.5 ч, с тиофеном и дибензотиофеном – 4 ч.
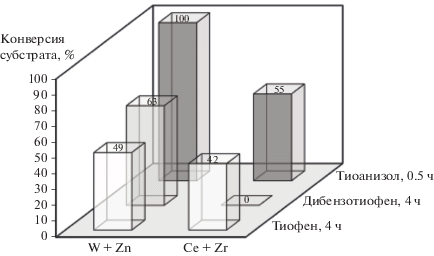
Схема 1 . Окисление дибензотиофена и тиоанизола.
Методами 1Н и 13С ЯМР-спектроскопии было установлено, что в реакциях на катализаторе W + Zn происходит окисление тиоанизола и дибензотиофена до соответствующих сульфонов. Напротив, при использовании катализатора Ce + Zr, помимо сульфона, в реакционной смеси обнаружен сульфоксид тиоанизола. Таким образом, скорости превращения промежуточных продуктов реакции на исследованных биметаллических композициях отличаются, что, вероятно, связано с различиями в механизме процесса окисления.
Чтобы понять природу активности катализаторов в отношении различных сероорганических субстратов, было исследовано окисление в присутствии радикальных ингибиторов реакции. Изопропанол использовали в качестве акцептора ${\text{O}}{{{\text{H}}}^{\centerdot }}$ [27, 32–34], а бензохинон – в качестве акцептора ${\text{O}}_{2}^{{\centerdot - }}$ [27, 28, 30, 31].
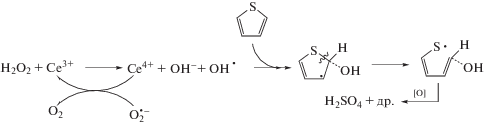
Как видно на рис. 3, добавление радикальных ингибиторов замедляет процесс окисления тиофена и тиоанизола в присутствии биметаллического катализатора Ce+Zr. Причем бензохинон оказывает более заметный ингибирующий эффект, что согласуется с литературными данными [51]. На основании результатов, полученных нами, можно предположить, что гидроксильный радикал и супероксид-ион могут образовываться в результате реакций, аналогичных реакциям Фентона–Габера–Вейса. Подобные результаты для каталитических систем на основе оксидов церия/циркония в различных процессах описываются в ряде работ [23–25], где механизм имеет радикальную природу и соответствует схеме 2 .
Рис. 3.
Влияние на процесс окисления тиоанизола (а) и тиофена (б) радикальных ингибиторов: 1 – в отсутствие ингибитора, 2 – изопропанола, 3 – бензохинона. Условия реакции: 60°С, 0.1 г катализатора Ce + Zr, 0.4 мл H2O2, [субстрат] : : [ингибитор] = 1.
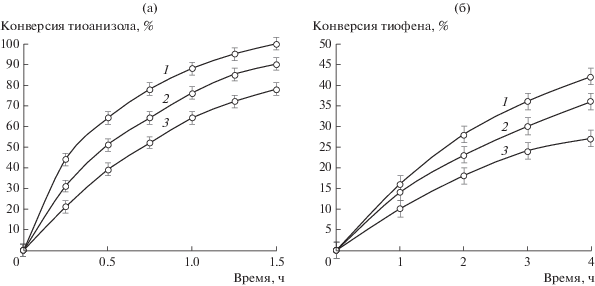
Схема 2 . Окисления тиофена по механизму Фентона–Габера–Вейса.
Согласно схеме 2 , образующийся в реакционной системе супероксид-ион участвует в каталитическом цикле, восстанавливая Ce4+, а гидроксильный радикал присоединяется к молекуле тиофена, вызывая ее дальнейшие превращения. Аналогично может развиваться реакция с тиоанизолом. Альтернативный путь – это отрыв атома водорода, который может осуществляться обеими радикальными частицами. Согласно расчетам, проведенным в литературе, взаимодействие радикалов с молекулой тиофена в ходе окисления протекает по соседнему с атомом с-еры атому углерода [52]. Вероятно, в случае д-ибензотиофена возникают стерические затруднения для такого взаимодействия. Это приводит к торможению радикального процесса, что и н-аблюдалось в случае катализатора Ce + Zr (рис. 2).
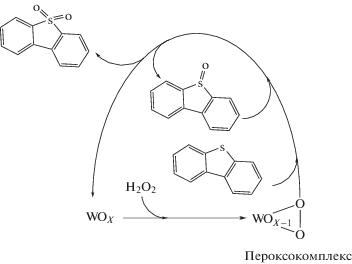
Добавление бензохинона и изопропанола к системе с катализатором на основе оксида вольфрама и цинка не привело к существенному изменению активности (рис. 4). Следовательно, гидроксильные радикалы и супероксид-ионы не вовлечены в процесс окисления. В данном с-лучае в механизме принимают участие пероксокомплексы, образующиеся в результате вза-имодействия пероксида водорода и производных вольфрама. Затем происходит нуклеофильная атака сероорганического субстрата на пероксокомплекс, обладающий высокой активностью (схема 3 ), в результате чего образуются продукты (преимущественно сульфоны) [14, 20, 21, 26, 41].
Рис. 4.
Влияние на процесс окисления тиоанизола (а) и тиофена (б) радикальных ингибиторов: 1 – в отсутствие ингибитора, 2 – изопропанола, 3 – бензохинона. Условия реакции: 60°С, 0.1 г катализатора W + Zn, 0.4 мл H2O2, [субстрат] : : [ингибитор] = 1.
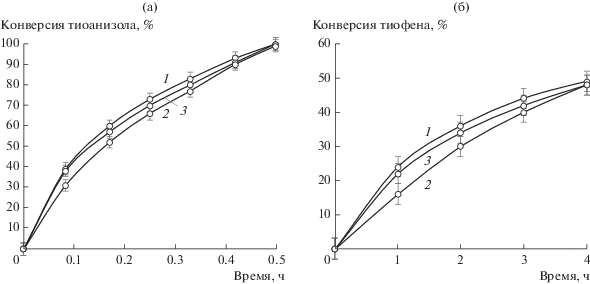
Схема 3 . Образование пероксокомплексов и их участие в окислении дибензотиофена.
Активность биметаллических композиций в отношении дибензотиофена можно объяснить различными механизмами катализа, причем радикальный процесс окисления с участием оксидов церия и циркония протекает гораздо медленнее, чем нуклеофильное замещение через образование пероксокомплексов в случае цинк-вольфрамовых систем.
ЗАКЛЮЧЕНИЕ
Таким образом, моно- и биметаллические ПЭО-системы активны в окислении сероорганических субстратов, причем катализаторы на основе смешанных оксидов проявляют более высокую эффективность по сравнению со своими монометаллическими аналогами. Среди испытанных образцов максимальная конверсия была достигнута при использовании катализатора на основе оксидов вольфрама и цинка. Результаты экспериментов по радикальному ингибированию с катализатором Ce + Zr указывают на протекание реакции с участием супероксид-ионов, т.е. на радикальную природу процесса. Напротив, ингибиторы не оказывают влияния на конверсию тиофена и тиоанизола с катализатором W + Zn, что свидетельствует в пользу механизма нуклеофильного замещения. Различие в механизмах катализа приводит к изменению в ряду активности субстратов.
Список литературы
Yerokhin A.L., Nie X., Leyland A., Matthews A., Dowey S.J. // Surf. Coat. Tech. 1999. V. 122. P. 73.
Mohedano M., Lu X., Matykina E., Blawert C., Arrabal R., Zheludkevich M.L. Plasma electrolytic oxidation (PEO) of metals and alloys. In: Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. 2017. https://doi.org/10.1016/b978-0-12-409547-2.13398-0
Штефан В.В., Смирнова А.Ю. // Электрохимия. 2015. Т. 51. № 12. С. 1309.
Patcas F., Krysmann W. // Appl. Catal. A. Gen. 2007. V. 316. P. 240.
Васильева М.С., Руднев В.С., Тулуш А.И., Недозоров П.М., Устинов А.Ю. // Журн. физ. химии. 2015. Т. 89. № 6. С. 938.
Jiang X., Zhang L., Wybornov S., Staedler T., Hein D., Wiedenmann F., Krumn W., Rudnev V., Lukiyanchuk I. // ACS Appl. Mater. 2012. V. 4. № 8. P. 4062.
Sadykov V., Sobyanin V., Mezentseva N., Alikina G., Vostrikov Z., Fedorova Y., Pelipenko V., Usoltsev V., Tikhov S., Salanov A., Bobrova L., Beloshapkin S., Ross J.R.H., Smorygo O., Ulyanitskii V., Rudnev V. // Fuel. 2010. V. 89. № 6. P. 1230.
Rudnev V.S., Lukiyanchuk I.V., Vasilyeva M.S., Morozova V.P., Zelikman V.M., Tarkhanova I.G. // Appl. Surf. Sci. 2017. V. 422. P. 1007.
Tarkhanova I.G., Bryzhin A.A., Gantman M.G., Ya-rovaya T.P., Lukiyanchuk I.V., Nedozorov P.M., Rudnev V.S. // Surf. Coat. Tech. 2019. V. 362. P. 132.
Hossain M.N., Park H.C., Choi H.S. // Catalysts. 2019. V. 9. № 3. Paper 229.
Rezakazemi M., Zhang Z. Comprehensive Energy Systems. 2018. V. 2. Chapter 00263 – 2.29. P. 944.
Abdul-Kadhim W., Deraman M.A., Abdullah S.B., Tajuddin S.N., Yusoff M.M., Taufiq-Yap Y.H., Rahim M.H.A. // J. Environ. Chem. Eng. 2017. V. 5. № 2. P. 1645.
Ji H.Y., Sun J., Wu P.W., Dai B.L., Chao Y.H., Zhang M., Jiang W., Zhu W.S., Li H.M. // J. Mol. Catal. A. Chem. 2016. V. 423. P. 207.
Craven M., Xiao D., Kunstmann-Olsen C., Kozhevnikova E.F., Blanc F., Steiner A., Kozhevnikov I.V. // Appl. Catal. B. Environ. 2018. V. 231. P. 82.
Du Y., Lei J.H., Zhou L.N., Guo Z.R., Du X.D., Li J.S. // Mater. Res. Bull. 2018. V. 105. P. 210.
Ji H.Y., Sun J., Wu P.W., Wu Y.C., He J., Chao Y.H., Zhu W.S., Li H.M. // Fuel. 2018. V. 213. P. 12.
Cheng S.F., Liu Y.M., Gao J.B., Wang L.L., Liu X.L., Gao G.H., Wu P., He M.Y. // Chin. J. Catal. 2006. V. 27. № 7. P. 547.
Zhang J., Wang A.J., Li X., Ma X.H. // J. Catal. 2011. V. 279. № 2. P. 269.
Abdullah W.N.W., Abu Bakar W.A.W., Ali R., Mokhtar W.N.A.W., Omar M.F. // J. Clean Prod. 2017. V. 162. P. 1455.
Moslemi A., Chermahini A.N., Sarpiri J.N., Rezaei S., Barati M. // J. Taiwan Inst. Chem. Eng. 2019. V. 97. P. 237.
Luna M.L., Alvarez-Amparán M.A., Cedeño-Caero L. // J. Taiwan Inst. Chem. Eng. 2019. V. 95. P. 175.
Ghubayra R., Nuttall C., Hodgkiss S., Craven M., Kozhevnikova E.F., Kozhevnikov I.V. // Appl. Catal. B. Environ. 2019. V. 253. P. 309.
Heckert E.G., Seal S., Self W.T. // Environ. Sci. Technol. 2008. V. 42. № 13. P. 5014.
Abdelkader E., Nadjia L., Naceur B., Boukoussa B., Mohamed A. // Adv. Sci. Technol. Innov. 2018. P. 129.
Aneggi E., Cabbai V., Trovarelli A., Goi D. // Int. J. Photoenergy. 2012. Paper 694721.
Li F.T., Wu B., Liu R.H., Wang X.J., Chen L.J., Zhao D.S. // Chem. Eng. J. 2015. V. 274. P. 192.
Hwang S., Huling S.G., Ko S. // Chemosphere. 2010. V. 78. № 5. P. 563.
Feng Y., Lee P.H., Wu D.L., Zhou Z.Y., Li H.K., Shih K.M. // J. Hazard. Mater. 2017. V. 331. P. 81.
Finkelstein E., Rosen G.M., Rauckman E.J. // Arch. Biochem. Biophys. 1980. V. 200. № 1. P. 1.
Qin Y.Y., Cui Y.P., Tian Z., Wu Y.L., Li Y.L. // Nanoscale Res. Lett. 2017. V. 12. Paper 247.
Palominos R., Freer J., Mondaca M.A., Mansilla H.D. // J. Photochem. Photobiol. A. Chem. 2008. V. 193. № 2–3. P. 139.
Ahmad M., Teel A.L., Furman O.S., Reed J.I., Watts R.J. // J. Environ. Eng. ASCE. 2012. V. 138. № 4. P. 411.
Georgaki I., Vasilaki E., Katsarakis N. // American J. Analytical Chemistry. 2014. V. 5. № 8. P. 518.
Liu T.T., Wang L., Lu X., Fan J.M., Cai X.X., Gao B., Miao R., Wang J.X., Lv Y.T. // RSC Adv. 2017. V. 7. № 20. P. 12 292.
Руднев В.С., Васильева М.С., Лукиянчук И.В. // Неорг. матер. 2019. Т. 55. № 7. С. 727.
Ismagilov Z., Yashnik S., Kerzhentsev M., Parmon V., Bourane A., Al-Shahrani F.M., Hajji A.A., Koseoglu O.R. // Catal. Rev. Sci. Eng. 2011. V. 53. № 3. P. 199.
Chen L.J., Guo S.H., Zhao D.S. // Chin. J. Chem. Eng. 2007. V. 15. № 4. P. 520.
Zhang B.Y., Jiang Z.X., Li J., Zhang Y.N., Lin F., Liu Y., Li C. // J. Catal. 2012. V. 287. P. 5.
Тарханова И.Г., Анисимов А.В., Буряк А.К., Брыжин А.А., Али-Заде А.Г., Акопян А.В., Зеликман В.М. // Нефтехимия. 2017. Т. 57. № 5. С. 536.
Kong L.Y., Li G., Wang X.S. // Catal. Today. 2004. V. 93–95. P. 341.
Ribeiro S.O., Juliao D., Cunha-Silva L., Domingues V.F., Valenca R., Ribeiro J.C., de Castro B., Balula S.S. // Fuel. 2016. V. 166. P. 268.
Aneggi E., Cabbai V., Trovarelli A., Goi D. // Int. J. Photoenergy. 2012. Paper 694721.
Saha B., Sengupta S. // Fuel. 2015. V. 150. P. 679.
Maity U., Selvin R., Basu J.K., Sengupta S. // J. Nanoeng. Nanomanufact. 2012. V. 2. № 3. P. 241.
Hasan Z., Jeon J., Jhung S.H. // J. Hazard. Mater. 2012. V. 205. P. 216.
Tang Q., Lin S., Cheng Y., Liu S.J., Xiong J.R. // Ultrason. Sonochem. 2013. V. 20. № 5. P. 1168.
Song C.S. // Catal. Today. 2003. V. 86. № 1–4. P. 211.
Wang F.C.Y., Robbins W.K., Di Sanzo F.P., McElroy F.C. // J. Chromatogr. Sci. 2003. V. 41. № 10. P. 519.
Li M., Zhang M., Wei A.M., Zhu W.S., Xun S.H., Li Y.A., Li H.P., Li H.M. // J. Mol. Catal. A. Chem. 2015. V. 406. P. 23.
Otsuki S., Nonaka T., Takashima N., Qian W.H., Ishihara A., Imai T., Kabe T. // Energy Fuels. 2000. V. 14. № 6. P. 1232.
Jiang W., Zhu W.S., Li H.M., Chao Y.H., Xun S.H., Liu H., Zhao Z. // J. Mol. Catal. A. Chem. 2014. V. 382. P. 8.
Zhang Y.J., Sun J.Y., Sun Y.X., Tang Y.Z., Wang R.S. // Comput. Theor. Chem. 2016. V. 1092. P. 74.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ