Кинетика и катализ, 2020, T. 61, № 2, стр. 272-276
Реакционная способность циклоолефинов С5–С10 в реакции сометатезиса с гексеном-1
В. И. Быков a, *, Б. А. Беляев a
a ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 29, Россия
* E-mail: bykov@ips.ac.ru
Поступила в редакцию 10.09.2019
После доработки 30.10.2019
Принята к публикации 01.11.2019
Аннотация
В широком интервале конверсий, при температурах 25 и 5°С определена реакционная способность циклоолефинов (циклопентена, циклогептена, циклооктена, циклононена и циклодецена) в реакции сометатезиса с гексеном-1 с использованием каталитической системы MoCl5/SiO2–SnMe4). Показано, что реакционная способность понижается с увеличением размера кольца циклоолефина. Добавление трифенилфосфина к реакционной смеси приводит к снижению массы продуктов сометатезиса по отношению к продукту гомометатезиса – децену-5. Предложен возможный механизм, объясняющий полученные закономерности.
Каталитический метатезис олефинов является одной из интереснейших и перспективных реакций для химии полимеров, тонкой органической химии и нефтехимии. Подтверждением этому служит присуждение в 2005 г. Нобелевской премии по химии за внедрение метатезисного метода в органический синтез. Вклад нобелевских лауреатов в развитие метатезисного подхода в основном связан c открытием металлокарбенового механизма (Chauvin Y.) и разработкой гомогенных катализаторов – Ru-карбеновых (Grubbs R.H.) и Мо(W)-карбеновых (Schrock R.R.). Эти металлокарбеновые комплексы способны подвергать метатезису сложные ненасыщенные структуры, содержащие различные функциональные группы [1]. Одним из перспективных направлений метатезисного метода в органической химии является синтез биологически активных природных соединений. В ИНХС РАН предложена новая гибкая малостадийная стратегия синтеза широкого ассортимента экологически чистых инсектицидов – феромонов насекомых и других природных соединений. Методология основана на реакции сометатезиса дешевого сырья (α-олефинов, циклоолефинов, циклооктадиена и этилена) нефтехимического происхождения [1–4]. Подход к синтезу феромонов включает сометатезис циклоолефинов (ЦО) С5–С10 с α-олефинами С4–С8 в присутствии Мо-содержащих гетерогенных катализаторов. В результате сометатезиса образуются 1,Δ-диены, различающиеся длиной углеводородной цепочки и положением внутренней двойной связи, которое определяет размер кольца ЦО. Региоселективная функционализация концевой двойной связи приводит к ненасыщенным спиртам, ацетатам или альдегидам, которые входят в состав очень большого числа феромонов различных насекомых отряда чешуекрылых – вредителей сельского и лесного хозяйств, теплиц и оранжерей, продуктовых складов и т.п.
В настоящей работе впервые определена реакционная способность ЦО в реакции сометатезиса с гексеном-1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подготовку исходных соединений, а также все реакции проводили в атмосфере аргона (“ос. ч.”) с использованием в качестве осушителя реагентов LiAlH4.
Приготовление катализатора MoCl5/SiO2
Катализатор MoCl5/SiO2 готовили следующим образом. Силикагель марки КСК (размер частиц 0.31–0.34 мм) прокаливали в вакууме (1 × 10–4 Торр) при температуре 300°С в течение 2 ч. Затем охлаждали в вакууме до комнатной температуры и заполняли ампулу аргоном высокой чистоты, после чего добавляли мелкодисперсный MoCl5 из расчета 3.2 × 10–4 моль на 1 г силикагеля. Смесь перемешивали и снова создавали вакуум. Выделяющийся HCl собирали в ловушку, охлаждаемую жидким азотом. Через некоторое время (~1 ч) HCl переконденсировали в емкость с известным объемом воды. Полученный раствор титровали 0.1 М NaOH, что позволяло определять динамику взаимодействия MoCl5 с поверхностными группами силикагеля и полноту его превращения. Так, при 80°С в течение 4 ч MoCl5 полностью реагировал с гидроксильными группами силикагеля.
Реакция сометатезиса
Сометатезис ЦО с α-олефинами проводили в термостатируемом стеклянном реакторе, снабженном капельной воронкой и обратным холодильником, при перемешивании магнитной мешалкой. В реактор загружали навеску катализатора и гексена-1, а в капельную воронку – определенное количество ЦО и сокатализатора Me4Sn. Мольное отношение ЦО : гексен-1 во всех опытах составляло 1 : 3.
Методы контроля
Контроль за чистотой исходных и полученных соединений, а также за ходом реакций осуществляли методом газовой хроматографии на хроматографе ЛХМ-8МД (ООО “НПФ “Мета-хром”, Россия), снабженном пламенно-ионизационным детектором, на кварцевой капиллярной колонке (50 м × 0.2 мм) со стационарной фазой SE-30. Газом-носителем служил Н2. Анализы проводили в условиях линейного программирования температуры от 40 до 270°С со скоростью 12 град/мин.
Масс-спектры под действием электронного удара регистрировали на приборе Finigan MAT 95 XL (“Finigan”, США, 70 эВ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
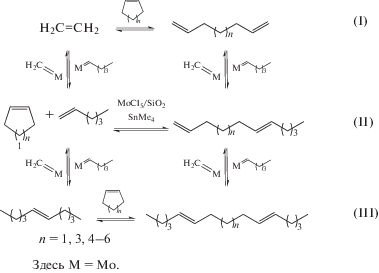
Cометатезис ЦО c гексеном-1 протекает по общей схеме 1 .
Схема 1 .
При мольном отношении ЦО : гексен-1 = 1 : 3 основными продуктами сометатезиса являются три типа диенов: с двумя концевыми связями (реакция (I)), с одной концевой связью (реакция (II)), не имеющие концевых двойных связей (реакция (III)), а также продукты гомометатезиса гексена-1 – децен-5 и этилен. В качестве критерия относительной реакционной способности ЦО в реакции сометатезиса с гексеном-1 использовали отношение массы продукта гомометатезиса – децена-5 – к суммарной массе продуктов сометатезиса. Чем выше реакционная способность ЦО, тем больше масса продуктов сометатезиса и меньше масса 5-децена в продуктах реакции и тем меньше отношение 5-децен : продукты. Оно будет зависеть от конверсии ЦО и температуры.
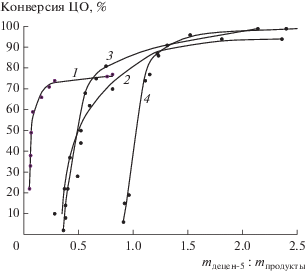
На рис. 1 приведены зависимости отношения массы 5-децена к суммарной массе продуктов сометатезиса от конверсии ЦО. Видно, что при температуре 25°С для ЦО С5–С9 с увеличением конверсии возрастает доля продукта гомометатезиса децена-5. Наибольшее количество продуктов сометатезиса получено для циклопентена (ЦП), близкие значения – для циклогептена (ЦГ) и циклооктена (ЦОК) и наименьшие – для циклононена.
Рис. 1.
Зависимость отношения массы децена-5 к суммарной массе продуктов сометатезиса от конверсии различных циклоолефинов при температуре 25°С: 1 – циклопентен, 2 – циклогептен, 3 – циклооктен, 4 – циклононен.
Следует отметить, что для циклогексена практически протекает только гомометатезис гексена-1 и конверсия циклогексена не превышает 2% (не показано). Низкие конверсии циклогексена наблюдались как при значительных мольных избытках гексена-1 по отношению к циклогексену, так и при обратном соотношении реагентов. Эта особенность объясняется высокой термодинамической стабильностью циклогексена и, как следствие, практически полным сдвигом равновесия в сторону исходного циклогексена.
При понижении температуры реакции до 5°С для всех ЦО С5–С9 увеличивается как масса продуктов сометатезиса (рис. 2), так и различие в реакционной способности. Максимальная реакционная способность наблюдается у циклопентена, средняя – у циклогептена, циклооктена и минимальная – у циклононена, т.е. с увеличением размера цикла ЦО реакционная способность падает.
Рис. 2.
Зависимость отношения массы децена-5 к суммарной массе продуктов сометатезиса от конверсии различных циклоолефинов при температуре 5°С: 1 – циклопентен, 2 – циклогептен, 3 – циклооктен, 4 – циклононен.
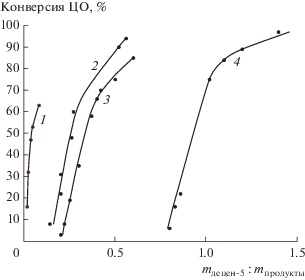
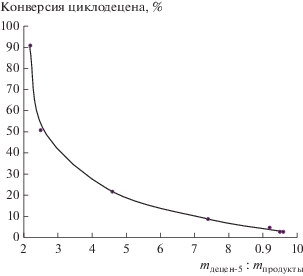
Для циклодецена (ЦД), в отличие от ЦО С5–С9, наблюдается обратная зависимость отношения массы децена-5 к суммарной массе продуктов сометатезиса от конверсии. С ростом конверсии масса децена-5 уменьшается (рис. 3). Это означает, что реакционная способность ЦД ниже, чем у гексена-1 и значительно ниже, чем у ЦО С5–С9.
Рис. 3.
Зависимость отношения массы децена-5 к суммарной массе продуктов сометатезиса от конверсии циклодецена при температуре 25°С.
Отношение массы децена-5 к суммарной массе продуктов сометатезиса
Добавление трифенилфосфина к реакционной смеси (Ph3P : Мо = 1 : 1) приводит к существенному снижению массы продуктов сометатезиса по отношению к продукту гомометатезиса – децену-5 (рис. 4). Из табл. 1 видно, что при 50%-ной конверсии циклоолефинов для всех ЦО содержание продуктов сометатезиса уменьшается (например, для циклопентена почти в 5 раз).
Рис. 4.
Зависимость отношения массы децена-5 к суммарной массе продуктов сометатезиса от конверсии различных циклоолефинов при температуре 25°С в присутствии трифенилфосфина: 1 – циклопентен, 2 – циклогептен, 3 – циклооктен.
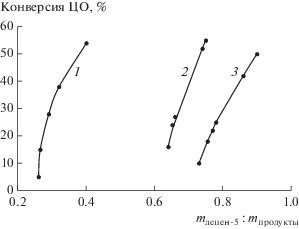
Таблица 1.
Влияние добавки Ph3P на отношение массы 5-децена к суммарной массе продуктов сометатезиса при 50%-ной конверсии ЦО при 25°С
| Циклоолефин | m5-децен : mпродукты (конверсия 50%) | |
|---|---|---|
| 25°С | 25°С, Ph3P | |
| ЦП | 0.07 | 0.32 |
| ЦГ | 0.48 | 0.66 |
| ЦОК | 0.48 | 0.90 |
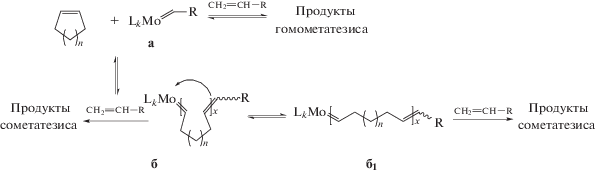
Полученные закономерности можно объяснить с помощью возможного механизма, представленного на схеме 2 (R = C4H9, Lk = SiO2, n = 1–6, х = 1).
Схема 2 .
Уменьшение реакционной способности ЦО с увеличением размера кольца ЦО связано с тем, что доля активных центров типа б, ответственных за протекание сометатезиса, уменьшается, а доля центров типа а, ответственных за гомометатезис гексена-1, как и других α-олефинов, увеличивается. Это связано с различной способностью ЦО к координации с центральным атомом Мо в зависимости от размера кольца. Она максимальна для циклопентена и минимальна для циклодецена, что, в конечном счете, определяет соотношение центров типа б, б1 и а. В случае ЦП образуется устойчивое 6-членное кольцо (пять атомов углерода и атом молибдена), а в случае ЦД – неустойчивое 11-членное, что приводит к увеличению доли активных центров типа а. Влияние Ph3P также объясняется сокращением числа центров типа б. Вхождение Ph3P в координационную сферу Мо препятствует образованию центров типа б и снижает количество продуктов сометатезиса, причем наиболее сильно для ЦП.
Список литературы
Handbook of Metathesis / Ed. Grubbs R.H. V. 2. Weinheim: Wiley-VCH, 2003.
Bykov V.I., Butenko T.A., Finkelshtein E.Sh., Henderson P.T. // J. Mol. Catal. 1994. V. 90. P. 111.
Быков В.И., Бутенко Т.А., Келбакиани Л.В., Финкельштейн Е.Ш. // Доклады РАН. 1996. Т. 349. № 2. С. 198.
Быков В.И., Бутенко Т.А., Келбакиани Л.В., Финкельштейн Е.Ш. // Изв. АН. Сер. хим. 1996. № 8. С. 2127.
Bykov V.I., Finkelshtein E.Sh. // J. Mol. Catal. 1998. V. 133. P. 17.
Bykov V.I., Butenko T.A., Petrova E.B., Finkelshtein E.Sh. // Tetrahedron. 1999. V. 55. P. 8249.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ