Кинетика и катализ, 2020, T. 61, № 2, стр. 225-234
Разложение метана на поверхности наночастиц молибдена при комнатной температуре
Е. В. Гуренцов a, *, А. В. Еремин a, Р. Н. Колотушкин a, b, Д. Н. Хмеленин c, Ю. В. Григорьев c
a ФГБУН Объединенный институт высоких температур РАН
125412 Москва, ул. Ижорская, 13, стр. 2, Россия
b ФГБОУ ВО Московский государственный технический университет им. Баумана
105005 Москва, 2-я Бауманская ул., 5, стр. 1, Россия
c ФГУ ФНИЦ “Кристаллография и фотоника” РАН
119333 Москва, Ленинский просп., 59, Россия
* E-mail: gurentsov@ihed.ras.ru
Поступила в редакцию 10.06.2019
После доработки 24.09.2019
Принята к публикации 22.10.2019
Аннотация
В настоящей работе экспериментально исследован процесс разложения метана на молибденовых наночастицах при комнатной температуре. Для синтеза молибденовых наночастиц в газовой фазе применяли ультрафиолетовый лазерный фотолиз паров Mo(CO)6 в проточном реакторе. Рабочая часть проточного реактора была оборудована кварцевыми окнами для введения излучения импульсного Nd:Yag лазера, работающим на 4-ой гармонике (266 нм) с частотой 10 Гц. В качестве несущего газа использовали метан. В результате облучения смеси метана с парами Mo(CO)6 в газовой фазе при комнатной температуре были синтезированы наночастицы с размерами 2–50 нм. Фазовый состав наночастиц включал чистый молибден, карбид молибдена Mo2C и оксид молибдена MoO3. В процессе реакции был измерен выход водорода высокочувствительным водородным анализатором ВГ-7 на основе полупроводникового металл-диэлектрического сенсора. Измеренная концентрация H2 находилась в диапазоне 5–25 миллионных долей объема (ppm) в зависимости от концентрации Mo(CO)6. На основе полученных данных обсуждается возможность разложения метана на молибденовых наночастицах при комнатной температуре.
ВВЕДЕНИЕ
Применение металлических наночастиц в различных областях науки и техники вызывает интерес к усовершенствованию методов их синтеза. Для предотвращения окисления, воздействия агрессивных сред, а также для обеспечения совместимости с биологическими материалами металлические наночастицы предлагается покрывать углеродной оболочкой [1]. Известно большое число разнообразных технологий синтеза металло-углеродных наночастиц [2–9], среди которых наибольшее распространены электродуговой метод [2–4] и метод лазерного пиролиза газообразных прекурсоров [6–8]. Одним из газофазных методов получения наночастиц является УФ-фотодиссоциация паров карбонилов металлов с последующим образованием металлических наночастиц в газовой фазе [10]. Этим способом были синтезированы наночастицы железа и молибдена, инкапсулированные в углеродную оболочку в результате фотодиссоциации паров карбонилов металлов с углеводородами [11, 12]. В работе [11] наночастицы железа в углеродной оболочке были получены путем облучения одним импульсом УФ-лазера на длине волны 266 нм смесей Fe(CO)5 + C2H2 и Fe(CO)5 + C6H6, разбавленных аргоном. С другой стороны, при УФ-лазерном воздействии на смеси толуола, 1-бутанола и метана с Fe(CO)5 наблюдалось только образование наночастиц железа без углеродной оболочки.
В работе [12] наночастицы молибдена, заключенные в углеродную оболочку, были синтезированы в условиях УФ-лазерной фотодиссоциации паров Mo(CO)6 в смесях с метаном, а также с парами ацетилена, толуола, 1-бутанола и бензола, разбавленными аргоном. Исследованные образцы наночастиц имели молибденовые ядра с примесью оксидов и карбидов молибдена, окруженные аморфным углеродным материалом. Аморфный углерод был обнаружен во всех образцах независимо от типа используемого углеводорода и его мольной доли в смеси. Таким образом, было установлено, что одного импульса УФ-лазера с энергией до 100 мДж было достаточно для диссоциации молекул Мо(СО)6, формирования наночастиц молибдена размерами 2–4 нм (270–2000 атомов) и последующего разложения углеводородов на поверхности этих наночастиц.
Необходимо отметить, что в работах [11, 12] металло-углеродные наночастицы были синтезированы при комнатной температуре. Однако в литературе нет сведений о каталитическом разложении углеводородов при комнатной температуре с образованием твердого углерода [13–15]. Известно, что УФ-лазерное излучение эффективно поглощается молекулами Fe(CO)5 или Mo(CO)6 [10], однако поглощение молекул углеводородов на длине волны 266 нм достаточно слабое и не может приводить к образованию твердого углерода из газовой фазы [16].
Целью настоящей работы являлась более подробное изучение процесса каталитического разложения метана на поверхности наночастиц молибдена с привлечением новых данных по выходу газообразного водорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
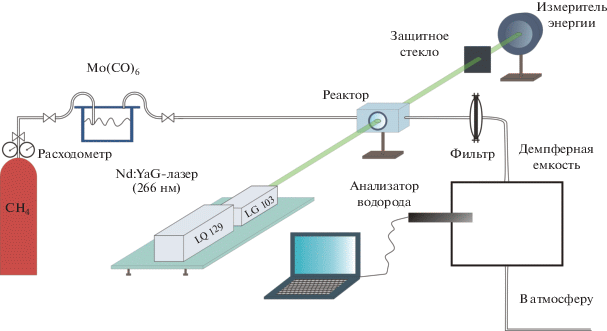
Эксперименты проводили в проточном реакторе из нержавеющей стали с расходом газовой смеси 3 л/мин. Схема экспериментальной установки представлена на рис. 1. Газовая смесь состояла из газа-носителя – метана (CH4 ≥ 99.9%) – и паров карбонила молибдена, которыми насыщался метан, проходя через емкость с порошком Mo(CO)6. Поскольку давление насыщенных паров Mo(CO)6 в условиях эксперимента было чрезвычайно низким, их давление определяли с помощью измерения температуры в помещении по известным данным [17]. При температуре в помещении 23°С давление паров Mo(CO)6 составляло 156 мкбар. Для фотодиссоциации паров Mo(CO)6 был использован импульсный Nd:YaG-лазер LQ-129 (“Solar laser systems”, Беларусь), работающий на длине волны 266 нм (длительность импульса 15 нс). Лазерное облучение газа и измерение энергии в лазерном импульсе осуществляли через пару параллельных кварцевых окон, установленных в рабочей камере проточного реактора. При проведении экспериментов газ в реактор подавали в течение 1 мин. За это время смесь облучали 600 лазерными импульсами при частоте 10 Гц со средней энергией в импульсе 30 мДж. Интервал между двумя импульсами лазера был такой, чтобы облученная часть газа успевала смещаться на расстояние большее, чем диаметр лазерного луча, для предотвращения нагрева конденсированных наночастиц молибдена.
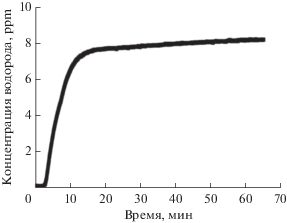
Предполагалось, что, как и в работе [12], в результате экспериментов синтезировались металло-углеродные наночастицы. Выход водорода в этом процессе измеряли с помощью водородного анализатора ВГ-7, изготовленного Национальным исследовательским ядерным университетом МИФИ. Этот анализатор при высокой чувствительности к концентрации водорода (до 0.1 миллионной объемной доли, ppm) обладает большой инерционностью. Для определения концентрации водорода использовали демпферную емкость 5 л, изначально наполненную воздухом при давлении 1 атм, так как водородный анализатор был изготовлен и откалиброван для измерений в водородо-воздушных смесях. При пропускании через реактор газового потока содержание водорода увеличивалось до максимального значения в течение примерно 1 ч (рис. 2). Было обнаружено, что относительная концентрация водорода при работе реактора в течение 1 мин без лазерного облучения смеси метана с парами Mo(CO)6 и, следовательно, без присутствия наночастиц молибдена, составляла 2.3 ppm. При стандартном давлении 1000 мбар и комнатной температуре 23°С это значение соответствуют общей концентрации водорода: 5.5 × 1013 см–3. При лазерном облучении той же смеси в течение одной минуты выход водорода, за вычетом уровня его концентрации в исходной смеси, составил 5.9 ppm (1.4 × 1014 см–3). При нагреве зоны реактора до 40°С он увеличивался до 25 ppm, что, вероятнее всего, связано с повышением давления паров Mo(CO)6, и соответственно, с бóльшим выходом наночастиц молибдена при лазерном облучении смеси.
Рис. 2.
Показания датчика ВГ-7 при измерении в демпферной емкости после УФ-облучения в проточном реакторе смеси Mo(CO)6 и метана при 23°С.
Для анализа состава синтезируемых наноматериалов применяли метод просвечивающей электронной микроскопии (ПЭМ). Образцы собирали на специальные медные сетки для электронного микроскопа, покрытые дырчатым углеродным слоем. Сетки устанавливали перпендикулярно газовому потоку после рабочего участка реактора на специальном фильтрующем элементе. Образцы наночастиц анализировали на просвечивающем электронном микроскопе Osiris (“FEI Company”, США) с ускоряющим напряжением 200 кВ во ФНИЦ “Кристаллографии и фотоники” РАН. Микрофотографии наночастиц с различным разрешением использовали для определения размеров наночастиц, а также для оценки объемного соотношения молибдена и углерода в образцах. Данные о фазовом и элементном составе наноматериалов получали методом микродифракции электронов и методом энергодисперсионной рентгеновской спектроскопии (ЭДС) соответственно на этом же электронном микроскопе. Кроме этого, на нем же проводили визуализацию пространственного распределения элементов в образце методом сканирующе-просвечивающей электронной микроскопии с широкоугловым детектором темного поля (HAADF-STEM).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 3 приведена микрофотография синтезированных наноматериалов в проточном реакторе при облучении смеси CH4 + Mo(CO)6 с помощью 600 импульсов УФ-лазера. На микрофотографии можно видеть цепочки темных наночастиц со средним размером около 10–50 нм, окруженные и соединенные между собой более светлым материалом. Наряду с крупными частицами 10–50 нм в диаметре были обнаружены более мелкие частицы с размерами 1.5–2.5 нм.
Рис. 3.
Микрофотографии наноматериалов, синтезированных в смеси метана с парами Mo(CO)6 с помощью 600 лазерных импульсов с частотой повторения 10 Гц.

Для выяснения состава синтезированных наноматериалов был проведен анализ микродифракционных картин наночастиц в образцах (рис. 4). Установлено, что практически все крупные ядра наночастиц являются кристаллическими, о чем свидетельствуют кольцевые рефлексы на электронограмме. Анализ электронограмм показывает наличие следующих межплоскостных расстояний (Å): 2.54 – MoO3; 2.36 – Mo2C; 2.20 – Mo; 1.73 – MoO3; 1.56 – Mo; 1.48 – Mo2C; 1.31 – Mo2C; 1.27 – Mo; 1.1 – Mo. Как видно из этих данных, ядра синтезированных материалов состоят из чистого молибдена, карбида молибдена и оксида молибдена. Mo2C – наиболее распространенная фаза карбида молибдена, которая стабильна при низких температурах и характеризуется плотноупакованной гексагональной кристаллической структурой с атомами углерода, расположенными в имеющихся октаэдрических пустотах.
Рис. 4.
Электронограмма образцов наночастиц, синтезированных при УФ-облучении смеси метана с парами Mo(CO)6.

Кроме этого образцы наночастиц анализировали с помощью ЭДС и HAADF-STEM. В спектре ЭДС (не показано на рисунках) были обнаружены пики элементов: Mo, C, O, Cu и Si. Атомы Мо и С, и О являются компонентами синтезированных наночастиц. Медь и кремний – материалы, использующиеся при изготовлении решеток для электронной микроскопии. Карты распределения элементарных атомов Мо, С и О в синтезированных наночастицах (4 изображения одного и того же места в образце) представлены на рис. 5. На рис. 5а приведено изображение образца молибдено-углеродных наночастиц, полученное методом HAADF-STEM. Распределение атомов Мо (рис. 5б) отражает структуру расположения ядер в агрегатах наночастиц. Локализация атомов углерода (рис. 5в) совпадает с положением агрегатов наночастиц, представленных на изображении HAADF-STEM, и указывает на окружающий ядра молибдена углеродный аморфный материал. Распределение атомов кислорода (рис. 5г) перекрывает область локализации атомов молибдена, но не превышает площадь распространения атомов углерода. Можно предположить, что кислород является как компонентом ядер наночастиц, частично состоящих из оксидов молибдена, так и адсорбирован в молекулярном виде в объеме углеродного материала. Наличие оксидов металла в наночастицах может объясняться их частичным окислением при длительном нахождении в воздушной среде, несмотря на наличие углеродной оболочки [11, 12].
Рис. 5.
Изображение HAADF-STEM (а) и соответствующие карты распределения атомов Mo (б), C (в) и O (г) в образцах наноматериалов, синтезированных при УФ-облучении смеси метана с парами Mo(CO)6.

Из данных, полученных методом электронной микроскопии, следует, что на поверхности наночастиц присутствует аморфный углерод, а часть углерода обнаруживается в ядрах наночастиц в виде карбида молибдена Mo2C. Выделяющийся в процессе эксперимента газообразный водород может быть зарегистрирован количественно.
Образование относительно большого количества аморфного углеродного материала в синтезированных образцах, объясняется воздействием электронного пучка при анализе на просвечивающем электронном микроскопе. Было обнаружено, что молибденовые наночастицы достаточно быстро покрываются углеродом непосредственно при воздействии электронного пучка, и это происходит тем скорее, чем больше время воздействия и ускоряющее напряжение электронов. Источником углеродного материала является слой, напыленный на решетки для электронного микроскопа. К сожалению, решетки с другим покрытием, например, кремниевым, оказались неподходящими для проведения анализа на используемом в настоящей работе приборе. На рис. 6 показаны микрофотографии одних и тех же наночастиц молибдена, в разной степени покрытых углеродным материалом вследствие воздействия электронного пучка. Видно, что на левой микрофотографии слой углерода вокруг наночастиц меньше, чем справа, так как она сделана на 10 с раньше.
Рис. 6.
Зарастание углеродом наночастиц, синтезированных при УФ-облучении смеси метана с парами Mo(CO)6 под воздействием электронного пучка. Разница во времени получения левого и правого снимков – 10 с.

При этом необходимо подчеркнуть, что разложение CH4 на твердый углерод и водород в результате реакции
при комнатной температуре с термодинамической точки зрения невозможно [18] (свободная энергия Гиббса данной реакции, рассчитанная как разность значений энергий Гиббса продуктов реакции и исходных веществ, при комнатной температуре положительна и равна $\Delta G_{{298}}^{f}$ = = 50.83 кДж/моль). Для осуществления возможности протекания реакции (I) необходимо значительное повышение температуры, что, в частности, могло бы происходить при нагреве наночастиц повторными лазерными импульсами. Однако в условиях проточного реактора какого-либо вторичного нагрева сформированных наночастиц молибдена не было вследствие их смещения вниз по потоку за время между двумя соседними лазерными импульсами. Кроме того, какое-либо воздействие лазерного излучения на молекулу метана также маловероятно, что подтверждает отсутствие полос поглощения в районе 266 нм [16]. Тем не менее, для того чтобы полностью исключить фактор нагрева наночастиц молибдена в условиях настоящих экспериментов повторными лазерными импульсами в проточном реакторе, были проведены эксперименты с введением метана значительно ниже по потоку, вне рабочей части, где происходила фотодиссоциация Mo(CO)6. Пары Mo(CO)6 в этом случае переносились аргоном с расходом 1.5 л/мин. Суммарный расход аргона и метана оставался равным 3 л/мин. Полученные результаты свидетельствуют, при этих условиях выход водорода был таким же, что и при использовании метана в качестве несущего газа в рабочей части реактора.Необходимо отметить, что прямое каталитическое разложение метана на водород и углеродный материал достаточно эффективно протекает только при температурах 500–1000°С [19–23]. Основными катализаторами являются наночастицы Fe, Ni, Co и их сплавы, нанесенные на керамические носители [19, 21–23], а также технический углерод [20]. В случае металлических катализаторов общепринятым является так называемый механизм “карбидного цикла” роста углеродного материала [24]. На определенной кристаллографической поверхности микрокристалла металлической частицы углеводороды адсорбируются и разлагаются через промежуточную стадию образования неустойчивых карбидоподобных соединений. Выделяющиеся атомы углерода растворяются в металлической частице и путем диффузионного переноса через “тело” металлической частицы выносятся на другую ее грань. На ней углерод выделяется в самостоятельную фазу графита. Структура этой фазы эпитаксильно формируется под влиянием особенностей этой грани.
Таким образом, вместо термодинамически запрещенной реакции (I) можно предположить взаимодействие метана и молибдена с образованием карбида молибдена, что также должно приводить к выходу газообразного водорода:
(II)
${\text{C}}{{{\text{H}}}_{4}} + 2{\text{Mo}} \to {\text{M}}{{{\text{o}}}_{2}}{\text{C}}\left( {{\text{тв}}} \right) + 2{{{\text{H}}}_{2}}\left( {{\text{газ}}} \right){\text{.}}$По разным данным, величина свободной энергии Гиббса образования карбида молибдена Mo2C по реакции (II) при комнатных температурах составляет ‒52.2 [25], –51.4 [26] и –65.8 кДж/моль [27], что делает ее протекание термодинамически возможным. Преодоление энергетического барьера реакции можно объяснить высокой активностью свободных (без подложки) молибденовых наночастиц с размерами около 2 нм, находящихся в газовой фазе. При таких размерах количество атомов в частице составляет ~270. Таким образом, бóльшая часть атомов находится на поверхности, и такая наночастица обладает высокой поверхностной энергией, которая позволяет преодолевать барьер реакции распада метана и образования карбида молибдена. Общий низкий уровень превращения углеводородов в водород в наших экспериментах может быть объяснен малым количеством наночастиц молибдена относительно количества метана и условиями комнатной температуры. Низкотемпературные условия, как известно, снижают скорости химических реакций по закону Аррениуса.
Необходимо отметить, что в отличие от молибдена формирование карбидов железа, никеля или кобальта, часто рассматриваемых как катализаторы прямого разложения метана, термодинамически невозможно при комнатной температуре [28, 29].
Количество конденсированного молибдена, образовавшегося в течение времени эксперимента, можно найти, найти зная число лазерных импульсов, величину измеренной энергии лазера и сечение поглощения молекулы Mo(CO)6 на длине волны 266 нм – 3 × 10–17 см2 [30]. Как было указано выше, концентрацию молекул Mo(CO)6 определяли на основании измерений температуры в помещении по данным о давлении насыщенных паров [17]. Согласно закону Ламберта–Бера соотношение прошедшей через поглощающую среду и падающей энергии лазера можно вычислить как:
(1)
${E \mathord{\left/ {\vphantom {E {{{E}_{0}}}}} \right. \kern-0em} {{{E}_{0}}}} = {\text{exp}}(--С\sigma l){\text{ }},$В соответствии с реакцией (II) 100% превращение молибдена в карбид приведет к такому же мольному выходу газообразного водорода, собранному в демпферной емкости. В эксперименте выход водорода составил 6 ppm (в объеме 5 л), что соответствует количеству 1.46 × 10–6 моль. Таким образом, измеренная величина выхода водорода совпадает по порядку со значением, рассчитанным по реакции (II). Точное совпадение возможно в предположении того, что в карбид превращается 80% конденсированного молибдена при его взаимодействии с метаном.
Если образование зарегистрированного количества водорода действительно связано с разложением метана на поверхности наночастиц молибдена, то при увеличении их количества выход водорода должен расти. Это предположение было подтверждено экспериментально: повышение температуры в зоне реактора до 40°С приводило к возрастанию давления паров Mo(CO)6 и, соответственно, к увеличению количества конденсированного молибдена. При этом выход водорода повышался до 25 ppm.
Кроме реакций (I) и (II) была рассмотрена вероятность протекания реакций образования высших углеводородов (этан, пентан, пропан, бутан) с выделением водорода из метана на молибденовом катализаторе. Все они оказались термодинамически невозможными при комнатной температуре. Единственной термодинамически разрешенной является реакция распада молекул СО на наночастицах молибдена, которые образуются при фотодиссоциации Mo(CO)6:
(III)
$3{\text{CO}} + 7{\text{Mo}} \to 3{\text{M}}{{{\text{o}}}_{2}}{\text{C}}({\text{тв}}) + {\text{Mo}}{{{\text{O}}}_{3}}({\text{тв}}).$Свободная энергия Гиббса реакции (III) составляет при комнатной температуре около –413 кДж/моль. Однако эта реакция не объясняет наблюдаемый выход водорода в эксперименте.
Еще одной возможной причиной выхода водорода могло бы явиться наличие паров воды в используемых газах. Массовая концентрация водяных паров в метане равна 0.03 г/м2, что соответствует объемной доле водяных паров 0.0039% (39 ppm), т.е. выше, чем наблюдаемый выход водорода. Каталитическая диссоциация молекул воды по реакции:
(IV)
$2{{{\text{Н}}}_{2}}{\text{О}}\left( {{\text{газ}}} \right) \to 2{{{\text{Н}}}_{2}}\left( {{\text{газ}}} \right) + {{{\text{О}}}_{2}}\left( {{\text{газ}}} \right)$Однако водород может выделяться по реакции:
(V)
$2{{{\text{Н}}}_{2}}{\text{О}}\left( {{\text{газ}}} \right) + {\text{Mo}}\left( {{\text{тв}}} \right) \to {\text{Мо}}{{{\text{О}}}_{2}}\left( {{\text{тв}}} \right) + 2{{{\text{Н}}}_{2}}\left( {{\text{газ}}} \right).$Образование других оксидов молибдена невозможно из-за положительных значений энергии Гиббса. Например, для реакции образования МоО3:
(VI)
$3{{{\text{Н}}}_{2}}{\text{О}}\left( {{\text{газ}}} \right) + {\text{Мо}}\left( {{\text{тв}}} \right) \to {\text{Мо}}{{{\text{О}}}_{3}}\left( {{\text{тв}}} \right) + 3{{{\text{Н}}}_{2}}\left( {{\text{газ}}} \right)~$Другим вариантом механизма образования водорода с наблюдаемым в эксперименте выходом могла явиться диссоциативная адсорбции воды на поверхности наночастиц молибдена:
(VII)
${{{\text{Н}}}_{2}}{\text{О}}\left( {\text{г}} \right) \to {{{\text{Н}}}_{2}}{\text{О}}\left( {{\text{ад}}} \right),$(VIII)
${{{\text{Н}}}_{2}}{\text{О}}\left( {{\text{ад}}} \right) \to {\text{ОН}}\left( {{\text{ад}}} \right) + {\text{Н}}({\text{ад)}}$(IX)
${\text{Н}}\left( {{\text{ад}}} \right) + {\text{Н}}\left( {{\text{ад}}} \right) \to {{{\text{Н}}}_{2}}\left( {{\text{ад}}} \right)$(X)
${{{\text{Н}}}_{2}}\left( {{\text{ад}}} \right) \to {{{\text{Н}}}_{2}}\left( {\text{г}} \right).$(XI)
${{{\text{Н}}}_{2}}{\text{О}}\left( {\text{г}} \right) \to 2{\text{ОН}}\left( {{\text{ад}}} \right) + {{{\text{Н}}}_{2}}\left( {\text{г}} \right).$Для того чтобы реакция (XI) была термодинамически возможна при комнатной температуре, энергия Гиббса образования адсорбированного радикала ОН должна быть меньше, чем у молекулы воды (–223 кДж/моль) в газовой фазе. С нашей точки зрения это маловероятно, так как согласно литературным данным энергия Гиббса адсорбированного радикала ОН на платине составляет порядка –58 кДж/моль [32].
Тем не менее, для анализа возможного влияния водяных паров на выход водорода при взаимодействии с наночастицами молибдена была проведена дополнительная серия экспериментов. В качестве несущего газа использовали азот технический чистотой 99.6% с паспортным объемным содержанием водяных паров 0.009% (90 ppm). Для введения дополнительного количества воды азот барботировали через слой дистиллированной воды, залитой в отдельную герметичную емкость. Опыты проводили при температуре 21.4°С, что соответствует давлению насыщенных паров воды 2.5 кПа (0.025% в азоте или 250 ppm). Азот, насыщенный парами воды, проходил через емкость с парами Mo(CO)6 и попадал в камеру с кварцевыми окнами для ввода лазерного УФ-излучения. Режим течения в проточном реакторе был тем же, что и в опытах с чистым метаном: 3 л/мин в течение 1 мин. Сначала измеряли выход водорода датчиком, расположенным в буферной емкости, без воздействия лазера. Это значение составило 0.3 ppm и соответствовало примесной концентрации водорода в газе. В опытах, проведенных в аналогичных условиях, но с воздействием 600 УФ-лазерных импульсов со средней энергией в импульсе 30 мДж в течение 1 мин и, соответственно, с образованием наночастиц молибдена и паров воды, было получено аналогичное значение выхода водорода – 0.3 ppm. Таким образом, в наших экспериментах выхода водорода при взаимодействии паров воды с молибденовыми наночастицами зарегистрировано не было. Косвенным свидетельством того, что взаимодействия паров воды с наночастицами молибдена при комнатной температуре не происходило, является отсутствие на электронограммах образцов микродифракционных колец, соответствующих оксиду молибдена МоО2; в то же время полученные данные указывали на существование оксида МоО3. При этом, как было показано выше, взаимодействие паров воды с наночастицами молибдена с образованием МоО3 невозможно при комнатной температуре.
Еще одним возможным путем образования водорода могла бы являться диссоциативная адсорбция метана на поверхности наночастиц молибдена с выделением газообразного водорода.
(XII)
${\text{С}}{{{\text{Н}}}_{4}}\left( {{\text{ад}}} \right) \to {\text{C}}{{{\text{H}}}_{3}}\left( {{\text{ад}}} \right) + {\text{H}}\left( {{\text{ад}}} \right),$(XII)
${\text{H}}\left( {{\text{ад}}} \right) + {\text{H}}\left( {{\text{ад}}} \right) \to {{{\text{H}}}_{2}}\left( {{\text{ад}}} \right),$(XIV)
${{{\text{Н}}}_{2}}\left( {{\text{ад}}} \right) \to {{{\text{Н}}}_{2}}\left( {\text{г}} \right).$Для того чтобы первая реакция была термодинамически возможной при комнатной температуре, энергия Гиббса образования адсорбированного СН3 должна по абсолютной величине превышать 180 кДж/моль (в то время как энергия образования свободного радикала СН3 при комнатной температуре составляет –19.6 кДж/моль) [33]. Это маловероятно, учитывая, что энергия Гиббса образования неадсорбированной стабильной молекулы метана равна –50.82 при Ткомн. Действительно, согласно данным работы [34] вероятность диссоциативной адсорбции метана на поверхности платины при температуре 400 К – примерно 10–8 и, соответственно, она по крайней мере на порядок меньше при температурах 300 К. Это связано с относительно высокой энергией активации этого процесса, составляющей около 60 кДж/моль. Похожие данные были получены в более позднем исследовании [35] при изучении диссоциативной адсорбции метана на кристаллическом никеле.
Таким образом, после рассмотрения всех вышеперечисленных механизмов можно утверждать, что наиболее вероятным объяснением выхода водорода в исследуемых условиях является взаимодействие метана с наночастицами молибдена с образованием карбида молибдена Mo2C по механизму “карбидного цикла” [24].
ЗАКЛЮЧЕНИЕ
Наночастицы, состоящие из молибдена, карбида молибдена и оксида молибдена, были синтезированы в проточном реакторе методом лазерной фотодиссоциации газообразных прекурсоров. Источником атомов молибдена были пары Mo(CO)6, а в источником углерода – газообразный метан. Обнаружено, что измеренная концентрация молекулярного водорода, образующегося при разложении метана на поверхности наночастиц молибдена, находится в диапазоне 5–25 ppm в зависимости от температуры в зоне реактора (23–40°С). Основной результат настоящего исследования – экспериментальное подтверждение разложения метана на молибденовых наночастицах с образованием карбида молибдена и водорода при комнатной температуре. Полученные данные показывают необходимость учета выхода водорода при контакте углеводородов с металлическими аэрозолями, что может, например, влиять на кинетику процессов воспламенения взрывоопасных смесей.
Список литературы
Si P.Z., Zhang Z.D., Geng D.Y., You C.Y., Zhao X.G., Zhang W.S. // Carbon. 2003. V. 41. P. 247.
Scott J.H.J., Majetich S.A. // Phys. Rev. B. 1995. V. 52. P. 12 564.
Dong X.L., Zhang Z.D., Xiao Q.F., Zhao X.G., Chuang Y.C., Jin S.R., Sun W.M., Li Z.J., Zheng Z.X., Yang H. // J. Mater. Sci. 1998. V. 33. P. 1915.
Zhang H. // J. Phys. Chem. Solids. 1999. V. 60. P. 1845.
Wang Z.H., Zhang Z.D., Choi C.J., Kim B.K. // J. Alloys. Comp. 2003. V. 361. P. 289.
David B., Pizúrova N., Schneeweiss O., Bezdicka P., Morjan I., Alexandrescu R. // J. Alloys Comp. 2004. V. 378. P. 112.
Díaz L., Santos M., Ballesteros C., Marysko M., Pola J. // J. Mater. Chem. 2005. V. 15. P. 4311.
Jager C., Mutschke H., Huisken F., Alexandrescu R., Morjan I., Dumitrache F., Bariega R., Soare I., David B., Schneeweiss O. // Appl. Phys. A. 2006. V. 85. P. 53.
Ning L., Xiaojie L., Xiaohong W., Honghao Y., Chengjiao Z., Haitao W. // Carbon. 2010. V. 48. P. 3858.
Гуренцов Е.В. // Кинетика и катализ. 2017. Т. 58. № 3. С. 241.
Eremin A.V., Gurentsov E.V., Musikhin S.A. // Mater. Res. Express. 2016. V. 3. № 10. P. 105041.
Eremin A.V., Gurentsov E.V., Kolotushkin R.N., Musikhin S.A. // Mater. Res. Bull. 2018. V. 103. P. 186.
Navarro R.M., Pena M.A., Fierro J.L.G. // Chem. Rev. 2007. V. 107. P. 3952.
Dupuis A.C. // Progress Mater. Sci. 2005. V. 50. P. 929.
Abbas H.F., Wan Daud W.M.A. // Int. J. Hydrogen Energy. 2010. V. 35. P. 1160.
Okabe H. Photochemistry of small molecules. New York: John Wiley & Sons, 1978. P. 298.
Ohta T., Cicoira F., Doppelt P., Beitone L., Hoffmann P. // Chem. Vapor Deposition. 2001. V. 7. P. 33.
Price G. Thermodynamics of chemical processes. Oxford: Oxford science publications, 1998. P. 96.
Torres D., de Llobet S., Pinilla J.L., L’azaro M.J., Suelves I., Moliner R. // J. Natur. Gas Chem. 2012. V. 21. P. 367.
Muradov N. // Int. J. Hydrogen Energy. 2001. V. 26. P. 1165.
Lua A.C., Wang H.Y. // Appl. Catal. B: Env. 2013. V. 132–133. P. 469.
Ibrahim A.A., Fakeeha A.H., Al-Fatesh A.S., Abasaeed A.E., Khan W.U. // Int. J. Hydrogen Energy. 2015. V. 40. P. 7593.
Avdeeva L.B., Reshetenko T.V., Ismagilov Z.R., Likholobov V.A. // Appl. Catal. A: Gen. 2002. V. 228. P. 53.
Чесноков В.В., Буянов Р.А. // Успехи химии. 2000. V. 69. №. 7. С. 675.
Solbakken A., Emmett P.H. // J. Am. Chem. Soc. 1969. V. 91. P. 31.
Gleiser M., Chipman J. // J. Phys. Chem. 1963. V. 67. P. 1539.
Iwai T., Takahashi I., Handa M. // Metallurgical Trans. A. 1986. V. 17A. P. 2031.
Lee M.-C., Simkovich G. // Metallurgical Trans. A. 1988. V. 19A. P. 2115.
Shatynski S.R. // Oxidation of metals. 1979. V. 13. № 2. P.105.
Buntin S.A., Cavanagh R.R., Richter L.J., King D.S. // J. Chem. Phys. 1991. V. 94. № 12. P. 7937.
Venkataraman B., Hou H., Zhang Z., Chen S., Bandukwalla G., Vernon M. // J. Chem. Phys. 1990. V. 92. P. 5338.
Kristofferson H.H., Vegge T., Hansen H. A. // Chem. Sci. 2018. V. 9. P. 6912.
Ван Кревелен Д.В. Свойства и химическое строение полимеров. Москва: Химия, 1976. 114 с.
Sun Y.-K., Weinberg W.H. // J. Vac. Sci. Technol. A. 1990. V. 8. P. 244.
Abbott H.L., Bukoski A., Kavulak D.F., Harrison I. // J. Chem. Phys. 2003. V. 119. P. 6407.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ