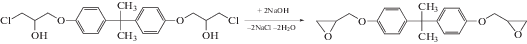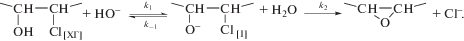Кинетика и катализ, 2020, T. 61, № 2, стр. 242-245
Кинетика реакции дегидрохлорирования хлоргидриновых эфиров бисфенола а
М. Н. Махин a, *, М. С. Клебанов a
a ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский просп., 29, Россия
* E-mail: Makhin.Maxim@gmail.com
Поступила в редакцию 23.06.2019
После доработки 02.08.2019
Принята к публикации 20.09.2019
Аннотация
Представлены результаты исследования кинетики реакции дегидрохлорирования хлоргидриновых эфиров бисфенола А в процессе получения эпоксидной смолы марки ЭД-20. Реакция была изучена в среде растворителя метилизобутилкетона. Определены вид кинетического уравнения и энергия активации.
ВВЕДЕНИЕ
В настоящее время в мире производится более 3 млн тонн эпоксидных смол (ЭС), которые широко применяются во многих областях промышленности благодаря возможности создания различных композиций с уникальными технологическими и физико-механическими свойствами – термо- и влагостойкость, механическая прочность и высокая адгезия [1–6]. Промышленным способом получения низкомолекулярных ЭС на основе бисфенола А (DGEBA) является его взаимодействие с эпихлоргидрином и раствором щелочи. Протекающие реакции можно представить уравнениями (I), (II):
Под действием щелочного катализатора происходит присоединение молекул эпихлоргидрина к гидроксильным группам бисфенола А. Дальнейшее взаимодействие с щелочным агентом приводит к образованию новых эпоксидных групп [2, 6–9]. Согласно требованиям, предъявляемым к качеству ЭС, содержание остаточного хлора хлоргидриновых групп (ХГ) в товарной смоле, не должно превышать 0.1%.
Побочной реакцией при производстве ЭС является омыление эпихлоргидрина, который берется в большом избытке по отношению к бисфенолу А, в глицерин. Особенно в заметной степени она протекает на конечных стадиях процесса, когда концентрация хлоргидриновых групп мала. Поэтому в промышленности дегидрохлорирование осуществляют в 2 стадии [6, 8–10]. Сначала NaOH добавляют в количестве 0.7–0.9 от стехиометрически необходимого [8, 9]. Это приводит к тому, что содержание хлора в образующейся смеси хлоргидриновых эфиров (ХГЭ) снижается до 1–1.5%. Затем избыток эпихлоргидрина отгоняют, ХГЭ растворяют в нейтральном растворителе и проводят дополнительное дегидрохлорирование до получения требуемого содержания остаточного хлора. Такой метод позволяет существенно снизить долю побочной реакции и, следовательно, расход эпихлоргидрина. Выбор растворителя в этом случае производится путем анализа многих факторов, таких как стоимость растворителя и его доступность на рынке; отсутствие функциональных групп, вступающих в реакцию с реагентами; ограниченная растворимость в воде; относительно низкие плотность и температура кипения; высокая скорость целевой реакции; низкая скорость образования нежелательных полимеров и др. В качестве нейтрального растворителя в промышленности используется толуол [7–9], однако в патентной литературе предлагаются и другие [8], в частности, метилизобутилкетон (МИБК). С учетом перечисленных критериев для выбора оптимального растворителя применение МИБК выглядит более предпочтительным, однако закономерности процесса дегидрохлорирования в присутствии МИБК не изучены.
Целью исследований было исследование кинетических особенностей реакции дегидрохлорирования хлоргидриновых эфиров бисфенола А в среде метилизобутилкетона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по изучению кинетики реакции дегидрохлорирования ХГЭ проводили в периодическом режиме в стеклянном реакторе объемом 200 мл, снабженном мешалкой, обратным холодильником, термопарой и системой обогрева. Скорость вращения мешалки составляла 1000 об/мин, что обеспечивало отсутствие градиента концентраций реагентов и температуры во всем реакционном объеме. Температуру в реакторе измеряли с точностью ±0.1°С. Смесь ХГЭ с содержанием хлора 1 мас. % была получена по известной технологии [6–9]. Другие реагенты и растворители были марки ХЧ. Навеску ХГЭ и растворителя определенного состава загружали в реактор и нагревали до заданной температуры. Реакцию проводили при стехиометрическом соотношении хлоргидринового эфира и щелочи. Для этого в реакционную смесь добавляли рассчитанное количество NaOH в виде раствора определенной концентрации. Использовали 20–50 мас. % растворы NaOH для изменения концентрации воды в реакционной смеси, объем которой фиксировали для расчета точных начальных концентраций всех реагентов. Отбираемые в ходе эксперимента пробы промывали водой для удаления NaOH и NaCl, затем из органической фазы выпаривали растворитель. Полученный продукт анализировали на содержание легкогидролизуемого хлора по методике ASTM D 1726-03.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всем исследованном интервале температур и концентраций реакция описывается кинетическим уравнением второго порядка, которое при стехиометрическом соотношении реагентов может быть преобразовано:
(1)
$ - \frac{{{\text{d}}C}}{{{\text{d}}\tau }} = {{k}_{{{\text{набл}}}}}{{C}_{{{\text{ХГ}}}}}{{C}_{{{\text{NaOH}}}}} = {{k}_{{{\text{набл}}}}}{{C}^{2}},$При этом в условиях экспериментов из-за взаимной частичной растворимости МИБК и воды реакция протекает в гомогенных условиях. Если выразить концентрацию реагентов через степень превращения X, то после интегрирования уравнение (1) принимает следующий вид:
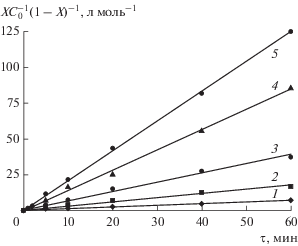
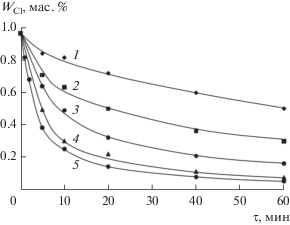
Для изучения кинетики дегидрохлорирования ХГЭ были проведены эксперименты в интервале температур от 25 до 80°С (рис. 1) в смеси 50% ХГЭ + 50% МИБК. Математическая обработка полученных данных с помощью уравнения (2) позволила определить наблюдаемые константы скорости реакции (рис. 2).
Рис. 1.
Зависимость содержания хлора в ХГЭ от времени реакции при разных температурах: 1 – 25; 2 – 40; 3 – 50; 4 – 60; 5 – 80°С.
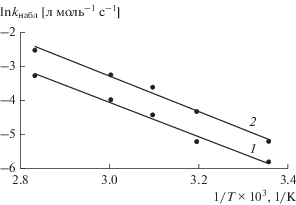
Температурные зависимости констант скорости реакции в координатах Аррениуса (рис. 3) позволили определить энергию активации процесса, которая составляет 41 850 ± 2000 Дж/моль. Столь низкая энергия активации свидетельствует об участии ионных частиц, а именно гидроксил-иона.
Механизм процесса дегидрохлорирования ХГЭ можно представить следующей схемой [11]:
Тогда наблюдаемая константа скорости будет иметь вид:
(3)
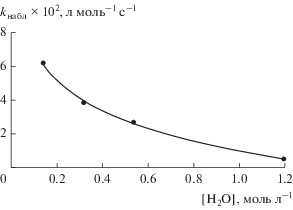
${{k}_{{{\text{набл}}}}} = \frac{{{{k}_{1}}{{k}_{2}}}}{{{{k}_{{ - 1}}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} + {{k}_{2}}}}.$О соотношении констант скоростей элементарных стадий можно судить по зависимости kнабл. от концентрации воды. При условии k2 $ \gg $ k–1 наблюдаемая константа скорости kнабл = k1 и не зависит от концентрации воды. Если k–1 $ \gg $ k2 или при равенстве ${{k}_{{ - 1}}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = k2 зависимость kнабл от ${{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ будет иметь характер гиперболы. Анализ результатов экспериментов с изменением концентрации воды (рис. 4) показал существенное снижение kнабл с ростом ${{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, что исключает условие k2 $ \gg $ k–1.
Рис. 4.
Зависимость наблюдаемой константы скорости реакции дегидрохлорирования ХГЭ от концентрации воды при 60°С (25% ХГЭ + 75% МИБК).
Определить каждую из констант в уравнении (3) представляется довольно трудоемкой задачей, однако математическая обработка полученных данных в исследованном интервале температур и концентраций позволила получить эмпирическое уравнение, которое адекватно описывает изменение наблюдаемой константы скорости реакции:
(4)
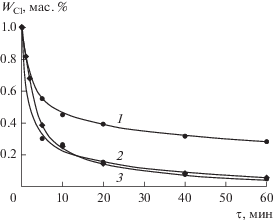
${{k}_{{{\text{набл}}}}} = \frac{{6.87 \times {{{10}}^{4}}}}{{1.15{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} + 0.14}}{{{\text{e}}}^{{ - \frac{{_{{41{\kern 1pt} 850 \pm 1000}}}}{{RT}}}}}.$Реакция дегидрохлорирования при использовании в качестве растворителя толуола (ТЛ) не описывается ни кинетическим уравнением второго порядка, ни каким-либо другим кинетическим уравнением гомогенной химической реакции. Данный факт обусловлен тем, что толуол и вода взаимно нерастворимы, и реакция протекает на границе частиц эмульсии. Это подтверждается экспериментом, в котором вместо ТЛ применялась его смесь с этанолом (ЭТ). Скорость реакции значительно возрастает (рис. 5) по двум причинам: 1) добавление в реакционную смесь полярного растворителя и 2) ее полная гомогенизация. В результате становится возможным определение наблюдаемой константы скорости реакции с помощью уравнения (4). Численные значения констант при проведении реакции в МИБК и смеси ТЛ + ЭТ совпадают в пределах статистической погрешности и имеют значение 0.037 л моль–1 с–1.
Рис. 5.
Зависимость содержания хлора в ХГЭ от времени реакции при 80°С: 1 – 50% ХГЭ + 50% ТЛ; 2 – 50% ХГЭ + 42.5% ТЛ + 7.5% ЭТ; 3 – 50% ХГЭ + 50% МИБК.
Таким образом, использование МИБК в качестве растворителя при производстве ЭС на основе бисфенола А является достаточно перспективным, а кинетика реакции дегидрохлорирования ХГЭ может быть описана следующим эмпирическим уравнением:
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования были определены кинетические закономерности реакции дегидрохлорирования хлоргидриновых эфиров бисфенола А в среде растворителя метилизобутилкетона, рассчитана наблюдаемая энергия активации реакции, показано влияние концентрации воды на скорость процесса. Результаты работы могут быть применены для проектирования стадии дополнительного дегидрохлорирования при производстве эпоксидных смол.
Список литературы
Paluvai N.R., Mohanty S., Nayak. S.K. // Polymer-Plastics Technol. Eng. 2014. V. 53. P. 1723.
Jin F., Li X., Park. S. // J. Ind. Eng. Chem. 2015. V. 29. P. 1.
Boyle M.A., Martin C.J., Neuner J.D. // Composite and Constituent Mater. 2001. V. 21. P. 78.
Gibson. G. // Brydson’s Plastics Materials. 2017. V. 27. P. 773.
Махин М.Н., Терехов А.В., Дмитриев Г.С., Махина Д.Н., Занавескин Л.Н., Хаджиев С.Н. // Журнал прикладной химии. 2018. Т. 91. № 5. С. 749.
Panda H. Epoxy Resins Technology Handbook. Delhi: Asia Pacific Business Press Inc., 2016. P. 560.
Hu F. // Pigm. Resin Technol. 2015. V. 44. № 3. P. 179.
Pat. 8461286 B2 USA, 2013.
Koci V., Loubal T. // Acta Env. Univ. Comenianae. 2012. V. 20. P. 62.
Petrie E.M. Epoxy Adhesive Formulations, 1st ed. NewYork: McGraw-Hill, 2005. P. 535.
Enikolopyan N.S., Markevitch M.A., Sakhonenko L.S., Rogovina S.Z., Oshmyan V.G. // J. Polym. Sci. 1982. V. 20. P. 1231.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ