Кинетика и катализ, 2020, T. 61, № 2, стр. 235-241
Антиоксидантная активность 2-аминотиазолов, содержащих дитерпеновый фрагмент, в модельной системе жидкофазного радикально-цепного окисления 1,4-диоксана
Л. Р. Якупова a, *, Р. А. Насибуллина a, В. А. Шамукаев a, Р. М. Султанова a, Р. Л. Сафиуллин a
a Уфимский Институт химии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра РАН
450054 Уфа, просп. Октября, 71, Россия
* E-mail: jkupova@anrb.ru
Поступила в редакцию 14.06.2019
После доработки 04.09.2019
Принята к публикации 30.09.2019
Аннотация
В модельной системе инициированного радикально-цепного окисления 1,4-диоксана количественно оценена антиоксидантная активность 2-аминотиазолов, содержащих дитерпеновый фрагмент, и установлено, что в зависимости от строения изученные соединения проявляют различную ингибирующую активность. Измерена эффективная константа скорости взаимодействия замещенных 2-аминотиазолов с пероксильным радикалом 1,4-диоксана. Показано, что более высокой реакционной способностью по отношению к пероксильному радикалу обладают 2-аминотиазолы, полученные на основе химических трансформаций N-фениламида малеопимаровой кислоты.
Аминотиазолы являются перспективными ингибиторами окислительных реакций, сочетающих антиоксидантные свойства с другими видами физиологического воздействия [1, 2]. Среди них найдены соединения с противовоспалительной, психотропной, антибактериальной, фунгицидной и противовирусной активностью [3]. Взаимодействие аминотиазола с пероксильными радикалами было изучено на примере трихлорметильного пероксильного радикала методом импульсного радиолиза [4] и в модельной системе радикально-цепного окисления кумола [5]. Антиоксидантное действие производного аминотиазола, содержащего малеопимаровую кислоту (МПК), в литературе не описано. Однако ранее нами было показано, что МПК усиливает антиоксидантную активность фуллерена. Так, эффективная константа скорости (fk7) взаимодействия пероксильного радикала этилбензола с молекулой фуллерена в сочетании с малеопимаровой кислотой увеличивается на порядок и составляет 2 × 103 л моль–1 с–1 (343 К) [6].
В настоящей работе была проведена оценка антиоксидантной активности замещенных 2-аминотиазолов, полученных путем химических трансформаций малеопимаровой кислоты по карбоксильной функции. Эти соединения представляют интерес, поскольку многие производные малеопимаровой кислоты обладают широким спектром биологической активности [7], которая зачастую коррелирует с антирадикальной активностью [8]. Для количественной оценки реакционной способности замещенных 2-аминотиазолов по отношению к пероксильным радикалам использовали модельную систему инициированного радикально-цепного окисления 1,4-диоксана. Выбор данного субстрата окисления связан с тем, что тестируемые соединения не растворимы в модельных системах, традиционно используемых для измерения антиоксидантной активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1,4-Диоксан (RH) и 2,2'-азо-бис-изобутиронитрил (АИБН) очищали по методике [9], а хлорбензол – согласно [10].
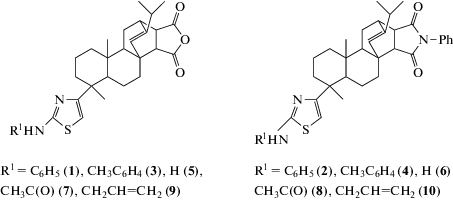
Структуры исследованных 2-аминотиазолов (1–10), содержащих дитерпеновый фрагмент
Методики получения и физико-химические характеристики соединений 1–10 приведены в работе [11]. В качестве инициатора использовали АИБН. Скорость инициирования рассчитывали по формуле: wi = 2ekр[АИБН], где kр – константа скорости распада АИБН в 1,4-диоксане, 2е – вероятность выхода радикалов в объем. При проведении расчетов использовали величины lg kр = 15.8 – 31.7/θ [с–1], где θ = 2.303RT × 10–3 ккал/моль [12], 2e = 1 [13].
1,4-Диоксан окисляли кислородом воздуха при температуре 333 К в стеклянном реакторе, в который загружали 1,4-диоксан и раствор инициатора АИБН в хлорбензоле. После нескольких минут термостатирования добавляли ингибитор в растворе 1,4-диоксана и следили за поглощением кислорода с помощью универсальной манометрической дифференциальной установки [14]. Объемы газовой и жидкой фаз составляли 21.6 и 6 мл соответственно.
Строение молекулы соединения 2 рассчитывали в квантово-химическом приближении методом M06L/6-311+G(d,p) [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Жидкофазное окисление 1,4-диоксана в условиях нашего эксперимента (333 К, wi = 1 × × 10–7 моль л–1 с–1) протекает по радикально-цепному механизму с квадратичным обрывом цепи [16]:
(i)
${\text{АИБН}}\xrightarrow{{{{k}_{i}}}}{{{\text{r}}}^{\centerdot }}\xrightarrow{{{\text{RH}}}}{{{\text{R}}}^{\centerdot }},$(I)
${{{\text{R}}}^{\centerdot }} + {{{\text{O}}}_{2}}\xrightarrow{{{{k}_{1}}}}{\text{RO}}_{2}^{\centerdot },$(II)
${\text{RO}}_{2}^{\centerdot } + {\text{RH}}\xrightarrow{{{{k}_{2}}}}{\text{ROOH}} + {{{\text{R}}}^{\centerdot }},$(VI)*
$\begin{gathered} {\text{RO}}_{2}^{\centerdot } + {\text{RO}}_{2}^{\centerdot }\xrightarrow{{2{{k}_{6}}}} \\ \to {\text{молекулярные}}\,\,{\text{продукты}}{\text{.}} \\ \end{gathered} $В отдельных опытах (в условиях [RH] = = 9.75 моль/л, wi = 1 × 10–7 моль л–1 с–1, 333 К) было показано, что исходные соединения – малеопимаровая кислота (МПК) и N-фенилимид малеопимаровой кислоты (N-Ph-МПК) – не влияют на скорость окисления 1,4-диоксана: [МПК] = (2.3–32.2) × 10–4 моль/л, [N-Ph-МПК] = = (4.6–23.0) × 10–4 моль/л. Также не проявили антирадикальную активность соединения 9 ((4.8–10.8) × 10–4 моль/л) и 8 ((4.5–22.7) × 10–4 моль/л).
Добавление к окисляемому субстрату соединений 1–7 и 10 приводит к снижению скорости поглощения кислорода вследствие расходования пероксильных радикалов по реакции (VII):
(VII)
${\text{RO}}_{2}^{\centerdot } + {\text{InH}}\xrightarrow{{{{k}_{7}}}}{\text{ROOH}} + {\text{I}}{{{\text{n}}}^{\centerdot }},$Типичные кинетические кривые поглощения кислорода при окислении 1,4-диоксана без ингибитора и в его присутствии представлены на рис. 1. Из графика следует, что без ингибитора окисление протекает с постоянной скоростью. Добавление соединения 2 приводит к снижению скорости окисления на начальном участке. По мере углубления процесса в результате расходования ингибитора по реакции (VII) скорость окисления повышается и становится равной скорости окисления в отсутствие ингибитора. Скорость окисления w на начальном участке и длительность тормозящего действия увеличиваются с ростом концентрации соединения 2 (рис. 1, кривые 2–4). Аналогичная картина наблюдалась и для соединений 1, 3–7 и 10. В табл. 1 приведены экспериментальные значения начальной скорости окисления 1,4-диоксана при различных концентрациях исследованных соединений.
Рис. 1.
Типичные кинетические кривые поглощения кислорода при окислении 1,4-диоксана в отсутствие ингибитора (1) и в присутствии соединения 2 в различных концентрациях, моль/л: 2 – 2.25 × 10–4, 3 – 4.50 × 10–4, 4 – 9.0 × 10–4. Условия реакции: [RH] = 9.75 моль/л, wi = 1 × 10–7 моль л–1 с–1, 333 К.
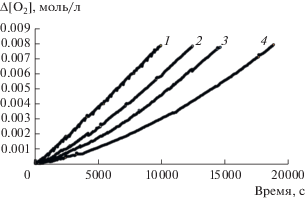
Таблица 1.
Зависимость скорости окисления 1,4-диоксана от концентрации ингибиторов 1–10
| InH | [InH]0 × 10–4, моль/л | w × 10–7, моль л–1 с–1 | InH | [InH]0 × 10–4, моль/л | w × 10–7, моль л–1с–1 |
|---|---|---|---|---|---|
| – | 0 | 9.3 | – | 0 | 9.3 |
| 1 | 1.3 | 7.1 | 2 | 0.9 | 6.5 |
| 2.3 | 5.9 | 2.2 | 4.7 | ||
| 4.4 | 5.2 | 3.2 | 4.1 | ||
| 4.6 | 5.4 | 4.5 | 3.0 | ||
| 9.1 | 4.2 | 6.8 | 2.2 | ||
| 13.7 | 3.4 | 9.0 | 1.7 | ||
| 18.3 | 2.9 | ||||
| 30.5 | 1.6 | ||||
| 3 | 4.6 | 6.7 | 4 | 0.9 | 8.1 |
| 9.2 | 5.8 | 2.3 | 5.9 | ||
| 13.8 | 5.1 | 4.5 | 5.2 | ||
| 18.4 | 4.4 | 9.1 | 3.2 | ||
| 20.9 | 3.8 | 13.6 | 2.5 | ||
| 22.7 | 1.8 | ||||
| 5 | 4.4 | 7.0 | 6 | 4.5 | 7.2 |
| 8.8 | 5.8 | 8.9 | 6.2 | ||
| 13.3 | 3.8 | 13.5 | 5.6 | ||
| 17.7 | 3.5 | 17.9 | 4.1 | ||
| 22.1 | 3.8 | 22.4 | 3.9 | ||
| 30.9 | 4.5 | 51.2 | 2.0 | ||
| 7 | 0.9 | 8.0 | 8 | (4.5–22.7) | Не ингибирует |
| 2.3 | 7.2 | ||||
| 9.1 | 4.3 | ||||
| 13.6 | 3.7 | ||||
| 22.7 | 1.0 | ||||
| 31.7 | 0.4 | ||||
| 9 | (4.8–10.8) | Не ингибирует | 10 | 3.7 | 8.2 |
| 7.3 | 8.5 | ||||
| 9.6 | 8.6 | ||||
| 14.7 | 7.6 | ||||
| 30.8 | 6.4 | ||||
| 31.4 | 6.7 |
На рис. 2 на примере соединения 2 представлена типичная зависимость начальной скорости окисления 1,4-диоксана (w) от концентрации ингибитора ([InH]0). Как видно, при повышении концентрации ингибитора скорость окисления снижается. Для определения эффективной константы скорости ингибирования полученную зависимость w от [InH]0 обрабатывали в координатах уравнения (1) [17]:
(1)
$\begin{gathered} F = {{{{w}_{0}}} \mathord{\left/ {\vphantom {{{{w}_{0}}} {\left( {w + {{w}_{i}}} \right)}}} \right. \kern-0em} {\left( {w + {{w}_{i}}} \right)}}--{{\left( {w + {{w}_{i}}} \right)} \mathord{\left/ {\vphantom {{\left( {w + {{w}_{i}}} \right)} {{{w}_{0}}}}} \right. \kern-0em} {{{w}_{0}}}} = \\ = {{{\text{ }}f{{k}_{7}}{{{\left[ {{\text{InH}}} \right]}}_{0}}} \mathord{\left/ {\vphantom {{{\text{ }}f{{k}_{7}}{{{\left[ {{\text{InH}}} \right]}}_{0}}} {{{{\left( {2{{k}_{6}}{{w}_{i}}} \right)}}^{{0.5}}}}}} \right. \kern-0em} {{{{\left( {2{{k}_{6}}{{w}_{i}}} \right)}}^{{0.5}}}}},~ \\ \end{gathered} $Рис. 2.
Зависимости скорости поглощения кислорода при окислении 1,4-диоксана w (1) и эффективности ингибирования F (2) от концентрации соединения 2 (r = 0.997). Условия реакции те же, что на рис. 1.
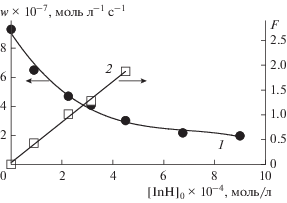
Как видно на рис. 2, зависимость скорости окисления 1,4-диоксана от концентрации ингибитора удовлетворительно линеаризуется в координатах уравнения (1). Это позволяет рассчитать эффективную константу скорости (fk7) взаимодействия пероксильного радикала 1,4-диоксана с соединением 2. Для обработки использовали результаты опытов, в которых длина цепи составляла не менее 3 звеньев [18]. Аналогичную обработку проводили для соединений 1, 3–7 и 10. Полученные значения эффективной константы скорости fk7 исследованных соединений представлены в табл. 2 (при расчете принимали 2k6 = 1 × 109 л моль–1 с–1 [16, 19]).
Таблица 2.
Значения параметра fk7 исследованных соединений 1–10
| Соединение | fk7 × 103, л моль–1 с–1 | Соединение | fk7 × 103, л моль–1 с–1 |
|---|---|---|---|
| 1 | 13.3 ± 2.0 | 2 | 41.2 ± 0.1 |
| 3 | 6.3 ± 0.3 | 4 | 19.5 ± 0.1 |
| 5 | 9.7 ± 1.2 | 6 | 6.4 ± 0.6 |
| 7 | 11.5 ± 0.8 | 8 | Не ингибирует |
| 9 | Не ингибирует | 10 | 1.5 ± 0.2 |
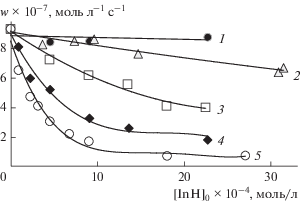
Согласно полученным данным скорость окисления 1,4-диоксана (w) наиболее сильно снижается в присутствии соединений 2 и 4 (рис. 3, кривые 4 и 5). Для этих производных 2-аминотиазола эффективная константа скорости fk7 равна 4.1 × 104 и 1.9 × 104 л моль–1 с–1 соответственно (табл. 2). По активности они сопоставимы с ионолом, для которого в аналогичных условиях fk7 = 2.8 × × 104 л моль–1 с–1 [16].
Рис. 3.
Зависимости скорости поглощения кислорода при окислении 1,4-диоксана от концентрации производных 2-аминотиазола: 8 (1), 10 (2), 6 (3), 4 (4), 2 (5). Условия реакции те же, что на рис. 1.
Полученные результаты и анализ литературных данных позволяют предположить, что наиболее вероятным участком молекулы, атакуемым пероксильным радикалом, является >N–H-связь [4, 5]. Все исследованные замещенные 2-аминотиазолы 1–10 имеют общую формулу R1RN–H. Из табл. 2 видно, что при R = МПК соединения 1, 3, 5 и 7 вне зависимости от заместителя R1 являются слабыми ингибиторами и по актиности сопоставимы с незамещенным 2-аминотиазолом. В нашем случае эффективная константа скорости (fk7) взаимодействия пероксильного радикала 1,4-диоксана с незамещенным 2-аминотиозолом составляет (7.9 ± 0.5) × 103 л моль–1 с–1. По данным [5], введение заместителя в тиазольный цикл также незначительно сказывается на реакционной способности 2-аминотиозола по отношению к кумилперекисным радикалам.
В случае N-Ph-МПК-производных 2-аминотиазола (соединения 2 и 4) наблюдается заметное усиление их реакционной способности по отношению к пероксильным радикалам по сравнению с незамещенным 2-аминотиазолом. При этом параметр fk7 зависит от заместителя R1 и увеличивается в ряду –N(CH2CH=CH2)–H < –N(H)–H < < –N(C6H4CH3)–H < –N(C6H5)–H. Известно, что в молекуле анилина прочность ArN(Н)–H-связи составляет 379 кДж/моль, а в молекуле дифениламина Ar2N–H – 367 кДж/моль [20]. Аналогичное снижение прочности >N–H-связи на 12 кДж/моль наблюдается при переходе от анилина к дифениламину [21]. В результате константа скорости реакции вторичного пероксильного радикала с анилином составляет 2.9 × 103 л моль–1 с–1 (333 К [22]), а пероксильного радикала стирола с дифениламином – 4.4 × 104 л моль–1 с–1 (338 К [23]). В нашем случае при переходе от RN(Н)–H к R(C6H5)N–H параметр fk7 также увеличивается на порядок. Это свидетельствует в пользу того, что наиболее вероятным участком молекулы, атакуемым пероксильным радикалом, является >N–H-связь.
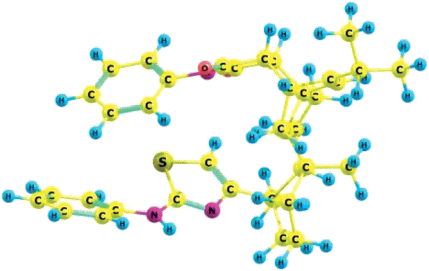
Таким образом, введение фрагмента N-фенилимида малеопимаровой кислоты в положение 4 тиазольного кольца и замена атома водорода в аминогруппе на фенильный заместитель увеличивают антиоксидантный эффект соединения 2 почти в пять раз. Возможно, это связано с тем, что для молекул исследованных соединений характерны геометрические, вращательные, конформационные изомеры [24, 25]. Например, проведенные теоретические расчеты свидетельствуют о возможности одного из таких состояний для соединения 2, в котором фенильные заместители малеопимаровой кислоты и 2-аминотиазола расположены на достаточно близком расстоянии друг от друга (рис. 4).
Из расчетов следует также, что длина связи N–H в соединении 6 составляет 0.997 Å. При введении фенильного заместителя (соединение 2) этот параметр равен 1.010 Å. Предположительно повышение антиокислительной активности для N-Ph-МПК-содержащих соединений 2 и 4 связано с тем, что существуют такие состояния этих молекул, когда фенильные кольца при имидном и аминном центрах, располагаясь определенным образом, оказывают влияние на аминогруппу, способствуя либо снижению прочности R1RN–H-связи, либо стабилизации образующегося аминильного радикала R1RN•.
Для 2-аминотиазолов 2 и 10 нами был отмечен следующий факт. При достаточно высокой концентрации ингибитора (~3 × 103 моль/л) по ходу процесса скорость поглощения кислорода не нарастает, а снижается. Возможно, это связано с тем, что образующийся из ингибитора аминильный радикал R1R2N• реагирует с пероксильным радикалом. По данным [26, 27], константа скорости реакции ${\text{RO}}_{2}^{\centerdot } + {\text{A}}{{{\text{r}}}_{{\text{2}}}}{{{\text{N}}}^{\centerdot }}$ составляет 6 × 108 л моль–1с–1. Тогда можно предположить, что в условиях нашего эксперимента при [2] = 30.5 × 10–4 моль/л образуется такая концентрация аминильного радикала, что его реакцией с пероксильным радикалом нельзя пренебречь. Видимо, по причине образующегося более активного радикала R1R2N• для малоактивного поначалу соединения 9 только по мере углубления процесса наблюдается снижение скорости окисления 1,4-диоксана.
Окисление 1,4-диоксана в присутствии соединений 1, 2 и 4 протекает с индукционным периодом (рис. 1, табл. 3). Длительность индукционного периода τ определяли интегральным методом, обрабатывая кинетические кривые по уравнению [28, 29]:
Таблица 3.
Стехиометрический коэффициент ингибирования, измеренный по длительности индукционного периода
| InH | [InH]0 × 10–4, моль/л | τ, с | f |
|---|---|---|---|
| 1 | 1.3 | 2747 | 2.1 |
| 4.4 | 9000 | 2.1 | |
| 2 | 0.9 | 1975 | 2.2 |
| 2.2 | 5291 | 2.4 | |
| 3.2 | 8999 | 2.8 | |
| 4.5 | 9600 | 2.1 | |
| 6.8 | 13 494 | 2.0 | |
| 9.0 | 14 942 | 1.7 | |
| 4 | 0.9 | 1632 | 1.8 |
| 2.3 | 5115 | 2.2 | |
| 4.5 | 8464 | 1.9 | |
| 9.1 | 14 383 | 1.6 |
Стехиометрический коэффициент ингибирования (f) рассчитывали из соотношения
Для соединений 1, 2 и 4, проявивших наибольшую реакционную способность по отношению к пероксильному радикалу, стехиометрический коэффициент ингибирования равен ~2 (табл. 3), следовательно, на одной молекуле этих соединений гибнет два пероксильных радикала.
ЗАКЛЮЧЕНИЕ
Таким образом, нами показано, что 2-аминотиазолы, содержащие дитерпеновый фрагмент, проявляют антиоксидантную активность, и предположено, что местом атаки пероксильным радикалом является аминогруппа. Замещенный 2-аминотиазол, содержащий фрагмент N-фенилимида малеопимаровой кислоты в положении 4 тиазольного кольца и фенил в аминогруппе, проявил наибольшую реакционную способность по отношению к пероксильным радикалам 1,4-диоксана (эффективная константа скорости fk7 составила (4.1 ± 0.1) × 104 л моль–1 с–1).
Список литературы
Uchikawa O., Fukatsu K., Suno M., Aono T., Doi T. // Chem. Pharm. Bull. 1996. V. 44. № 11. P. 2070.
Kalpana K.V., Srinivasan M., Menon V.P. // Mol. Cell. Biochem. 2008. V. 314. № 1–2. P. 95.
Kashyap S.J., Garg V.K., Sharma P.K., Kumar N., Dudhe R., Gupta J.K. // Med. Chem. Res. 2012. V. 21. № 8. P. 2123.
De S., Adhikari S. Tilak-Jain J., Menon V.P., Devasagayam T.P.A. // Chem. Biol. Interact. 2008. V. 173. № 3. P. 215.
Карпов К.А., Пекаревский Б.В., Потехин В.М. // Журн. общ. химии. 2001. Т. 71. № 9. С. 1567.
Якупова Л.Р., Сахаутдинов И.М., Маликова Р.Н., Сафиуллин Р.Л. // Кинетика и катализ. 2019. Т. 60. № 1. С. 25.
Дикусар Е.А., Бей М.П., Ювченко А.П., Поткин В.И., Козлов Н.Г., Тлегенов Р.Е. // Химия растительного сырья. 2011. № 1. С. 105.
Sultanova R.M., Sakhautdinov I.M. // Chem. Nat. Compd. 2019. T. 55. № 1. C. 47.
Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Гимадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г., Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. № 3. С. 507.
Якупова Л.Р., Сахаутдинова Р.А., Панкратьев Е.Ю., Сафиуллин Р.Л. // Кинетика и катализ. 2012. Т. 53. № 6. С. 708.
Sultanova R.M., Lobov A. N., Shumadalova A.V., Meshcheryakova S. A., Zileeva Z.R., Khusnytdinova N.S., Vakhitov V.A., Vakhitova Yu.V. // Nat. Prod. Res. 2019. https://www.tandfonline.com/doi/full/10.1080/14786419. 2019.1648459
Moroni A.F. // Makromol. Chem. 1967. V. 105. № 6. P. 43.
Henrici-Olive G., Olive S. // Makromol. Chem. 1962. V. 58. № 1. P. 188.
Якупова Л.Р., Проскуряков С.Г., Зарипов Р.Н., Рамеев Ш.Р., Сафиуллин Р.Л. // Бутлеров. сообщ. 2011. Т. 28. № 19. С. 71.
Zhao Y., Truhlar D.G. // J. Chem. Phys. 2006. V. 125. № 19. P. 194101.
Якупова Л.Р., Хайруллина В.Р., Сафиуллин Р.Л., Герчиков А.Я., Баймуратова Г.Р. // Кинетика и катализ. 2008. Т. 49. № 3. С. 387.
Денисов Е.Т., Азатян В.В. Ингибирование цепных реакций. Черноголовка: Изд-во РАН. 1997. 266 с.
Цепалов В.Ф. Исследование синтетических и природных антиоксидантов in vitro и in vivo. Сб. науч. статей. Москва: Наука, 1992. С. 16.
Сафиуллин Р.Л., Запольских В.В., Якупова Л.Р., Зарипов Р.Н., Терегулова А.Н. // Хим. физика. 2001. Т. 20. № 5. С. 110.
Denisov E.T., Khudyakov I.G. // Chem. Rev. 1987. V. 87. № 6. P. 1313.
Luo Yu-R. Handbook of Bond Dissociation Energies in Organic Compounds. Boca Raton: CRC Press LLC, 2003. 380 p.
Denisov E.T., Denisova T.G. Handbook of Antioxidants. Bond Dissociation Energies, Rate Constants, Activation Energies and Enthalpies of Reactions. CRC Press, 2017. 190 p.
Valgimigli L., Pratt D.A. Antioxidants in Chemistry and Biology. Encyclopedia of Radicals in Chemistry, Biology and Materials. Chichester: John Wiley & Sons Ltd., 2012. P. 1623.
Yao G.Y., Ye M.Y., Huang R.Z., Li Y.J., Zhu Y.T., Pan Y.M., Liao Z.X., Wang H.S. // Bioorg. Med. Chem. Lett. 2013. V. 23. № 24. P. 6755.
Xu X., Song Z.-Q., Shang S.-B., Wang H.-X., Rao X.-P. // Acta Crystallogr. E. 2009. V. 65. № 10. P. O2443.
Варламов В.Т., Сафиуллин Р.Л., Денисов Е.Т. // Хим. физика. 1983. № 3. С. 408.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxdants in Organic Chemistry and Biology. Boca Raton: CRC Press, 2005. 981 p.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2002. V. 34. № 3. P. 162.
Плисс Е., Сафиуллин Р., Злотский С. Ингибированное окисление непредельных соединений. Кинетика, механизм, связь структуры с реакционной способностью. Saarbrucken: LAP Lambert Acad. Publ., 2012. 140 с.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ